
포도껍질 추출물이 인체유방암세포 사멸에 미치는 영향
Abstract
We investigated the apoptotic effects of grape skin extracts (GSE) and related gene expressions in human breast cancer MDA-MB-231 cells cultured in the presence of 0, 0.5, 1 and 1.5 mg/mL of GSE for 72 hours. MTT assay, trypan blue and nuclei staining showed lower cellular mitochondrial activities and increased cell deaths with a higher concentration of GSE (p<0.05). Increased cell number with fragmentated DNA of sub-G1 phase was calculated as a measure of apoptotic cell death by FACS analysis (p<0.05). In particular, apoptotic cell death caused markedly increased in the 1 and 1.5 mg/mL of GSE groups, as revealed by flow cytometry (Annexin V-FITC). RT-PCR analysis was performed on apoptotic and preapoptotic genes. Expression of the apoptosis suppressor gene bcl-2 significantly decreased, proapoptotic gene bax was significantly increased and procaspase-3 showing the presence of caspase-3 significantly decreased (p<0.05). Furthermore, bcl-2/bax ratio which is considered to be an important indicator of apoptosis, significantly decreased in a concentration-dependent manner (p<0.05). These results indicated that GSE induces apoptosis in MDA-MB-231 human breast cancer cells.
Keywords:
Grape skin, MDA-MB-231 cell, apoptosis, Bcl-2, Bax, caspase-3서 론
한국인의 서구화된 생활방식으로 인해 한국여성의 유방암 발생률이 증가하면서 전체 암 발생률의 2위를 차지하고 있다(Son et al 2006). 유방암은 조기에 발견할 경우, 비교적 치료가 잘 되는 암으로 수술 및 방사선요법, 항암제 등을 사용하는데, 항암제는 독성과 부작용이 매우 심한 경우가 대부분이므로, 인체에 무해하면서도 효과적으로 암을 치료할 수 있는 새로운 약제 개발을 위하여 식물자원을 이용한 항암제 연구가 다각도로 진행되고 있는 실정이다. 즉, 천연물은 안전하게 생리 기능을 조절하며, 항암활성을 향상시키는 것으로 알려져 있어 광범위하게 연구되어오고 있다(Hatcher et al 2008).
세포의 사멸은 apoptosis와 necrosis로 구분되며, apoptosis는 내재된 자살 기전의 결과로 예정세포사(programmed cell death)라고도 불리며, necrosis는 물리적 외상이나 다양한 종류의 독성물질에 의해 사멸하는 것이다(Kim et al 2000). Apop- tosis는 정상적인 현상으로 우리 몸의 항상성 유지에 중요한 역할을 하고 있지만, 사멸해야 하는 세포가 사멸하지 않으면 apoptosis와 관련된 몇몇 세포들의 돌연변이가 암으로 이어질 수 있다.
Apoptosis와 관련된 유전자 bcl-2 family 중 antiapoptotic인 bcl-2와 proapoptotic인 bax가 있는데, bcl-2는 과발현되면 이형이량체(heterodimer)인 bcl-2/bax 유전자는 apoptosis 억제 효과에 영향을 주고, bax가 과발현되면 동형이량체(homodimer)인 bax/bax 유전자는 apoptosis 촉진 효과에 영향을 주므로 bcl-2와 bax의 비율은 세포자멸사를 결정하는 중요요소이다. 또한 cytochrome-c는 미토콘드리아에서 세포질로 이동하면서 apoptotic cascade를 통해 비활성 procaspase-3를 caspase-3로 활성화시킨다. Bcl-2는 cytochrome-c 분비와 caspase-3활성을 모두 억제하며, bax는 반대로 촉진한다(Kluck et al 1997; Yang et al 1997).
포도와 그 안의 생리활성물질은 다양한 효능을 나타내는데, 포도에 다량 함유되어 있는 생리활성물질인 카테킨, 레스베라트롤, 플라보노이드, 안토시아니딘은 항돌연변이(Saito et al 1998; Peterson & Dwyer 1998) 및 항바이러스(Saito et al 1998), 죽상동맥경화증 예방(Kovac & Pekic 1991), 항산화(Hudson et al 2007; Peterson & Dwyer 1998; Nijveldt et al 2001)효과가 있으며, 심장혈관질환 및 뇌졸중 예방(Peterson & Dwyer 1998), 신생혈관형성 및 세포주기 억제를 통한 암세포전이 억제(Aggarwal et al 2004), 항염증 및 항암(Bertelli et al 1998; Udenigwe et al 2008, Hudson et al 2007; Yun et al 2010)효과를 가진다. 또한, 와인과 포도주스는 내피기능개선(Stein et al 1999) 및 관상동맥질환환자의 산화 LDL콜레스테롤 감수성 감소(Stein et al 1999)를 시키며, 협착된 관상동맥의 혈전증 저해 및 혈소판 활동 저해(Demrow et al 1995)를 돕는다.
포도는 항산화(Jeong et al 2007; Jayaprakasha et al 2001; Rockenbach et al 2011; Hudson et al 2007; Moura et al 2002), 항돌연변이(God et al 2007) 및 항암(God et al 2007; Morré et al 2006), 혈소판 기능억제 및 항염증, 활성산소방출억제(Vitseva et al 2005) 효과를 가진다. 이 중 포도껍질은 전립선(Hudson et al 2007) 및 자궁경부암 항암효과(Morré et al 2006), 혈관확장 및 항고혈압(Moura et al 2002) 효과를 가지고 있다.
이처럼 포도와 생리활성물질인 페놀화합물, 레스베라톨, 플라보노이드, 안토시아닌, 와인 및 포도주스에 대한 다양한 연구가 진행되었지만, 포도껍질 추출물을 이용한 인체유방암세포의 항암효과는 아직 보고되지 않았다.
이에 본 연구는 70% ethanol 추출법을 이용하여 다양한 생리활성물질이 농축되어 있는 포도껍질 추출물의 처리 농도에 따라 유방암세포 MDA-MB-231의 활성, 막 투과성, 사멸, 자멸사 및 괴사구분, 세포주기 등을 분석하고, apoptosis 기전에 관여하는 bcl-2와 bax, procaspase-3 유전자를 mRNA 수준에서 분석하여 포도껍질의 항암효과를 확인하고자 하였다.
재료 및 방법
1. 시료
포도의 품종은 스튜벤(Vitis labrusca)이며, 2013년 10월에 충남 아산시 배방읍 회룡리 포도 농장에서 비가림 재배와 봉지 씌우기 및 친환경 재배를 통하여 수확한 후, 저온 저장 시킨 것을 2014년 2월에 구입하여 사용하였다.
2. 시료추출
포도에서 껍질만 얻기 위해 생포도 595g 중 껍질을 핀셋으로 수작업하여 분리한 결과, 94.31g(포도 전체 중 약 15.8%) 을 얻어내었다. 포도껍질 94.31g에 용질의 10배인 943 mL의 70% ethyl alcohol을 첨가하여 80℃ water bath(CA-1112, Tokyo Rikakikai Co., Ltd, Tokyo, Japan)에서 3시간마다 추출액을 얻었으며, 총 9시간동안 환류추출을 하였다. 그 후 감압농축(EYELA N-1000, Tokyo Rikakikai Co., Ltd, Japan)하였고, —70℃의 동결 건조기(Ilshin® Freeze dryer, Ilshin Lab Co., Ltd, Daejeon, Korea)를 사용하여 24시간 동안 동결 건조시켰다. 이를 곱게 powder 형태로 만들어 12.10 g을 얻을 수 있었으며, 수율(yield rate)은 12.83%였다. 추출물은 분주하여 실험할 때까지 —20℃ 냉동고에 저장하였으며, 실험 시 배양액에 필요한 농도로 희석하여 사용하였다.
3. 세포배양
인체 유방암 MDA-MB-231세포는 51세 caucasian female의 세포로 한국 세포주 은행(KCLB, Korean Cell Line Bank) 에서 구입하여 사용하였다. MDA-MB-231세포의 배양액은 먼저 Dulbeco's modified eagle's medium(DMEM, Gibco, Grand Island, NY, USA)에 10% Fetal bovine serum(FBS, Welgene, Seoul, Korea)와 1% penicillin-streptomysin(GIBCO, Grand Island, NY, USA)을 혼합한 후 여과시켜 사용하였다. MDA- MB-231 세포는 100 mm culture dish(SPL, Seoul, Korea)에 1×106 cells/well의 밀도로 10 mL 배양액에 계대하였으며, 5% CO2와 37℃의 환경을 가진 incubator(MCO-15AC, Sanyo, Tokyo, Japan)에서 배양하였다. 세포가 부착 후 dish 면적의 70∼80% 정도로 증식한 때에, DPBS(Welgene, Daegu, Korea)로 2회 세척한 후 0.25% trypsin-EDTA(Gibco, Grand Island, NY, USA)로 부착된 세포를 분리시켜 계대 배양하였다.
4. MTT 분석
포도껍질 추출물(grape skin extracts, GSE)의 농도별 처리에 따른 MDA-MB-231 세포의 증식억제 및 사멸을 알아보기 위해 MTT(3-[4,5-Dimethyl-2-thiazolyl]-2,5-diphenyl-2H-tetrazo- lium bromide, Alfa Aesar®, Karlsruhe, Germany)로 측정하였다.
MDA-MB-231세포를 96 well plate에 2×104 cells/well 밀도로 계대하고, 200 μL 배지를 첨가하여 24시간 배양한 후, 포도껍질 추출물을 0, 0.25, 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2 mg/mL 의 농도로 처리하여 다시 72시간 동안 5% CO2, 37℃ incubator에서 배양시켰다. 72시간 후, 2 mg/mL 농도의 MTT assay 50 μL를 각 well에 첨가하여 2시간 동안 incubator에서 배양시킨 후, 각 well의 배지를 조심스레 suction한 다음 DMSO 150 μL를 첨가하였다. Rotator(C-SKS, Chang Shin Science Co., Ulsan, Korea)를 이용하여 shaking한 후, ELISA reader(Spectra max M2, molecular devices, CA, USA)를 이용하여 570 nm의 파장에서 흡광도(OD)를 측정하였다. 세포생존율은 대조군의 흡광도를 100%로 하여 각 처리군의 흡광도를 상대적인 백분율로 나타내었으며, 이를 바탕으로 흡광도를 50%로 감소시킬 수 있는 시료의 농도(IC50, half maximal inhibitory concentra- tion)와 앞으로 수행될 실험에 사용될 농도 0.5, 1, 1.5 mg/mL을 산출하였다.
5. Trypan Blue
세포생존율을 확인하는 가장 일반적인 방법 중 하나로, 세포막의 투과성을 보기 위해 trypan blue 염색법을 사용하였다. 온전한 세포막을 가지고 있는 생존한 세포는 trypan blue 시약이 투과하지 못해 염색되지 않지만, 손상된 세포막을 가지고 있는 사멸되거나 괴사된 세포는 trypan blue시약이 투과하여 염색된다.
MDA-MB-231세포를 6 well plate에 4×105 cells/well 밀도로 계대하고, 3 mL 배지를 첨가하여 24시간 배양하였다. 그리고 GSE 0.5, 1, 1.5 mg/mL를 72시간 처리 후, 0.1% trypan blue solution([C.I. 23850, Direct Blue 14, Niagraa Blue 3B] T1708, Samchun Chemical Co., Ltd, Seoul, Korea) 50 μL를 첨가하고 실온에서 10분간 방치하였다. 그리고 광학현미경(IX- 71S8F-2, Olympus Optical Co., ltd., Tokyo, Japan)으로 Bright filed 200배와 100배 배율에서 각 농도마다 3곳을 무작위로 선정하였으며, 현미경 디지털 카메라시스템(DP50-CU, Olympus Optical Co., ltd.,Tokyo, Japan)을 사용하여 세포단층촬영을 하였다. 염색된 세포(dead/dying cell)와 염색되지 않은 세포(viable cell)를 각 처리군별 600개 이상 계상하였으며, 모든 실험은 3회 수행하였다. 이는 Venkateswaran et al(2013)이 보고한 세포생존율 공식을 이용하여 세포사멸율을 결정하였다.
6. Hoechst 33342/ Propidium Iodide(PI)
포도껍질 추출물의 처리에 따른 MDA-MB-231 세포막의 투과성 여부를 trypan blue로 확인하였다면 더 나아가 실제적으로 사멸(death; apoptosis or necrosis)을 유도하는지 조사하기 위해 DNA 결합염료인 Hoechst 33342(Sigma, St Louis, MO, USA)와 핵산염료인 propidium iodide(Sigma, St Louis, MO, USA)를 사용하여 분석하였다.
GSE 0.5, 1, 1.5 mg/mL를 72시간 처리 후, 각 농도별로 dish에서 세포를 분리하여 모은 후 DPBS 50 μL를 첨가하여 pipetting으로 세포를 풀어준 다음, Hoechst 33342(HO342)를 10 μg/mL의 농도로 첨가하여 incubator에서 25분간 방치한 후 다시 꺼내어 PI를 2.5 μg/mL의 농도로 첨가하여 incubator에서 5분간 방치하였다. 조심스레 pipetting한 후 chamlide microscope slides에 각 농도별로 10 μL씩 분주하였고, 그 위에 cover glass를 덮어 광학현미경(IX71S8F-2, Olympus Optical Co., ltd., Tokyo, Japan)으로 관찰 후 fluorescence filed 200배와 100배 배율에서 세포단층촬영을 하였다. 200배 배율의 영상을 기록하고, 시료 처리에 따른 MDA-MB-231의 apoptosis 및 necrosis를 계상하였다. 모든 실험 분석은 3개의 반복 군을 설정하였고, 각 처리군별 Hoechst 33342와 PI가 염색된 세포를 총 600개 이상 계상하여 그 비율을 구하였다.
7. Cell Cycle(RNase and PI Staining)
GSE에 영향을 받은 MDA-MB-231 세포의 세포주기 분포 및 배수성상태를 유동세포계수법(flow cytometry)의 DNA con- tent분석을 통해 관찰하였다.
72시간 동안 GSE 농도 0.5, 1, 1.5 mg/mL를 처리한 세포 pellet에 75% ethanol을 이용하여 —4℃에서 12시간 동안 고정시켰다. 12시간 후 4℃, 13,000 rpm에서 5분간 원심분리하고, pellet만 남도록 EtOH은 제거하였다. 그리고 PBS 480 μL를 넣어 tapping한 후 FACS용 tube에 옮겨 담아 PI 2 mg/mL 와 RNase를 각각 10 μL씩 넣어 최종 volume이 500 μL가 되도록 하였다. 그리고 FACS Canto II flow cytometer(BD Bio- sciences, San Jose, CA, USA)를 이용하여 DNA함량에 따른 histogram을 측정하였으며, 모든 분석은 3반복하였다.
8. Annexin V-FITC and PI Staining
MDA-MB-231 세포에 GSE를 처리하였을 때, apoptosis의 초기 및 후기를 확실하게 구분하기 위하여 annexin V-FITC와 PI 형광염료로 염색시킨 후 유세포분석기(FACS)를 이용하였다.
GSE 0.5, 1, 1.5 mg/mL를 72시간 처리한 pellet에 DPBS를 첨가하여 총 세포수를 일정하게 맞추었다. 각 농도별로 E-tube에 1 mL를 옮긴 후 centrifuge 4℃, 13,000 rpm에서 5분간 원심분리하였다. 상층액을 제거하고 남은 세포 pellet에 차가운 1×binding buffer(AposcreenTM Annexin V Apoptosis Kit, Sou- thern biotech, Birmingham, AL, USA)를 100 μL씩 첨가하여 잘 섞어준 후 FACS용 tube(BD Falcon, USA)에 옮겼다. Annexin V 3 μL를 첨가하여 suspension하고, 빛을 차단한 ice에서 15분 동안 방치한 후, 1×binding buffer를 첨가하였으며, 바로 PI 10 μL를 첨가하였다. 이 때 각 tube의 최종 volume은 500 μL가 되도록 하였다. 그리고 flow cytometer(FACS Canto II, BD Biosciences, San Jose, CA, USA)기기를 이용하여 10,000개의 단일세포를 측정하여 viable, early apoptotic, late apoptotic 및 necrotic 세포의 수를 분석하였다.
9. RT-PCR(Reverse Transcription-Polymerase Chain Reaction)
GSE 0.5, 1, 1.5 mg/mL 72시간 처리에 따른 유방암 세포 MDA-MB-231세포의 사멸유도에 관여하는 유전자의 mRNA 수준 변화를 관찰하기 위하여 RT-PCR을 수행하였다.
1,000 ng으로 정량한 각 농도별 RNA template 2.5 μL와 one-step RT-PCR kit(Legene Biosciences Inc., San Diego, CA, USA)의 1.25× reaction mix 20 μL, enzyme mix 0.5 μL를 분주하였으며, 세포사멸에 관여하는 유전자인 bcl-2, bax, prcas- pase-3의 10 pmol/μL sense와 antisense primer pair(COSMO Genetech Co., Ltd., Seoul, Korea)를 각각 1 μL씩 첨가하여 총 volume이 25 μL가 되도록 하였다. PCR 기기(Takara PCR thermal cycler, Seta 3-4-1, Takara Bio Inc., Otsu, Shiga, 520- 2193, Japan)를 사용하여 먼저 cDNA합성을 40℃에서 20분 동안 시켰으며, denaturation 반응은 94℃에서 2분 동안 하였다. 또한, PCR amplification은 94℃에서 15초, 55∼65℃(primer마다 annealing 온도가 다름)에서 30초, 68℃에서 1분 동안 40 cycles 반응시킨 후, 72℃에서 10분 동안 post extension(Table 1)시켰다. 1.0% agarose(Promega Corporation, Madison, Wis- consin, USA) gel(1× TBE buffer, DNA dye, 1.0% agar)에서 20분 동안 100 voltage에서 전기영동(Mupid-2 plus, Advance, Tokyo, Japan)을 한 후 gel documentation system(ChemiDoc XRS, Biorad, Hercules, CA, USA)으로 촬영하여 시각화하였다. PCR산물의 발현 정도를 수치화하기 위하여 Image J 프로그램(http://rsb.info.nih.gov/ij NIH, Bethesda, MD, U.S.A)을 이용하였으며, 이를 통해 세포사멸 유전자의 대조군으로 사용되는 유전자 β-actin 수치에 대한 상대적인 유전자 bcl-2, bax, procaspase-3 수치의 비율(%)을 결정하고, 세포사멸지수인 bcl-2/bax의 비율을 산출하였다.
10. 통계처리
본 연구의 모든 실험은 독립적으로 3회 이상 실시하였으며, 얻어진 결과는 평균(mean)과 표준편차(standard deviation, SD)로 표시하였다. 또한, 각각의 값은 SPSS statistics 20.0 (IBM, Seoul, Korea) 프로그램을 이용하여 ANOVA분석 후 Duncan's multiple range test와 Scheffe's multiple range test로 p<0.05 수준에서 처리군 간의 유의성을 검증하였다.
결과 및 고찰
1. MTT 분석
GSE의 처리에 따른 MDA-MB-231 세포의 생존율을 확인하기 위하여 MTT분석을 하였다.
MDA-MB-231 세포에 GSE 농도 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2 mg/mL를 첨가하고, 72시간 지속시킨 후 MTT시약을 첨가하고, 흡광도를 측정하였다(Fig. 1). 96well plate를 보면 대조군은 진한 보라색을 띄는 침상의 formazan crystal을 형성하였으나, GSE 처리 농도가 높아질수록 탈수소효소반응이 나타나지 않아 formazan crystal을 형성하는 세포가 줄어드는 동시에 연한 보라색을 띄는 것을 볼 수 있었다. 대조군 대비 백분율로 표시하여 나타낸 결과, 0.5, 0.75, 1, 1.25, 1.5, 1.75 및 2.0 mg/mL 처리군에서 세포 생존율이 82%, 75%, 61%, 56%, 50%, 39%, 30% 및 28%로 농도 의존적으로 감소하였다(p<0.05)(Fig. 1). 이 중 흡광도를 50%로 감소시킬 수 있는 시료의 농도(IC50) 0.5, 1, 1.5 mg/mL로 산출하였고, GSE 0.5 mg/mL 처리군은 약 20%의 세포사멸을 보였고, 1 mg/mL 처리군은 약 40%로 세포활성이 떨어지는 것을 확인할 수 있었다. 1.5 mg/mL에서는 대다수의 세포가 미토콘드리아가 파괴되어 탈수소 효소반응이 일어나지 않아 세포사멸이 60% 이상으로 나타난 것으로 사료된다.
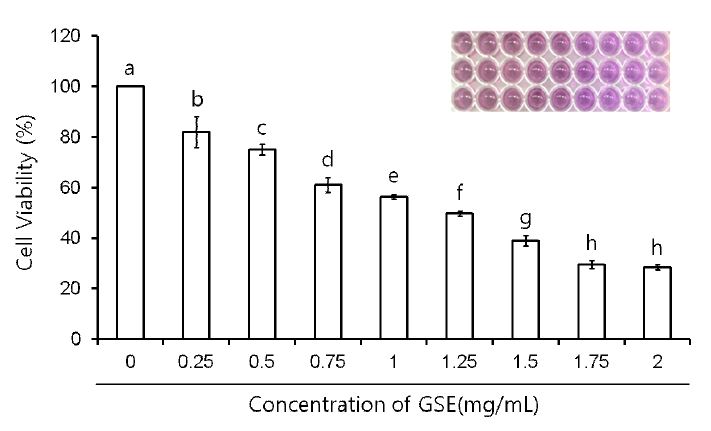
The effect of grape skin extract (GSE) on cell viability by MTT assay in MDA-MB-231 human breast cancer cells.To estimate the cell viability after GSE treatment for 72hr, 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2 mg/mL of GSE treated in MDAMB-231 cells. Cell viability decreased in does-dependent manners. The values are mean±S.D. of three independent experiments. Bars with different alphabet letters are significantly different at p<0.05. In set is a typical appearance of MTT assay 96-well microplate, showing color reaction.
Sudheer et al(2006)은 포도씨의 화합물 프로안토시아니딘을 유방암세포 4T1, MCF-7 및 MDA-MB-468에 첨가하였을 때 농도 및 시간 의존적으로 생존율 감소가 관찰되었으며, Andrew et al(2002)등은 인체의 암 세포주(유방암세포 MCF-7, 백혈병세포 HL-60, 식도편평암 HCE7, 식도선암 Bic-1 등)에 포도의 대표적인 화합물 레스베라트롤 30, 50, 100, 200, 300 μm 농도로 처리하여 농도 의존적으로 세포 증식 억제 효과가 나타났다. Sun et al(2012)은 포도껍질에서 추출한 poly- phenol을 쥣과의 유방암세포 4T1에 5∼100 ugl/mL 농도로 처리하였을 때 농도 의존적으로 생존율 감소 효과를 보였다. 이러한 보고들은 본 연구와 유사한 결과를 나타내었다.
2. Trypan Blue Staining에 의한 세포사멸(Cell Death) 분석
GSE의 처리에 따른 MDA-MB-231 세포의 사멸을 분석하기 위하여 세포막 투과성의 원리를 이용한 trypan blue 염색법을 사용하였다. 온전한 세포막을 가진 생존한 세포는 염색되지 않으며, 손상된 세포막을 가진 사멸된 세포는 염색되지 않는 원리를 통해 세포생존 및 사멸을 구분하였다.
MDA-MB-231 세포에 GSE 0.5, 1, 1.5 mg/mL의 농도로 처리하고, 72시간 후 0.1%의 trypan blue 염료를 첨가한 후 현미경 명시야에서 사진을 촬영한 결과, 농도 의존적으로 세포사멸이 관찰되었다(Fig. 2A). 추출물을 처리하지 않은 대조군에서는 대부분의 세포가 trypan blue로 염색되지 않은 생존한 모습을 관찰할 수 있었다. 반면에 GSE 농도 0.5 mg/mL 처리군에서는 수축한 모양과 함께 옅은 청색으로 염색되어진 세포들이 부분적으로 보이기 시작했다. 농도 1 mg/mL 처리군에서는 세포막이 손상되고 응축한 모양에 짙은 청색으로 염색되어진 세포들이 증가하였다. 농도 1.5 mg/mL 처리군에서는 전반적으로 응축 및 파편화된 짙은 청색을 띄는 것이 관찰되었다.
GSE 처리농도에 따른 세포 사멸을 정량 수치화하기 위하여 trypan blue 염료로 염색된 세포와 전체 세포 수를 기록하여 세포사멸율을 나타낸 결과(Fig. 2B), 추출물을 처리하지 않은 대조군은 0.1% 미만으로 대부분 생존한 세포였고, 농도 0.5 mg/mL 처리군은 13%로 사멸이 시작되어 1, 1.5 mg/mL의 처리군에서는 34%, 59%의 현저한 증가율을 보이며, 세포 사멸율이 농도 의존적으로 증가하였다(p<0.05).
Hsu et al(2009)은 포도씨의 프로시아니딘을 대장암 세포주(HT-29, SW-480, LoVo, Colo 320DM)에 첨가하여 trypan blue 염색법을 이용하여 세포생존율이 시간 및 농도 의존적으로 감소한 것으로 보아, 시간 의존적으로도 apoptosis를 일으킬 수 있는 가능성을 제시함과 동시에 포도껍질에도 다량 함유되어 있는 프로시아니딘이 탈분극 현상에 따른 막 투과성을 증가시켜 세포증식 및 종양 형성을 억제한다는 것을 확인할 수 있었다.
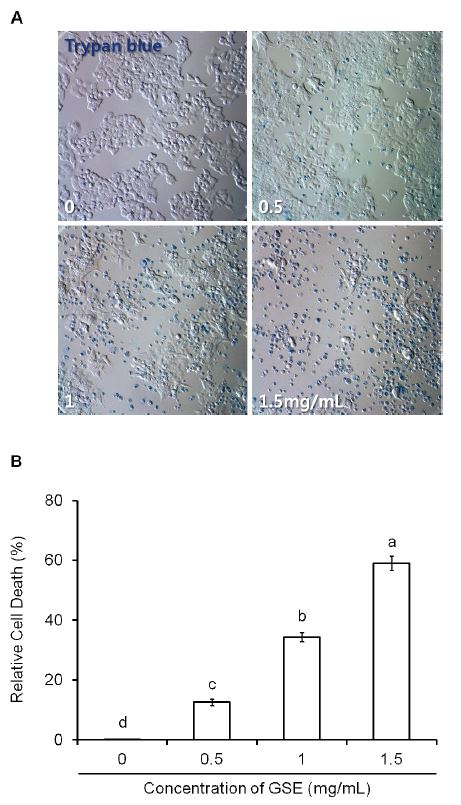
The effect of grape skin extract (GSE) on cell death as evidenced by trypan blue incorporation into MDA-MB-231 human breast cancer cells(A) After 72h of incubation with culture medium 0.5, 1, 1.5, 2 mg/mL GSE, the cells were stained or unstained with trypan blue and observed with microscopy bright field(×200). MDA- MB-231 cells induced cell death were indicated by shrinkage and positive staining for trypan blue. (B) The ratio of dead cells (blue) was calculated and reported as a percentage of the total number of cells counted. Cell death increased in does-dependent manners. The values are mean±S.D. of three independent expe- riments. Bars with different alphabet letters are significantly different at p<0.05.
3. PI/ Hoechst 33342 이중염색에 의한 Apoptosis 분석
GSE의 처리에 따른 MDA-MB-231 세포의 사멸이 일어나고 있는 세포막과 핵의 상태를 명확하게 분석하기 위하여 Hoechst 33342(blue)와 PI(red) 이중염색을 이용하여 apoptosis 및 nec- rosis를 구별하였다. 두 염료로 세포를 염색할 경우, 살아있는 세포는 온전한 핵을 가지며 파란색을 보이며, early apoptosis세포는 응축한 핵을 가지며 파란색을 나타낸다. 하지만 late apoptosis세포는 응축한 핵을 가지며 손상된 원형질막에 의해 PI가 염색되어 파란색과 빨간색을 동시에 나타내며, nec- rosis된 세포는 비교적 온전한 핵을 가지며, 원형질막이 손상되어 파란색과 빨간색을 동시에 나타낸다(Sung KJ 2000).
GSE를 0.5, 1, 1.5 mg/mL로 처리하고 72시간 지속 후 Hoe- chst 33342와 PI를 염색하여 형광현미경에서 200배 배율로 사진을 촬영하였으며, 이중염색을 통해 분석하기 위해 adobe photoshop CS6 프로그램으로 merge하였다(Fig. 3A). 추출물 처리를 하지 않은 대조군에서는 대부분의 세포가 둥근 모양의 정상적인 핵과 손상없는 원형질막을 가지고 있으면서 파란색을 띄고 있었다. 하지만 GSE 농도 0.5 mg/mL 처리군부터는 변형된 핵 모양과 함께 PI로 염색되어 파란색과 빨간색(merge시 보라색)을 동시에 띄는 세포들이 보이기 시작하였다. 농도 1 mg/mL 처리군에서는 염색질이 농축되고, 핵이 응축된 모양과 함께 원형질막이 손상된 상태로 파란색과 빨간색(보라색)을 띄는 세포들이 증가하기 시작하였다. 농도 1.5 mg/mL 처리군의 대부분의 세포들은 깨지거나, DNA 분절과 응축한 핵으로 인해 핵이 빨간색으로 염색되어 있으며, 원형질막이 손상되어 파란색과 빨간색(보라색)을 동시에 나타내었다.
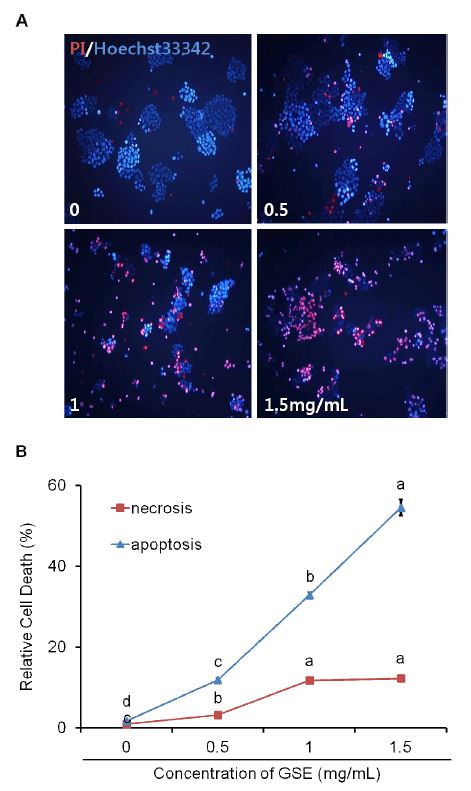
The effect of grape skin extract (GSE) on cell death by apoptosis or necrosis in MDA-MB-231 human breast cancer cells.(A) Morphological changes in MDA-MB-231 cells induced by GSE. (B) To quantitative analysis of cells death by apoptosis or necrosis in MDA-MB-231 cells, MDA-MB-231 cells stained with Hoechst 33342+PI. The ratio between apoptotic and nec- rotic cells was calculated and reported as a percentage of the total number of cell counted. Values with different alphabet of the total number of cell counted. The values represent the mean ±S.D. of three independent experiments. Values with different alphabet letters are significantly different at p<0.05.
Apoptosis와 necrosis를 구분하고 수치화하기 위하여 apop- totic 세포(early and late) 및 necrotic 세포를 3회 수행하여 평균값을 내었다(Fig. 3B). 그 결과, 대조군에서는 2%였으며, 농도 0.5, 1, 1.5 mg/mL 처리군의 apoptotic 세포는 12%, 33%, 55%로 apoptosis가 농도 의존적으로 증가하며, 유의적인 차이를 보였다(p<0.05). Necrotic 세포는 대조군과 농도 0.5, 1 mg/mL 처리군에서는 1%, 3%, 12% 으로 유의적인 차이를 보였으나, 농도 1.5 mg/mL 처리군에서는 1 mg/mL 처리군과 같은 12%로 유의적인 차이를 보이지 않았다.
세포의 apoptosis는 발현 시에 유전자가 필요하며, 수명이 다하여 사멸하는 능동적인 현상이라면, necrosis는 발현 시에 유전자가 필요없고 물리적인 힘에 의해 손상을 입거나 염증으로 파손되어 사멸하는 수동적인 현상으로 GSE를 처리한 MDA-MB-231세포의 apoptosis가 급격한 증가를 보인 것은 세포증식 억제 효과를 증명해 주었으나, necrosis가 조금 증가한 것은 GSE의 농도가 높아 세포에 독성으로서 작용한 것도 있다고 판단되어진다.
Engelbrecht et al(2007)은 포도씨의 프로안토시아니딘이 대장암 세포(CaCo2)에 Hoechs33342와 PI로 염색한 결과, 10 μg/mL 처리군에서는 PI양성 핵 염색을 유도하지 않았지만, 50과 100 μg/mL 처리군에서는 PI 양성염색도 현저히 증가하는 것으로 apoptosis유도를 확인하였으며, Jin et al(2010)은 플라보노이드의 다이드제인을 유방암세포 MCF-7에 첨가하여 응축된 핵을 가진 apoptotic세포가 25, 50, 100 μM(24hr)처리군에서 농도 의존적으로 증가하는 것으로 본 연구와 유사한 결과를 나타내었으며, 세포내 핵을 Hoechst 33342와 PI로 염색하였을 때 apoptosis가 일어난 세포는 apoptotic body가 농도 의존적으로 증가하여 핵이 응축되는 것과 같은 형태학적 변화가 뚜렷하게 관찰된다는 것을 알 수 있었다.
4. Cell Cycle의 Sub-G1을 통한 Apoptosis 분석
GSE에 의한 MDA-MB-231 세포 증식 억제 효과가 apoptosis 유도에 의한 것인지 알아보기 위해 apoptosis를 정량적으로 분석하는 flow cytometry를 이용하여 Sub-G1 phase의 DNA fragmentation 및 DNA content 변화를 관찰하였다(Lee et al 2002).
GSE를 처리한 72시간 후 MDA-MB-231세포의 apoptosis 유도 기전 결과(Fig. 4A), 추출물을 처리하지 않은 대조군은 sub-G1 phase의 응축된 핵과 DNA content는 낮았지만, GSE 0.5 mg/mL 농도를 첨가하였을 때 DNA fragmentation 및 content가 16.1%로 증가하였다. 또한 1 mg/mL와 1.5 mg/mL 농도에서는 58.1%와 74.3%로 S phase의 세포가 빠져나가면서 sub-G1 phrase의 DNA content가 증가(p<0.05)(Fig. 4B)하는 것을 보아, apoptosis가 농도 의존적으로 유도되는 것을 확인하였다. 결과적으로 세포주기의 G0/G1 arrest 발생으로 S기로의 진행에 영향을 주어 DNA 합성이 저해되었으며, sub-G1 phase에 apoptotic 세포의 점진적인 축적이 일어나 apoptosis를 유도한다고 사료된다.
Hong & Yi-min(2006)은 프로안토시아니딘 추출물이 인체 급성골수성 백혈병14.3D10 세포에서 세포사멸을 유도하는지 알아보기 위하여 PI로 염색 후 flow cytometry를 이용하여 sub-G1의 DNA 분획물을 통해 apoptosis된 핵의 비율을 결정하였으며, Benitez et al(2007)등의 연구에서는 레스베라트롤을 처리한 전립선 암세포주(LNCaP, PC-3 및 PZ-HPV-7)의 apoptosis 유도를 확인하기 위하여, RNase 처리 후 PI dye를 측정한 결과, 100 μM 및 150 μM 범위의 농도에서 LNCaP와 PC-3 전립선암세포의 세포사멸 속도를 증가시킨다는 것을 보고하여 포도껍질에 함유된 프로안토시아니딘과 레스베라트롤이 다른 암세포에서 apoptosis를 일으켜 DNA가 절편 및 분획되어지고, 이는 세포증식 억제 효과를 지닐 수 있음을 시사하였다.
또한, 이러한 연구들은 본 실험과 같이 flow cytometry를 통하여 sub-G1 phase의 DNA-hypodiploid 형태가 농도 의존적으로 증가하는 동일한 결과를 나타내는 것으로 보아 GSE에 의해 apoptosis가 유도되는 것을 확인할 수 있었다.

The effect of grape skin extract (GSE) on the cell cycle progression in MDA-MB-231 human breast cancer cells.(A) Cell cultures were treated with 0∼1.5 mg/mL of GSE during 72 hours. Representative histograms of flow cytometry experiments showing cell distribution upon DNA content in absence or presence of GSE. Cell distribution in the sub-G1, G0/G1, S and G2/M phases of cell cycle was evaluated by flow cytometry using PI staining. The region corresponding to cells with sub-G1 DNA content (considered as apoptotic cells) is indicated as P5. (B) Accumulation of cells in the sub-G1 phase has been considered to be the marker of apoptotic cell death. Data were expressed as means±S.D. of 3 different experiments. Bars with different alphabet letters are significantly different at p<0.05.
5. Annexin V-FITC와 PI 염색에 의한 Early, Late Apop- tosis 및 Necrosis 분석
GSE에 의한 MDA-MB-231세포의 정량분석을 통해 apop- tosis의 유도를 확인하였지만, sub-G1 phase는 핵의 변화가 나타나야 측정이 가능한 상태로 annexin V-FITC 방법보다 세포의 표시가 적게 나타날 수 있다. 그래서 초기 단계의 세포도 반응을 잘 보이며, early apoptosis, late apoptosis 및 necrosis가 농도에 따라 의미있게 증가되는지 구분하기 위하여 fluore- scein isothiocyanate(FITC)-labeled annexin V(Annexin V-FITC) 와 PI 이중염색법을 이용하였다. 농도별 총 10,000개의 세포 early apoptosis, late apoptosis 및 necrosis의 정도는 annexin V+/PI−, annexin V+/PI+ 및 annexin V−/PI+의 염료반응비율로 결정한다.
실험 결과, 농도가 증가함에 따라 점차적으로 형광밀도가 높아지는 것이 관찰되었다(Fig. 5). GSE 투여 72시간 후의 대조군과 처리군에서 발생한 세포사멸의 변화는 viable cell/ early apoptotic cell/ late apooptotic cell/ necrotic cell(%)로 진행 중인 세포의 구성 결과, 대조군은 annexin V와 PI 음성반응 밀도가 높으며, 89.6%, 3.9%, 6.0%, 0.5%로 viable 세포가 많았다. GSE 0.5 mg/mL 처리군에서는 79.6%, 7.0%, 11.9%, 1.3%로 대조군에 비하여 viable 세포는 약 10%가 더 줄었으나, annexin V 양성, PI 음성반응인 세포 early apoptosis와 모두 양성반응을 나타내는 세포 late apoptosis의 밀도가 조금 높아지는 것으로 보아 apoptosis가 진행되기 시작한 것을 알 수 있었다. 또한, GSE 1 mg/mL 처리군에서는 60.3%, 8.8%, 28.9%, 2.0%로 viable 세포가 줄어들고, early apoptosis와 late apoptosis 세포가 증가하였으며, necrosis 세포가 2%로 약간 증가하는 것으로 보아 apoptosis와 necrosis세포가 공존하는 것으로 사료되었다. GSE 1.5 mg/mL 처리군에서는 32.9%, 4.4%, 58.5%, 4.2%로 viable 세포는 급격히 줄어든 모습을 보였으며, early apoptosis의 밀도는 4.4%로 1 mg/mL 처리군 8.8%보다 낮아졌지만, late apoptosis는 58.5%로 급격히 증가하였다. 이러한 결과를 바탕으로 GSE를 처리한 MDA-MB-231세포는 농도가 증가할수록 DNA 손상과 apoptosis 진행이 초기와 후기 모두 증가하지만 1.5 mg/mL부터는 오히려 early apoptosis는 감소하고, late apoptosis가 많이 일어나는 것으로 보아 GSE는 전체세포의 초기보다 후기의 apoptosis에 미치는 영향이 크다는 것을 관찰할 수 있었다. 또한, Hoechst/PI 이중염색 결과와 같이 necrosis는 미세하게 증가하였는데, 이는 농도 증가로 인한 독성이 영향을 미치는 것으로 사료된다.
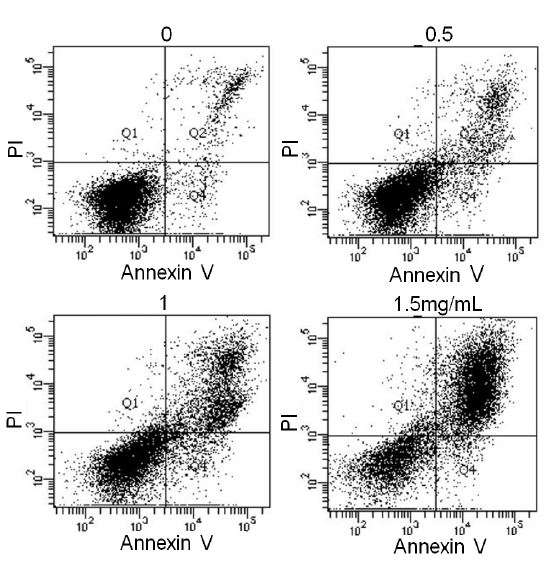
The effect of grape skin extract (GSE) on apotosis in MDA-MB-231 human breast cancer cells.After 72hr of incubation with culture medium 0.5, 1, 1.5, 2 mg/mL GSE, the apoptotic and necrotic cell death was asse- ssed by measuring the exposure of phosphatidylserine residues on the cell surface (double staining with annexin Ⅴ-FITC and PI). Legend for cytogram : the lower left quadrant includes the viable cells, which are negative for annexin V-FITC binding (annexin V−) and exclude PI (PI−); the lower right right quadrant include early apoptosis cells, which are positive for annexin V-FITC binding (annexin V+) but PI−; the upper right quadrant represent the late apoptotic cells, which are annexin V+ and show PI uptake (PI+); the upper left quadrant repre- sents necrotic cells, which are annexin V−/PI+.
Hsu et al(2009)은 농도 50 mg/L 안토시아니딘을 대장암 세포주(HT-29, SW-480, LoVo, Colo 320DM)에 첨가한 후, annexin V-FITC을 통해 SW480, HT-29와 LoVo 세포가 30%, 50%와 60%로 유의적으로 증가하고, Colo 320DM는 10% 정도로 증가하는 것으로 apoptosis를 분석하였으며, Jin et al (2010)은 플로보노이드의 다이드제인 농도 25, 50, 100 μM (24hr)를 유방암세포 MCF-7에 첨가한 후 annexin V 양성과 PI 음성반응의 early apoptosis를 관찰한 것으로 보아, 포도껍질의 안토시아니딘이 유방암뿐만 아니라, 다른 암세포의 항증식에 효과가 있으며, 플로보노이드는 농도의존적으로 유방암세포의 apoptosis를 유도할 수 있음을 시사하였다. 또한, 세포의 apoptosis가 발생하면 세포형태의 변화뿐만 아니라, apop- tosis signal에 의해 세포막 내면에 있던 phosphatidyl serine(PS)을 세포표면으로 이동시키는데, 이때 단백질 annexin V-FITC 염료는 PS와 선택적으로 결합하고, PI 염료는 DNA와 RNA의 이중 사슬에 결합하므로 apoptosis를 보다 명확하게 구분할 수 있도록 한다는 것을 알 수 있었다(Zhang et al 1997).
6. RT-PCR에 의한 세포사멸 유전자 발현 분석
포도껍질 추출물 처리에 따른 유방암 세포 MDA-MB-231의 mRNA 발현에 미치는 영향을 관찰하기 위하여 apoptosis 유도 신호전달 기전에 중요한 유전자 bcl-2, bax, procaspase-3를 통해 세포사멸효과를 확인하였으며, 대조군으로 house- keepingene인 β-actin을 이용하여 비교하였다.
DNA 손상 등의 죽음을 나타내는 신호는 미토콘드리아를 경유하는 내인성 기전에 의해 활성화되며, 이 과정은 bcl-2 family gene의 세포사 억제유전자(antiapoptotic molecule: bcl-2, bcl-XL, mcl-1)와 세포사 촉진 유전자(proapoptotic molecule: bax, bak, bcl-Xs)의 균형에 의해 조절된다. Bax 유전자는 기능이 정반대인 bcl-2유전자와 bcl-2/bax 이형이량체(heterodi- mer)를 형성하여 bcl-2의 작용에 길항물질로 작용해 apoptosis를 억제하며, bax/bax의 동형이량체(homodimer)는 apoptosis를 유도한다(Cho et al 2000; Lee et al 2006).
세포 증식을 촉진시키기보다는 apoptosis를 차단 및 억제시키는 유전자인 Bcl-2의 발현은 농도 0.5 mg/mL 처리군에서부터 대조군 대비 비율 0.60으로 감소하였으며, 1 mg/mL과 1.5 mg/mL 처리군에서는 0.31과 0.17로 급격한 감소율을 보임으로서 농도 의존적으로 유의적인 감소를 나타내었다(p<0.05) (Fig. 6A, 6B). Apoptosis를 촉진 및 유도하는 유전자인 bax의 발현은 농도 0.5와 1 mg/mL 처리군에서 1.82와 1.94 비율로 증가하였으며, 농도 1.5 mg/mL 처리군에서는 2.70 비율로 약 3배 정도 증가하여 농도가 증가함에 따라 유의적으로 증가하였다(p<0.05)(Fig. 6A, 6B). 이러한 결과를 바탕으로 proapoptotic인 bax의 과발현은 세포사멸을 촉진하나, 반대로 antiapoptotic인 bcl-2의 과발현은 bax의 기능을 억제함으로써 apoptosis를 억제한다고 사료된다. Takako et al(2010)은 유방암세포 MCF-7에 에스트로겐수용체로 세포사멸에 대해 연구하였는데, bcl-2/ bax의 비율이 0.70로 감소하는 것을 보고, apoptosis 및 환원이 이루어진다고 보고하였으며, 본 실험에서도 GSE을 처리한 세포의 bcl-2/bax 비율을 구해본 결과, 농도 0.5, 1, 1.5 mg/mL 처리군이 0.60, 0.31, 0.17 로 유의적으로 감소하여 apoptosis를 촉진하는 것으로 나타났다(p<0.05)(Fig. 7).
GSE의 농도가 증가함에 따라 bcl-2의 감소, bax의 증가, bcl-2/bax 비율의 감소가 유의적으로 나타나는 것으로 보아, GSE가 apoptosis를 유도하는 것으로 사료되었으며 Zhou et al(2003)은 레스베라트롤을 첨가한 인체 식도암세포 EC-9706세포의 bcl-2/bax비율 감소와 bcl-2 발현 감소와 bax 발현 증가를 보고 apoptosis가 매개되어진다고 보고하였는데, 이는 본 연구와 유사한 결과를 나타내었다.
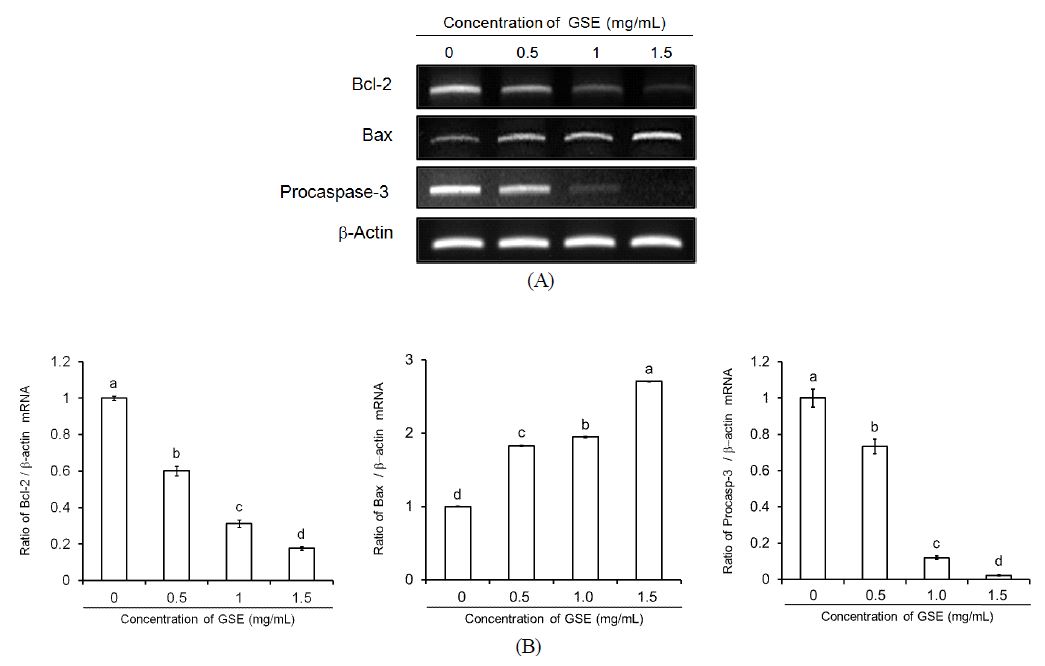
The effect of grape skin extract (GSE) on Bcl-2, Bax, Procaspase-3 mRNA expression in MDA-MB-231 human breast cancer cells.(A) Image of chemiluminescent detection of RT-PCR. (B) Quantitative analysis of RT-PCR products. The values represent the mean±S.D. of three independent experiments. Bars with different alphabet letters are significantly different at p<0.05.
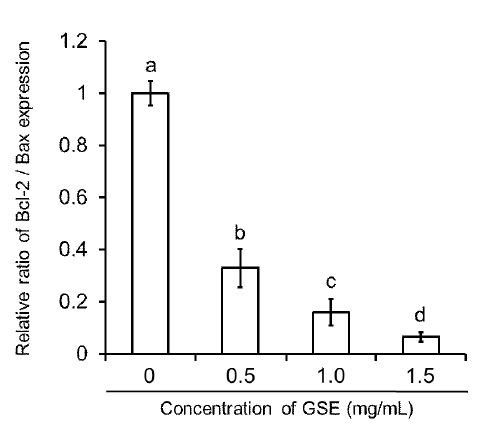
The effect of grape skin extract (GSE) on Bcl-2/ Bax ratio in MDA-MB-231 human breast cancer cells.To estimate the apoptosis-ratio by Bcl-2, Bax gene expression, each bar of Bcl-2/Bax ratio represents the mean±S.D. of three independent experiments. Bars with different alphabet letters are significantly different at p<0.05.
Apoptosis의 신호가 전달되면 미토콘드리아 막의 투과성을 증가시켜 cytochrome-c를 세포질로 방출하게 하며, 이 cytoch- rome-c는 dATP와 결합하여 apaf-1와 apoptosome을 형성한다. 이는 caspase-3, caspase-7, caspase-9 등의 effector molecule을 활성화(단백질 절단)시켜 최종적인 세포자멸사를 유발하게 된다(Samali et al 1998). Caspase(cystein-dependent aspartate- specific protease)는 apoptosis가 일어날 때 활성화되는 단백질 분해효소로서 core effector로 간주되고, caspase-3는 apoptosis를 중재하는 미토콘드리아와 수용체의 주요 매개체이다(Zhang et al 2010). 세포질 안에 들어있는 비활성 상태인 procas- pase-3의 단백질 가수분해 절단으로 caspase-3가 활성상태가 될 수 있으므로 procaspase-3의 감소는 활성화된 caspase-3 의 증가를 간접적으로 나타낸다.
GSE를 처리한 MDA-MB-231세포에 procaspase-3로 처리한 결과, 농도 0.5 mg/mL 처리군에서 0.73 비율이 나왔으며, 1, 1.5 mg/mL 처리군에서는 0.11, 0.02 비율로 급격하게 감소하며, 농도 의존적으로 유의적 차이를 보였다(p<0.05)(Fig. 6A, 6B). 이에 따라 bcl-2의 감소와 bax의 증가 결과는 비활성화 procaspase-3가 caspase-3로 가수분해되면서 활성화(pro- caspase-3 감소, caspase-3 증가)시켜 apoptosis를 유도하는 것으로 사료된다. Zhang et al(2010)은 포도씨의 올리고머 프로시아니딘이 인체 악성뇌교종 U-87세포의 apoptosis 유도를 관찰하였는데, 이를 분석한 방법이 본 연구와 같았으며, procas- pase의 발현을 통해 caspase-3의 활동 부재를 알아내고자 하였다.
결론 및 요약
GSE의 농도별 처리가 인체 유방암 세포 MDA-MB-231의 세포사멸에 미치는 영향을 확인하기 위하여 탈수소효소반응을 이용한 MTT 분석, 세포막투과성을 이용한 trypan blue 염색분석, Hoechst 33342/PI 형광염료의 이중 핵 염색분석, FACS 기기를 이용한 cell cycle 분석과 annexin V-FITC/PI 염색분석을 통하여 세포사멸을 관찰하였다. MTT 분석 결과, 1 mg/mL와 1.5 mg/mL 처리군 사이에서 약 50%의 세포사멸을 나타내었으며, 세포사멸이 농도 의존적으로 증가되었고(p<0.05), trypan blue 염색법을 이용한 세포사멸 분석에서는 1.5 mg/mL 처리군에서 약 60%의 현저한 증가율을 나타내며, 농도 의존적으로 증가되었다(p<0.05). 세포사멸 중에서도 세포자멸사(apop- tosis)와 괴사(necrosis)를 구분하기 위하여 이중 핵 염색 분석을 한 결과, 예정세포사인 apoptosis가 농도 의존적으로 급격히 증가되었다(p<0.05). 보다 더 명확한 세포사멸을 확인하기 위하여 FACS를 이용해 cell cycle sub-G1 phase의 DNA con- tent를 확인한 결과, apoptosis가 1 mg/mL에서 약 60%로 급격히 증가하였고, 농도 의존적으로 증가되었다(p<0.05). FACS를 이용한 또 다른 annexinⅤ-FITC/PI 염색분석으로 apoptosis를 명확히 구분하였는데, early apoptosis보다는 late apoptosis가 농도 의존적으로 급격히 증가하였고(p<0.05), 특히 1.5 mg/mL에서 약 60%의 late apoptosis를 보였다. 세포사멸관련 mRNA 유전자 발현을 관찰한 결과, 세포사멸 억제 유전자 bcl-2는 처리농도가 증가할수록 유의적 감소를 보였으며(p<0.05), 세포사멸 유도 유전자인 bax는 농도 의존적으로 유의적 증가를 보였다(p<0.05). Apoptosis의 지표인 bcl-2/bax의 비율은 농도 의존적인 감소를 나타내었으며(p<0.05), 세포사멸유도의 주요 매개자인 procaspase-3는 caspase-3로 활성화되면서 농도 의존적인 감소를 나타냈다(p<0.05). 결론적으로 포도껍질 추출물은 유방암 세포 MDA-MB-231의 세포 증식 억제 및 세포사멸을 유도하는 것으로 사료되어 천연항암물질의 가능성을 제시해 주었다.
REFERENCES
- Andrew, K., Hui, L., Masumi, S., Muhammet, EV., Danhua, X., Bernard, W., (2002), Resveratrol induces growth inhibition, s-phase arrest, apoptosis, and changes in biomarker expression in several human cancer cell lines, Clin Cancer Res, 8, p893.
- Aggarwal, BB., Bhardwaj, A., Aggarwal, RS., Seeram, NP., Shishodia, S., (2004), Role of resveratrol in prevention and therapy of cancer: Preclinical and clinical studies, Anticancer Res, 24, p2783-2840.
-
Benitez, DA., Pozo-Guisado, E., Alvarez-Barrientos, A., Fernandez-Salguero, PM., Castellón, EA., (2007), Mechanisms involved in resveratrol induced apoptosis and cell cycle arrest in prostate cancer-derived cell lines, J Andrology, 28, p282-293.
[https://doi.org/10.2164/jandrol.106.000968]

- Bertelli, AA., Ferrara, F., Diana, G., Fulgenzi, A., Corsi, M., Ponti, W., Ferrero, ME., Bertelli, A., (1998), Resveratrol, a natural stilbene in grapes and wine, enhances intraphagocytosis in human promonocytes: A co-factor in antiinflammatory and anticancer chemopreventive activity, Int J Tissue React, 21, p93-104.
- Cho, SM., Kim, SS., Hwang, YS., (2000), The apoptosis and expression of bcl-2, bcl-xs, bax proteins in fetal brain after treating pregnant mice with endotoxin, J Korean Pediatr Soc, 43, p97-104.
-
Demrow, HS., Slane, PR., Folts, JD., (1995), Administration of wine and grape juice inhibits in vivo platelet activity and thrombosis in stenosed canine coronary arteries, Circul, 91, p1182-1188.
[https://doi.org/10.1161/01.CIR.91.4.1182]

-
Engelbrecht, AM., Mattheyse, M., Ellis, B., Loos, B., Thomas, M., Smith, R., Peters, S., Smith, C., Myburgh, K., (2007), Proanthocyanidin from grape seeds inactivates the PI3-kinase/PKB pathway and induces apoptosis in a colon cancer cell line, Cancer Lett, 258, p144-153.
[https://doi.org/10.1016/j.canlet.2007.08.020]

-
God, JM., Tate, P., Larcom, LL., (2007), Anticancer effects of four varieties of muscadine grape, J Med Food, 10, p54-59.
[https://doi.org/10.1089/jmf.2006.699]

-
Hatcher, H., Planalp, R., Cho, J., Torti, FM., Torti, SV., (2008), Curcumin: from ancient medicine to current clinical trials, Cell and Mol Life Sci, 65, p1631-1652.
[https://doi.org/10.1007/s00018-008-7452-4]

- Hong, HU., Yi-min, Q., (2006), Grape seed proanthocyanidin extract induced mitochondria-associated apoptosis in human acute myeloid leukaemia 14.3D10 cells, Chin Med J, 119, p417-421.
- Hsu, CP., Lin, YH., Chou, CC., Zhou, SP., Hsu, YC., Liu, CL., Ku, FM., Chunh, YC., (2009), The mechanisms of grape seed procyanidin-induced apoptosis in colorectal carcinoma cells, Anticancer Res, 29, p283-289.
-
Hudson, TS., Hartle, DK., Hursting, SD., Nunez,, NP., Wang, TT., Young, HA., Arany, P., Green, JE., (2007), Inhibition of prostate cancer growth by muscadine grape skin extract and resveratrol through distinct mechanisms, Cancer Res, 67, p8396-8405.
[https://doi.org/10.1158/0008-5472.CAN-06-4069]

-
Jayaprakasha, GK., Singh, RP., Sakariah, KK., (2001), Antioxidant activity of grape seed(Vitis vinifera) extracts on peroxidation models in vitro, Food Chem, 73, p285-290.
[https://doi.org/10.1016/S0308-8146(00)00298-3]

-
Jeong, HJ., Park, SB., Kim, S., Kim, HK., (2007), Total polyphenol content and antioxidative activity of wild grape(Vitis coignetiae) extracts depending on ethanol concentrations, J Korean Soc Food Sci Nutr, 36, p1491-1496.
[https://doi.org/10.3746/jkfn.2007.36.12.1491]

-
Jin, S., Zhang, QY., Kang, XM., Wang, JX., Zhao, WH., (2010), Daidzein induces MCF-7 breast cancer cell apoptosis via the mitochondrial pathway, Ann Oncol, 21, p263-268.
[https://doi.org/10.1093/annonc/mdp499]

- Kim, DS., Kim, HY., Linton, JA., (2000), Apoptosis of peripheral blood mononuclear cells in different ages of normal children, J Korean Pediatr Soc, 43, p463-469.
-
Kluck, RM., Bossy-Wetzel, E., Green, DR., Newmeyer, DD., (1997), The release of cytochrome c from mitochondria; a primary site for Bcl-2 regulation of apoptosis, Sci, 275, p1132-1136.
[https://doi.org/10.1126/science.275.5303.1132]

- Kovac, V., Pekic, B., (1991), Proanthocyanidols from grape and wine, Contem Agri, 39, p5-17.
- Lee, SD., Park, SW., Hong, SA., Kwon, GY., Lee, TJ., (2006), Expression of survivin, HSP90, bcl-2 and bax proteinsin Nbutyl-N-(4-hydroxybutyl) nitrosamine-induced rat bladder carcinogenesis, Korean J Pathol, 40, p333-338.
-
Lee, SMY., Li, MLY., Tse, YCT., Steve, LCL., Lee, MMS., Tsui, SKW., Fung, KP., Lee, CY., Waye, MMY., Radix, P., (2002), Paeoniae Radix, a Chinese herbal extract, inhibit hepatoma cells growth by inducing apoptosis in a p53 independent pathway, Life Sci, 71, p2267-2277.
[https://doi.org/10.1016/S0024-3205(02)01962-8]

-
Morré, DM., Morré, DJ., (2006), Anticancer activity of grape and grape skin extracts alone and combined with green tea infusions, Cancer lett, 238, p202-209.
[https://doi.org/10.1016/j.canlet.2005.07.011]

-
Moura, RS., Viana, FS., Souza, MAV., Kovary, K., Guedes, DC., Oliveira, EP., Rubenich, LM., Carvalho, LC., Oliveira, RM., Tano, T., Correia, ML., (2002), Antihypertensive, vasodilator and antioxidant effects of a vinifera grape skin extract, J Pharm Pharmacol, 54, p1515-1520.
[https://doi.org/10.1211/002235702153]

- Nijveldt, RJ., van Nood, E., van Hoorn, DE., Boelens, PG., van Norren, K., (2001), Flavonoids: A review of probable mechanisms of action and potential applications, Am J Clin Nutr, 74, p418-425.
-
Peterson, J., Dwyer, J., (1998), Flavonoids: Dietary occurrence and biochemical activity, Nutr Res, 18, p1995-2018.
[https://doi.org/10.1016/S0271-5317(98)00169-9]

-
Rockenbach, II., Gonzaga, LV., Rizelio, VM., Gonçalves, AEDSS., Genovese, MI., Fett, R., (2011), Phenolic compounds and antioxidant activity of seed and skin extracts of red grape(Vitis vinifera and Vitis labrusca) pomace from Brazilian wine making, Food Res Intern, 44, p897-901.
[https://doi.org/10.1016/j.foodres.2011.01.049]

-
Saito, M., Hosoyama, H., Ariga, T., Kataoka, S., Yamaji, N., (1998), Antiulcer activity of grape seed extract and procyanidins, J Agric Food Chem, 46, p1460-1464.
[https://doi.org/10.1021/jf9709156]

-
Samali, A., Zhivotovsky, B., Jones, DP., Orrenius, S., (1998), Detection of pro-caspase-3 in cytosol and mitochondria of various tissues, FEBS Lett, 431, p167-169.
[https://doi.org/10.1016/S0014-5793(98)00740-6]

-
Son, BH., Kwak, BS., Kim, JK., Kim, HJ., Hong, SJ., (2006), Changing patterns in the clinical characteristics of Korean patients with breast cancer during the last 15 years, Arch Surg, 141, p155-160.
[https://doi.org/10.1001/archsurg.141.2.155]

-
Stein, JH., Keevil, JG., Wiebe, DA., Aeschlimann, S., Folts, JD., (1999), Purple grape juice improves endothelial function and reduces the susceptibility of LDL cholesterol to oxidation in patients with coronary artery disease, Circul, 100, p1050-1055.
[https://doi.org/10.1161/01.CIR.100.10.1050]

- Sudheer, KM., Manjeshwar, SB., Santosh, KK., (2006), Grape seed proanthocyanidins induce apoptosis and inhibit metastasis of highly metastatic breast carcinoma cells, Carcinogenesis, 27, p1682-1691.
- Sung, KJ., (2000), Assays for apoptotic events, Korean J Dermatol, 7, p209-213.
-
Sun, T., Chen, QY., Wu, LJ., Yao, XM., Sun, XJ., (2012), Antitumor and antimetastatic activities of grape skin polyphenols in a murine model of breast cancer, Food Chem Toxicol, 50, p3462-3467.
[https://doi.org/10.1016/j.fct.2012.07.037]

-
Udenigwe, CC., Ramprasath, VR., Aluko, RE., Jones, PJ., (2008), Potential of resveratrol in anticancer and anti inflammatory therapy, Nutrition Rev, 66, p445-454.
[https://doi.org/10.1111/j.1753-4887.2008.00076.x]

- Venkateswaran, KV., Mathuram, LN., Parthiban, TM., (2013), Antiproliferative avtivity of Tinospora cordifolia determined by cell count and trypan blue dye exclusion method in MCF-7 cells, Int J Bioassays, 2, p719-722.
-
Vitseva, O., Varghese, S., Chakrabarti, S., Folts, JD., Freedman, JE., (2005), Grape seed and skin extracts inhibit platelet function and release of reactive oxygen intermediates, J Cardio Pharm, 46, p445-451.
[https://doi.org/10.1097/01.fjc.0000176727.67066.1c]

-
Yang, J., Liu, X., Bhalla, K., Kim, CN., Obrado, AM., Cai, J., Wang, X., (1997), Prevention of apoptosis by Bcl-2: Release of cytochrome c from mitochondria blocked, Sci, 275, p1129-1132.
[https://doi.org/10.1126/science.275.5303.1129]

-
Yun, JW., Lee, WS., Kim, MJ., Lu, JN., Kang, MH., Kim, HG., Kim, DC., Choi, EJ., Choi, JY., Kim, HG., Lee, YK., Ryu, CH., Kim, GS., Choi, YH., Park, OJ., Shin, SC., (2010), Characterization of a profile of the anthocyanins isolated from Vitis coignetiae pulliat and their anti-invasive activity on HT-29 human colon cancer cells, Fd Chem Toxic, 48, p903-909.
[https://doi.org/10.1016/j.fct.2009.12.031]

-
Zhang, FJ., Yang, JY., Mou, YH., Sun, BS., Wang, JM., Wu, CF., (2010), Oligomer procyanidins from grape seeds induce a paraptosis-like programmed cell death in human glioblastoma U-87 cells, Eur J Pharm Bio, 48, p883-890.
[https://doi.org/10.3109/13880200903311102]

- Zhang, G., Gurtu, V., Kain, SR., Yan, G., (1997), Early detection of apoptosis using a fluorescent conjugate of annexin V, Biotechniques, 23, p525-531.
- Zhou, HB., Yan, Y., Sun, YN., Zhu, JR., (2003), Resveratrol induces apoptosis in human esophageal carcinoma cells, World J Gastroenterol, 9, p408-411.

