
오미자(Schizandra chinensis) 종자 추출물의 멜라닌 형성 저해 및 피부 탄력에 미치는 영향
Abstract
Schizandra chinensis seeds contain various physiologically active compounds, and their antioxidant, anti-inflammatory, and antibacterial properties have been previously reported. However, studies on their effects on melanogenesis and skin elasticity are still limited. Therefore, this study aimed to investigate the effects of Schizandra chinensis seed extracts on skin-related functions, focusing on melanogenesis and elasticity at both the cellular and gene expression levels. Water and 70% ethanol were used as extraction solvents to prepare water extracts (WES) and ethanol extracts (EES) of Schizandra chinensis seeds. These extracts were tested at concentrations of 10, 50, 100, and 200 μg/mL. To assess melanin production, B16F10 cells were stimulated with 3-isobutyl-1-methylxanthine(IBMX), followed by treatment with WES and EES. The results showed that both extracts effectively inhibited melanin synthesis at the cellular level. To investigate the underlying mechanism, reverse transcription-polymerase chain reaction(RT-PCR) analysis was performed. The expression levels of tyrosinase-related protein(TRP)-1 and 2, the key genes involved in melanin synthesis, were significantly downregulated, indicating inhibition of melanogenesis. Furthermore, treatment with WES and EES significantly upregulated the mRNA expression of fibronectin and collagen type I alpha 2 chain(Col1α2), genes associated with skin elasticity effect. These findings suggest that Schizandra chinensis seed extracts have potential as natural functional ingredients for skin health as they exhibit both anti-melanogenic and elasticity-enhancing properties. Thus, they may be useful in the development of skin-beneficial functional foods or cosmetics.
Keywords:
Schizandra chinensis seeds, skin, melanogenesis, elasticity서 론
피부는 신체를 둘러싸고 있는 가장 큰 기관으로 외부 환경으로부터 신체 내부를 보호하며, 체온 조절뿐만 아니라, 수분 손실 방지 및 미생물 감염으로부터 체내를 보호하는 다양한 기능을 한다(Rittié L & Fisher GJ 2002; Zhang S & Duan E 2018). 피부는 구조적으로 표피, 진피 및 피하지방으로 구성되어 있으며 피부의 가장 외곽을 이루고 있는 표피는 세포 형성, 분화 및 분열 과정을 반복하여 항상성을 유지하는 피부 장벽 역할을 한다(Burgdorf WHC & Bickers DR 2015). 표피의 95%를 차지하는 각질형성세포는 기저층에서 세포 분열을 통해 증식하고, 표면으로 이동하면서 각질형성세포로 분화한다(Feingold KR 등 1991). 또한 각질세포가 기저층에서 표피의 가장 바깥쪽 층인 각질층으로 분화함에 따라 세포의 모양은 더욱 평평해진다(Feingold KR 등 2007).
멜라닌은 표피의 기저층에 존재하는 멜라닌 세포에서 합성되어, 수지상 돌기를 통해 표피의 각질형성세포로 이동하여 피부색을 나타내는 색소로 작용하며(Kim KY & Lee NK 2014), 자외선과 같은 외부의 유해한 인자들로부터 피부를 보호하는 역할을 한다(D’Mello SA 등 2016). 피부의 색소 침착 반응은 자외선에 의해 각질형성세포와 멜라닌 세포에서 α-melanocyte stimulating hormone(MSH)과 세포막 수용체와 결합, 세포 내 cAMP양을 증가시켜 tyrosinase의 활성을 유도하여 tyrosine을 3,4-dihydroxyphenylalanine(DOPA), DOPA quinone으로 전환 시키고, DOPA quinone은 산화 효소반응으로 DOPA chrome을 거쳐 tyrosinase related protein(TRP)-1과 TRP-2에 의해 멜라닌을 생성한다(Tsukamoto K 1992). 피부에서 이러한 멜라닌이 과잉 생산되어 축적되면 주근깨, 기미 및 피부 반점 등을 유발하고 더 나아가 피부암과 같은 질병으로 이어질 수 있다(Yoon JW 등 2013).
진피는 섬유아세포와 세포사이의 세포외기질로 구성되어 있으며, 세포외기질은 피부의 구조적 지지와 강도 및 탄력을 제공하는 콜라겐, 엘라스틴, 수분 결합 및 압축성을 조절하는 물질 등을 포함한다(Kendall RT & Feghali-Bostwick CA 2014). 콜라겐은 세포외기질을 구성하는 주요 구조 단백질 중 하나로, 인장 강도 부여 및 세포구조 유지 등 인체를 보호하는 필수적인 역할을 수행한다(Jung KM 등 2021). 진피의 섬유아세포 노화는 세포 크기의 감소, 기능 저하 및 콜라겐양의 감소 등으로 주름 발생, 진피층의 위축, 건조 등 진피층의 변형을 특징으로 진행된다(Jang SH 등 2022). 파이브로넥틴은 세포외기질(extracellular matrix, ECM)과 다양한 세포 간의 상호작용을 매개하는 다기능성 접착 단백질로, 세포의 부착, 이동, 성장 및 분화 등 생리학적 과정에 핵심적인 역할을 한다(Pankov R & Yamada KM 2002). 특히, 파이브로넥틴은 콜라겐과 직접 결합하여 조직 복구 과정을 촉진하고, 피부 구조의 밀착성과 탄력성을 유지하는 데 중요한 기여를 한다(Argirova MD & Ortwerth BJ 2003). 이러한 섬유구조 단백질의 발현 증가는 피부 주름 형성을 억제하고 탄력 개선에 효과적이므로, 피부 건강 증진을 위한 주요 표적으로 주목받고 있다. 이에 따라, 피부 섬유 단백질의 생합성을 유도할 수 있는 천연 유래 기능성 소재의 탐색에 대한 연구가 활발히 이루어지고 있다(Liu LK 등 2009).
오미자(Schizandra chinensis Baillon)는 목련과의 넝쿨성 식물인 오미자 나무의 열매로, 짙은 붉은 빛의 공 모양으로 지름이 약 1 cm이며, 속에는 붉은 즙과 적갈색의 종자가 1~2개 들어 있다(Kim MS 등 2017). 오미자 열매는 신맛, 단맛, 쓴맛, 짠맛 및 매운맛의 5가지 맛을 나타내며, 약리작용 또한 우수하다고 알려져 약용 및 식용으로 이용되고 있다(Lee WY 등 2006). 오미자의 생리적 효과는 항산화(Chae HJ 등 2005), 간 보호(Heo JH 등 2006) 및 항우울(Kang MG 등 2014) 등의 연구가 보고되어 있다. 또한 오미자(Schizandra chinensis)는 한방에서 널리 활용됐으며 식품이나 음료 같은 가공품으로 생산되어 왔다(Hsu HY 등 1986). 오미자(Schizandra chinensis)에는 1.50%의 당, 탄닌 및 색소 물질 등이 함유되어 있으며, citral, β-chamigrene, β-camigrenol 및 sesquicarene 등으로 대표되는 정유 성분이 약 3% 포함되어 있고 구연산, 말산 및 푸마르산 등의 유기산과 비타민 C 및 E와 구리, 망간, 니켈 및 아연 등도 함유되어 있다(Lee JY 등 2013). 그러나 오미자의 열매보다 종자에 다량의 기능성 성분이 함유되어 있다고 보고되어 있으며, 오미자 종자의 항산화와 항균에 관한 연구가 보고되어 있다(Jung GT 등 2000; Choi EY 등 2019). 오미자 종자에는 지방유가 33%, 강장제의 유효 성분으로 알려진 schizandrin이 0.12%, deoxyschizandrin, pseudo-Y-schizandrin, essenoil 및 schizandrol이 총 1.60% 함유하는데 그 주요 성분은 citral로 보고된 바 있다(Shon HJ 등 1989). 이러한 오미자의 생리활성성분은 열매보다 종자에 함유되어 있으나 오미자 종자를 활용한 피부 건강에 관한 연구는 미미한 실정이다.
따라서 본 연구에서는 오미자 종자를 정제수와 70% 에탄올로 각각 추출하여 세포와 유전자 수준에서 멜라닌 생성 저해와 피부 탄력에 미치는 영향을 평가하였다. 더 나아가 오미자 종자 추출물이 피부 건강에 긍정적인 영향을 주는 건강기능식품 소재로서의 활용 가능성을 고찰하였다.
재료 및 방법
1. 실험 재료
Dimethyl sulfoxide(DMSO)와 isopropanol은 Junsei Chemical Co., Ltd.(Tokyo, Japan)에서 구매하여 사용하였으며, potassium phosphate dibasic anhydrous와 potassium phosphate monobasic은 Daejung(Seoul, Korea)에서 구매하여 실험에 사용하였다. 3-Isobutyl-1-methylxanthine(IBMX), thiazolyl blue tetrazolium bromide(MTT) 및 chloroform은 Sigma-Aldrich(St. Louis, MO, USA)에서 구매하였다. Dulbecco’s Modified Eagle’s Medium(DMEM), fetal bovine serum(FBS), trypsin-ethylenediaminetetraacetic acid(trypsin-EDTA) 및 penicillinstreptomycin은 WELGENE Inc.(Daegu, Korea)에서 구매하였다. 본 실험에 사용된 B16F10 세포는 한국세포주은행(Korea Cell Line Bank No. 80008, Korea)에서 분양받았으며, human skin fibroblasts(HSFs)는 American type culture collection(PCS-201-012, USA)에서 분양받았다.
2. 오미자 종자 추출물 제조
본 실험에서는 오미자(Schizandra chinensis) 종자를 분쇄한 후 각각 500 g을 10배수의 정제수 및 70%의 에탄올로 추출을 진행하였다. 추출을 진행한 뒤 5 μm pp(polyproylene) 카트리지 필터를 이용해 필터링을 진행하였다. 그 후 진공 동결건조기(LP 20; Ilshinbiobase, Dongducheon, Korea)를 사용하여 동결건조하여 추출 전 무게에 대한 동결건조 후 무게의 백분율로 나타내어 추출 수율을 계산하였다. 오미자 종자 정제수 추출물(water extract of Schizandra chinensis seeds; WES)의 추출 수율은 7.32%(w/w-dry weight), 70% 에탄올 추출물(70% Ethanol extract of Schizandra chinensis seeds; EES)은 6.65%(w/w-dry weight)로 나타났으며(Table 1), —20℃에 보관하며 실험에 사용하였다.
3. 세포배양
B16F10 세포와 HSFs는 세포배양 dish에 10%(v/v)의 FBS와 1%(v/v)의 penicillin-streptomycin이 포함된 DMEM을 처리하여 37℃의 5%(v/v) CO2 배양기(Incubator 311, Thermo Fisher Scientific, MA, USA)에서 배양하여 실험에 사용하였으며, 이틀에 한 번 FBS-DMEM을 교체해 주었다.
4. WES와 EES 처리에 의한 세포 생존율 평가
WES와 EES 처리에 의한 B16F10 세포와 HSFs에서의 생존율을 평가하기 위해 MTT assay를 실시하였다. WES와 EES를 포함한 FBS-DMEM을 24 hr 동안 처리한 후 FBS-DMEM을 완전히 제거하고 MTT-media를 200 μg/mL 첨가 후 1 hr 동안 처리하였다. MTT-media를 제거하고 각 well에 DMSO를 넣어 생존한 세포 내에서 생성된 formazan을 녹여낸 다음 96-well plate에 분주하여 570 nm의 흡광도로 microplate reader(VersaMax, Molecular Devices, Sunnyvale, CA, USA)를 통해 측정하여 세포 생존율(% of control)을 계산하였다.
5. B16F10 세포에서의 멜라닌 생합성 억제 활성
WES와 EES의 처리가 B16F10 세포 수준에서 멜라닌 생합성 억제에 효과가 있는지 확인하기 위해 멜라닌 생성을 유도하고 생성된 멜라닌을 정량하였다. 0.5 mM IBMX를 처리하여 멜라닌 생성을 유도하고 WES와 EES를 10, 50, 100 및 200 μg/mL의 농도로 120 hr 동안 함께 처리하였다. 세포 내의 WES와 EES 처리에 의한 멜라닌 축적 억제 정도를 현미경을 통해 관찰하였다. DMEM 제거 후 PBS(phosphate buffered saline)로 세척하고 trypsin-EDTA 200 μL를 사용하여 세포를 microcentrifuge tube에 모은 다음 5 min 동안 원심분리하여 얻어낸 세포 pellet을 1N NaOH와 10%(v/v) DMSO를 처리하여 100℃에서 10 min 동안 녹여낸 후에 405 nm에서 흡광도를 microplate reader(VersaMax, Molecular Devices, Sunnyvale, CA, USA)를 통해 측정하였다. 멜라닌을 유도하지 않은 것을 (—)control, 멜라닌을 유도한 것을 (+)control로 명명하였으며, (+)control의 흡광도를 대조군으로 하여 멜라닌 함량(% of control)을 계산하였다.
6. Reverse Transcription-Polymerase Chain Reaction(RT-PCR)을 통한 미백 및 탄력 관련 mRNA 발현 수준 분석
WES와 EES의 처리가 미백 관련 인자의 mRNA 발현 수준을 확인하기 위해 B16F10 세포에 10, 50, 100 및 200 μg/mL 농도의 WES 및 EES와 함께 0.5 mM의 IBMX를 120 hr 동안 처리하여 멜라닌 축적을 유도한 다음 세포를 수확하였다. 피부 탄력과 관련한 인자의 mRNA 발현 수준을 확인하기 위해 HSFs에 WES와 EES를 각각 10, 50, 100 및 200 μg/mL 농도로 24 hr 동안 처리한 다음 세포를 수확하였다. 각각 처리된 세포를 TRIzolⓇ을 이용하여 total RNA를 추출하였다. TRIzolⓇ 추출물에 chloroform 100 μL를 넣고 혼합한 후 12,000×g에서 15 min 동안 원심분리하여 상층액을 획득하였다. 획득한 상층액에 250 μL의 isopropanol을 넣고 혼합한 다음 10 min 동안 상온에서 반응시킨 다음 12,000×g에서 10 min 동안 RNA pellet을 분리하였다. 이후 분리한 RNA pellet 주위에 잔여 하는 시약을 제거하기 위해 75%(v/v) 에탄올 40 μL을 넣은 후 7,500×g에서 5 min 동안 처리하였다. 얻어낸 RNA를 RNase-free water에 녹여낸 후 BioDrop (BioDrop nano-spectrophotometer, Cambridge, UK)을 이용하여 정량하고 Cycle Script RT PreMix을 이용하여 thermal cycler(Bio-Rad, CA, USA)로 cDNA를 합성하여 RT-PCR을 실시하였다. 본 실험에 사용된 primer sequences는 Table 2에 나타내었다.
7. 통계분석
모든 실험 데이터는 3회 반복을 통해 이루어졌으며, 평균±표준편차로 표현하였다. 통계 처리는 Statistical Package for Social Science(Ver. 18, SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 각 구간에 대한 유의성 차이는 Duncan’s test 방법(p<0.05) 또는 Student’s t-test(*p<0.05, **p<0.01 그리고 ***p<0.001) 방법에 따라 각 구간의 유의성 차이를 검증하였다.
결과 및 고찰
1. WES와 EES 처리에 의한 B16F10 세포에서의 세포 생존율
B16F16 세포에서 WES와 EES의 처리에 의한 농도별 세포 생존율을 확인하기 위해 MTT assay를 실시하여 Fig. 1에 나타내었다. WES와 EES를 10, 50, 100, 200 및 400 μg/mL의 농도로 처리하였을 때 세포 생존율은 각각 87.84%, 82.55%, 88.82%, 86.68% 및 84.32%와 93.28%, 91.12%, 91.08%, 97.18% 및 93.56%로 나타났다. WES와 EES는 모든 농도에서 유의적인 차이는 없었으며 이후 실험은 200 μg/mL 농도까지 사용하였다.
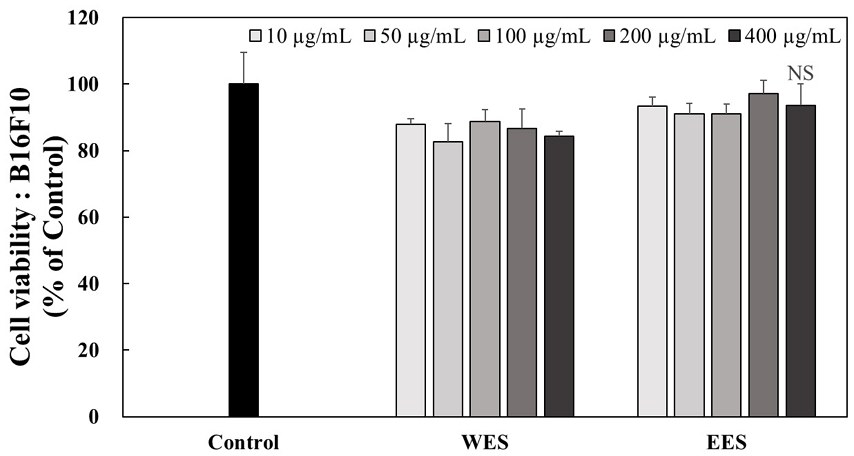
The cytotoxic effects of WES and EES treatment for 24 hr in B16F10 cells. B16F10 cells were treated with 10, 50, 100, 200, and 400 μg/mL of WES and EES extracts for 24 hr. The cell viability was quantified using MTT assay at 570 nm of absorbance. Corresponding letters indicate significant differences by t-test.WES: Water extract of Schizandra chinensis seeds, EES: 70% ethanol extract of Schizandra chinensis seeds, NS: Not significant.
2. B16F10 세포에서 WES와 EES 처리에 의한 멜라닌 생합성 억제 활성
멜라닌은 피부, 머리카락, 눈 색깔의 주요 결정 요인으로 여러 단계를 거쳐 생성되며 멜라닌이 과생성되면 주근깨, 기미 및 검버섯과 같은 색소 침착을 유발할 수 있다(Videira IF 등 2013). 이러한 과색소 침착은 염증 및 자외선을 포함한 다양한 생물학적, 환경적 요인에 의해 발생하지만 색소 침착 장애에 대한 효과적인 치료는 멜라닌 생성을 억제하는 것을 기반으로 한다(Shin HJ 등 2022).
WES와 EES의 처리가 B16F10 세포에서 멜라닌 생합성에 영향을 미치는지 확인하기 위해 멜라닌 정량을 실시하여 Fig. 2에 나타내었다. 멜라닌 생합성을 유도하기 위해 0.5 mM IBMX를 120 hr 동안 처리하고 같은 시간 동안 WES와 EES를 각각 10, 50, 100 및 200 μg/mL의 농도로 처리하였다. 0.5 mM IBMX로 멜라닌 생합성을 유도한 (+)control에서 다량의 멜라닌이 축적되었으며 WES와 EES를 각각 10, 50, 100 및 200 μg/mL의 농도로 처리 시 (+)control과 비교하였을 때 WES 처리 시 멜라닌 축적은 38.17%, 24.45%, 22.26% 및 18.35%로 나타났으며, EES 처리 시 멜라닌 축적은 39.00%, 31.16%, 32.50% 및 30.04%로 나타났다(Fig. 2A). 또한, B16F10 세포에 축적된 멜라닌의 양을 이미지로 정성 분석하였을 때 위의 정량 결과와 유사한 결과를 나타냈다(Fig. 2B, 2C). 멜라닌 생합성을 유도한 (+)control 대비 WES와 EES를 처리한 군에서는 농도 의존적으로 멜라닌 축적이 억제된 것을 관찰할 수 있었다. Li H 등(2020)은 화학적으로 표준화된 검은 커민(Nigella sativa) 종자인 ThymocidⓇ가 B16F10 세포 수준에서 멜라닌 함량을 측정한 결과 ThymocidⓇ를 2.50, 5, 10 및 20 µg/mL의 농도로 처리하였을 때 ThymocidⓇ를 처리하지 않은 control과 비교하면 멜라닌 생성이 57.50%, 56.10%, 52.90% 및 38.40%로 멜라닌 축적이 억제하는 것으로 나타났다. Shin HJ 등(2022)은 연꽃의 종자인 연자육이 B16F10 세포 수준에서 멜라닌 함량을 측정한 결과 연자육 추출물을 0.20%와 0.50% 처리한 결과 연자육 추출물이 B16F10 세포 내에서 알부틴 대비 21%와 24% 감소시키는 결과를 나타냈다. 이는 오미자 종자 추출물과 비교하였을 때 오미자 종자 추출물 처리에 의해 멜라닌 형성을 억제하는 미백 활성을 확인할 수 있었다. 따라서 이 결과는 오미자 종자 추출물이 멜라닌 생합성 저해 효과의 천연 소재로서의 가능성을 시사한다.
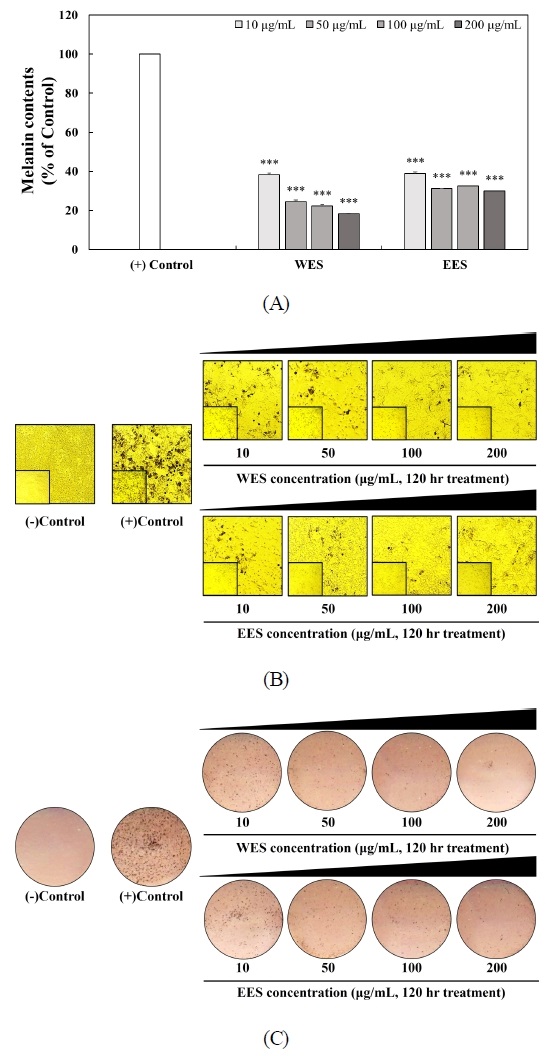
Inhibitory effects of WES and EES treatment on B16F10 melanogenesis.B16F10 cells were treated by 0.5 mM IBMX to initiate in the presence or absence of 10, 50, 100, and 200 μg/mL of WES and EES for 120 hr. Intracellular melanin contents were quantified at 405 nm (A). WES and EES against melanin accumulation of IBMX-treated B16F10 cells were observed by optical microscope (B). The intracellular melanin levels were obtained using image scanner (C). Corresponding letters indicate significant differences by t-test (***p<0.001).WES: Water extract of Schizandra chinensis seeds, EES: 70% ethanol extract of Schizandra chinensis seeds.
3. 유전자 수준에서 WES와 EES 처리에 의한 멜라닌 생합성 억제
멜라닌 생합성과 관련된 효소로는 tyrosinase, TRP-1, TRP-2 및 microphthalmia-associated transcription factor(MITF)가 있다. TRP-1과 TRP-2는 5,6-dihydroxyindole-2-carboxylic acid(DHICA)를 흑갈색으로 나타내는 indole-5,6-quinone-2-carboxylic acid로 전환시켜 최종적으로 멜라닌을 합성하고, tyrosinase는 멜라닌을 생성하는 효소로서 tyrosine hydroxylase와 DOPA oxidase의 활성을 나타내며, 멜라닌 세포 내에서 tyrosinase, TRP-1 및 TRP-2 등의 유전자 발현이 증가하면 멜라닌 생성이 증가하게 된다(Lee SH 1996).
WES와 EES의 처리가 B16F10 세포에서 어떠한 경로를 통해 멜라닌 생합성을 억제하는지 확인하기 위해 멜라닌 생합성에 관여하는 tyrosinase, TRP-1, TRP-2 및 MITF의 유전자 발현 수준을 RT-PCR을 통해 분석하여 Fig. 3에 나타내었다. WES와 EES의 처리가 B16F10 세포에서 멜라닌 생합성에 관여하는 유전자인 tyrosinase와 MITF의 유전자 발현 수준은 (+)control과 비교했을 때 차이는 없었으나 TRP-1과 TRP-2의 유전자 발현 수준은 감소하는 양상을 나타냈다(Fig. 3A). WES와 EES의 처리에 의해 유전자 발현 수준이 감소된 TRP-1과 TRP-2를 밴드 정량 프로그램인 이미지 J(ImageJ software, Ver. 1.54k, National Institutes of Health, MD, USA)를 통해 정량하였을 때 TRP-1의 mRNA 발현 수준이 (+)control과 10, 50, 100 및 200 μg/mL의 농도별로 WES은 101.05% 87.32%, 104.94% 및 61.18%이고, EES는 84.94%, 64.07%, 52.15% 및 61.66%로 발현 수준이 유의적으로 감소하는 것을 나타냈다(Fig. 3B), 뿐만 아니라 TRP-2의 mRNA 발현 수준이 (+)control에 비해 WES은 89.32% 66.73%, 94.45% 및 88.89%로 나타났으며, EES는 87.92%, 77.70%, 45.40% 및 20.55%로 발현 수준이 유의적으로 감소하는 것으로 나타냈다(Fig. 3C). Jang TW & Park JH(2017)은 미선나무 미성숙 종자 추출물이 멜라닌 생성에 미치는 영향을 확인하기 위해 멜라닌 생성에 관여하는 tyrosinase, TRP-1, TRP-2 및 MITF의 유전자 발현 수준을 확인하였으며 미선나무 미성숙 종자 추출물을 25, 50 및 100 μg/mL의 농도로 처리하였을 때 tyrosinase의 유전자 발현 수준은 95.42%, 76.01% 및 64.35%로 나타났으며 TRP-1의 유전자 발현 수준은 148.68%, 142.34% 및 111.25%, TRP-2의 발현 수준은 193.10%, 151.74% 및 151.05%, MITF의 유전자 발현 수준은 70.53%, 32.92% 및 27.37%로 나타났다고 보고하였다. 따라서 미선나무 미성숙 종자 추출물을 처리하지 않은 control과 비교하였을 때 유의적으로 유전자 발현 수준을 저해하였다. 또한 Choi EY & Jang YA(2021)은 은행나무 종자 추출물이 멜라닌 생성에 관여하는 tyrosinase, TRP-1, TRP-2, MITF의 유전자 발현 수준이 10, 20 및 40 μg/mL에서 농도 의존적으로 감소하였으며, 최고농도인 40 μg/mL의 농도에서 은행나무 종자 추출물을 처리하지 않은 control에 비해 tyrosinase, TRP-1, TRP-2 및 MITF는 각각 37%, 21%, 21% 및 11%로 유전자 발현 수준을 감소시켰다. 따라서 오미자 종자 추출물은 TRP-1 과 TRP-2의 유전자 발현 수준을 효과적으로 감소시킴으로써 멜라닌 생합성을 억제하는 것으로 판단된다.
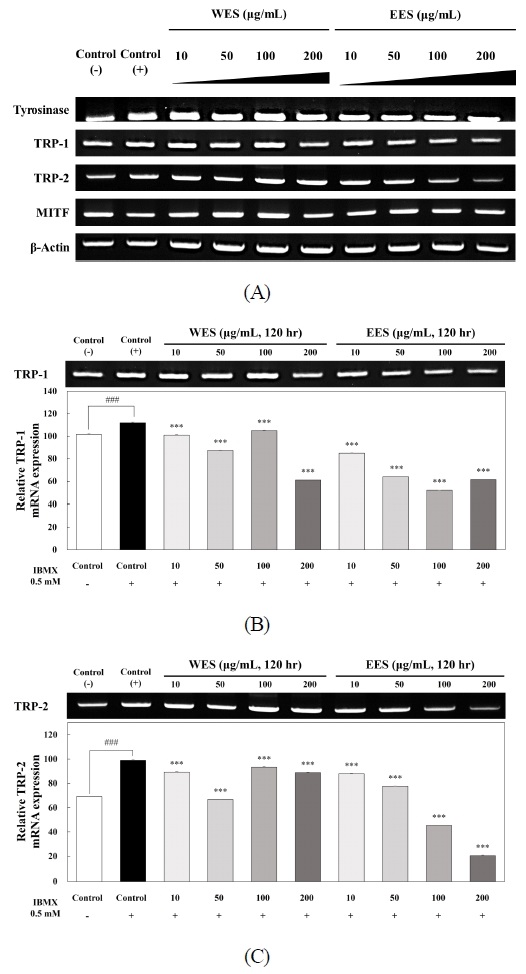
Effects of WES and EES treatment on the expression levels of mRNA-related with B16F10 melanogenesis.The mRNA expressions of melanogenic-related genes such as tyrosinase, TRP-1, TRP-2 and MITF were examined by RT-PCR analysis. β-Actin was used as a control in RT-PCR analysis. The mRNA expressions were quantified using Image J program. Each value of the graph corresponds to the percent concentrations divided by the amount of β-actin which is the control. Statistical analysis was performed at ###p<0.001 versus control(—), ***p<0.001 versus control(+) by t-test.(—)Control: Not IBMX treated-cells, (+)Control: IBMX treated-cells, IBMX: Isobutyl methylxanthine, WES: Water extract of Schizandra chinensis seeds, EES: 70% ethanol extract of Schizandra chinensis seeds, TRP-1: Tyrosinase related protein 1, TRP-2: Tyrosinase related protein 2, MITF: Microphthalmia-associated transcription factor.
4. WES와 EES 처리에 의한 HSFs에서의 세포 생존율
HSFs에서 WES와 EES의 처리에 의한 농도별 세포 생존율을 확인하기 위해 MTT assay를 실시하여 Fig. 4에 나타내었다. WES와 EES를 10, 50, 100, 200 및 400 μg/mL의 농도로 각각 처리 시 세포 생존율은 102.36%, 97.75%, 94.61%, 98.42% 및 101.85%와 91.34%, 93.58%, 106.29%, 108.84% 및 107.82%로 나타났다. WES와 EES는 모든 농도에서 유의적인 차이는 없었으며 이후 실험은 200 μg/mL 농도까지 사용하여 실시하였다.
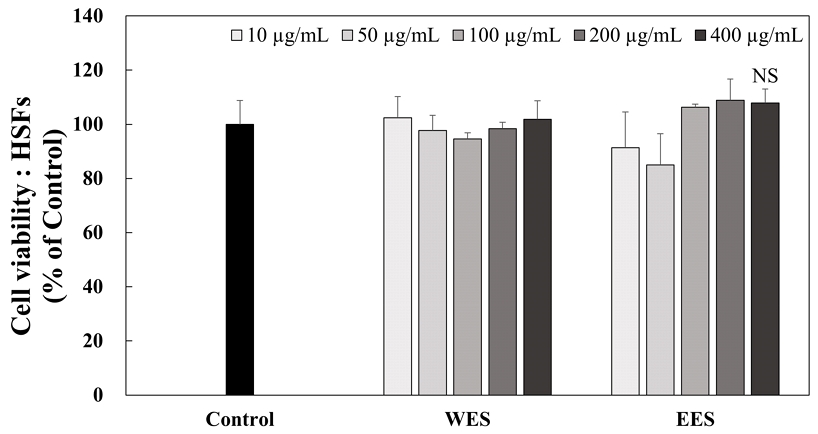
The cytotoxic effects of WES and EES treatment for 24 hr in HSFs.HSFs was treated with 10, 50, 100, 200, and 400 μg/mL of WES and EES extracts for 24 hr. The cell viability was quantified using MTT assay at 570 nm of absorbance. Corresponding letters indicate significant differences by t-test.HSFs: Human skin fibroblasts, WES: Water extract of Schizandra chinensis seeds, EES: 70% ethanol extract of Schizandra chinensis seeds, NS: Not significant.
5. WES와 EES 처리에 의한 탄력 관련 유전자 발현 분석
WES와 EES의 처리가 HSFs에서 탄력과 관련된 유전자 발현 수준에 영향을 미치는지 확인하기 위해 파이브로넥틴, Col1α2의 유전자 발현 수준을 RT-PCR을 통해 분석하여 Fig. 5에 나타내었다. WES와 EES의 처리가 탄력에 관여하는 인자인 파이브로넥틴과 Col1α2의 유전자 발현 수준을 control과 비교했을 때 유전자 발현 수준이 증가하는 양상을 나타냈다(Fig. 5A). WES와 EES의 처리 시 유전자 발현 수준이 증가된 파이브로넥틴과 Col1α2의 유전자 발현 수준을 밴드 정량 프로그램인 이미지 J를 통해 정량하였을 때 파이브로넥틴의 mRNA 발현 수준이 control에 비해 WES 처리 시 64.46% 55.62%, 70.11% 및 71.38%로 나타났으며, EES 처리 시에는 65.31%, 60.39%, 71.01% 및 131.42%로 파이브로넥틴의 발현 수준을 유의적으로 증가시켰다(Fig. 5B), 뿐만 아니라 Col1α2의 mRNA 발현 수준이 control에 비해 WES의 처리 시 187.00%, 193.73% 209.49% 및 187.87%로 나타났으며, EES 처리 시에는 197.12%, 162.58%, 167.82% 및 255.58%로 Col1α2의 발현 수준을 유의적으로 증가시켰다(Fig. 5C). Clark RAF 등(1995)은 손상된 피부에서 섬유아세포는 콜라겐을 축적하고 콜라겐 기질을 압축하고 상처를 수축시키기 시작하며 형태학적, 증식적 및 합성적 특성을 가지고 길쭉한 방추형 형태를 발달시키며 활발하게 증식하고 콜라겐 합성을 시작한다고 보고하였다. 따라서 오미자 종자 추출물은 피부에 가장 많이 존재하는 콜라겐 Ⅰ형에 주요 요소인 Col1α2의 유전자 발현 수준을 증가시키고 상처 치유와 주름 개선에 도움을 주는 파이브로넥틴의 유전자 발현 수준을 증가시킴으로써 탄력 증진과 주름 개선에 도움이 되는 건강기능식품 천연 소재로 활용될 수 있음을 시사한다.
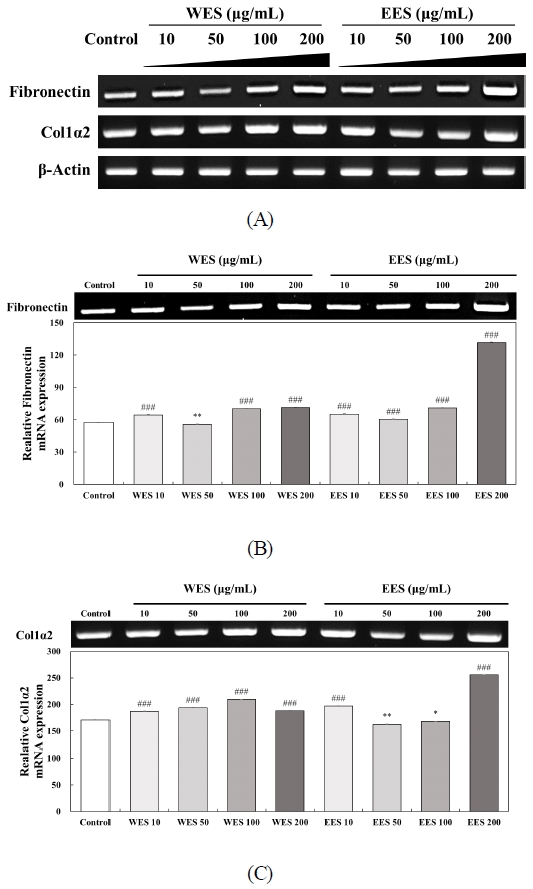
Effects of WES and EES treatment on the mRNA expression levels of fibril-related genes in HSFs. The mRNA expressions of fibril-related genes such as fibronectin, Col1α2 and β-actin were examined by RT-PCR analysis. β-Actin was used as a control in RT-PCR analysis. The mRNA expressions were quantified using Image J program. Each value of the graph corresponds to the percent concentrations divided by the amount of β-actin which is the control. Statistical analysis was performed *p<0.05, **p<0.01 and ###p<0.001 versus control by t-test.WES: Water extract of Schizandra chinensis seeds, EES: 70% ethanol extract of Schizandra chinensis seeds, Col1α2: Collagen1α2.
요 약
본 연구에서는 일반적으로 활용되지 않고 버려지는 오미자 종자가 전반적으로 피부에 미치는 영향을 미치는지 확인하기 위해 피부에서 가장 많이 차지하는 표피와 진피에서 어떠한 관여를 하는지 확인하였다. 오미자 종자는 증류수와 70% 에탄올을 용매로 하여 추출하여 멜라닌 생합성과 탄력에 관여하는 유전자 발현 수준을 분석하였다. 멜라닌 정량을 통하여 오미자 종자 추출물이 B16F10 세포 수준에서 0.5 mM IBMX를 120 hr 동안 처리하였을 때 오미자 종자 추출물을 처리하지 않은 (+)control에 비해 멜라닌 생합성이 저해된 것을 확인하였다. 뿐만 아니라, 멜라닌 생합성에 관여하는 TRP-1과 TRP-2의 mRNA 발현 수준을 유의적으로 감소시켰으며, 탄력에 관여하는 파이브로넥틴과 Col1α2의 mRNA 발현 수준을 유의적으로 증가시켰다. 따라서 오미자 종자 추출물은 미백과 탄력 증진을 위한 건강기능식품의 개발을 위한 천연 소재로써 활용될 수 있을 것으로 사료된다.
References
-
Argirova MD, Ortwerth BJ (2003) Activation of protein-bound copper ions during early glycation: Study on two proteins. Arch Biochem Biophys 420(1): 176-184.
[https://doi.org/10.1016/j.abb.2003.09.005]

-
Burgdorf WHC, Bickers DR (2015) The scientific legacy of stephen rothman. J Invest Dermatol 135(4): 954-959.
[https://doi.org/10.1038/jid.2014.447]

- Chae HJ, Hwang HI, Lee IS, Moon HY (2005) Comparison of on rat intestinal digestive enzyme inhibitory activity and antioxidant enzyme activity of Korean and Chinese Schizandra chinensis. J Exp Biomed Sci 11(4): 517-523.
- Choi EY, Jang YA (2021) The analysis of whitening effects on extracts from Ginkgo (Ginkgo biloba L.) seeds. J Korean Appl Sci Technol 38(5): 1229-1240.
- Choi EY, Sohn HY, Lee JT (2019) The antioxidant and anti-aging effects of treatment with Schisandra chinensis seeds fractions in UVB-irradiated human HaCaT cells. J Life Sci 29(10): 1071-1079.
-
Clark RA, Nielsen LD, Welch MP, McPherson JM (1995) Collagen matrices attenuate the collagen-synthetic response of cultured fibroblasts to TGF-β. J Cell Sci 108(Pt 3): 1251-1261.
[https://doi.org/10.1242/jcs.108.3.1251]

-
D’Mello SAN, Finlay GJ, Baguley BC, Askarian-Amiri ME (2016) Signaling pathways in melanogenesis. Int J Mol Sci 17(7): 1144.
[https://doi.org/10.3390/ijms17071144]

-
Feingold KR, Man MQ, Proksch E, Menon GK, Brown BE, Elias PM (1991) The Lovastatin-treated rodent: A new model of barrier disruption and epidermal hyperplasia. J Invest Dermatol 96(2): 201-209.
[https://doi.org/10.1111/1523-1747.ep12461153]

-
Feingold KR, Schmuth M, Elias PM (2007) The regulation of permeability barrier homeostasis. J Invest Dermatol 127(7): 1574-1576.
[https://doi.org/10.1038/sj.jid.5700774]

- Heo JH, Park JG, Cheon HJ, Kim YS, Kang SS, Hung TM, Bae KH, Lee SM (2006) Hepatoprotective activities of gomisin A and gomisin N. Kor J Pharmacogn 37(4): 294-301.
- Hsu HY, Chen YP, Shen SJ, Hsu CS, Chen CC, Chang HC (1986) Oriental Materia Medica. Oriental Healing Arts Institute, California, USA. p 624.
-
Li H, DaSilva NA, Liu W, Xu J, Dombi GW, Dain JA, Li D, Chamcheu JC, Seeram NP, Ma H (2020) ThymocidⓇ, a standardized Black Cumin (Nigella sativa) seed extract, modulates collagen cross-linking, collagenase and elastase activities, and melanogenesis in murine B16F10 melanoma cells. Nutrients 12(7): 2146.
[https://doi.org/10.3390/nu12072146]

-
Liu LK, Chou FP, Chen YC, Chyau CC, Ho HH, Wang CJ (2009) Effects of mulberry (Morus alba L.) extracts on lipid homeostasis in vitro and in vivo. Agric Food Chem 57(16): 7605-7611.
[https://doi.org/10.1021/jf9014697]

-
Jang SH, Ha CW, Kim SH, Hong SS, Park MR, Kim YK, Soh EH (2022) Ameliorating effect of Astragalus sinicus ethanol extract on dermal aging. Korean J Medicinal Crop Sci 30(5): 357-365.
[https://doi.org/10.7783/KJMCS.2022.30.5.357]

-
Jang TW, Park JH (2017) Antioxidative activities and whitening effects of ethyl acetate fractions from the immature seeds of Abeliophyllum distichum. J Life Sci 27(5): 536-544.
[https://doi.org/10.5352/JLS.2017.27.5.536]

- Jung GT, Ju IO, Choi CS, Hong JS (2000) The antioxidative, antimicrobial and nitrite scavenging effects of Schizandra chinensis (Omija) seed. Korean J Food Sci Technol 32(6): 928-935.
-
Jung KM, Yang MS, Kim SH, Roh JH, Kim WG (2021) The efficacy of AP collagen peptides intake on skin wrinkle, elasticity, and hydration improvement. J Korean Soc Food Sci Nutr 50(5): 429-436.
[https://doi.org/10.3746/jkfn.2021.50.5.429]

-
Kang MG, Kim YH, Im AR, Nam BS, Chae SW, Lee MY (2014) Antidepressant-like effects of Schisandra chinensis Baillon water extract on animal model induced by chronic mild stress. Korean J Medicinal Crop Sci 22(3): 196-202.
[https://doi.org/10.7783/KJMCS.2014.22.3.196]

-
Kendall RT, Feghali-Bostwick CA (2014) Fibroblasts in fibrosis: Novel roles and mediators. Front Pharmacol 5: 123.
[https://doi.org/10.3389/fphar.2014.00123]

- Kim KY, Lee NK (2014) Herbal extracts research trend that have effects on melanin production and control. Asian J Beauty Cosmetol 12(4): 453-461.
-
Kim MS, Sung HJ, Park JY, Sohn HY (2017) Evaluation of anti-oxidant, anti-microbial and anti-thrombosis activities of fruit, seed and pomace of Schizandra chinensis Baillon. J Life Sci 27(2): 131-138.
[https://doi.org/10.5352/JLS.2017.27.2.131]

- Lee JY, Lee GY, Yang CH, Poh SS (2013) The study on chemical components and oriental medical effects of Schizandrae Fructus. J Appl Orient Med 13(2): 61-66.
- Lee SH (1996) Melanogenesis and its control. Proceedings of the Society of Cosmetic Scientists of Korea Symposium, Korea, pp 22-32.
- Lee WY, Choi SY, Lee BS, Park JS, Kim MJ, Oh SL (2006) Optimization of extraction conditions from Omija (Schizandra chinensis Baillon) by response surface methodology. Food Sci Preserv 13(2): 252-258.
-
Pankov R, Yamada KM (2002) Fibronectin at a glance. J Cell Sci 115(Pt 20): 3861-3863.
[https://doi.org/10.1242/jcs.00059]

-
Rittié L, Fisher GJ (2002) UV-light-induced signal cascades and skin aging. Ageing Res Rev 1(4): 705-720.
[https://doi.org/10.1016/S1568-1637(02)00024-7]

-
Shin HJ, Kim MH, Shin BS, Bae SH (2022) Anti-melanogenic effect of Lotus seed and seedpod extracts via downregulation of tyrosinase stability in B16F10 murine melanoma cells. Asian J Beauty Cosmetol 20(1): 111-120.
[https://doi.org/10.20402/ajbc.2022.0004]

- Sohn HJ, Bock JY, Baik SO, Kim YH (1989) Determination of lignan compounds in fruits of Schizandra chinensis Baillon by capillary-GC(FID). J Korean Agric Chem Soc 32(4): 350-356.
-
Tsukamoto K, Jackson IJ, Urabe K, Montague PM, Hearing VJ (1992) A second tyrosinase-related protein, TRP-2, is a melanogenic enzyme termed DOPAchrome tautomerase. EMBO J 11(2): 519-526.
[https://doi.org/10.1002/j.1460-2075.1992.tb05082.x]

-
Videira IF, Moura DF, Magina S (2013) Mechanisms regulating melanogenesis. An Bras Dermatol 88(1): 76-83.
[https://doi.org/10.1590/S0365-05962013000100009]

-
Yoon JW, Han JM, Yoon HJ, Ko WS (2013) Inhibitory effects of methanol extract of Kaempferia galanga on melanogenesis in B16/F10 melanoma cells. J Korean Med Ophthalmol Otolaryngol Dermatol 26(1): 1-18.
[https://doi.org/10.6114/jkood.2013.26.1.001]

-
Zhang S, Duan E (2018) Fighting against skin aging: The way from bench to bedside. Cell Transplant 27(5): 729-738.
[https://doi.org/10.1177/0963689717725755]


