사과박과 사과주스의 이화학적 특성 및 항산화 성질 평가
Abstract
This study aimed to compare the physicochemical characteristics and antioxidant properties of apple pomace (AP) and apple juice (AJ) to provide a basis for the utilization of AP. The samples were obtained from commercial Korean apples, Fuji (Malus pumila), and dried in a rotary drier at 80℃ for 12 hours. The total soluble solids and reducing sugar content of AJ were significantly higher than that of AP, but the pH was significantly lower. The total content of polyphenols and flavonoids of AJ was significantly higher. The corresponding content of AP was 65.2% that of AJ. The antioxidant activity (2,2-diphenyl-1picrylhydrazyl [DPPH], 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) radical scavenging activities [ABTS], ferric reducing antioxidant power [FRAP], and Reducing power) also showed a trend similar to that of the antioxidant components. Thus, the polyphenol content of AP reached an average of 65.2% compared to that of AJ, indicating that AP still contained a considerable amount of antioxidant components. This suggest that AP has significant potential as a sustainable ingredient for the development of apple pomace-based products.
Keywords:
apple pomace, by-product, physicochemical characteristics, antioxidant activity, sustainable서 론
사과(Malus pumila)는 중앙아시아를 중심으로 기원되었으며, 사과 특유의 조직감과 새콤달콤한 맛으로 한국인이 선호하는 과일 중 하나이다(Kim MS 등 2020; Lyu F 등 2020). 국내 사과 생산량은 2015년에 58만 2,845톤, 2019년에는 53만 5,324톤, 2023년에는 39만 4,428톤으로 점차 감소하였으나, 사과 가공품 중 하나인 사과주스는 최근 10년 동안 생산량이 증가 추세를 보였다(KOSIS 2024). 2023년에는 전체 사과 생산량 중 약 4만 320톤이 가공에 이용되었으며, 주요 가공 형태로는 주스(3만 4,663톤), 음료(1,737톤), 즙청(1,651톤), 술(572톤) 그리고 잼(559톤) 등이 있다(KOSIS 2023). 이러한 사과 가공품들은 압착 과정을 통해 얻은 과즙을 이용하므로, 생산 과정에서 다량의 사과박이 발생하며 일부만이 가축의 사료와 비료로 이용되고 대부분 폐기 처분되는 실정이다.
사과박(apple pomace)은 사과 가공품 제조 과정에서 사과 중량의 20~30% 정도로 발생하며 과육, 껍질, 씨앗이 포함된다(Park YK 등 2011; O’Shea N 등 2015; Zaky AA 등 2024). 사과박은 탄수화물(9.5~22%), 식이섬유(4.3~10.5%), 펙틴(1.5~2.5%) 등의 영양성분이 풍부하며 catechin, epicatechin, quercetin, procyanidin, chlorogenic acid, caffeic acid 및 p-cumaric acid와 같은 파이토케미컬(phytochemical)을 함유한다(Lee JH 등 2000; Kim HJ 등 2001; Kosmala M 등 2011). 파이토케미컬은 항알러지성, 항암성, 그리고 항산화성 등 다양한 생리활성 기능과 과산화물 생성 억제능을 가진 것으로 보고된다(Barreira JCM 등 2019; Lee JY 등 2000). 사과박의 식이섬유는 cellulose, hemicellulose, pectins, lignins, gums으로 구성되어 있고 섭취 시 장내 이동성과 대변의 수분함량을 증가시키며 대장암, 비만, 심혈관계질환 및 당뇨병 예방에 매우 효과적이다(Sudha ML 등 2007). 그 외 기능적 특성으로 Elleuch M 등(2011)의 식이섬유가 풍부한 식품 가공 부산물에 대한 연구에 따르면 사과박 식이섬유는 수분 및 오일 보유력과 겔 형성 능력을 증가시킨다고 보고하였다. 또한 O’Shea N 등(2015)의 사과와 오렌지 부산물의 물리화학적 평가연구에 따르면 사과박의 펙틴이 식품에 첨가되었을 때 제품 내 구조를 향상시키는 점탄성을 보이는 것으로 나타났다. 이러한 사과박을 활용한 선행연구로는 사과박 첨가 머핀(Kim YK 등 2019), 쿠키(Oh CH & Kang CS 2016), 설기떡(Park YK 등 2011a), 가래떡(Park YK 등 2011b), 요거트(Wang X 등 2020; Kim JS 등 2023), 면류(Hong JS 등 1993), 조청(Lee MN 등 2024) 그리고 시리얼바(Pyeon JY 등 2022)와 같은 연구가 있다. 사과박의 항산화 활성 연구로는 산지에 따른 비교 연구(Bang HY 등 2015), 품종별 procyanidin B2, C1의 함량 분석 연구(Kim JY 등 2021), 열풍 건조 후의 항산화 연구(Lee JH 등 2000), 산처리 후의 항산화 활성 연구(Moon JE 등 2023), 사과 부위별 비교 연구(Lee KH 등 2018), 제조공정에 따른 사과주스 연구(Kim KR 등 2024), 저온 및 고온살균 사과주스 연구(Lee SJ 등 2012)가 진행되었다. 기존 선행연구들은 사과박에 함유된 성분규명 및 기능성, 사과박 첨가 식품의 품질 특성, 사과박 처리방법이나 품종에 따른 항산화 성질 등에 대한 연구들이 대부분이다. Łata B & Tomala K(2007)의 연구에서 사과 전체와 사과 껍질의 flavonols 함량의 차이처럼 사과는 부위에 따라 함유된 생리활성 성분의 종류와 농도가 크게 다르다. 사과 주스 제조 시에 사과의 사용 부위에 따라서도 사과박의 품질 특성에 차이를 나타낼 것으로 보이나, 이에 대한 연구가 부족하다. 따라서 사과의 사용 부위를 달리하여 제조된 사과 주스와 사과박을 비교한 품질 특성 규명에 대한 연구는 필요하다. 이에 본 연구에서는 사과의 사용 부위를 달리하여 제조한 사과주스(AJ)와 사과박(AP)의 시료를 구축하기 위해 사과를 껍질과 꼭지 및 과육을 포함한 전체 사용군(WAP, WAJ), 껍질과 과육을 포함한 군(PAP, PAJ), 과육만 사용한 군(FAP, FAJ)으로 구분하여 착즙 후 발생한 사과박과 사과주스를 동일한 온도와 시간 조건에서 열풍 건조 처리한 후, 이들의 이화학적 특성, 항산화 성분 및 항산화 활성을 비교, 평가하였다. 본 연구는 사과의 부위별 활용이 사과박 및 사과주스의 품질과 항산화 기능성에 미치는 영향을 분석함으로써, 식품 소재로서의 사과박의 고부가가치 활용 가능성을 과학적으로 제시하고자 하였다.
재료 및 방법
1. 실험 재료
본 연구에서 사용된 사과는 2024년 충청북도 증평군에서 재배된 부사(Malus pumila) 품종을 익산시 대형 마트에서 구매하여 사용하였다.
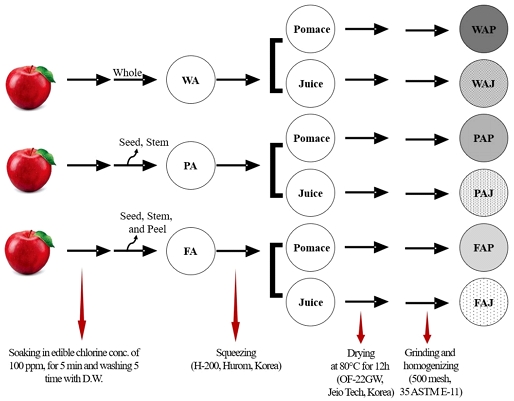
2. 사과박 분말 제조
사과의 전처리는 Fig. 1과 같다. 사과 세척은 학교급식위생관리지침(MOE 2021)에 따라 소독제 유효염소 농도 100 ppm에서 5분 동안 침지하여 흐르는 물로 세척하였으며, 착즙기(H-200, Hurom, Seoul, Korea)를 이용하여 사과박과 사과주스로 분리하였다. 각각의 사과박과 사과주스 시료는 80℃ dry oven(OF-22GW, Jeio Tech, Daejeon, Korea)에서 12시간 동안 건조하였으며, 건조된 시료는 분쇄기(PULVERISETTE 11, Fritsch.de, Idar-Oberstein, Germany)를 이용해 분쇄한 후 표준망체 500 mesh(No. 35)에 통과한 분말을 연구에 사용하였다.
3. 상등액 제조
분석에 사용된 용액는 시료에 증류수을 첨가하여 4,000 rpm에서 15분 동안 원심분리(Combi 524R, Hanil, Daejeon, Korea)한 후 다시 16,000 rpm에서 10분 동안 원심분리(Smart R17 Plus, Hanil, Gimpo, Korea)하여 얻었다.
4. 실험 방법
사과박의 수분 함량은 AOAC 표준 분석법(AOAC 2000)에 따라 분석하였으며, 105℃에서 상압 가열 건조법을 적용하여 dry oven(OF-22GW, Jeio Tech, Daejeon, Korea)을 활용하여 측정하였다. pH는 추출한 상등액 3 mL를 취하여 pH 미터(S220-k, Mettler Toledo International, Inc., Seoul, Korea)를 이용해 측정하였다. 적정 산도는 상등액 5 mL에 증류수 45 mL를 혼합하여 10배로 희석한 뒤, pH 8.35에 도달할 때까지 0.1N NaOH 용액으로 적정하였다. 적정 산도(%)는 아래 식을 통해 산출하였으며, 유기산 계수는 말산(malic acid) 0.0067을 적용하여 계산하였다.
- V = 소비된 0.1N NaOH의 양(mL)
- A = 유기산 계수
- D = 시료의 희석 배수
- F = 표준용액의 Factor
- S = 시료의 양(mL)
가용성 고형분의 함량은 시료 200 μL를 활용하여 전자 당도계(SCM-1000, HM Digital Inc., Seoul, Korea)로 측정하였으며, °Brix 단위로 나타내었다. 환원당의 함량은 DNS(3,5-dinitrosalicylic acid) 방법을 적용하여 분석하였다.
갈색도는 상등액 1 mL의 용액에 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 사용하여 420 nm에서 흡광도를 측정하였다. 색도는 시료 2 g을 petri dish(35 × 10mm)에 고르게 펼쳐 색차계(CR-10 Plus, Konica Minolta Holdings, Inc., Tokyo, Japan)를 이용하여 L*(명도), a*(적색도), b*(황색도)를 측정하였다. 또한 시료 간 색상 차이(∆E*)를 알아보기 위해 아래 방정식을 사용하여 계산하였다. 색차계는 측정 전에 백색판(L*=97.3, a*= —0.9, b*=3.0)으로 보정 후 사용하였다.
사과박의 총 폴리페놀 함량은 Dewanto V 등(2002)의 방법을 일부 변형하여 분석하였다. 추출한 상등액에 Folin-Ciocalteu’s reagent 50 μL를 첨가한 뒤 3분 동안 반응시켰으며, 이후 2% Na2CO3 1 mL를 넣고 암실에서 30분간 방치하였다. 반응이 완료된 후 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 이용하여 750 nm에서 흡광도를 측정하였다. 측정된 값은 표준 물질인 gallic acid(Sigma-Aldrich, Co., USA)의 표준 곡선을 기준으로 함량을 계산하였다.
사과박의 총 플라보노이드 함량은 Shen Y 등(2009)의 방법을 일부 변형하여 측정하였다. 상등액 100 μL에 5% NaNO2 75 μL를 첨가한 후 5분 동안 반응시켰으며, 이어서 10% AlCl3·6H2O 150 μL를 넣고 6분 동안 반응하였다. 이후 1M NaOH 500 μL를 추가한 뒤 암실에서 11분간 반응시킨 후, 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 활용하여 415 nm에서 흡광도를 측정하였다. 측정된 값은 표준 물질인 rutin(Sigma-Aldrich, Co., USA)의 표준 곡선을 이용하여 함량을 산출하였다.
DPPH radical 소거능은 Blois MS(Blois MS 1958)의 방법을 일부 변형하여 분석하였다. DPPH 시약은 methyl alcohol을 사용하여 0.1 mM 농도로 제조한 후, 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 활용하여 517 nm에서 흡광도 값이 1.0이 되도록 조정하였다. 상등액 100 μL에 DPPH 시약 1 mL를 첨가하여 혼합한 뒤, 암실에서 30분 동안 반응시켰으며, 이후 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 사용하여 517 nm에서 흡광도를 측정하였다. 측정된 값은 methyl alcohol과 반응한 흡광도 값을 기준으로 백분율로 산출하였다.
ABTS(2,2′-azino-bis-3-ethylbenzothiazoline-6-sulphonic acid) radical 소거능은 Re R 등(Re R 등 1999)의 방법을 일부 변형하여 분석하였다. 7 mM ABTS와 2.4 mM Potassium persulfate를 제조하여 동일한 비율로 혼합한 후, 암실에서 12시간 동안 반응시켜 ABTS+(ABTS cation radical)을 형성하였으며, 흡광도 값이 0.7이 되도록 PBS 용액을 추가하여 조정하였다. 상등액 100 μL에 ABTS+ 1 mL를 첨가하여 혼합한 뒤, 암실에서 30분간 반응을 진행한 후, 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 이용하여 735 nm에서 흡광도를 측정하였다. 측정된 값은 표준 물질인 Trolox(Sigma-Aldrich, Co., USA)의 표준 곡선 방정식에 적용하여 함량을 산출하였다.
FRAP(ferric reducing antioxidant power)법을 이용한 항산화력 측정은 (Benzie IFF & Strain JJ 1996)의 방법을 기반으로 수행하였다. 0.2 M sodium acetate buffer, 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ), 20 mM ferric chloride hexahydrate, 그리고 증류수를 10:1:1:1 비율로 혼합하여 FRAP working solution을 제조하였으며, 37℃ water bath에서 30분 동안 반응시킨 후 실험에 활용하였다. 상등액 100 μL에 FRAP working solution 1 mL를 첨가한 뒤, 암실에서 30분간 반응을 진행한 후, 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 이용하여 595 nm에서 흡광도를 측정하였다. 측정된 데이터는 표준 물질인 Trolox(Sigma-Aldrich, Co., USA)의 표준 곡선 방정식을 적용하여 함량을 계산하였다.
환원력 분석은 Oyaizu M(Oyaizu M 1986)의 방법을 기반으로 수행하였다. 0.2 M sodium phosphate buffer의 pH를 pH 미터기(S220-K, Mettler Toledo International, Inc., Seoul, Korea)를 이용하여 6.6으로 조정하였다. 상등액 100 μL에 0.2 M sodium phosphate buffer와 1% potassium ferricyanide를 각각 300 μL씩 첨가한 후, 50℃ water bath에서 20분 동안 반응시켰다. 이후 10% trichloroacetic acid(TCA) 300 μL와 0.1% ferric chloride 100 μL를 첨가한 뒤, 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 이용하여 700 nm에서 흡광도를 측정하였다. 측정된 결과는 표준 물질인 Trolox(Sigma-Aldrich, Co., USA)의 표준 곡선 방정식을 활용하여 함량을 산출하였다.
본 연구에서는 총 4회 반복하여 측정을 진행하였으며, 측정된 결과는 XLSTAT(Lurnivero, Co., USA)를 활용하여 평균±표준편차로 정리하였다. 시료 간 차이는 유의수준 p<0.05에서 ANOVA(analysis of variance)를 적용하여 분석하였으며, 평균값 간 유의적인 차이를 확인하기 위해 Duncan’s multiple range test를 수행하였다.
결과 및 고찰
1. 수분 함량, pH 및 적정 산도
사과박(AP)과 사과주스(AJ)의 수분 함량, pH 및 적정 산도의 결과는 Table 1과 같다. AP의 수분 함량은 10.42~11.88% 범위이었으며, AJ의 수분 함량은 15.99~17.61% 범위로 AJ의 수분 함량이 높았으며, 특히 PAJ가 17.61%로 가장 높게 나타났다. 이는 열풍 건조 전 시료의 구성성분이 AP는 사과, 씨앗 그리고 과육 등의 섬유소가 주를 이루며, AJ는 과즙과 당 등을 포함하여 수분 함량이 상대적으로 높기 때문이라고 판단된다. AP와 AJ의 pH는 AP가 pH 4.66~4.75, AJ는 pH 4.50~4.61로 AP가 유의적으로 높은 pH를 보였다(p<0.05). 이에 따라 적정 산도는 AP가 0.06~0.08%이었으며, AJ는 0.12~0.14% 범위였다. 이는 AJ는 유기산이 많이 함유되어 있으므로 섬유소의 비율이 큰 AP보다 pH가 낮을 것으로 생각된다. pH와 적정 산도는 Lee SJ 등(2012)의 살균 방법에 따른 사과 주스의 품질 특성 연구에서의 사과주스의 pH와 유사한 범위이고, 그에 따른 적정 산도의 경향도 유사하게 나타났다.
2. 총 가용성 고형분 및 환원당 함량
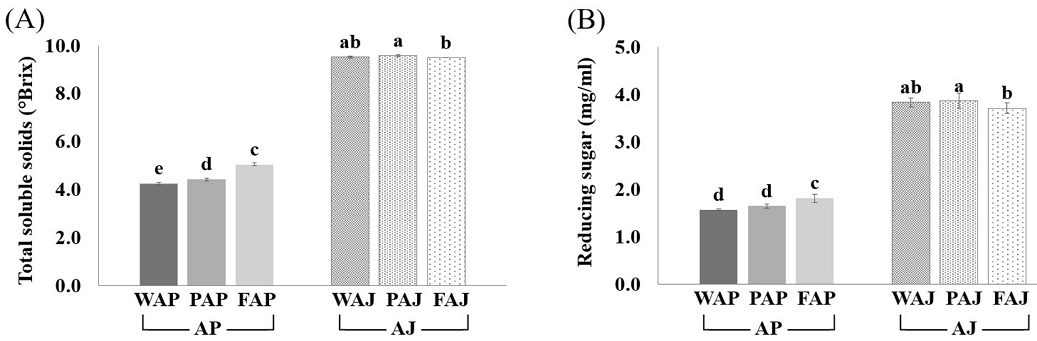
사과박(AP)과 사과주스(AJ)의 총 가용성 고형분(°Brix) 및 환원당 함량은 Fig. 2A, 2B와 같다. Fig. 2A와 같이 AJ의 총 가용성 고형분 함량은 9.5~9.6 °Brix 범위로 AP(4.3~5.1 °Brix)와 비교하여 유의적으로 높게 나타났다(p<0.05). AJ에서는 사과껍질과 과육만을 포함한 PAJ가 과육만을 포함한 FAJ에 비해 유의적으로 총당 함량이 높았으나, AP에서는 과육만을 포함한 FAP가 유의적으로 높은 수치를 나타냈다(p<0.05). Fig. 2B의 환원당 함량도 총 가용성 고형분 함량과 같은 경향을 보였다. 이는 사과의 총 가용성 고형분 및 환원당이 AJ에 많이 함유되어 있기 때문이라고 판단된다. Kim JS 등(2021)의 시판 사과주스에 관한 연구에서도 총 가용성 고형분 함량이 7.17~14.32 °Brix 범위로 나타나 본 연구의 결과와 유사한 경향을 보였다.
3. 색도 및 갈색도
사과박(AP)과 사과주스(AJ)의 색도와 갈색도는 Table 2와 같다. AP의 L*값(명도)은 67.6~70.0 범위였으며, AJ의 L*값(명도)인 42.2~43.5에 비해 유의적으로 높게 나타났다(p<0.05). AP의 a*값(적색도)은 8.9~9.8 범위였으며, AJ의 a*값(적색도)인 5.6~6.5에 비해 유의적으로 높게 나타났다(p<0.05). 이는 AP의 구성성분 중 사과껍질에 함유된 붉은색 색소 성분인 cyanidin-3-galactoside의 영향을 받았을 것으로 생각된다(Treutter D 등 2001). AP의 b*값(황색도)은 19.8~21.4 범위였으며, AJ의 b*값(황색도)인 4.9~6.4와 비교하여 유의적으로 높게 나타났다(p<0.05). ∆E*값은 시료의 L*, a*, b*를 모두 고려한 시료의 색상 차이를 수치화한 것이다(Choi HW 등 2023). 본 연구에서 AP 시료(WAP, PAP, FAP)의 ∆E*값의 범위는 1.5~1.7이었고, AJ 시료(WAJ, PAJ, FAJ)의 ∆E*값은 0.7~1.3이었으므로 넓은 범위에서 동일한 색상으로 인식된다. 그러나 AP와 AJ 사이의 ∆E*값의 범위는 최대 21.1로서 다른 색상으로 인식되는 결과를 나타냈다. 갈색도의 경우 AJ는 0.55~0.65 범위로 AP(0.29~0.35)와 비교하여 유의적으로 높게 나타났다(p<0.05). 이는 사과를 착즙하는 과정에서 AP와 AJ에 효소적 갈변이 있었을 것으로 예상되며, 열풍 건조를 통해 수분을 많이 함유한 AJ가 AP보다 활발한 비효소적 갈변이 작용했을 것으로 예상된다. 그러나 사과의 효소적, 비효소적 갈변에 의한 항산화 성분 및 활성 비교 연구는 없으므로 향후 연구가 필요할 것으로 고려된다.
4. 항산화 성분
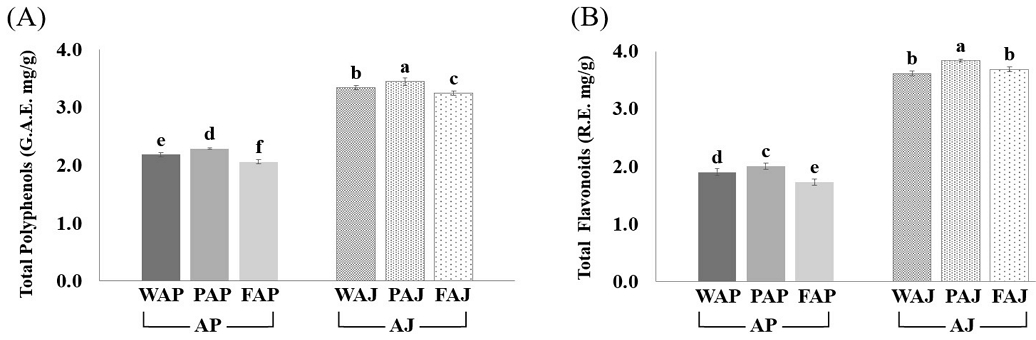
사과박(AP)과 사과주스(AJ)의 항산화 성분 결과는 Fig. 3A, 3B과 같다. Fig. 3A의 총 폴리페놀 함량에서 AP는 2.06~2.29 G.A.E. mg/g 범위였고, AJ가 3.24~3.45 G.A.E. mg/g 범위로 나타나 AP가 유의적으로 낮게 나타났다(p<0.05). Fig. 3B에 나타난 총 플라보노이드 함량도 총 폴리페놀 함량과 유사한 경향을 보였다. 특히 사과껍질과 과육만을 포함한 PAJ는 총 폴리페놀(3.45±0.07 G.A.E. mg/g)과 총 플라보노이드(3.84±0.02 R.E. mg/g) 함량이 유의적으로 가장 높았다(p<0.05). Kim KR 등(2024)의 보고에 따르면 사과주스의 총 폴리페놀 함량이 3.68±0.19~5.70±0.21 G.A.E. mg/g 범위였으며, 총 플라보노이드 함량은 1.43±0.06~18.31±0.51 C.E. mg/g라고 보고하였다. Won HR 등(2005)의 미숙성 사과 추출물의 항산화 특성 연구에서도 사과껍질이 포함된 경우가 사과껍질을 포함하지 않은 경우보다 총 플라보노이드 함량이 많다고 보고하였다. Fernandes PAR 등(2019)의 연구에서도 씨앗, 꼭지, 펄프 및 껍질을 보유한 사과박의 건조 중량에서 페놀산이 3%, 플라보놀 2%, 디하이드로칼콘이 1%로 나타났으며, 사과박의 주된 폴리페놀인 프로시아니딘이 912 g/kg 농도로 존재한다고 보고하였다.
5. 항산화 활성
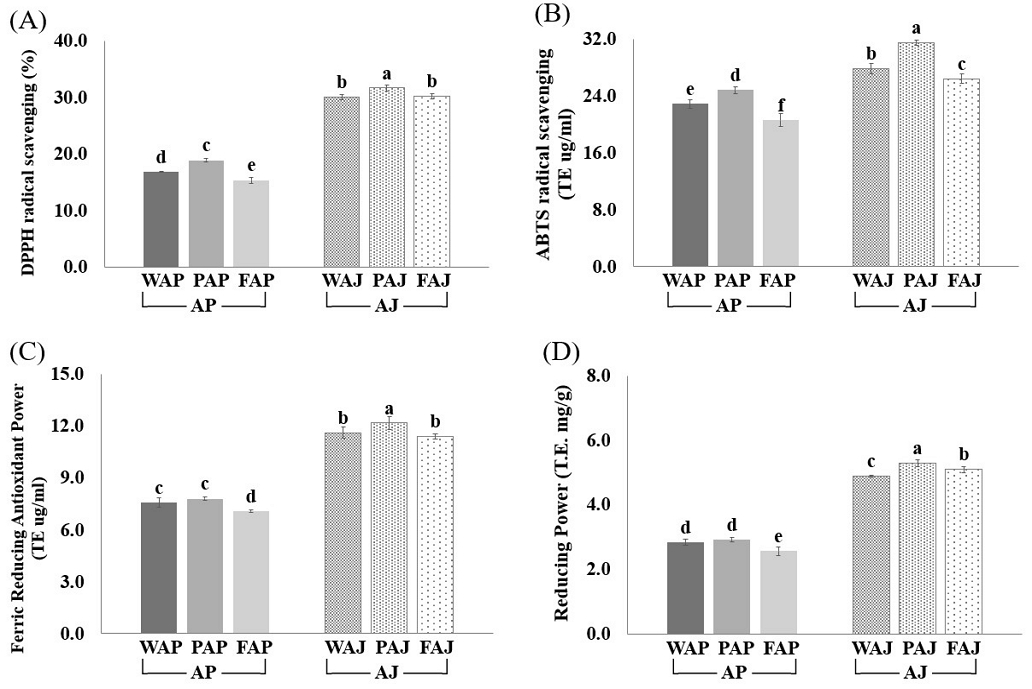
사과박(AP)과 사과주스(AJ)의 항산화 활성의 결과는 Fig. 4A, 4B, 4C, 그리고 4D와 같다. 항산화 활성 측정으로 항산화 성분에 대한 전자공여능을 측정하는 DPPH radical 소거능 측정법, 양이온 radical과 항산화 화합물의 상호작용에 대한 ABTS radical 소거능 측정법, TPTZ 복합체에 의해 Fe3+이 Fe2+으로 환원되는 것을 분석하여 시료 내 항산화력을 측정하는 FRAP 측정법, 그리고 potassium ferricyanide가 ferrocyanide로 환원되는 반응을 보는 환원력 측정법을 통해 시료의 항산화력을 분석하였다(Miller NJ 등 1993; Moreno MI 등 2000). Fig. 4A의 DPPH radical 소거능에서 AP가 AJ보다 유의적으로 낮게 나타났으며, 사과껍질과 과육만을 포함한 PAP가 AP에서 항산화 활성이 유의적으로 가장 높았고, 그 다음은 WAP, FAP 순으로 나타났다(p<0.05). AJ에서도 유사한 경향을 보였으며, 기타 항산화 활성 분석(ABTS, FRAP, 환원력)도 DPPH와 유사한 경향을 나타냈다(p<0.05). 이 결과는 Fig. 3의 항산화 성분 함량과 유사한 경향을 보였으며, 항산화 성분 함량과 항산화 활성 간에 유의미한 상관관계를 나타내었다. Kim KR 등(2024)은 사과주스의 항산화 활성은 총 폴리페놀 및 총 플라보노이드와 같은 항산화 성분 분석 결과가 비슷한 경향을 보인다고 보고하였다. 또한 본 연구 결과와 같이 Lee SJ 등(2012)과 Kim JE 등(2021)의 연구에서도 총 폴리페놀 함량의 증가에 비례하여 항산화 활성도 증가한다는 사실이 보고되었다.
요약 및 결론
본 연구는 사과주스(AJ)의 제조에서 생성되는 사과박(AP)의 품질 평가를 위하여 사과 전체 사용(WAP, WAJ), 사과껍질과 과육 사용(PAP, PAJ), 과육만 사용(FAP, FAJ)한 AP과 AJ를 제조하여 이화학적 특성, 항산화 성분 및 활성 분석을 진행하였다. AP의 수분 함량은 10.42~11.88% 범위였으며, AJ의 수분 함량은 15.99~17.61% 범위로 AJ의 수분 함량이 유의적으로 높았다(p<0.05). AP의 pH는 범위가 pH 4.66~4.75이었고, AJ는 pH 4.50~4.61이었다. 이에 따라 적정 산도는 AP가 0.06~0.08%이었으며, AJ는 0.12~0.14% 범위였다. AJ의 총 가용성 고형분 함량은 9.5~9.6 °Brix 범위로 AP(4.3~5.1 °Brix)와 비교하여 유의적으로 높게 나타났으며, 사과껍질과 과육만을 포함한 PAJ, 과육만을 포함한 FAP가 AJ와 AP에서 가장 높은 함량을 나타내었고, AJ의 함량 간 유의적 차이는 없었다. 환원당 함량도 총 가용성 고형분 함량과 같은 경향을 보였다. 갈색도의 범위는 AP가 0.29~0.35였고, AJ는 0.55~0.65이었으며 AJ가 유의적으로 높게 나타났다(p<0.05). 항산화 성분의 총 폴리페놀의 경우 AP는 2.06~2.29 G.A.E. mg/g 범위였고, AJ가 3.24~3.45 G.A.E. mg/g 범위로 나타나 AP가 유의적으로 낮게 나타났다(p<0.05). 특히 사과껍질과 과육만을 포함한 PAP와 PAJ가 AP와 AJ에서 유의적으로 가장 높은 항산화 성분 함량을 나타냈다(p<0.05). 항산화 성분의 총 플라보노이드 함량도 총 폴리페놀과 유사한 경향을 보였다. 항산화 활성인 DPPH radical 소거능에서 AP는 AJ보다 유의적으로 낮게 나타났다(p<0.05). AP에서 사과껍질과 과육만을 포함한 PAP가 항산화 활성이 유의적으로 가장 높았고, 그 다음은 WAP, FAP 순으로 나타났다(p<0.05). AJ의 항산화 활성도 AP와 유사한 경향을 보였으며, 기타 항산화 활성 분석(ABTS, FRAP, 환원력)도 DPPH와 유사한 경향을 나타냈다(p<0.05). 본 연구결과 AP에도 AJ의 65.2%에 해당하는 상당한 항산화 성분이 함유되어 식품 소재로서의 활용 가치를 충분히 지니고 있었다. AP 중에서도 사과껍질과 과육을 포함한 PAP가 항산화 성질이 유의적으로 높게 나타났으므로 지속 가능한 식품 개발 및 가공 생산 분야에서 주된 식품 원료로서의 활용도를 높이는 향후 연구가 필요하다.
References
- AOAC (2000). Official Methods of Analysis. 17th ed. The Association of Official Analytical Chemists, Gaithersburg, MD, USA.
-
Bang HY, Cho SD, Kim DM, Kim GH (2015) Comparison of antioxidative activities of fuji apple parts according to production region. J Korean Soc Food Sci Nutr 44(4): 557-563.
[https://doi.org/10.3746/jkfn.2015.44.4.557]

-
Barreira JCM, Arraibi AA, Ferrira ICFR (2019) Bioactive and functional compounds in apple pomace from juice and cider manufacturing: Potential use in dermal formulations. Trends Food Sci Technol 90: 76-87.
[https://doi.org/10.1016/j.tifs.2019.05.014]

-
Benzie IFF, Strain JJ (1996) The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Anal Biochem 239(1): 70-76.
[https://doi.org/10.1006/abio.1996.0292]

-
Blois MS (1958) Antioxidant determination by the use a stable free radical. Nature 181(4617): 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Choi HW, Park SE, Son HS (2023) Color image experession through CIE L*a*b* system in foods. J Korean Soc Food Sci Nutr 52(2): 223-229.
[https://doi.org/10.3746/jkfn.2023.52.2.223]

-
Dewanto V, Wu X, Adom KK, Liu RH (2002) Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant acticity. J Agric Food Chem 50(10): 3010-3014.
[https://doi.org/10.1021/jf0115589]

-
Elleuch M, Bedigian D, Roiseux O, Besbes S, Blecker C, Attia H (2011) Dietary fibre and fibre-rich by-products of food processing: Characterisation, technological functionality and commercial applications: A review. Food Chem 124(2): 411-421.
[https://doi.org/10.1016/j.foodchem.2010.06.077]

-
Fernandes PAR, Bourvellec CL, Renard CMGC, Nunes FM, Bastos R, Coelho E, Wessel DF, Coimbra MA, Cardoso SM (2019) Revisiting the chemistry of apple pomace polyphenols. Food Chem 294: 9-18.
[https://doi.org/10.1016/j.foodchem.2019.05.006]

- Hong JS, Kim MK, Yoon S, Ryu NS, Kim YK (1993) Preparation of noodle supplemented with treated apple pomace and soymilk residue as a source of dietary fiber. Appl Biol Chem 36(2): 80-85.
- Kim HJ, Hur JK, Huh CS, Baek YJ (2001) Effects of extractants on the characteristic of soluble dietary fiber from apple pomace. Korean J Food Sci Technol 33(2): 161-165.
- Kim JE, Shin JY, Yang JY (2021) Nutritional analyses and antioxidant activity of apple pomace. J Life Sci 31(7): 617-625.
-
Kim JS, Jung HN, Yang JW, Choi IS (2021) Comparsion of physicochemical characteristics and antioxidant properties in commercial apple beverage products. Korean J Human Ecol 30(6): 973-984.
[https://doi.org/10.5934/kjhe.2021.30.6.973]

-
Kim JS, Kim MS, Choi IS (2023) Physicochemical characteristics, antioxidant properties and consumer acceptance of greek yogurt fortified with apple pomace syrup. Foods 12(9): 1856.
[https://doi.org/10.3390/foods12091856]

-
Kim JY, Jang HN, Kim GC, Kang HJ, Hwang IG (2021) Validation of analytical method and procyanidin B2, C1 content in Korean apple cultivars. J Korean Soc Food Sci Nutr 50(11): 1258-1263.
[https://doi.org/10.3746/jkfn.2021.50.11.1258]

-
Kim KR, Kim KO, Park S, Kim SH, Kim TW, Lee DH, Sung JH (2024) Physicochemical characteristics and antioxidant activities of apple juices produced using different manufacturing processes. J Korean Soc Food Sci Nutr 53(3): 265-271.
[https://doi.org/10.3746/jkfn.2024.53.3.265]

-
Kim MS, Walters N, Martini A, Joyner HS, Duizer LM, Grygorczyk A (2020) Adapting tribology for use in sensory studies on hard food: The case of texture perception in apples. Food Qual Prefer 86: 103990.
[https://doi.org/10.1016/j.foodqual.2020.103990]

-
Kim YK, Jeong SL, Cha SH, Yi JY, Kim DI, Yoo DI, Hyun TK, Jang KI (2019) Quality and antioxidant properties of muffin added with ‘fuji’ apple pomace powder. J Korean Soc Food Sci Nutr 48(3): 319-327.
[https://doi.org/10.3746/jkfn.2019.48.3.319]

- KOSIS (2023) Overview of Fruit Processing Trends. Statistical Records on Fruit Processing. https://kosis.kr/, (accessed on 10. 2. 2025)
- KOSIS (2024) Crop Production Survey. Apple Production Volume. https://kosis.kr/, (accessed on 10. 2. 2025)
-
Kosmala M, Kolodziejczyk K, Zduńczyk Z, Juśkiewicz J, Boros D (2011) Chemical composition of natural and polyphenol-free apple pomace and the effect of this dietary ingredient on intestinal fermantation and serum lipid parameters in rats. J Agric Food Chem 59(17): 9177-9185.
[https://doi.org/10.1021/jf201950y]

-
Łata B, Tomala K (2007) Apple peel as a contributor to whole fruit quantity of potentially healthful bioactive compounds. cultivar and year lmplication. J Agric Food Chem 55(26): 10795-10802.
[https://doi.org/10.1021/jf072035p]

- Lee JH, Kim YC, Kim MY, Chung HS, Chung SK (2000) Antioxidative activity and related compounds of apple pomace. Korean J Food Sci Technol 32(4): 908-913.
-
Lee JY, Lee YT, Mok CK (2000) Drying of apple pomace and Bifidobacterium fermentation of dry apple pomace/saccharified rice solution. Food Eng Prog 4(1): 1-8.
[https://doi.org/10.13050/foodengprog.2000.4.1.1]

- Lee KH, Yoon YJ, Kwon HW, Lee EH (2018) Antioxidant component and activity of different part extracts in apple (Malus domestica cv. Fuji). Korean J Food Nutr 31(6): 858-864.
-
Lee MN, Kim ES, Kwak EJ (2024) The quality characteristic and antioxidant properties of jocheng containing apple cheong with added apple powder. J East Asian Soc Diet Life 34(3): 193-202.
[https://doi.org/10.17495/easdl.2024.6.34.3.193]

-
Lee SJ, Jang HL, Shin SR, Yoon KY (2012) Quality characteristics of apple juice according to the sterilization methods. Food Sci Preserv 19(2): 178-184.
[https://doi.org/10.11002/kjfp.2012.19.2.178]

-
Lyu F, Luiz SF, Azeredo DRP, Cruz AG, Ajlouni S, Ranadheera CS (2020) Apple pomace as a functional and healthy ingredient in food products: A review. Processes 8(3): 319.
[https://doi.org/10.3390/pr8030319]

-
Miller NJ, Rice-Evans C, Davies MJ, Gopinathan V, Milner A (1993) A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status inpremature neonates. Clin Sci (Lond) 84(4): 407-412.
[https://doi.org/10.1042/cs0840407]

-
Moon JE, Heu HJ, Lee JS, Yang JW (2023) Acid treatment enhances the antioxidant activity of apple peel by converting flavonoid aglycones to glycosides. J Korean Soc Food Sci Nutr 52(2): 146-153.
[https://doi.org/10.3746/jkfn.2023.52.2.146]

-
Moreno MI, Isla MI, Sampietro AR, Vattuone MA (2000) Comparison of the free radical scavenging activity of propolis from several regions of argentina. J Ethnopharmacol 71(1-2): 109-114.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
O’Shea N, Ktenioudaki A, Smyth TP, McLoughlin P, Doran L, Auty MAE, Arendt E, Gallagher E (2015) Physicochemical assessment of two fruit by-products as functional ingredients: Apple and orange pomace. J Food Eng 153: 89-95.
[https://doi.org/10.1016/j.jfoodeng.2014.12.014]

-
Oh CH, Kang CS (2016) Effects of apple pomace on cookie quality. Culi Sci & Hos Res 22(8): 89-98.
[https://doi.org/10.20878/cshr.2016.23.8.008]

-
Oyaizu M (1986) Studies on products of browning reaction: Antioxidantive activities of products of browning reaction prepared from glucosamine. Jpn J Nutr Diet 44(6): 307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Park YK, Kim HS, Park HY, Han GJ, Kim MH (2011a) Quality characteristic of sulgidduk with apple pomace dietary fiber. Food Eng Prog 15(3): 250-256.
[https://doi.org/10.13050/foodengprog.2011.15.3.250]

- Park YK, Kim HS, Park HY, Han GJ, Kim MH (2011b) Retarded retrogradation effect of garaetteok with apple pomace dietary fiber powder. J Korean Soc Food Cult 26(4): 400-408.
- Pyeon JY, Kim YJ, Jang KI, Jeong JY, Kim YH (2022) Physicochemical characteristics and antioxidant activity of cereal bars containing apple pomace. J Korean Soc Food Cult 37(6): 547-554.
-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26(9-10): 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Shen Y, Jin L, Xiao P, Lu Y, Bao JS (2009) Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weigh. J Cereal Sci 49(1): 106-111.
[https://doi.org/10.1016/j.jcs.2008.07.010]

-
Sudha ML, Baskaran V, Leelavathi K (2007) Apple pomace as a source of dietary fiber and polyphenols and its effect on the rheological characteristics and cake making. Food Chem 104(2): 686-692.
[https://doi.org/10.1016/j.foodchem.2006.12.016]

-
Treutter D (2001) Biosynthesis of phenolic compounds and its regulation in apple. Plant Growth Regul 34: 71-89.
[https://doi.org/10.1023/A:1013378702940]

-
Wang X, Kristo E, LaPointe G (2020) Adding apple pomace as a fuctional ingredient in stirred-type yogurt and yogurt drinks. Food Hydrocoll 100: 105453.
[https://doi.org/10.1016/j.foodhyd.2019.105453]

- Won HR, Park MW, Choi MY (2005) Antioxidant properties of unripened apple extracts. Korean J Community Living Sci 16(2): 11-16.
-
Zaky AA, Rajchert DW, Nowacka M (2024) Turning apple pomace into value: Sustainable recycling in food production-a narrative review. Sustainability 16: 7001.
[https://doi.org/10.3390/su16167001]