식용곤충으로부터 제조한 키토올리고당의 생산 및 특성
Abstract
In this study, the adequacy of standards such as indicator components and heavy metals was evaluated for 10 types of edible insects in Korea through the manufacturing of chitin, chitosan, and chitooligosaccharide from edible insects. The yield of chitin extracted was highest at 7.62% from Allomyrina dichotoma, and the yield of chitosan was highest at 67.98%. In addition, glucosamine and chitooligosaccharides were high from Allomyrina dichotoma at 6.92 mg/g and 6.84 mg/g, respectively, while free D-glucosamine was highest from both Allomyrina dichotoma and Zophobas atratus at 0.08 mg/g. Among heavy metals, plumbum, cadmium, and mercury were detected at 0.05 mg/kg, 1.4 mg/kg, and 0.03 mg/kg (or less), respectively, from all edible insect chitooligosaccharides, but arsenic was not detected. The pH levels were 5 to 6, viscosity ranged from 1∼5 cps, and total coliforms were negative. This study suggests that chitooligosaccharides manufactured from edible insects can be used as new functional material.
Keywords:
edible insects, chitin, chitosan, chitooligosaccharide서 론
국제식량농업기구는 2050년경 세계인구가 약 90억 명에 이를 것으로 추정하였으며, 현재보다 두 배 이상의 식량이 필요할 것으로 예상함에 따라 미래 식량난과 환경 파괴를 해결해줄 대안으로 곤충을 지목하고 있다(Food and Agriculture Organization of the United Nations 2013). 이에 국내·외에서 식용곤충을 활용한 단백질 소재화 기술과 다양한 생리활성을 확인한 기능성 소재로서 식용곤충에 대한 관심이 높다. 선진국들은 이미 곤충 생산 공장을 준공하여 곤충의 식용화를 위한 준비에 들어갔으며, 식용곤충 산업을 블루오션으로 규정하고, 기능성 소재화 산업을 활성화하는 데 주력하고 있다(Korea Technology and Information Promotion Agency for SMEs 2022).
현재 우리나라에서 식용이 가능한 곤충은 총 10종이 있다. 예전부터 식용사례가 있었던 곤충인 메뚜기(Oxya joponica Thungberg), 백강잠(Bombyx mori L.), 식용누에유충·번데기(Bombyx batryticatus)가 식품원료로 등록되어 있으며, 한시인정원료에서 일반원료로 전환된 곤충에는 갈색거저리 유충(T. molitor L.), 쌍별귀뚜라미(Gryllus bimaculatus), 흰점박이꽃무지유충(Protaetia brevitarsis), 장수풍뎅이유충(Allomyrina dichotoma)이 있다. 한시인정원료로는 아메리카왕거저리유충(Zophobas atratus), 수벌번데기(Apis mellifera L.), 풀무치(Locusta migratoria)가 사용 가능한 식품원료로 식약처로부터 인정받았으며, 풀무치는 사육농가에서 식품원료 등재 요청되어 10번째 식품원료로 인정되었다(Ministry of Food and Drug Safety 2019; Ministry of Food and Drug Safety 2021)
식용곤충의 주요 구성성분으로는 단백질과 지방 그리고 키틴 등이다(Yoo JM 등 2013; Adámková A 등 2017; Feng Y 등 2018). 식용곤충의 단백질 함량은 50% 이상으로 육류(닭, 소, 돼지, 생선 등과 같은)보다 높고 지방, 철과 아연 등의 미네랄, 비타민뿐만 아니라 다양한 생리 기능성 성분 중 동물성 식이섬유라고 하는 키틴도 다량 함유되어 있다(Nowak V 등 2016; Nongonierma AB & FitzGerald RJ 2017; de Castro RJS 등 2018; Zielińska E 등 2018). 갑각류로부터 키틴을 아세틸화한 키토산은 항암 활성(Nishmura K 등 1986), 항균 활성(Shimojoh M 등 1996), 항산화 활성(Ngo DN 등 2009), 콜레스테롤 저하작용(Maeazki Y 등 1993), 고혈압 억제작용(Okuda H 등 1997)을 갖는 것으로 보고되었으며, 이에 따라 기능성 식품, 기능성 화장품, 기능성 바이오 소재 및 의약품 소재로서의 용도 개발이 이루어지고 있다.
식용곤충의 키틴에 관한 연구로 집파리(Musca domestica), 이질바퀴(Periplaneta americana), 귀뚜라미(Gryllus bimaculatus)와 밀웜(Tenebrio molitor)에서 키틴 및 키토산을 추출한 후 기초적인 물리화학적 특성을 규명한 연구(Won R 2017)와 귀뚜라미 키토산의 항균 특성에 관한 연구(Noh YY 2017) 등 이를 활용하여 키틴을 분리한 후 키토산을 생성하고 의료용으로 활용하고자 하는 연구가 활발히 진행되고 있다.
최근에는 식용곤충의 생리활성에 대한 연구가 진행되어 식용곤충의 키토산을 효소 가수분해하여 키토올리고당(chitooligosaccharide)의 분자량에 따른 항종양 활성(Han FS 등 2016), 항산화 작용(Liu B 등 2007), 항치매(Byun HG 등 2005), 항당뇨(Cho EJ 등 2008), 항고혈압(Park PJ 등 2008), 칼슘흡수 촉진 작용(Jung WK 등 2006), 면역강화 작용 및 항알레르기 작용(Vo TS 등 2011)이 보고되었다. 그러나 식용곤충에 다량 함유되어 있는 키틴과 이로부터 제조한 키토산은 물에 녹지 않는 불용성이며 고분자 형태로 체내 흡수가 어렵다. 따라서 식용곤충으로부터 저분자량의 수용성 키토올리고당을 제조하여 생산성이 높은 기능성 소재 가능성을 규명하는 것이 필요하지만 이러한 연구는 부족한 실정이다.
본 연구에서는 10가지 식용곤충을 이용하여 제조한 키토올리고당의 글루코사민, D-글루코사민, 키토올리고당과 같은 지표성분 및 규격에 대한 적정성을 평가하여 소화·흡수력을 높인 저분자량의 수용성 키토올리고당의 기능성 소재로서 특성을 규명하고자 하였다. 본 연구결과는 향후 식용곤충의 기능성 소재화에 대한 연구에 활용될 수 있을 것으로 기대한다.
재료 및 방법
1. 연구재료
본 연구에 사용한 식용곤충은 메뚜기(Oxya japonica Thungberg), 백강잠(Bombyx mori L.), 식용누에유충·번데기(Bombyx batryticatus), 갈색거저리유충(Tenebrio molitor L.), 쌍별귀뚜라미(Gryllus bimaculatus), 흰점박이꽃무지유충(Protaetia brevitarsis), 장수풍뎅이유충(Allomyrina dichotoma), 아메리카왕거저리유충(Zophobas atratus), 수벌번데기(Apis mellifera L.), 풀무치(Locusta migratoria)의 총 10가지이며, 시중에 판매되고 있는 건조된 식용곤충을 온라인(곤충마켓, 미스터메뚜기, 한방몰)에서 구입한 후 밀폐 용기에 4℃ 냉장 보관하면서 사용하였다.
2. 키틴 추출, 키토산 및 키토올리고당 제조
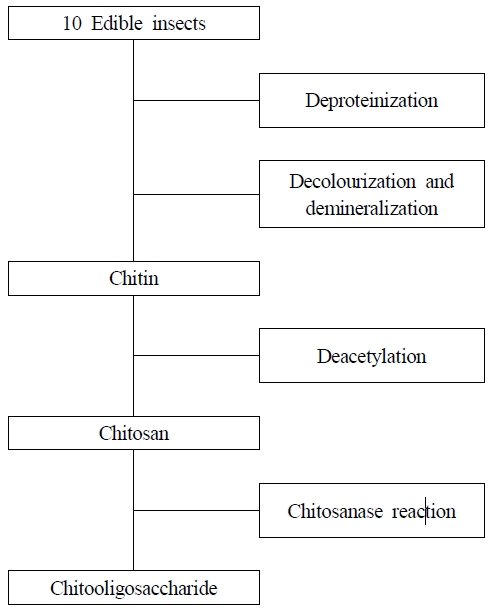
식용곤충의 키틴 추출방법은 Fig. 1과 같다. 식용곤충을 건조기(LO-FS150, Labogene, Labogene, Denmark)에서 30℃로 건조시킨 후 분쇄하여 항온수조(C-WBD2, Daihan Scientific Co., Ltd, Wonju, South Korea)에서 95℃, 6시간 동안 1 M 수산화나트륨에 용해하였다. 반응이 끝난 후 용해된 용액을 2,795×g에서 15분간 원심분리(VARISPIN 15R, Hettich Lab Technology, Tuttlingen, Germany)하여 용액과 침전물로 분리하였다. 분리된 침전물을 증류수로 1회 여과하고 80℃ 수조에서 30분 동안 가열한 후 다시 증류수로 세척하였다. 여기에 1 N 염산 용액을 첨가하여 pH meter(S220, Mettler Toledo, Greifensee, Switzerland)를 이용하여 pH 6.5로 조정한 뒤, 일반 증류수로 2회 세척하고 여과하였다. 색상과 미네랄을 제거하기 위해 침전물을 진탕 수조에서 30분 동안 95℃, 2×g에서 가열한 후 1 M 염산 용액에 넣은 다음 실온에서 24시간 동안 보관하였다. 반응이 끝난 후 용해된 용액을 2,795×g에서 15분간 원심분리하여 용액과 침전물로 분리하였다. 분리된 침전물을 증류수로 1회 여과하고 80℃ 수조에서 30분간 가열한 후 다시 증류수로 세척하였으며, 1 M 수산화나트륨 용액을 첨가하여 pH 6.5로 조정한 뒤, 일반 증류수로 두 번 세척하고 여과한 다음 동결건조기(MCFD, Ilshin BioBase, Dongducheon, South Korea)를 사용하여 진공에서 60℃에서 12시간 이상 밤새 건조하였다.
키토산은 키틴을 아세틸화하여 다음과 같이 제조하였다. 키틴을 55% 수산화나트륨 용액으로 95℃, 2×g로 9시간 동안 진탕 수조에서 처리하였으며, 반응이 끝난 용액을 2,795×g에서 15분간 원심분리하여 용액과 침전물로 분리하였다. 분리된 침전물을 증류수로 1회 여과하고 80℃ 수조에서 30분 동안 가열한 후 다시 증류수로 세척하였으며, 1 N 염산 용액을 첨가하여 pH 6.5로 조정하였다. 일반 증류수로 두 번 세척하고 여과한 다음 60℃ 진공 오븐에서 12시간 이상 밤새 건조시켰다.
추출 제조한 키토산에 증류수 300 mL, 초산 30 mL, 황산 0.9 mL를 순서대로 넣고 교반시키면서 온도를 서서히 올려 50℃에 도달하면 30% 과산화수소 125 mL를 첨가하였다. 혼합용액을 50℃로 유지시키면서 6시간 동안 저분자 수용화 반응을 진행하여 1차 분해단계를 거쳤다. 저분자 수용화 반응이 완결되면 반응액을 얼음욕 속으로 옮겨 냉각시키면서 30% 수산화나트륨 수용액 70 mL를 사용하여 pH 7의 중성용액으로 중화시켰다. 중화가 완료된 용액에 젖산 2 mL를 첨가하여 pH 5.5 정도로 맞추었다. 2차 분해단계로 키토사나아제 1.0 mL를 첨가하여 55℃에서 천천히 교반하면서 3시간 동안 분해한 다음 80℃에서 15분간 가열하여 효소를 활성화시켰다. 모든 반응이 완료된 용액을 원심분리기를 이용하여 5,478×g에서 20분 동안 원심분리하고 투석막(Spectra/Por Membrane MWCO 10,000, 1,000)으로 투석하여 키토올리고당을 제조하였다.
3. 식용곤충의 총 글루코사민, D-글루코사민, 키토올리고당의 함량 분석
식용곤충에서 추출한 키토산 0.04 g과 구입한 D-글루코사민 염산염(Chitosan, D-glucosamine hydrochloride, CAS No. 66-84-2)을 증류수 100 mL에 용해시킨 후 염산 7 mL, 증류수 13 mL을 첨가하였다. 이 용액 5 mL를 시험관에 취하여 탈기 밀봉 후 140℃에서 90분 동안 분해한 후 감압농축기(LE1700V, LabTech, Genova, Italy)를 이용하여 염산 및 증류수를 제거하였으며, 잔류물에 증류수 5 mL를 가하여 녹였다. 여액 1 mL를 마개 있는 시험관에 취하고 아세틸아세톤 시액 2 mL를 가하여 혼합하였으며, 96℃에서 1시간 가열하고 흐르는 물에서 냉각시킨 후 96% 에탄올 20 mL를 가하였다. 여기에 p-디메틸아미노벤즈알데히드 시액 2 mL를 가하여 혼합하고 실온에서 2시간 방치하였다. 반응한 D-글루코사민 염산염 생성량을 530 nm 파장에서 흡광도를 측정한 후 다음과 같이 총글루코사민 함량을 산출하였다.
- Ca: 시료의 흡광도
- Ct: 표준용액의 흡광도
- S: 시료 채취량(g)
- 1/1,000: 단위 환산 계수
표준용액은 구입한 D-글루코사민 염산염 0.5 g을 증류수 100 mL에 용해시켜 사용하였으며, 시험용액은 각각의 식용곤충 키토올리고당 0.5 g을 증류수 100 mL에 용해시켜 0.45 μm의 멤브레인 필터로 여과한 것으로 하였다. D-글루코사민은 시차굴절검출기(Refractive Index Detecor)가 달린 액체크로마토그래프(Arc HPLC, Waters, Milford, MA, USA)와 NH2-60(4.6 × 250 mm, 5 μm, Shiseido, Tokyo, Japan) 컬럼을 사용하여 분석한 후 다음과 같이 계산하였다.
- C: 시험용액 중의 글루코사민 염산염(또는 황산염)의 농도(mg/mL)
- a: 시험용액의 전량(mL)
- b: 희석배수
- S: 시료 채취량(g)
키토올리고당 함량은 건강기능식품공전(Ministry of Food and Drug Safety 2023)의 총 글루코사민 정량법에 근거하여 앞서 분석한 총 글루코사민 함량과 D-글루코사민의 함량을 이용하여 다음과 같이 계산하였다.
4. 식용곤충 키토올리고당의 중금속 함량, pH, 점도, 대장균군 분석
중금속 중 납, 카드뮴, 비소의 함량은 ICP-MS(iCAP RQ, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 분석하였다. 각각의 식용곤충 키토올리고당을 0.1 g 정도 취하여 질산 10 mL을 넣은 다음 마이크로분석시스템(microwave digestion system; MARS 6 230/60, CEM, North Carolina, NC, USA)을 이용하여 분해하였다. 분해 용액은 질산 14% 용액으로 50 mL까지 희석하여 분석하였으며, 표준용액은 표준원액(Plumbum Cadmium Arsenic, Inorganic ventures, VA, USA)을 질산 14% 용액으로 희석하여 제조하였다. 수은 함량은 각 시료를 0.02 mg 채취하여 가열기화금아말감법을 활용한 Mercury analyzer(HydraⅡ, Teledyne, Thousand Oaks, CA, USA)을 사용하여 분석하였으며, 표준원액(Mercury, SCP SCIENCE, Quebec, Canada)은 증류수에 희석하여 제조하여 측정하였다.
식용곤충 키토올리고당의 pH는 pH meter(S220, Mettler Toledo, Greifensee, Switzerland)를 이용하여 3회 반복 측정하여 평균값으로 나타내었다. 측정 전 표준용액으로 pH를 보정하고 측정 시 온도를 15±5℃로 유지하였다. 점도는 점도계(DV2TLVT, Brookfield, Middleboro, MA, USA)를 이용하여 SC62 스핀들로 20 rpm에서 1분간 측정하였으며, 시료별로 3회 반복 측정하여 평균값을 산출하였다.
대장균군은 식품공전을 기준으로 건조필름을 이용하여 측정하였다. 제조된 키토올리고당 1 mL를 PetrifilmTM 대장균군 카운트플레이트(6403, 3M Company, Maplewood, MN, USA)에 접종하고 37℃에서 24시간 동안 배양한 후 붉은색 집락 중 주위에 기포를 형성한 집락을 계수하였다.
5. 통계분석
통계분석은 SAS program(Ver. 9.4 SAS Institute, Cary, NC, USA)을 이용하여 실시하였다. 모든 변수의 차이는 일원분산분석(one-way ANOVA)을 실시한 후 Duncan’s multiple range test로 사후검정을 실시하였다. 모든 통계분석의 유의성은 p<0.05 수준에서 검정하였다.
결과 및 고찰
1. 식용곤충의 키토올리고당 수율
식용곤충에서 제조한 키토올리고당의 수율은 Table 1과 같다. 식용곤충 10가지 중 키틴의 수율은 장수풍뎅이유충이 7.62%로 가장 높았으며, 다음으로 벼메뚜기(7.46%), 풀무치(6.19%) 순이었고 식용누에유충·번데기가 1.50%로 가장 낮았다. 키틴으로부터 아세틸화한 키토산의 수율은 장수풍뎅이유충이 67.98%로 가장 높았으며, 다음으로 흰점박이꽃무지유충(66.65%), 수벌번데기(62.24%) 순이었고 식용누에유충‧번데기가 32.27%로 가장 낮았다. 이러한 결과를 종합할 때, 키틴과 키토산 수율은 장수풍뎅이유충이 가장 높았으며, 식용누에유충·번데기가 가장 낮게 나타났다. An CB & Lee EH(1992)는 6가지 갑각류 부산물로부터 제조한 키틴의 수율은 11.2%∼22.7% 정도였으며, 그 중 붉은 대게의 각피로 키틴을 제조하였을 때의 수율이 22.7%로 가장 높다고 보고하였다. 게 껍질 폐기물을 이용하여 효소 처리를 통해 키토산 생산 수율을 향상시킨 Bolat Y 등(2010)의 연구에서는 키토산 수율이 4.65%로 나타났다. 갑각류 폐기물은 주로 30%∼40%의 단백질과 30%∼50%의 회분(주로 탄산칼슘) 및 20%∼30%의 키틴으로 구성되어 있지만, 곤충은 외골격이 3%∼60%로 범위가 넓고 개체 중량이 갑각류에 비해 적기 때문에 수율이 낮은 것으로 보인다.
2. 식용곤충의 글루코사민, D-글루코사민, 키토올리고당의 함량
식용곤충의 글루코사민, D-글루코사민, 키토올리고당의 함량은 Table 2와 같다. 글루코사민은 식용누에유충‧번데기의 1.86 mg/g에서 장수풍뎅이유충의 6.92 mg/g까지 함량을 보여 식용곤충에 따라 유의한 차이를 보였다(p<0.001). D-글루코사민은 식용누에유충·번데기, 장수풍뎅이유충, 아메리카왕거저리유충, 수벌번데기가 0.07∼0.08 mg/g의 높은 함량을 보였으며, 메뚜기와 쌍별귀뚜라미가 0.01 mg/g으로 낮아 식용곤충 간에 유의한 차이를 보였다(p<0.001). 특히 장수풍뎅이유충, 아메리카왕거저리유충은 0.08 mg/g으로 D-글루코사민 함량이 같았다. 키토올리고당은 식용누에유충·번데기의 1.78 mg/g에서 장수풍뎅이유충의 6.84 mg/g까지 함량을 보여 식용곤충에 따라 유의한 차이를 보였다(p<0.001). 이상의 결과를 종합할 때, 10가지 식용곤충 중 글루코사민은 장수풍뎅이유충이 가장 높았으며, D-글루코사민은 장수풍뎅이유충과 아메리가왕거저리유충이, 키토올리고당은 장수풍뎅이유충이 가장 높았다. Seo DJ 등(2017)은 갈색거저리 껍질을 이용하여 제조한 콜로이달 키틴에서 N-아세틸글루코사민 함량이 5,041.3 ppm이라고 보고하였는데, 본 연구의 키토올리고당 함량은 Seo DJ 등(2017) 연구 결과와 비슷한 수준이었다. 한편 식품의약품안전처 건강기능식품의 키토산/키토올리고당 기준 및 규격에 의하면, 탈아세틸화도가 80% 이상이어야 하며, 글루코사민으로 키토산을 800 mg/g 이상을 함유하고 있어야 한다(Ministry of Food and Drug Safety 2024). 건강기능식품의 기준규격과 식용곤충이라는 소재를 분석한 연구 결과를 단순 비교하기 어렵지만, 향후 식용곤충의 키토산/키토올리고당을 이용한 건강기능식품 제조 시에는 이러한 기준 및 규격을 충족하기 위하여 식용곤충의 키토산/키토올리고당 수율이나 생산성 등을 고려해야 할 것이다.
3. 식용곤충 키토올리고당의 중금속 함량
식용곤충에서 제조한 키토올리고당의 중금속 함량 결과는 Table 3과 같다. 납은 메뚜기의 0.01 mg/kg에서 풀무치의 0.04 mg/kg까지 함량을 보였으며, 카드뮴은 아메리카왕거저리유충의 0.68 mg/kg에서 백강잠의 1.35 mg/kg까지 함량을 보였다. 수은은 갈색거저리유충, 장수풍뎅이유충, 풀무치가 0.03 mg/kg의 높은 함량을 보였으며 식용누에유충·번데기와 수벌번데기는 검출되지 않았다(p<0.001). 이러한 결과를 종합해 보면, 납은 모든 식용곤충의 키토올리고당에서 0.05 mg/kg 이하로 검출되었으며, 특히 메뚜기가 가장 낮은 함량을 보였다. 카드뮴은 모두 1.4 mg/kg 이하로 검출되었으며 아메리카왕거저리유충이 가장 적은 함량을 보였고, 수은은 0.03 mg/kg 이하로 검출되었음을 알 수 있었다. 특히 비소는 모든 식용곤충의 키토올리고당에서 검출되지 않았다. 본 연구에서 모든 식용곤충의 키토올리고당 중금속 함량은 허용기준(납 3.0 mg/kg, 카드뮴 0.3 mg/kg, 수은 1.0 mg/kg) (Ministry of Food and Drug Safety 2024) 이하의 수준을 보였으나 카드뮴은 이를 초과하는 것으로 나타났다. 납, 카드뮴, 수은, 비소는 인체에 유해 정도가 높아 정부에서 규제하고 있는 대표적인 유해 중금속으로 식품 등을 통해 인체에 들어오게 되면 몸 밖으로 빠져나가지 않아 체내 축적성이 높다(Jung JH 등 1999; Kim HY 등 2009). 그 중에서 카드뮴은 주로 신장, 폐 그리고 뼈에 유해하여 기억력 손실, 후각 상실, 폐렴, 폐부종 등을 유발하기 때문에 식품에서의 안전성 확보가 필요하다. 따라서 이를 보완한다면 유해물질인 중금속에 안전한 식품 소재가 될 것으로 기대한다.
4. 식용곤충 키토올리고당의 pH, 점도, 대장균군
식용곤충에서 제조한 키토올리고당의 pH, 점도, 대장균군을 분석한 결과는 Table 4와 같다. pH는 식용누에유충·번데기의 5.01에서 풀무치의 6.68까지 나타났으며, 점도는 식용누에유충‧번데기의 1.40 cps에서 쌍별귀뚜라미의 4.62 cps까지 수준이었다. 이상의 결과를 종합할 때, 모든 식용곤충에서 제조한 키토올리고당의 pH는 5∼6 범위였으며, 점도는 1∼5 cps, 대장균군은 모두 음성이었다. 키토올리고당의 품질기준 중 제품으로서 대장균군은 음성이어야 하며, 점도의 경우에는 현재 시판되고 있는 키토산올리고당 제품을 이용하여 동일한 농도의 수용액으로 측정한 점도가 1∼5 cps(Mirae Biotech 2003)와 같아 유사한 수준이었다. 따라서 본 연구에서 키토올리고당을 분석한 결과는 품질기준과 제품으로서 요건을 모두 충족함을 알 수 있다.
요 약
식용곤충은 동물성 식이섬유라고 하는 키틴을 다량 함유하고 있어 이를 가공한 식용곤충이 천연소재로서 주목을 받고 있다. 따라서 본 연구에서는 우리나라 식용곤충 10종에 대하여 키틴, 키토산, 키토올리고당의 제조 단계를 거쳐 글루코사민, D-글루코사민, 키토올리고당과 같은 지표성분 및 중금속 등 규격에 대한 적정성을 평가하고자 하였다. 키틴의 수율은 장수풍뎅이 유충이 7.62%, 키토산의 수율은 백강잠이 67.98%로 가장 높았다. 총글루코사민과 키토올리고당 함량은 장수풍뎅이유충이 총글루코사민 6.92 mg/g, 키토올리고당 6.84 mg/g으로 가장 높았다. 중금속 중 납, 카드뮴, 수은은 모든 식용곤충 키토올리고당에서 각각 0.05 mg/kg, 1.4 mg/kg, 0.03 mg/kg 이하로 검출되었고, 비소는 검출되지 않았다. 식용곤충 키토올리고당의 pH는 5∼6, 점도는 1∼5 cps로 나타났다. 또한 대장균군 정량분석 결과, 모든 식용곤충 키토올리고당에서 대장균군이 검출되지 않았다. 이상의 결과를 종합하면, 키토올리고당은 장수풍뎅이유충이 가장 높은 함량을 보였으며, 체내에서 분해되지 않고 서서히 축적되는 성질을 가지고 있어 소량씩 섭취하더라도 누적된 독성이 심각한 문제를 일으킬 수 있는 카드뮴을 제외하고 중금속 및 대장균군의 유해성분으로부터 안전성이 확인되었다. 이는 식용곤충에서 제조한 키토올리고당은 일반 특성 및 안전성 면에서 기능성 식품소재로 개발 단계로 진입 가능성을 시사하며, 앞으로 이를 이용하여 다양한 생리기능을 규명하는 연구가 이루어져야 할 것이다.
Acknowledgments
이 논문은 국립공주대학교 재원으로 2023년도 국립대학 육성사업 미래핵심 산업분야 학문후속세대 양성사업(과제번호: 2023-1001-01) 지원을 받아 수행된 연구임.
References
-
Adámková A, Mlček J, Kouřimská L, Borkovcová M, Bušina T, Adámek M, Bednářová M, Krajsa J (2017) Nutritional potential of selected insect species reared on the island of Sumatra. Int J Environ Res Public Health 14(5): 521.
[https://doi.org/10.3390/ijerph14050521]

- An CB, Lee EH (1992) Utilization of chitin prepared from the shellfish crust, effect of chitosan film packing on quality of lightlysalted and dried horse mackerel. Korean J Fish Aquat Sci 25(1): 51-57.
- Bolat Y, Bilgin Ș, Günlü A, Izci L, Koca SB, Çetinkaya S, Koca HU (2010) Chitin-chitosan yield of freshwater crab (Potamon potamios, Olivier 1804) shell. Pak Vet J 30(4): 227-231.
-
Byun HG, Kim YT, Park PJ, Lin X, Kim SK (2005) Chitooligosaccharides as a novel β-secretase inhibitor. Carbohydr Polym 61(2): 198-202.
[https://doi.org/10.1016/j.carbpol.2005.05.003]

- Cho EJ, Rahman A, Kim SW, Baek YM, Hwang HJ, Oh JY, Hwang HS, Lee SH, Yun JW (2008) Chitosan oligosaccharides inhibit adipogenesis in 3T3-L1 adipocytes. J Microbiol Biotechnol 18(1): 80-87.
-
de Castro RJS, Ohara A, dos Santos Aguilar JG, Domingues MAF (2018) Nutritional, functional and biological properties of insect proteins: Processes for obtaining, consumption and future challenges. Trends Food Sci Technol 76: 82-89.
[https://doi.org/10.1016/j.tifs.2018.04.006]

-
Feng Y, Chen XM, Zhao M, He Z, Sun L, Wang CY, Ding WF (2018) Edible insects in China: Utilization and prospects. Insect Sci 25(2): 184-198.
[https://doi.org/10.1111/1744-7917.12449]

- Food and Agriculture Organization of the United Nations (2013) The State of Food Insecurity in the World. IFAD and WFD, Italy. pp 8-28.
-
Han FS, Yang SJ, Lin MB, Chen YQ, Yang P, Xu JM (2016) Chitooligosaccharides promote radiosensitivity in colon cancer line SW480. World J Gastroenterol 22(22): 5193-5200.
[https://doi.org/10.3748/wjg.v22.i22.5193]

- Jung JH, Hwang LH, Yun ES, Kim HJ, Han IK (1999) A study on the contents of the heavy metals in meat and meat products. Korean J Vet Serv 22(1): 1-7.
-
Jung WK, Moon SH, Kim SK (2006) Effect of chitooligosaccharides on calcium bioavailability and bone strength in ovariectomized rats. Life Sci 78(9): 970-976.
[https://doi.org/10.1016/j.lfs.2005.06.006]

- Kim HY, Kim JI, Kim JC, Park JE, Lee KJ, Kim SI, Oh JH, Jang YM (2009) Survey of heavy metal contents of circulating agricultural products in Korea. Korean J Food Sci Technol 41(3): 238-244.
- Korea Technology and Information Promotion Agency for SMEs (2022) Future Food and Edible Insect Industries and the Role of Small and Medium-Sized Businesses. TIPA, Korea. pp 3-38.
-
Liu B, Liu WS, Han BQ, Sun YY (2007) Antidiabetic effects of chitooligosaccharides on pancreatic islet cells in streptozotocin-induced diabetic rats. World J Gastroenterol 13(5): 725-731.
[https://doi.org/10.3748/wjg.v13.i5.725]

-
Maezaki Y, Tsuji K, Nakagawa Y, Kawai Y, Akimoto M, Tsugita T, Takekawa W, Terada A, Hara H, Mitsuoka T (1993) Hypocholesterolemic effect of chitosan in adult males. Biosci Biotechnol Biochem 57(9): 1439-1444.
[https://doi.org/10.1271/bbb.57.1439]

- Ministry of Food and Drug Safety (2019) Korean Food Standards Codex. https://ko.fm, (accessed on 14. 7. 2024).
- Ministry of Food and Drug Safety (2021) Korean Food Standards Codex. https://ko.fm, (accessed on 29. 7. 2024).
- Ministry of Food and Drug Safety (2023) Health Functional Code. https://url.kr, (accessed on 11. 10. 2023).
- Ministry of Food and Drug Safety (2024) Health Functional Code. https://ko.fm, (accessed on 5. 7. 2024).
- Mirae Biotech (2003) Chitin and Chitosan Section. http://www.mrchito.com, (accessed on 5. 7. 2024).
-
Ngo DN, Lee SH, Kim MM, Kim SK (2009) Production of chitin oligosaccharides with different molecular weights and their antioxidant effect in RAW 264.7 cells. J Funct Foods 1(2): 188-198.
[https://doi.org/10.1016/j.jff.2009.01.008]

-
Nishimura K, Ishihara C, Ukei S, Tokura S, Azuma I (1986) Stimulation of cytokine production in mice using deacetylated chitin. Vaccine 4(3): 151-156.
[https://doi.org/10.1016/0264-410X(86)90002-2]

- Noh YY (2017) Anti-microbial effects of cricket (Gryllus bimaculatus) chitosan and their applications into fresh and processed foods. MS Thesis Hanyang University, Seoul. pp 10-20.
-
Nongonierma AB, FitzGerald RJ (2017) Unlocking the biological potential of proteins from edible insects through enzymatic hydrolysis: A review. Innov Food Sci and Emerg Technol 43: 239-252.
[https://doi.org/10.1016/j.ifset.2017.08.014]

-
Nowak V, Persijn D, Rittenschober D, Charrondiere UR (2016) Review of food composition data for edible insects. Food Chem 193: 39-46.
[https://doi.org/10.1016/j.foodchem.2014.10.114]

- Okuda H, Kato H, Tsujita T (1997) Antihypertensive and antihyperlipemic actions of chitosan. J Chitin Chitosan 2(3): 49-59.
-
Park PJ, Ahn CB, Jeon YJ, Je JY (2008) Renin inhibition activity by chitooligosaccharides. Bioorg Med Chem Lett 18(7): 2471-2474.
[https://doi.org/10.1016/j.bmcl.2008.02.041]

-
Seo DJ, Moon C, Song YS, Choi SH, Han YS, Jo YH, Noh MY, Jung WJ (2017) Production of N-acetyl-glucosamine by chitinase from Serratia marcescens PRNK-1 using chitin obtained from edible Tenebrio molitor Larva. J Chitin Chitosan 22(3): 149-155.
[https://doi.org/10.17642/jcc.22.3.2]

-
Shimojoh M, Masaki K, Kurita K, Fukushima K (1996) Bactericidal effects of chitosan from squid pensonoral streptococci. J Agric Chem Soc Japan 70(7): 787-792.
[https://doi.org/10.1271/nogeikagaku1924.70.787]

-
Vo TS, Kong CS, Kim SK (2011) Inhibitory effects of chitooligosaccharides on degranulation and cytokine generation in rat basophilic leukemia RBL-2H3 cells. Carbohydr Polym 84(1): 649-655.
[https://doi.org/10.1016/j.carbpol.2010.12.046]

-
Won R (2017) Insect-based chitin research and its potential application to insect industry in Korea. J Chitin Chitosan 22(4): 215-220.
[https://doi.org/10.17642/jcc.22.4.1]

-
Yoo JM, Hwang JS, Goo TW, Yun EY (2013) Comparative analysis of nutritional and harmful components in Korean and Chinese mealworms (Tenebrio molitor). J Korean Soc Food Sci Nutr 42(2): 249-254.
[https://doi.org/10.3746/jkfn.2013.42.2.249]

-
Zielińska E, Karaś M, Baraniak B (2018) Comparison of functional properties of edible insects and protein preparations thereof. LWT-Food Sci Technol 91: 168-174.
[https://doi.org/10.1016/j.lwt.2018.01.058]