치즈에서 병원성 식중독균 성장 저해를 위한 Modified Atmosphere Packaging(MAP) 및 Bacteriophage 효과 평가
Abstract
This study evaluated the effects of modified atmosphere packaging (MAP) and bacteriophage treatment on the control of pathogenic Escherichia coli strains (EHEC, EPEC, ETEC) and Listeria monocytogenes in cheese stored at 4℃, 7℃, 10℃, and 15℃. Cheese inoculated with the pathogens were packaged under various MAP conditions (MAP1: 100% N2, MAP2: 75% N2 + 25% CO2, MAP3: 50% N2 + 50% CO2, MAP4: 25% N2 + 75% CO2, and MAP5: 100% CO2). Bacteriophages were applied at concentrations of 1%, 1.5%, and 2% to the surfaces (7.5 cm2) of the cheese. At 7℃, pathogenic E. coli did not grow in cheese packaged at any MAP conditions. Cheese packaged at MAP4 conditions exhibited a trend of pathogenic E. coli die-off beginning on the 12th day of storage. Increasing CO2 levels in the packaging significantly inhibited the growth of pathogenic E. coli and L. monocytogenes at 10℃ and 15℃. Specifically, E. coli O157:H7 growth was reduced by 70%∼87%, while L. monocytogenes growth was reduced by 52%∼64%. At 4℃, the growth of L. monocytogenes was not effectively controlled by either bacteriophage or MAP4 condition alone, although the population of pathogenic E. coli decreased. However, the combination of bacteriophage treatment and MAP4 condition completely eliminated L. monocytogenes growth at 4℃. This study underscores the potential synergistic effects of combining bacteriophage application with MAP to enhance the food safety of cheese, particularly at lower storage temperatures.
Keywords:
dairy products, cheese, bacteriophage, modified atmosphere packaging, hurdle technology, pathogens서 론
유가공품은 원유를 주원료로 하여 가공한 우유류, 가공유류, 산양유, 발효유류, 버터유, 농축유류, 유크림유, 버터류, 치즈류, 분유류, 유청류, 유당, 유단백 가수분해 식품을 말한다(Ministry of Food and Drug Safety [MFDS] 2021). 유가공품은 단백질, 생리활성 펩타이드, 아미노산, 지방, 지방산, 비타민, 미네랄 등 인체에 필요한 대부분의 영양소가 풍부하다(Van mierlo LAJ 등 2006). 유가공품 중 치즈와 버터는 식생활의 서구화로 인해 최근 소비량이 증가하고 있는 추세를 보이고 있는데, 2020년도 기준 치즈의 소비량은 188,231톤, 버터는 17,832톤으로 각각 2016년 대비 1.34%, 1.54% 증가하였다(Ministry of Agriculture Food and Rural Affairs 2024). 치즈와 버터의 소비량이 증가함에 따라 유통환경에서 안전관리가 중요해지고 있고, 유제품의 안전성을 위협하는 주요 식중독균으로 Listeria monocytogenes, pathogenic E. coli, Salmonella spp. 등이 보고되고 있다(Donnelly C 2004; Lee JY & Yoon YH 2017). 미국에서는 2007년부터 2012년까지 비 살균 원유 및 비 살균 원유로 만든 유가공품(아이스크림, 치즈, 발효유, 버터 등)과 관련된 발병 사례 중 약 17%의 원인균이 Shiga-toxin producing E. coli(STEC)로 보고되어 병원성 대장균에 대한 안전관리가 중요시되고 있다(Centers for Disease Control and Prevention 2017).
병원성 대장균은 발병 양식에 따라 5가지로 분류하며, 장출혈성 대장균(Enterohemorrhagic E. coli, EHEC)은 용혈성 빈혈, 혈소판감소증, 급성신부전 등을 특징으로 하는 용혈성 요독증후군(hemolytic uremic syndrome, HUS)을 일으킨다(Momtaz H 등 2013; Dhaka P 등 2016). Shiga toxins(Stx) 생산은 EHEC O157:H7 발병기전의 특성 중 하나이며 용혈성 요독증후군과 관련된 주요 독성인자이다. EHEC은 선모를 이용하여 장 점막에 밀접하게 부착하여 독성인자를 주입하며 독성인자는 부착소멸적 손상(attaching-effacing, A/E)을 나타내는 eae 유전자를 보유해 조직학적 변화를 일으킨다(Croxen MA 등 2013). L. monocytogenes는 listeriosis를 발병 시키는 원인 균이며, 오염된 음식을 섭취하였을 때, 장 장벽을 가로질러 림프절을 통해 혈류로 퍼져 간과 비장과 같은 표적조직으로 퍼질 수 있다. 일반적으로 건강한 사람은 L. monocytogenes가 높게 오염이 된 음식을 먹어도 경증에서 중증의 위장염만을 나타낸다(Radoshevich L & Cossart P 2018), 그러나 인체 내에서 생존능력이 있어 장 장벽, 혈액-뇌 장벽, 태아-태반 장벽을 넘어 뇌나 자궁 등의 장기를 감염시켜 뇌수막염, 유산 등을 일으키며 면역체계가 약한 사람들에게 심각한 영향을 끼칠 수 있다(Buchanan RL 2017).
식품의 안전한 섭취를 위해 품질유지에 효과적인 MAP(modified atmosphere packaging)은 식품의 유통기한을 연장할 수 있는 방법 중 하나이다(Hotchkiss JH 등 2006). MAP포장에 사용되는 N2는 비활성가스로 낮은 용해도로 인해 MAP 포장에서 충전제로 많이 사용된다. 질소는 식품에 잘 흡수되지 않으며 물과 지방에 잘 용해되지 않기 때문에 CO2의 용해에 따른 포장 변패를 예방하기 위해 사용되며, 산소에 의한 변패가 잘 일어나는 식품에서 호기성 세균의 성장을 억제하기 위해 진공포장대신 사용한다(Kang DH 2012). 또한, CO2의 경우 세균과 곰팡이 발육에 저해효과가 크며 보관 온도가 낮아질수록 용해도는 증가하고 물과 지방에 녹기 쉽다. 세균의 성장억제는 CO2가 세포막을 투과하여 세포내 pH를 낮추고 세포막의 기능을 변화시켜 영양분의 흡수에 영향을 주며, 효소의 작용을 억제한다(Kang DH 2012). Bacteriophage는 박테리아 표면의 수용체에 부착하여 유전체를 박테리아에 전달하고, 박테리아내에서 새로운 phage가 형성되면 박테리아의 용해를 통해 세포질을 탈출한다(Kortright KE 등 2019), 식품에서의 Bacteriophage의 효과는 다양한 식품에서 박테리아 병원체를 특이적으로 표적화하기 때문에 효과적인 천연 및 녹색 항균기술로 활용도가 높아지고 있다(Moye ZD 등 2018).
따라서 본 연구에서는 L. monocytogenes와 병원성 장출혈성 대장균에 취약한 치즈의 냉장 유통기한을 연장시키기 위해 MAP와 Bacteriophage를 활용하여 치즈에서 병원성 장출혈성 대장균 및 L. monocytogenes의 성장 제어 효과 및 두 방법의 시너지 효과를 분석 연구하였다.
재료 및 방법
1. 병원성 장 출혈성 대장균 및 L. monocytogenes의 시험균액 준비
온도변화와 기체조성에 따라 행동변화를 관찰하기 위해 E. coli O157:H7(NCTC 12079), EPEC(살균 전 원유 분리 균주), ETEC(소 유두 표면 분리 균주)는 20% glycerol(Ducksan Pure Chemical Co., Ansan, Korea)이 포함된 tryptic soy broth(TSB, KisanBio, Seoul, Korea)에 배양하여 —80℃에서 보관하였다. L. monocytogenes(ATCC 15313, 19111)는 20% glycerol와 0.6% yeast extract(KisanBio, Korea)가 포함된 TSB(KisanBio, Korea)에 배양하여 —80℃에서 보관하였다. 실험을 위해 보관된 균주를 TSB 10 mL와 0.6% yeast extract이 포함된 TSB 10 mL에 각각 10 μL씩 균을 접종하여 140 rpm, 36℃에서 전배양(VS-8480, Vision Scientific Co., Daejeon, Korea)하였다. 각각의 전배양한 균을 원심분리(VS-550, Vision Scientific Co.)하여 cell pellet을 취하고 이를 멸균된 0.1% 펩톤 희석액(DifcoTM Peptone Water, Difco, Detroit, MI, USA) 10 mL와 함께 재원심분리 하였다. 재원심분리 후 상등액을 제거하고 각각의 pellet에 0.1% 펩톤 희석액(Difco) 10 mL를 넣어 균 액을 준비하였다. 이와 같이 준비된 Pathogenic Escherichia coli 3가지 균주와 L. monocytogenes 2가지 균주를 각각 혼합하고 멸균된 0.1% 펩톤 희석액으로 실험 목적에 따라 10진 희석하여 실험에 사용하였다.
2. 치즈시료 준비 및 MAP 포장 처리
본 연구에 사용한 치즈(Seoul Dairy Co., Seoul, Korea)는 본 연구의 목적을 달성하기 위해 오염도가 낮고 대중성(대형마트 판매량 순위), 이화학적 특성 분석을 비교하여 구워먹는 치즈로 시료를 선정하였다. 치즈는 대형마트(서울 동대문구)에서 구매해 무균적으로 10 g씩 채취하여 Enterohemorrhagic E. coli와 L. monocytogenes 혼합균주를 각각 초기 균수가 약 1.8∼2 log CFU/g이 되도록 접종하였다. MAP 포장의 기체 조성에 따라 치즈에서 Enterohemorrhagic E. coli 와 L. monocytogenes 행동에 미치는 영향을 분석하기 위해 MAP1(N2 100%), MAP2(N2 75%, CO2 25%), MAP3(N2 50%, CO2 50%), MAP4(N2 25%, CO2 75%), MAP5(CO2 100%) 각각의 기체 조성 조건하에 MAP 포장기(MAP Mix 9001, AMETEK MOCON, MN, USA)로 포장 후 4℃, 7℃, 10℃, 15℃에 저장하였다. 치즈의 유통환경을 고려하여 대조군은 진공포장(FR-B100WB, CSE Corp., Siheung, Korea)하여 저장하였다. 저장 기간 중 일정 시간마다 각각의 시료 10 g과 멸균된 0.1% 펩톤 희석액 90 mL를 멸균백(BagFilter P, Interscience Co., Saint Nom, France)에 넣어 Stomacher (Bagmixer 400, Interscience Co., Saint Nom, France)를 이용하여 2분 동안 균질화 후 0.1% 펩톤 희석액으로 10진 희석하여 Eosin Methylene blue(EMB, Oxoid Limited, Hampshire, England)와 Polymyxin Acriflavin LiCl Ceftazidime Esculin Mannitol(PALCAM, Oxoid Limited, England) agar에 200 μL을 분주하여 36℃에서 24∼48시간 배양 후 colony counter(Scan 1200, Interscience Co.)로 집락을 계수하였다.
각 온도에서 시간별 장출혈성 대장균 및 L. monocytogenes의 변화를 보여주는 1차 생장모델은 GraphPad Prism(GraphPad Software V7.03, San Diego, CA, USA) 프로그램을 사용하여 Modified Gompertz model(Gibson AM 등 1987)공식을 이용하여 유도기(lag time, LT), 최대증식속도(specific growth rate, SGR), 최대개체군밀도(maximum population density, MPD)를 산출하였다.
- Modified Gompertz model
- Y=N0+C*exp(-exp((2.718*SGR/C)*(LT-X)+1))
- Y: 균수(log CFU/mL)
- N0: 초기 균 로그수
- C: 마지막과 초기 균수의 차이
- LT: 유도기(day), SGR: 최대증식속도(log CFU/day), X: 시간(day)
3. Bacteriophage 처리가 병원성 식중독균에 미치는 영향 연구
Bacteriophage는 E. coli bacteriophage(Phageguard E, Phageguard, Wageningen, PA, Netherlands), Listeria bacteriophage(Phageguard Listex, Phageguard)를 사용하였으며, Phage의 양은 제조사의 가이드라인에 따라 10 μL/cm2의 기준으로 7.5 cm2의 면적에 75 μL를 분주하였으며 적용된 phage의 양은 2 × 107∼4 × 107 PFU/cm2이었다(Phageguard 2024). 치즈는 무균적으로 각각 10 g씩 채취하여 E. coli O157:H7(NCTC 12079) 균주와 L. monocytogenes(ATCC 15313, 19111) 2가지 균주를 각각 초기 균수가 약 3∼4 log CFU/g이 되도록 접종한 후, 0%(control), 1%, 1.5%, 2% 농도의 Bacteriophage를 75 μL 처리 후 진공포장 하여 이후 치즈가 유통되는 냉장온도를 고려하여 7℃와 온도남용온도를 고려해 15℃에 각각 저장하였다. 저장과정에서 Phage 처리 유무와 농도에 따라 시료를 채취하여 E. coli O157:H7와 L. monocytogenes 증식에 미치는 영향을 분석하였다. 저장 기간 중 일정 시간마다 각각의 시료 10 g과 멸균된 0.1% 펩톤 희석액 90 mL를 멸균백에 넣어 Stomacher를 이용하여 2분동안 균질화 후 0.1% 펩톤 희석액으로 10진 희석하여 EMB와 PALCAM agar에 200 µL을 각각 분주하여 36℃에서 24∼48시간 배양 후 colony counter로 집락을 계수하였다.
4. Modified Atmosphere Packaging(MAP)과 Bacteriophage의 병합 처리 효과
치즈를 무균적으로 각각 10 g씩 채취하여 E. coli O157:H7와 L. monocytogenes의 균주를 초기 균수가 약 3∼4 log CFU/g이 되도록 접종한 후, ① Control(Vacuum), ② Phage 1.5%(Vacuum), ③ MAP4(N2 25%, CO2 75%), ④ Phage 1.5%+MAP4(N2 25%, CO2 75%)로 구분하여 처리하였다. MAP포장과 Bacteriophage의 처리 유무와 병합처리에 따라 E. coli O157:H7와 L. monocytogenes에 미치는 영향을 분석하기 위해 MFDS(2009) 설문조사 결과 가정 냉장고 온도(최빈 2.1℃)와 선행연구결과(MFDS 2022)를 참고해 마켓 냉장온도 최빈 4.1℃, 치즈가 유통되는 최저 냉장온도를 고려하여 4℃에 저장하였다. 저장 기간 중 일정 시간마다 각각의 시료 10 g과 멸균된 0.1% 펩톤 희석액 90 mL을 멸균백에 넣어 Stomacher를 이용하여 2분 동안 균질화 후 멸균된 0.1% 펩톤 희석액으로 10진 희석하여 EMB와 PALCAM agar에 200 µL을 분주하여 36℃에서 24∼48시간 배양 후 colony counter로 집락을 계수하였다.
5. 통계처리
본 연구는 SAS software(Ver. 9.4, SAS Institute, NC, USA)를 이용하여 치즈에서 MAP 포장 기체조성변화에 따른 LT, SGR, MPD값의 유의적인 차이 검증에 대해 일원배치 분산분석(one-way ANOVA)을 이용하였고 사후검증은 Duncan’s multiple range test를 사용하여 신뢰 수준 p<0.05 수준으로 유의성을 비교 분석하였다.
결과 및 고찰
1. 병원성 식중독균 성장 저해를 위한 MAP 효과
치즈의 다양한 가스조성 포장방법 및 보관온도(7℃, 10℃, 15℃)가 병원성 대장균 혼합 균주(EHEC, EPEC, ETEC) 및 L. monocytogenes의 행동에 어떻게 영향을 주는지에 대한 연구결과는 다음 Fig. 1과 같다. 포장방법은 MAP1(N2 100%), MAP2(N2 75%, CO2 25%), MAP3(N2 50%, CO2 50%), MAP4(N2 25%, CO2 75%), MAP5(CO2 100%)를 비교 분석하였다. 병원성 대장균은 냉장보관 온도인 7℃에서는 진공포장 및 MAP2, MAP3로 포장된 치즈에서는 증식하지 않는 것으로 확인되었다(Fig. 1A). 그러나 75% CO2가 포함된 MAP4(N2 25%, CO2 75%)로 포장된 치즈에서는 병원성 대장균은 저장 12일째부터 사멸하는 경향을 보였다.
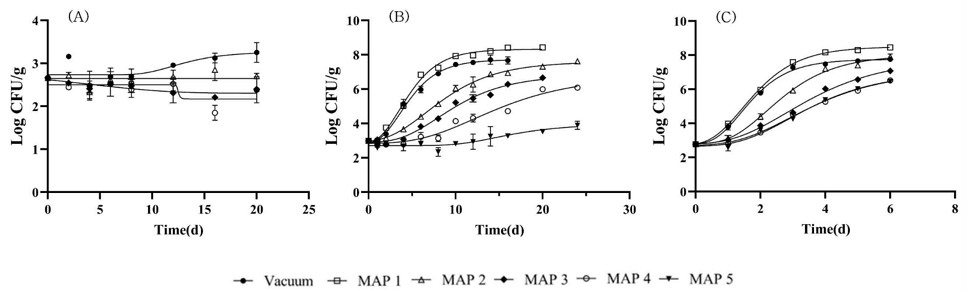
Effects of temperature and gas composition on the behavior of pathogenic E. coli in cheese.MAP1: 100% N2, MAP2: 75% N2+25% CO2, MAP3: 50% N2+50% CO2, MAP4: 25% N2+75% CO2, MAP5: 100% CO2. (A) 7℃, (B) 10℃, (C) 15℃.
10℃ 온도에서는 포장방법에 따라 성장패턴에 유의적인 차이를 볼 수 있었다(p<0.05). 10℃에서 병원성대장균의 유도기는 각각 1.14, 0.96, 2.17, 3.45, 5.72, 10.28일로, 진공포장과 MAP1, MAP2 포장방법과의 유도기에는 유의적 차이가 없었다. 그러나 최대증식속도는 포장방법에 따라 모두 유의적 차이를 보였다. 특히 CO2 100%의 기체조성 포장인 MAP5에서 병원성 대장균의 증식이 저해되는 것으로 나타났다(Fig. 1B).
15℃에서는 MAP2, MAP3, MAP4, MAP5 포장방법 간에는 병원성 대장균의 유도기에 유의적인 영향을 미치지 않았으나 MAP4(N2 25%, CO2 75%) 포장에서 최대증식속도가 유의적으로 감소하였다(Fig. 1C). 최대개체군밀도의 경우 10℃, 15℃의 온도에서 기체조성 간의 유의적인 차이를 볼 수 있었으며 결론적으로 보관온도가 낮을수록 기체조성의 변화에 따라 병원성 대장균의 행동특성에 영향을 유의적으로 주는 것을 확인하였다. 특히 CO2의 함량에 따라 병원성 식중독균의 유도기와 최대증식속도에 영향을 주었으나, N2 함량은 병원성 식중독균의 성장지연 효과에는 유의적으로 영향을 주지 않는 것으로 나타났다. MAP1 기체조성의 경우, 대조군인 진공포장의 경우와 유도기나 최대증식속도에서 크게 다르지 않았고, MAP5의 경우 다른 실험군에 비해 병원성 식중독균 성장 저해에 가장 큰 영향을 끼쳤으나, 포장용기가 무너져 활용할 수 있는 포장방법으로는 적절치 않은 것으로 확인되었다. Brown SRB 등(2018)의 연구에서도 MAP 포장의 부패 미생물을 억제하는 효과는 CO2가 증가함에 따라 같이 증가하는 반면 100%의 N2상태나 진공포장의 경우 다른 MAP 조건들에 비해 효과적으로 미생물을 제어하지 못한다는 연구 결과와 일치하였다.
포장방법이 보관온도에 따라 L. monocytogenes 행동에 미치는 영향은 다음 Fig. 2와 같다. 7℃에서 대조군으로 진공포장을 포함해 MAP2, MAP3, MAP4 4가지 포장방법의 효과를 분석하였다. L. monocytogenes의 유도기는 1.29일(진공포장), 1.22일(MAP2), 1.68일(MAP 3), 1.96일(MAP 4)로 MAP4(N2 25%, CO2 75%)만 유의적인 차이가 있었다(p<0.05). 그러나 최대증식속도는 기체조성별로 모두 유의적인 차이를 보였으며 MAP4(N2 25%, CO2 75%)의 기체조성에서 가장 느리게 성장하는 것을 확인할 수 있었다(Fig. 2A). 10℃의 경우 유도기는 0일(진공), 0.73일(MAP1), 0.83일(MAP2), 0.84일(MAP3), 0.80일(MAP4), 0.99일(MAP5)로 진공포장 이외에 MAP 포장의 기체조성의 변화는 L. monocytogenes의 유도기에 유의적 영향을 주지 않았다. 최대증식속도는 10℃에서 1.05(진공), 1.27(MAP1), 0.91(MAP2), 0.75(MAP3), 0.60(MAP4), 0.45(MAP5) Log CFU/d로 대조군과 실험군들 사이에서의 유의적인 차이(p<0.001)가 나타났다. 10℃, 15℃에서 병원성대장균의 유도기와 비교하였을 때 L. monocytogenes의 유도기는 두 온도에서 매우 짧아 치즈에서는 병원성 대장균보다 L. monocytogenes의 성장이 더 잘 이루어지는 것을 확인할 수 있었다. 그러나 10℃의 병원성대장균과 L. monocytogenes를 비교하였을 때 CO2 100%의 공기조성인 MAP5의 경우 최대 약 9.29일 정도 병원성대장균의 유도기가 연장되어 병원성 대장균에게 MAP포장이 성장을 저지하는 데 더 효과가 있는 것을 확인할 수 있었다. 선행연구에 따르면 신선한 치즈, 가금류, 생 연어, 가공치즈에서 L. monocytogenes의 성장은 CO2에 의해 저해하지는 못하였으나(Brown SR 등 2018), Pseudomonas fluorescens와 같은 그람음성 세균은 40% 이상의 높은 CO2 공기조성에 의해 제어된 것으로 보고되었다(Guillard V 등 2016). 또한 그람양성인 L. monocytogenes은 그람 음성인 대장균에 비해 두꺼운 세포벽과 펩티도글리칸의 함량이 높기 때문에, CO2에 의한 세포벽이 영향을 덜 받아 성장억제효과가 비교적 덜 나타난 것으로 보고되었다(Abou-Zeid KA 등 2007). 남용온도인 15℃에서 L. monocytogenes는 CO2가 증가할수록 성장이 지연되었으나 포장방법에 따른 행동패턴의 차이는 감소하는 것으로 확인되었다.
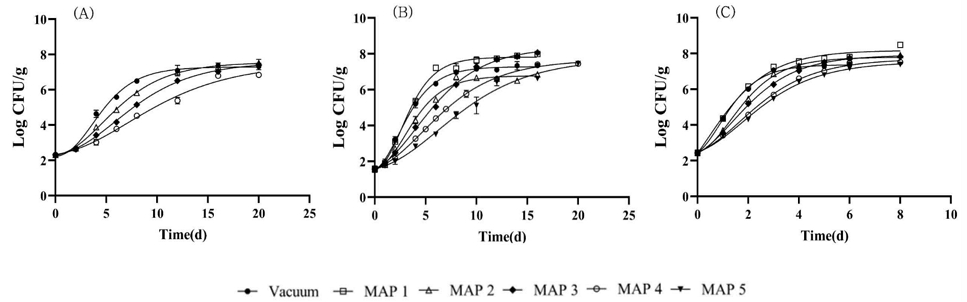
Effect of temperature and gas composition on the behavior of L. monocytogenes in cheese.MAP1: 100% N2, MAP2: 75% N2+25% CO2, MAP3: 50% N2+50% CO2, MAP4: 25% N2+75% CO2, MAP5: 100% CO2. (A) 7℃, (B) 10℃, (C) 15℃.
치즈에서 병원성 대장균과 L. monocytogenes를 접종 후 7℃에서 보관하여 20일 후에 기체조성 변화를 관찰한 결과는 다음 Table 1과 같다. 시간이 지남에 따라 모든 군에서 O2의 양이 증가하였으며, CO2는 감소하는 경향을 보였다. CO2는 MAP2, MAP3, MAP4에서 각각 약 40%, 38%, 28% 감소하였으며, CO2의 함량이 높을수록 감소하는 양이 적어지는 것을 관찰할 수 있었다. Barukčić I 등(2020)의 연구에서도 신선치즈에서 N2 60%, CO2 40% 포장한 치즈에서 CO2가 약 25% 감소하고 O2의 양이 증가하는 비슷한 경향을 보고하였다. Cabral GJ 등(2019)의 연구에서도 Minas Frescal 치즈에서 시간이 지남에 따라 20% 이하의 CO2 농도를 제외한 나머지에서 O2는 증가하였으며 CO2 역시 감소하는 경향을 보여 본 연구결과와 일치하는 것으로 나타났다. 전반적으로 CO2의 감소율이나 O2의 증가 정도는 약간의 차이를 보였으나 치즈의 종류 및 보관온도와 같은 저장환경에 따라 그 차이는 더욱 증가하는 것으로 나타났다.
2. 병원성 식중독균 저감화를 위한 Bacteriophage 처리 효과
치즈에서 병원성 식중독균의 저감화를 위한 허들기술 중 하나로 Bacteriophage에 특이성을 갖는 E. coli O157:H7와 L. monocytogenes 균주를 사용하여 병원성 대장균의 최저 증식온도인 7℃와 남용온도로 15℃에서 보관하며 1%, 1.5%, 2%의 Bacteriophage 처리가 치즈에서 고 위험 식중독균 행동에 미치는 영향을 분석한 결과는 다음 Fig. 3과 같다. 본 실험에서 사용한 Bacteriophage는 USDA와 FDA에서 승인하여 실제 치즈공장에서도 사용하고 있기 때문에 농도에 제한을 받지 않고 안전하게 사용할 수 있다(Phageguard 2024).
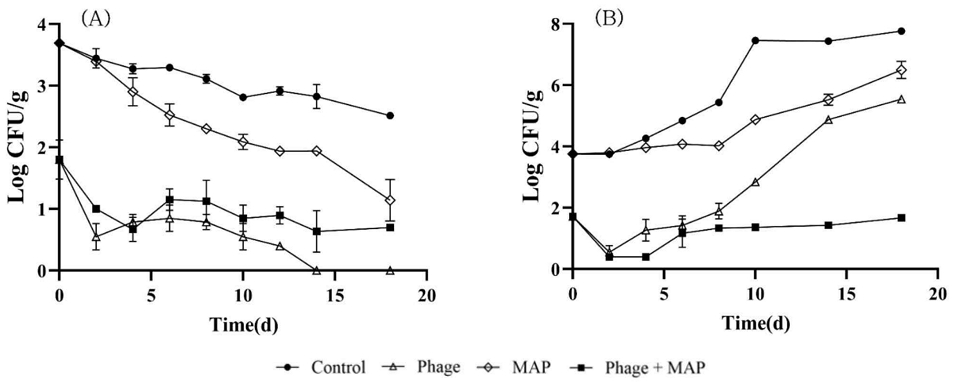
Effect of bacteriophage concentration on the behavior of pathogenic E. coli (A, B) and L. monocytogenes (C, D) in cheese at 7℃ and 15℃.
7℃에서 E. coli O157:H7은 Bacteriophage를 처리한 모든 실험군에서 3 log CFU/g(99.9%) 이상의 저감화가 일어났고 시간에 따라 사멸하는 경향을 보였다(Fig. 3A). 15℃에서는 Bacteriophage를 처리한 모든 실험군에서 초기에는 사멸하는 경향을 보였다가 저장 2일 후부터는 다시 증식하였다(Fig. 3B). 병원성 대장균은 7℃에서 증식하지 않으므로 Bacteriophage를 처리한 후에 더욱 감소하는 경향을 보였으나 남용온도인 15℃에서는 병원성 대장균의 증식을 저해하지 못해 다른 추가 허들기술이 필요한 것으로 사료된다. L. monocytogenes의 경우 E. coli O157:H7와 달리 7℃와 15℃에서 모두 Bacteriophage 처리 후 초기에 2.5∼2.8 log CFU/g 정도의 L. monocytogenes 균의 감소를 확인하였으나 7℃와 15℃에서 증식이 완전히 저해되지 못했다(Fig. 3C, 3D). Silva ENG 등(2014)의 연구에 따르면 부드러운 치즈사이에 8.3 × 107 PFU/g Bacteriophage 처리 후 L. monocytogenes의 저감화를 보였지만 냉장온도에서 다시 증가하는 경향을 보고하였다. 또한 조리햄(Devlieghere F & Vermeiren L 2019)과 잎채소(Truchado P 등 2020)에서 L. monocytogenes phage 처리시 저감화 효과연구에서도 약 2.5 log CFU/g로 본 연구에서 비슷한 저감화 효과와 일정시간이 지나면 다시 증식하는 경향이 일치하는 것으로 나타났다. 7℃에서는 E. coli O157:H7, L. monocytogenes 모두 bacteriophage의 농도에 따른 큰 차이를 보이지 않았다. 그러나 15℃에서는 다른 실험군보다 1% 농도 처리군에서 증식 억제 효과가 낮았으나 1.5%∼2% 농도 처리군에서는 증식억제 효과에 유의적 차이를 보이지 않았다.
3. Modified Atmosphere Packaging(MAP)과 Bacteriophage의 병합처리 효과
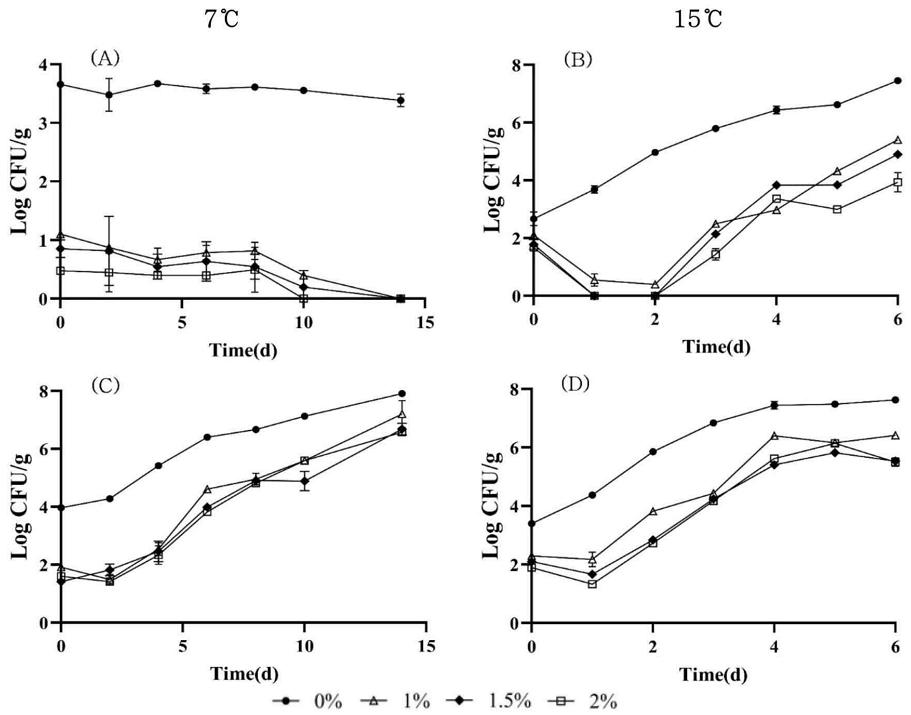
치즈에서 MAP와 Bacteriophage의 병합처리 효과를 보기위한 방법으로 병원성 식중독균의 증식을 저해하는 가장 좋은 조건인 1.5% phage와 N2 25%, CO2 75%의 기체조성을 갖는 MAP4의 병합처리 후 4℃의 냉장온도에서 보관하며 행동 변화를 분석한 결과는 다음 Fig. 4와 같다. 4℃에서 E. coli O157:H7은 시간이 지남에 따라 모든 처리군에서 서서히 사멸하였다. MAP4 조성으로 포장한 치즈에서는 초기에 저감화가 일어나지는 않았지만 대조군인 진공포장보다 더 빨리 사멸하였으며 이 결과는 7℃에서 가스조성에 상관없이 MAP로 단독 포장한 결과와 일치하였다(Fig. 1). Bacteriophage 단독 처리군과 Bacteriophage와 MAP4를 병합처리한 군은 비슷한 경향을 보였는데, 초기에 저감화가 약 2 log CFU/g 일어나고, 그 이후에 서서히 사멸하였으며 이 또한 낮은 냉장온도의 영향을 받아 나타난 것으로 사료된다(Fig. 4A). 반면 4℃ 냉장온도에서 증식하는 L. monocytogenes 경우는 병합처리 이외의 모든 군에서 성장이 확인되었다(Fig. 4B). MAP4(N2 25% CO2 75%)로 포장한 처리군은 대조군인 진공포장보다는 성장을 지연시켰지만 성장을 억제하지는 못하였다. 이와 같은 결과는 L. monocytogenes가 성장하는 4℃에서는 MAP4 단독 처리로는 성장을 저해하지 못하는 것으로 재확인되었다. 반면 1.5% Bacteriophage만 단독처리한 실험군은 초기에는 약 2 log CFU/g 정도 저감화가 일어났지만 저장 3일째부터 다시 증식하는 경향을 보여 역시 Bacteriophage 단독처리로도 4℃에 보관한 치즈에서 L. monocytogenes의 증식을 저해하지 못하였다. 그에 비해 Bacteriophage와 MAP4의 병합처리군에서는 초기 저감화가 일어난 후 그 수가 유지되는 경향을 보였는데, 이는 Bacteriophage로 인한 초기 저감화가 일어나고 그 후 MAP4 포장을 함으로써 성장을 지연시켜 4℃의 온도에서 L. monocytogenes 성장을 억제할 수 있음을 확인하였다. 이러한 결과는 닭 가슴살 필레에서 Salmonella(Sukumaran AT 등 2016), 시금치에서 E. coli O157:H7(Boyacioglu O 2011) 관련 선행연구 결과와 같이 대조군, MAP 단독처리, Bacteriophage 단독처리, 병합처리군 중에서 병합처리군이 성장을 억제하고 지연시키는 데 큰 효과가 있다는 결과와 일치하였다.
요 약
본 연구에서는 식생활의 서구화로 인하여 소비량이 늘어난 치즈를 MAP와 bacteriophage를 각각 또는 병합처리시 냉장유통환경(4℃, 7℃, 10℃) 및 남용온도(15℃)에서 주요 식중독균으로 L. monocytogenes와 장출혈성 대장균의 성장 억제 가능성을 분석하였다. 그 결과 7℃ 이하에서 장 출혈성 E. coli는 성장하지 않았으며, 10℃, 15℃에서 Pathogenic E. coli(EHEC, EPEC, ETEC)와 L. monocytogenes 모두 MAP 가스조성에서 CO2의 함량이 올라갈수록 성장이 지연되는 것을 확인하였다. Bacteriophage는 0%∼2%의 농도로 처리하였을 때, E. coli O157:H7의 경우 최대 99%의 높은 저감화를 보였으며 1.5%∼2%의 농도에서는 큰 차이가 없었으나 1%의 농도에서는 저감화 효과가 적었다. 그러나 4℃ 낮은 냉장온도에서도 성장하는 L. monocytogenes의 경우 MAP와 bacteriophage의 단독처리만으로는 성장을 완전히 억제할 수 없었다. 그러나 MAP4(N2 25%, CO2 75%)와 1.5% bacteriophage의 병합처리 효과를 실험한 결과 E. coli O157:H7에서는 모든 처리군에서 사멸을 하는 경향을 보였으며 MAP4 포장이 진공포장을 한 대조군보다 더 빠른 사멸을 보였다. 또한, bacteriophage 단독처리군과 MAP4 병합처리군은 비슷한 행동을 보였으며 초기 저감화 후 시간이 지남에 따라 천천히 사멸하였다. 4℃에서 L. monocytogenes의 경우 병합처리 이외의 모든 군에서 성장을 하였고, MAP4 또는 1.5% bacteriophage 단독처리로는 L. monocytogenes 성장을 저해할 수 없었으나 병합처리군에서는 초기 저감화 후 낮은 농도로 계속 유지할 수 있었다. 결론적으로 pathogenic E. coli의 경우 MAP와 bacteriophage의 단독처리만으로도 4℃ 냉장온도에서 성장을 저해할 수 있으나 L. monocytogenes는 낮은 온도에서도 성장하기 때문에 두 가지를 병합처리 하였을 때 L. monocytogenes의 성장을 저해할 수 있었다. 따라서 MAP4와 bacteriophage 병합처리는 냉장에서 유통기한이 긴 치즈에서 L. monocytogenes에 의한 식중독을 예방하는 방법으로 효과적인 것으로 사료된다.
References
-
Abou-Zeid KA, Yoon KS, Oscar TP, Schwarz JG, Hashem FM, Whiting RC (2007) Survival and growth of Listeria monocytogenes in broth as a function of temperature, pH, and potassium lactate and sodium diacetate concentrations. J Food Prot 70(11): 2620-2625.
[https://doi.org/10.4315/0362-028X-70.11.2620]

-
Barukčić I, Ščetar M, Marasović I, Lisak Jakopović K, Galić K, Božanić R (2020) Evaluation of quality parameters and shelf life of fresh cheese packed under modified atmosphere. J Food Sci Technol 57(7): 2722-2731.
[https://doi.org/10.1007/s13197-020-04308-6]

- Boyacioglu O (2011) Use of a bacteriophage cocktail in combination with modified atmosphere packaging to control Escherichia coli O157: H7 contamination on fresh-cut green leafy vegetables. Ph D Dissertation North Carolina A&T State University, North Carolina. pp 3-5.
-
Brown SRB, Forauer EC, D'Amico DJ (2018) Effect of modified atmosphere packaging on the growth of spoilage microorganisms and Listeria monocytogenes on fresh cheese. J Dairy Sci 101(9): 7768-7779.
[https://doi.org/10.3168/jds.2017-14217]

-
Buchanan RL, Gorris LGM, Hayman MM, Jackson TC, Whiting RC (2017) A review of Listeria monocytogenes: An update on outbreaks, virulence, dose-response, ecology, and risk assessments. Food Control 75: 1-13.
[https://doi.org/10.1016/j.foodcont.2016.12.016]

-
Cabral GJ, Valencia GA, Carciofi BAM, Monteiro AR (2019) Modeling microbial growth in Minas Frescal cheese under modified atmosphere packaging. J Food Process Preserv 43(8): e14024.
[https://doi.org/10.1111/jfpp.14024]

- Centers for Disease Control and Prevention (2017) Raw milk Question and Answers. https://www.cdc.gov/food-safety/foods/raw-milk, (accessed on 10. 7. 2024).
-
Croxen MA, Law RJ, Scholz R, Keeney KM, Wlodarska M, Finlay BB (2013) Recent advances in understanding enteric pathogenic Escherichia coli. Clin Microbiol Rev 26(4): 822-880.
[https://doi.org/10.1128/CMR.00022-13]

- Devlieghere F, Vermeiren L (2019) Efficacy of phage P100 on L. monocytogenes in refrigerated vacuum packaged cooked ham. Fleischwirtschaft 99(11): 92-95.
-
Dhaka P, Vijay D, Vergis J, Negi M, Kumar M, Mohan V, Doijad S, Poharkar KV, Malik SS, Barbuddhe SB, Rawool DB (2016) Genetic diversity and antibiogram profile of diarrhoeagenic Escherichia coli pathotypes isolated from human, animal, foods and associated environmental sources. Infect Ecol Epidemiol 6(1): 31055.
[https://doi.org/10.3402/iee.v6.31055]

-
Donnelly CW (2004) Growth and Survival of Microbial Pathogens in Cheese. Cheese: Chemistry, Physics and Microbiology. Elsevier, Nethalands. pp 541-559.
[https://doi.org/10.1016/S1874-558X(04)80081-2]

-
Gibson AM, Bratchell N, Roberts TA (1987) The effect of sodium chloride and temperature on the rate and extent of growth of Clostridium botulinum type A in pasteurized pork slurry. J Appl Bacteriol 62(6): 479-490.
[https://doi.org/10.1111/j.1365-2672.1987.tb02680.x]

-
Guillard V, Couvert O. Stahl V, Hanin A, Denis C, Huchet V, Chaix E, Loriot C, Vincelot T, Thuault D (2016) Validation of a predictive model coupling gas transfer and microbial growth in fresh food packed under modified atmosphere. Food Microbiol 58: 43-55.
[https://doi.org/10.1016/j.fm.2016.03.011]

-
Hotchkiss JH, Werner BG, Lee EYC (2006) Addition of carbon dioxide to dairy products to improve quality: A comprehensive review. Compr Rev Food Sci Food Saf 5(4): 158-168.
[https://doi.org/10.1111/j.1541-4337.2006.00008.x]

- Kang DH (2012) Current thermal/non-thermal technologies to control foodborne pathogens. Food Sci Ind 45(1): 48-59.
-
Kortright KE, Chan BK, Koff JL, Turner PE (2019) Phage therapy: A renewed approach to combat antibiotic-resistant bacteria. Cell Host Microbe 25(2): 219-232.
[https://doi.org/10.1016/j.chom.2019.01.014]

-
Lee JY, Yoon YH (2017) Microbiological safety concerns with dairy products from farmstead plants. J Dairy Sci Biotechnol 35(4): 215-220.
[https://doi.org/10.22424/jmsb.2017.35.4.215]

- Ministry of Agriculture, Food and Rural Affairs (2024) KOSIS Production and Consumption Performance by Dairy Product. https://kosis.kr, (accessed on 10. 7. 2024).
- Ministry of Food and Drug Safety (2009) Food Hygiene in the Home for Consumer Awareness Survey. Consumers Korea, Korea. p 48.
- Ministry of Food and Drug Safety (2021) Korea Food Code: Dairy Product. https://foodsafetykorea.go.kr, (accessed on 10. 7. 2024).
- Ministry of Food and Drug Safety (2022) Korea Food Code: Standards and Specifications by Food. https://www.foodsafetykorea.go.kr, (accessed on 10. 7. 2024).
-
Momtaz H, Dehkordi FS, Rahimi E, Ezadi H, Arab R (2013) Incidence of shiga toxin-producing Escherichia coli serogroups in ruminant’s meat. Meat Sci 95(2): 381-388.
[https://doi.org/10.1016/j.meatsci.2013.04.051]

-
Moye ZD, Woolston J, Sulakvelidze A (2018) Bacteriophage applications for food production and processing. Viruses 10(4): 205.
[https://doi.org/10.3390/v10040205]

- Phageguard (2024) Listeria Solutions for Cheese Processors. https://phageguard.com, (accessed on 10. 7. 2024).
-
Radoshevich L, Cossart P (2018). Listeria monocytogenes: Towards a complete picture of its physiology and pathogenesis. Nat Rev Microbiol 16(1): 32-46.
[https://doi.org/10.1038/nrmicro.2017.126]

-
Silva ENG, Figueiredo ACL, Miranda FA, Almeida RCC (2014) Control of Listeria monocytogenes growth in soft cheeses by bacteriophage P100. Braz J Microbiol 45(1): 11-16.
[https://doi.org/10.1590/S1517-83822014000100003]

-
Sukumaran AT, Nannapaneni R, Kiess A, Sharma CS (2016) Reduction of Salmonella on chicken breast fillets stored under aerobic or modified atmosphere packaging by the application of lytic bacteriophage preparation SalmoFreshTM. Poult Sci 95(3): 668-675.
[https://doi.org/10.3382/ps/pev332]

-
Truchado P, Elsser-Gravesen A, Gil MI, Allende A (2020) Post-process treatments are effective strategies to reduce Listeria monocytogenes on the surface of leafy greens: A pilot study. Int J Food Microbiol 313: 108390.
[https://doi.org/10.1016/j.ijfoodmicro.2019.108390]

-
Van Mierlo LAJ, Arends LR, Streppel MT, Zeegers MPA, Kok FJ, Grobbee DE, Geleijnse JM (2006) Blood pressure response to calcium supplementation: A meta-analysis of randomized controlled trials. J Hum Hypertens 20(8): 571-580.
[https://doi.org/10.1038/sj.jhh.1002038]