
오미자(Schizandra chinensis) 종자 추출물의 항산화 및 미백 활성
Abstract
Schizandra chinensis seeds contain a variety of antioxidant compounds, including lignans. In this study, we examined the antioxidant and skin-whitening properties of extracts derived from Schizandra chinensis seeds using both distilled water and 70% ethanol as solvents. A series of in vitro assessments were conducted, including total phenolic assay, DPPH radical scavenging activity, copper reduction, and tyrosinase inhibition assays. The extraction yields for WES (water extract of Schizandra chinensis seeds) and EES (70% ethanol extract of Schizandra chinensis seeds) were found to be 7.32% and 6.65%, respectively. To evaluate antioxidant activity, vitamin C(ascorbic acid), a well-known antioxidant, was utilized as a positive control, while arbutin was used as a positive control for assessing skin-whitening activity. Both WES and EES exhibited dose-dependent responses in terms of antioxidant and skin-whitening effects. Noteworthy, the copper reduction assay revealed reduction powers of 57.05 μM and 43.35 μM at concentrations of 800 μg/mL for WES and EES, respectively. Remarkably, WES exhibited a higher reduction power compared to the antioxidant vitamin C(ascorbic acid). Overall, both WES and EES demonstrated substantial antioxidant activity when compared to the positive controls, which included vitamin C(ascorbic acid). In conclusion, these findings indicate the potential suitability of WES and EES as ingredients for functional foods with potential antioxidant and skin-whitening benefits.
Keywords:
antioxidant, copper reduction, whitening, functional foods, Schizandra chinensis seeds서 론
오미자(Schizandra chinensis)는 오미자 나무과(Schisandraceae)에 속하는 낙엽성 목본의 덩굴성 식물이며 둥근 형태의 붉은색을 띠는 과실이다(Jung GT 등 2000; Mok CY 2005). 오미자는 관상, 약용으로 재배되고 있으며, 과실은 단맛, 신맛, 쓴맛, 매운맛 및 짠맛으로 총 5가지가 어우러진 독특한 맛을 가지고 있다(Kim KI 등 1973). 특히 다섯 가지 맛을 낸다는 특징을 가진 오미자는 다양한 기능성 음료가 차지하는 비중이 점차 커지는 최근의 국내외 음료 시장에서 상품성 높은 원료로서 주목받고 있다(Haglind C & Tengblad J 1994). 오미자 특유의 붉은 색은 anthocyanin의 성분에 의한 것이며(Kim KI 등 1973; Cho SB 등 2003), 오미자의 기능성은 주로 anthocyanin을 포함한 폴리페놀 화합물에서 기인된다고 알려져 있다(Mocan A 등 2014).
오미자의 생리활성에는 항산화 효과(Choi SR 등 2011)와 항당뇨(Qu Y 등 2015) 등이 있다고 보고되어 있다. 이와 같은 오미자의 생리활성은 dibenzocyclooctadiene계의 기본골격을 가진 약 40여 종의 리그난 화합물에 의한 것으로 알려져 있다(Taguchi H & Ikeya Y 1975; Ikeya Y 등 1979; Opletal L 등 2004; Choi YW 등 2006). 또한 리그난 화합물은 미백(Lee JN 등 2017) 효과가 있는 것으로 보고하였으며, 리그난 성분 schizandrin, gomisin A 및 gomisin N의 합을 기능성 성분으로 활용하고 있다(Ministry of Food and Drug Safety 2019).
Schisandrin은 항염(Huang SX 등 2008), 신경보호 작용(Xu X 등 2012), 항산화 활성(Jang EH 등 1996) 및 항균 활성(Lee JY 등 2001)이 있는 것으로 보고된 바 있다. Gomisin은 항산화 작용을 나타낸다고 보고되었으며(Kim OC & Jang HJ 1994), gomisin A는 간세포 보호 작용(Hong M 등 2017)과 acetylcholinesterase 억제 효능(Hung TM 등 2007)을 가진 것으로 보고되어 있다. 또한, 오미자는 추출물로서 근력 개선과 갱년기 여성 건강의 도움을 주는 기능성 원료로 인정되어 있다(Shin D 등 2016).
이러한 오미자의 기능성 성분은 과육보다는 종자에 많이 함유된 것으로 보고되어 있으며(Choi HJ 등 2013; Kim YJ 등 2013), 오미자 과육에 대한 주요 성분 연구로는 오미자 유래 리그난 성분 분석이 주를 이룬다(Deng X 등 2008). 또한 오미자 과실 전체에 함유된 리그난 성분의 항산화, 항염증 및 항암과 관련하여 많은 연구가 이루어져 있으며, 오미자 종자의 기능성 성분이 분쇄하여 추출을 진행하였을 때 분쇄를 하지 않은 것에 비해 항염증 효과에도 탁월한 효과가 더 증가한다는 연구 보고가 있다(Kwon J 등 2001; Choi HJ 등 2013).
그러나, 오미자 과육 추출물의 기능성 성분에 관한 연구 및 추출 용매에 따른 오미자 과육의 항산화, 항염증, 항당뇨 및 항암 활성과 관련된 연구는 이루어져 있으나 오미자 종자 자체를 분쇄하여 추출 용매에 따라 항산화와 미백 활성에 관한 연구는 미흡한 실정이다. 이밖에도 오미자 종자를 분쇄하지 않고 그 자체를 열수 추출하거나 주정으로 추출하여 항산화 활성을 평가한 연구는 나타나 있지만 분쇄 후에 열수 추출과 주정 추출에 관한 연구 및 이에 대한 비교는 미흡한 실정이다.
따라서 본 연구에서는 오미자 과육에 비해 기능성 성분을 더 많이 함유하고 있는 종자를 활용하여 항산화 및 미백 활성을 평가하기 위해 오미자 종자를 분쇄한 뒤 열수 추출과 70% 주정 추출을 진행하여 확인하였다. 뿐만 아니라 열수 추출과 70% 주정 추출을 함께 비교함에 따라 오미자 종자에 함유되어있는 기능성 성분을 용매에 따른 활성을 평가하였다. 더 나아가 오미자 종자가 건강기능식품의 재료로서 가능성을 확인하기 위해 실시하였다.
재료 및 방법
1. 실험 재료
Dimethyl sulfoxide(DMSO)는 Junsei chemical Co., Ltd.(Tokyo, Japan)에서 구매하였고, 94.5% ethanol, potassium phosphate monobasic과 potassium phosphate dibasic anhydrous는 Daejung(Seoul, Korea)에서 구입하였다. Folin-Ciocalteu’s phenol, sodium carbonate, gallic acid, 2,2-diphenyl-1-picrylhydrazy(DPPH), ascorbic acid, sodium phosphate dibasic, copper(Ⅱ) chloride, neocuproine, L-tyrosine, mushroom tyrosinase 및 arbutin은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였다. 추출에 사용한 70% 에탄올은 ㈜주정판매월드(Jeonju, Korea)에서 95% 에탄올을 구매해 증류수와 95%와 5%의 비율로 제조하였다.
2. 오미자 종자 추출물(WES, EES) 제조
본 실험에서는 오미자(Schizandra chinensis) 종자를 분쇄한 후 각각 500 g을 10배수의 정제수 및 95% 주정과 증류수를 혼합하여 제조한 70%의 주정으로 추출을 진행하였다. 추출을 진행한 뒤 5 μm pp(polyproylene)카트리지 필터를 이용해 필터링을 진행하였다. 이에 따른 추출 수율은 각각 7.32%와 6.65%로 나타났으며 WES(water extract of Schizandra chinensis seeds)와 EES(70% ethanol extract of Schizandra chinensis seeds)로 명명해 Table 1에 나타내었다. 각 추출물을 동결건조 시킨 후 —20℃에 보관하였으며 추후 항산화와 미백 활성 평가를 진행하였다.
3. 총 페놀 함량
오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 총 페놀 함량은 Folin-Ciocalteu 시약을 이용해 측정하였다. 증류수와 같은 비율로 50%(v/v) Folin-Ciocalteu 페놀 시약을 제조하여 본 실험에 사용하였다. 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES는 DMSO를 용매로 하여 10, 50, 100, 200, 400 및 800 μg/mL의 농도로 단계 희석하여 각 시약을 분주 후 빛이 들어오지 않는 환경에서 1 hr 동안 반응시켰다. 반응이 끝난 뒤 96-well plate에 200 μL씩 분주하여 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 725 nm에서 흡광도를 측정하였다. 추출물과 동일한 방법으로 gallic acid를 표준물질로 사용하여 물에 녹여 표준곡선을 작성한 후 총 페놀 함량을 구하였고, 표준 곡선의 방정식은 y=0.0375x—0.0378이고 R2값은 0.999이다. Gallic acid equivalent(GAE)로 환산하여 μg GAE/mL로 나타내었다.
4. DPPH 라디칼 소거 활성
오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 항산화를 확인하기 위해 DPPH 라디칼 소거 활성을 진행하였으며 94.5% ethanol에 DPPH 시약을 용해하여 사용했다. 190 μL의 0.2 mM DPPH에 10, 50, 100, 200, 400 및 800 μg/mL의 농도로 희석하여 제조한 열수 추출물 WES와 70% 주정 추출물 EES를 200 μL가 되도록 96-well plate에 각각 10 μL 분주 후 37℃에서 30 min 동안 반응시켰다. 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼소거능은 다음과 같은 식으로 계산하였으며, 양성대조군으로는 비타민C(ascorbic acid)를 이용했으며 증류수로 희석하여 오미자 종자 추출물과 같은 농도로 제조하여 이후 과정은 동일하게 진행하였다.
5. 환원력
오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 환원력을 평가하기 위해 copper reduction을 진행하였다. CuCl2를 이용해 Cu+2에서 Cu+1로 환원되는 정도를 파악하여 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 환원력을 평가하였다. 20 μL의 1 mM CuCl2, 80 μL의 0.625 mM neocuproine, 60 μL의 10 mM potassium phosphate buffer 및 40 μL의 농도별 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES를 96-well plate에 각각 분주하여 실온에서 1 hr 동안 반응시켰다. 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 454 nm에서 흡광도를 측정하였다. 양성대조군으로는 비타민C(ascorbic acid)를 물에 녹여 사용하였으며, 결과 값은 Cu+1/neocuproine의 extinction coefficient(7.95 × 103M—1cm—1)를 이용하여 흡광도로부터 계산된 Cu+1의 농도로 표시하였다.
6. Tyrosinase 저해 활성
L-Tyrosine을 기질로서 이용하여 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 미백 활성을 평가하였다. 미리 제조해 둔 220 μL의 0.1 M sodium phosphate buffer, 20 μL의 농도별 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES, 40 μL의 1.5 mM L-tyrosine 및 20 μL의 1,500 U/mL mushroom tyrosinase를 96-well plate에 분주하여 37℃ incubator에서 15 min 동안 반응시켰다. 반응이 끝난 뒤 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 490 nm에서 흡광도를 측정하였다. Tyrosinase 저해능은 다음과 같은 식으로 계산하였으며, 양성대조군으로는 미백 성분으로 잘 알려진 arbutin을 물에 녹여 사용하였다.
7. 통계분석
모든 실험 데이터는 3회 반복을 통해 이루어졌으며, 평균±표준편차로 표현하였다. 통계처리는 Statistical Package for Social Science(Ver. 18, SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 각 구간에 대한 유의성 차이는 Duncan’s test 방법에 따라 각 구간의 유의성 차이(p<0.05)를 검증하였다.
결과 및 고찰
1. 총 페놀 함량
페놀성 화합물의 주요한 역할은 자유 라디칼을 소거하는 것이며, 그 이외에도 여러 가지 생리기능을 갖는다는 연구가 많이 보고되었다(Madsen HL 등 1996; Moller JKS 등 1999; Park YJ 등 2016). 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 총 페놀 함량을 조사하기 위해 total phenolic assay를 실행하였다. Gallic acid를 사용하여 작성한 표준 곡선의 결과와 열수 추출물 WES와 70% 주정 추출물 EES의 농도를 각각 10, 50, 100, 200, 400 및 800 μg/mL로 진행한 결과는 Fig. 1에 나타내었다. 열수 추출한 WES는 각각 0.53, 0.89, 1.33, 2.17, 3.89 및 6.54 μg GAE/mL의 총 페놀의 함량이 나타났으며, 70% 주정으로 추출한 EES은 0.36, 0.65, 1.19, 2.10, 3.50 및 5.71 μg GAE/mL로 나타났다. 각 추출물은 농도 의존적으로 증가하는 양상을 띠었으며, 70% 주정 추출물 EES에 비해 열수 추출물 WES가 높은 총 폴리페놀 함량을 보였다. 선행연구(Kim MS 등 2017)에서 오미자 종자의 총 페놀 함량이 과육에 비해 4.2배 이상 높은 함량을 함유하고 있다는 연구 결과가 나타나 있다. 오미자 이외에도 생대추 과육 및 종자 추출물의 항산화에 관한 선행연구(Yu MH 등 2006)에서도 대추 과육에 비해 대추 종자에서 더 많은 총 폴리페놀을 함유하고 있다는 연구 결과가 나타나 있다. 선행 연구와 본 연구 결과 오미자에 함유된 다양한 항산화 성분이 과육에 비해 종자에 많이 함유되어 있는 것을 확인하였다. 따라서 오미자 과육만을 이용하고 버려지는 종자를 활용하여 건강기능식품의 소재로 사용될 수 있을 것으로 사료되며, 이를 통해 고부가가치화의 소재로 사용될 전망이다. 뿐만 아니라 오미자, 대추 이외에도 항산화 성분을 다량 함유하고 있으나 버려지는 종자에 대해서도 응용하여 활용할 수 있을 것으로 사료된다.
2. DPPH 라디칼 소거 활성
DPPH(2,2-diphenyl-1-picrylhydrazyl)는 분자 내에 라디칼을 함유하는데, 항산화 활성을 가진 물질과 반응하여 자유 라디칼이 소거되며(Kim NM 등 2020), DPPH 라디칼 소거 활성 측정은 안정적인 자유 라디칼을 가지는 DPPH가 항산화 활성을 가지는 물질과 만나면서 전자를 내어주어 짙은 자색이 탈색되어 노란색으로 바뀌는 원리를 이용하여 항산화 물질의 항산화 활성을 측정하는 방법으로 측정이 비교적 간단하여 항산화 활성 측정에 많이 이용된다(Blois MS 1958). 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES의 항산화 활성을 평가하기 위해 DPPH 라디칼 소거 활성을 이용해 평가하였다. WES, EES 및 양성대조군인 비타민 C를 10, 50, 100, 200, 400 및 800 μg/mL의 농도로 하여 측정한 결과는 Fig. 2에 나타내었다. 열수 추출물 WES의 DPPH 라디칼 소거능은 6.50%, 11.11%, 15.57%, 24.33%, 37.25% 및 56.70%로 측정되었으며, 70% 주정 추출물 EES는 5.36%, 9.57%, 13.82%, 19.90, 32.36% 및 54.62%의 DPPH 라디칼 소거능을 나타냈다. 양성대조군인 비타민 C(ascorbic acid)도 추출물과 동일한 농도로 DPPH 라디칼 소거 활성을 평가하였으며 50 μg/mL의 농도에서부터 98% 이상의 높은 활성을 나타내었다. 오미자 종자 열수 추출물 WES와 70% 주정 추출물 EES은 각각 농도 의존적인 DPPH 소거 활성을 보였다. 선행연구(Cho IJ 등 2016)에서 오미자 종자의 추출 용매에 따라 DPPH 라디칼 소거 활성에 차이가 있는 것으로 연구가 나타났으며, 과육에 비해 종자의 DPPH 소거능이 3배 이상 나타났으며 전반적으로 종자가 과육에 비해 높은 항산화 활성을 보였다. 뿐만 아니라 열수 추출과 주정 추출의 DPPH 라디칼 소거 활성을 평가한 결과 100℃ 열수 추출이 60% 주정 추출에 비해 강한 활성을 나타내었다. 본 연구에서도 선행연구와 유사하게 열수 추출이 70% 주정 추출에 비해 높은 항산화 활성을 나타내었다. 따라서 오미자 종자에 존재하는 다양한 항산화 성분이 주정을 용매로 한 것에 비해 열수 추출했을 때 많이 추출됐을 것으로 판단된다. 오미자 이외에도 과육만을 이용하고 종자를 버리는 대추에 관한 선행연구(Yu MH 등 2006)에서 생대추 과육에 비해 종자에서 DPPH 라디칼을 소거하는 것을 확인하였으며 이 결과를 바탕으로 하여 전반적으로 과육에 비해 종자에 항산화 성분이 더 많이 함유되어있으며 그에 따라 종자를 이용해 건강기능식품에 활용될 수 있을 것으로 사료된다.

The DPPH radical scavenging activities of WES and EES.Ascorbic acid was known as a whitening ingredient, was used as a positive control group. Different corresponding letters indicate significant differences by Duncan’s test (p<0.05).WES: Water extract of Schizandra chinensis seeds.EES: 70% ethanol extract of Schizandra chinensis seeds.
3. 환원력
환원력은 활성 산소종(reactive oxgen species, ROS)과 유리기에 전자를 공여하는 능력을 뜻하며(Yang EY 2022), Cu2+가 Cu1+으로 환원되는 원리를 이용하여 copper reduction을 측정한다. WES, EES 및 양성대조군인 비타민 C를 10, 50, 100, 200, 400 및 800 μg/mL의 농도로 하여 reducing power assay를 진행하여 Fig. 3에 나타내었다. 열수 추출한 WES는 1.17, 5.80, 11.31, 23.88, 46.51 및 57.05 μM로 나타났으며, 70% 주정 추출물 EES는 1.88, 5.45, 9.99, 17.45, 30.60 및 43.35 μM로 나타났다. 특히 열수 추출한 WES는 200 μg/mL 농도 이상에서 70% 주정 추출한 EES보다 높은 수준의 환원력을 나타내었다. 양성대조군인 비타민 C(ascorbic acid)는 100 μg/mL의 농도에서 45 μM 이상의 환원력을 보였다. WES와 EES은 각각 농도 의존적으로 증가하는 것을 확인할 수 있었으며, 800 μg/mL의 농도에서 양성대조군인 비타민 C(ascorbic acid)와 비교했을 때 WES의 경우 환원력, 즉 항산화 활성이 높으므로 이는 천연 항산화 소재로서 활용될 가능성이 큰 것으로 판단된다.
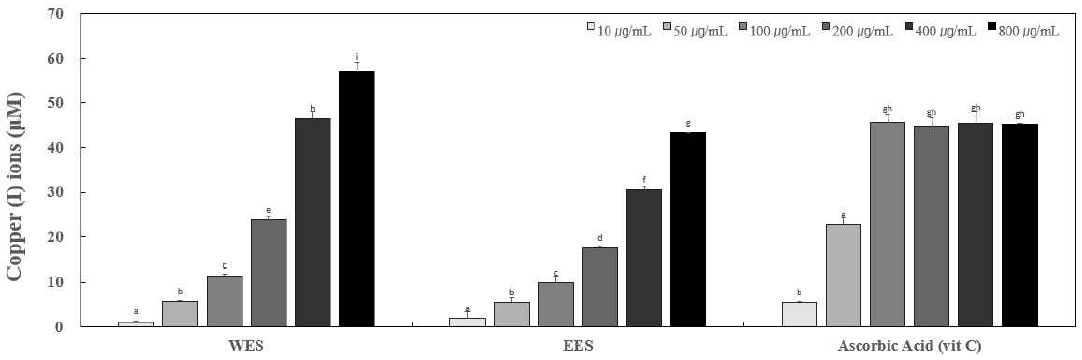
Copper reduction of WES and EES.Ascorbic acid was known as a whitening ingredient, was used as a positive control group. Different corresponding letters indicate significant differences by Duncan’s test (p<0.05).WES: Water extract of Schizandra chinensis seeds.EES: 70% ethanol extract of Schizandra chinensis seeds.
4. Tyrosinase 저해 활성
Tyrosinase는 피부 기저층에 있는 melanocyte의 melanosome에서 L-tyrosine을 기질로 하여 피부에서 melanin 생합성 시에 주요 작용을 하는 효소이다(Yang B 등 2008). 따라서 tyrosinase 효소활성을 저해하여 산화반응이 저해됨으로써 멜라닌색소가 감소된다(Shin JY 2001). 오미자 종자 추출물 WES, EES 및 양성대조군으로 미백성분으로 알려진 arbutin을 10, 50, 100, 200, 400 및 800 μg/mL의 농도로 하여 tyrosinase 저해 활성을 측정하여 Fig. 4에 나타내었다. 열수 추출한 WES는 14.09%, 16.05%, 24.05%, 28.20%, 41.45% 및 42.55%의 tyrosinase 저해 활성을 보였으며, 70% 주정을 이용해 추출한 EES는 14.15%, 12.57%, 20.94%, 25.64%, 33.45% 및 43.02%의 tyrosinase 저해 활성을 나타내는 것을 확인하였다. 각 추출물의 tyrosinase 저해 활성은 농도 의존적으로 증가하였으며, arbutin과 비교하였을 때 arbutin 100 μg/mL의 농도에 달하는 tyrosinase 저해 활성을 나타낸다. 이 밖에 복숭아 유과(Kim KH 등 2012)와 복숭아 유과 종자(Kim DM 등 2012)의 미백 효과의 차이에서도 복숭아 유과 과육보다 종자에서 더 높은 미백 활성을 보이는 것을 확인할 수 있었다. 본 실험의 오미자 종자의 미백 활성 평가와 다른 선행연구의 결과를 바탕으로 하여 과육보다는 종자에서 많은 미백 성분을 포함하고 있는 것으로 확인되었다. 따라서 열매의 과육을 섭취하고 버려지는 종자 부분을 활용하여 미백 관련 제품을 생산하는 것에 도움이 될 것이라 사료된다. 더 나아가 본 실험의 결과를 바탕으로 B16F10 세포를 이용해 세포 수준에서도 멜라닌 생성 억제 효과를 확인할 필요가 요구된다.

Tyrosinase inhibition assay of WES and EES.Arbutin, known as a whitening ingredient, was used as a positive control group. Different corresponding letters indicate significant differences by Duncan’s test (p<0.05).WES: Water extract of Schizandra chinensis seeds.EES: 70% ethanol extract of Schizandra chinensis seeds.
요 약
본 연구에서는 오미자 과육을 활용하고 남은 종자의 활용 방안을 탐색하기 위해 열수와 70% 주정을 용매로 하여 추출해 항산화와 미백 활성에 대해 연구를 진행하였다. 오미자 종자 열수 추출물과 70% 주정 추출물의 총 페놀 함량, DPPH 라디칼 소거 활성 및 환원력 평가를 통해 항산화 활성을 평가하여 항산화제로 잘 알려진 비타민 C(ascorbic acid)와 비교 시 최고 농도인 800 μg/mL 농도에서 높은 항산화 활성을 보였다. 미백 성분으로 알려진 arbutin을 양성대조군으로 하여 각 추출물의 미백 활성을 확인하였다. 본 연구를 통해서 오미자 종자 열수 추출물과 70% 주정 추출물은 항산화와 미백 활성을 확인하였으며, 추출 용매에 따른 오미자 종자의 추출 수율과 추출되는 항산화 성분의 차이로 인해 항산화 활성이 달리 나타났다. 오미자 종자 열수 추출물이 70% 주정 추출물에 비해 강한 항산화 활성을 나타내었으며, tyrosinase 저해 활성 또한 70% 주정 추출물에 비해 열수 추출물이 강하게 나타났다. 이는 오미자 종자의 건강기능식품의 소재로서 활용될 수 있을 것으로 사료된다.
References
-
Blois MS (1958) Antioxidant determinations by the use of a stable free radical. Nature 181(4617): 1198-1200.
[https://doi.org/10.1038/1811199a0]

- Cho IJ, Kim MS, Cho YJ, Kang SM (2016) Antioxidant activities microbial effects of omija (Schizandra chinensis) flesh and seed extracts against human skin pathogens. Korean J Soc of Cosmetol 22(2): 255-262.
- Cho SB, Kim HJ, Yoon JI, Chun HS (2003) Kinetic study on the color deterioration of crude anthocyanin extract from Schizandra fruit (Schizandra chinensis fructus). Korean J Food Sci Technol 35(1): 23-27.
-
Choi HJ, Choi YW, Baek SY, Kim BS, Ahn SC, Rhee MS, Yoon S (2013) Activity-guided screening of anti-inflammatory compounds from the hexane extracts of Schisandra chinensis fruit. J Life Sci 23(2): 311-318.
[https://doi.org/10.5352/JLS.2013.23.2.311]

-
Choi SR, Kim CS, Kim JY, You DH, Kim JM, Kim YS, Song EJ, Kim YG, Ahn YS, Choi DG (2011) Changes of antioxidant activity and lignan contents in Schisandra chinensis by harvesting times. Korean J Medicinal Crop Sci 19(6): 414-420.
[https://doi.org/10.7783/KJMCS.2011.19.6.414]

-
Choi YW, Satoshi T, Shabana IK, Pullela VS, Daneel F, Zhao J, Khan IA (2006) Schisandrene, a dibenzocyclooctadiene lignan from Schisandra chinensis: Structure-antioxidant-activity relationships of dibenzocyclooctadiene lignans. J Nat Prod 69(3): 356-359.
[https://doi.org/10.1021/np0503707]

-
Deng X, Chen X, Cheng W, Shen Z, Bi K (2008) Simultaneous LC-MS quantification of 15 lignans in Schisandra chinensis (Turcz.) Baill. fruit. Chromatographia 67(7-8): 559-566.
[https://doi.org/10.1365/s10337-008-0589-3]

- Haglind C, Tengblad J (1994) Effect of caffeine containing energy drinks. Scand J Nutr 43(4): 169-175.
-
Hong M, Zhang Y, Li S, Tan HY, Wang N, Mu S, Hao X, Feng Y (2017) A network pharmacology-based study on the hepatoprotective effect of Fructus Schisandrae. Molecules 22(10): 1617.
[https://doi.org/10.3390/molecules22101617]

-
Huang SX, Han QB, Lei C, Pu JX, Xiao WL, Yu JL, Sun HD (2008) Isolation and characterization of miscellaneous terpenoids of Schisandra chinensis. Tetrahedron 64(19): 4260-4267.
[https://doi.org/10.1016/j.tet.2008.02.085]

-
Hung TM, Na MK, Min BS, Ngoc TM, Lee IS, Zhang XF, Bae KH (2007) Acetylcholinesterase inhibitory effect of lignans isolated from Schizandra chinensis. Arch Pharm Res 30(6): 685-690.
[https://doi.org/10.1007/BF02977628]

-
Ikeya Y, Taguchi H, Yosioka I, Kobayashi H (1979) The constituents of Schizandra chinensis Baill. I. isolation and structure determination of five new lignans, gomisin A, B, C, F and G, and the absolute structure of Schizandrin. Chem Pharm Bull 27(6): 1383-1394.
[https://doi.org/10.1248/cpb.27.1383]

- Jang EH, Pyo YH, Ahn MS (1996) Antioxidant effect of omija (Schizandra chinensis Baillon) extracts. Korean J Food Cook Sci 12(3): 372-376.
- Jung GT, Ju IO, Choi JS, Hong JS (2000) The antioxidative, antimicrobial and nitrite scavenging effects of Schizandra chinensis ruprecht (omija) seed. Korean J Food Sci Technol 32(4): 928–935.
-
Kim DM, Kim KH, Kim YS, Koh JH, Lee KH, Yook HS (2012) A study on the development of cosmetic materials using unripe peaches seed extracts. J Korean Soc Food Sci Nutr 41(1): 110-115.
[https://doi.org/10.3746/jkfn.2012.41.1.110]

-
Kim KH, Kim DM, Yu SY, Yook HS (2012) Antioxidant and whitening activities of various cultivars of Korean unripe peaches (Prunus persica L. Batsch). J Korean Soc Food Sci Nutr 41(2): 156-160.
[https://doi.org/10.3746/jkfn.2012.41.2.156]

- Kim KI, Nam JY, Kwon TW (1973) On the proximate composition, organic acids and anthocyanins of omija, Schizandra chinensis Baillion. Korean J Food Sci Technol 5(3): 178-182.
-
Kim MS, Sung HJ, Park JY, Sohn HY (2017) Evaluation of anti-oxidant, anti-microbial and anti-thrombosis activities of fruit, seed and pomace of Schizandra chinensis Baillon. J Life Sci 27(2): 131-138.
[https://doi.org/10.5352/JLS.2017.27.2.131]

- Kim NM, Park JD, Choi YS, Lee MH, Sung JM (2020) Antioxidant activity of Pleurotus ostreatus and Pleurotus eryngii hot water extracts by drying methods. Korean J Food Nutr 33(1): 64-73.
- Kim OC, Jang HJ (1994) Volatile components of Schizandra chinensis Buillon. Appl Biol Chem 37(1): 30-36.
-
Kim YJ, Ha N, Han SH, Jeon JY, Hwang MH, Im YJ, Lee SY, Chae SW, Kim MG (2013) Confirmation of Schizandrin as a marker compound in Jangsu omija powder. J Korean Soc Food Sci Nutr 42(2): 244-248.
[https://doi.org/10.3746/jkfn.2013.42.2.244]

- Kwon J, Lee SJ, So JN, Oh CH (2001) Effects of Schizandra chinensis fructus on the immunoregulatory action and apoptosis of L1210 cells. Korean J Food Sci Technol 33(3): 384-388.
-
Lee JN, Ryu HS, Kim JM, Jung TH, Park SM, Lee YM (2017) Anti-melanogenic effect of gomisin N from Schisandra chinensis (Turcz.) Baillon Schisandraceae in melanoma cells. Arch Pharm Res 40(7): 807-817.
[https://doi.org/10.1007/s12272-017-0903-4]

- Lee JY, Min YK, Kim HY (2001) Isolation of antimicrobial substance from Schizandra chienensis Baillon and antimicrobial effect. Korean J Food Sci Technol 33(3): 389-394.
-
Madsen HL, Nielsen BR, Bertelsen G, Skibsted LH (1996) Screen of antioxidative activity of spices: Acomparison between assays based on ESR spin trapping andelectrochemical measurement of oxygen consumption. Food Chem 57(2): 331-337.
[https://doi.org/10.1016/0308-8146(95)00248-0]

- Ministry of Food and Drug Safety (2019) The Korean Pharmacopoeia. https://www.mfds.go.kr, (accessed on 3. 7. 2019).
-
Mocan A, Crisan G, Vlase L, Crisan O, Vodnar DC, Raita O, Gheldiu AM, Toiu A, Oprean R, Tilea I (2014) Comparative studies on polyphenolic composition, antioxidant and antimicrobial activities of Schisandra chinensis leaves and fruits. Molecules 19(9): 15162-15179.
[https://doi.org/10.3390/molecules190915162]

- Mok CY (2005) Quality characteristics of instant tea prepared from spraydried omija (Schizandra chinensis Baillon) extract/grape juice mixture. Food Eng Prog 9(3): 226-230.
-
Moller JKS, Madsen HL, Altonen T, Skibsted LH (1999) Dittany (Origanum dictamnus) as a source of water extractable antioxidants. Food Chem 64(2): 215-219.
[https://doi.org/10.1016/S0308-8146(98)00143-5]

-
Opletal L, Sovová H, Bártlová M (2004) Dibenzo[a,c]cyclooctadiene lignans of the genus Schisandra: Importance, isolation and determination. J Chromatogr B 812(1-2): 357-371.
[https://doi.org/10.1016/S1570-0232(04)00646-4]

-
Park YJ, Cheon GY, Song HW, Shin CS, Ku YG, Kang NR, Heo BG (2016) Mineral composition and physiological activities of methanol extract from the seeds of the Persicaria tinctoria. Korean Journal of Plant Reources 29(1): 32-38.
[https://doi.org/10.7732/kjpr.2016.29.1.032]

-
Qu Y, Chan JY, Wong CW, Cheng L, Xu C, Leung AW, Lau CB (2015) Antidiabetic effect of Schisandrae chinensis Fructus involves inhibition of the sodium glucose cotransporter. Drug Dev Res 76(1): 1-8.
[https://doi.org/10.1002/ddr.21233]

-
Shin D, Hong SB, Geum JH, MA JY, Chung HS (2016) Effects of Schisandrae Fructus on menopause symptoms in ovariectomized mice. Korean J Med 37(3): 39-46.
[https://doi.org/10.13048/jkm.16033]

- Shin JY (2001) Screening of natural products that have activities against skin-aging. Korean J Food Nutr 14(6): 568-572.
-
Taguchi H, Ikeya Y (1975) The constituents of Schizandra chinensis Baill. I. The structures of gomisin A, B and C. Chem Pharm Bull 23(12): 3296-3298.
[https://doi.org/10.1248/cpb.23.3296]

-
Xu X, Zhou X, Zhou XW, Zhang Z, Liao MJ, Gao Q, Luo HM (2012) Schizandrin prevents dexamethasone-induced cognitive deficits. Neurosci Bull 28(5): 532-540.
[https://doi.org/10.1007/s12264-012-1258-y]

-
Yang B, Zhao M, Jiang Y (2008) Optimization of tyrosinase inhibition activity of ultrasonic-extracted polysaccharides from longan fruit pericarp. Food Chem 110(2): 294- 300.
[https://doi.org/10.1016/j.foodchem.2008.01.067]

- Yang EY (2022) Physiological Activities analysis of thunberg fruit (Rosa multiflora) and quality characteristics of beverage added with fermented extract. Ph D Dissertation Sookmyung Women’s University, Seoul. p 107.
- Yu MH, Im HG, Lee HJ, Ji YJ, Lee IS (2006) Components and their antioxidative activities of methanol extracts from sarcocarp and seed of Zizyphus jujuba var. inermis Rehder. Korean J Food Sci Technol 38(1): 128-134.

