진피 추출물의 항산화 및 항비만 활성
Abstract
Citrus peel (Citrus unshiu Marcov.), a byproduct of citrus processing, is often discarded. This study aimed to assess the physiological benefits of citrus peel. The dose-dependent antioxidant activity of water extract of citrus peel (CPE) was evaluated by assessing the 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging activity at concentrations of 10, 50, 100, 250, 500 and 1,000 μg/mL. Further, a cytotoxicity assay was conducted to identify the appropriate non-toxic concentration for assessing the anti-obesity properties of CPE in 3T3-L1 preadipocytes. Its impact on lipid accumulation during the differentiation of preadipocytes into adipocytes (adipogenesis) was also evaluated. CPE inhibited 3T3-L1 adipocyte differentiation by 32.03% at a concentration of 400 μg/mL when compared with the control group. Therefore, this study revealed the potential antioxidant and anti-obesity properties of CPE. Furthermore, it underscored the importance of utilizing discarded citrus peels, thus contributing to reducing environmental pollution.
Keywords:
citrus peel, antioxidant, adipogenesis, obesity, 3T3-L1서 론
활성 산소종(reactive oxygen species)은 인체 내에서 대사 과정 중 자연스럽게 발생하며, 과격한 운동이나 환경호르몬 등 인체에서 산화적 스트레스로 발생된다(Cho 등 2011). 활성 산소종의 종류로는 hydrogen peroxide(H2O2), superoxide radical(O2-) 및 hydroxyl radical(OH) 등이 있으며, 과도하게 발생한 활성 산소종은 생체내의 단백질, 세포막 및 DNA 등의 손상을 일으켜 비만을 비롯하여 고혈압, 노화, 암 및 당뇨 등의 여러 질병을 유발한다(Gardner PR & Fridovich I 1991; Dröge W 2002; Willcox JK 등 2004). 이러한 활성 산소종을 제거하기 위하여 butylated hydroxytoluene(BHT), butylated hydroxyanisole(BHA) 및 propyl gallate(PG) 등의 합성 항산화제를 사용하였으나, 많은 연구에서 이러한 합성 항산화제가 세포내 독성을 나타내거나 암을 유발하는 등의 다양한 부작용을 발생시킬 수 있다고 보고하였다(Ito N 등 1986; Safer AM & al-Nughamish AJ 1999). 이에 합성 항산화제보다 더욱 안전하면서 보다 효과적인 천연소재의 항산화제를 찾고자 하는 연구가 진행되고 있다(Min HJ 등 2023).
비정상적으로 지방세포 수와 크기의 증가는 지방 축적의 직접적인 원인으로 알려져 있다. 특히, 지방세포 수의 증가는 전지방세포(preadipocytes)에서 지방세포(adipocytes)로 분화되는 adipogenesis 과정과 밀접한 관련이 있으며, 중성지방 형태의 에너지가 과잉 저장되는 것을 유도하는 과정이다(Naowaboot J 등 2012). Adipogenesis는 지방 조직의 발달 및 성장에 중요하며 비만과 밀접하게 관련되어 있음이 보고되었으며, adipogenesis를 억제 또는 지연시키는 것은 비만 예방에 있어 주요한 방법이다(Kang SI 등 2012; Min B 등 2014).
비만은 에너지의 섭취에 비해 소비하는 양이 상대적으로 낮아 체내의 지방이 과도하게 축적되어 다양한 합병증을 유발하게 되면서 그 위험성이 대두되고 있다. 비만은 고혈압, 고지혈증, 심혈관계질환, 간기능의 이상과 염증, 지방간, 제2형 당뇨병 및 내분비 장애 등의 각종 대사 질환의 주요한 원인으로 꼽히고 있다(Lowell BB & Spiegelman BM 2000; Barstard JP 등 2006; Attie AD & Scherer PE 2009). 이러한 비만의 심각성으로 인하여 전 세계 시장에서 비만에 대한 치료제인 오르리스타트(orlistat), 시부트라민(sibutramine) 및 토피라메이트(topiramate)와 같은 치료제가 시중에 사용되고 있으나(Hwang HS 등 2009), 치료제에 의한 부작용으로 두통, 구토, 불면증, 심근경색 및 뇌졸중과 같은 심각한 질환을 유발한다고 알려져 있다(Yoo SJ 2008). 따라서 이러한 부작용을 최소화하기 위해 천연물을 이용한 비만 치료제의 개발이 필요한 실정이다.
감귤(Citrus unshiu Marcov.)은 우리나라 과일 생산량의 30% 이상을 차지하고 있으며, 국내에서 많이 생산 및 소비되는 과일이다(Hong YS & Kim KS 2016). 과거에는 생산된 감귤이 대부분 생과로 소비되었으나, 현재 식생활의 변화와 식품 산업과 가공 기술의 발달로 20% 이상 가공된 제품으로 소비되고 있다(Hyon JS 등 2010). 감귤은 다른 과실에 비해 서 독특한 향미와 풍부한 과즙을 가지고 있을 뿐만 아니라, 감귤에는 헤스페리딘(hesperidin), 나린진(naringin) 등과 같은 폴리페놀 성분 및 노빌레틴(nobiletin), 탄게레틴(tangeretin)과 같은 60종 이상의 생리활성 물질이 밝혀져 있다(Lee JH 등 2009; Hyun JM 등 2015). 특히 감귤은 과육보다 과피에 다양한 생리활성 물질이 많이 함유되어 있으며, 카로티노이드, 플라보노이드 색소와 식이섬유 등이 높아 항균 및 항산화 효과가 우수하다고 잘 알려져 있다(Ahn MS 등 2007). 그러나 가공 과정 중 버려지는 50% 이상의 부산물이 발생하며, 이를 폐기할 시 발생하는 비용 문제와 환경 문제가 대두되고 있는 실정이다.
따라서 본 연구에서는 가공 후, 폐기되는 진피를 열수 추출하여 항산화 활성을 평가하고, 3T3-L1 전지방세포에서 진피 추출물이 지방세포 분화과정에서 지방 축적에 어떻게 작용을 하는지 평가하여 폐기물로 다량 버려지고 있는 진피의 항산화 및 항비만 기능성 천연소재로서의 가능성에 대해 실험을 실시하였다.
재료 및 방법
1. 실험재료
본 실험에 사용된 진피는 롯데마트 마산점(Changwon, Korea)에서 구매하였다. 항산화 활성 측정에 사용한 2,2-diphenyl-1-picrylhydrazyl(DPPH), ascorbic acid와 세포독성 평가에 사용한 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)와 Oil Red O(ORO), dexamethasone, insulin, 3-isobutyl-1-methylxanthine(IBMX) 및 chloroform은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하였다. 세포 배양을 위해 Dulbecco’s modified Eagle’s medium(DMEM), phosphate-buffered saline(PBS) 및 penicillin-streptomycin는 WELGENE Inc.(Daegu, Korea)에서 구입하였다. Fetal bovine serum(FBS)과 bovine calf serum(BCS)은 Gibco BRL.(Carlsbad, CA, USA)에서 구입하여 사용하였다. Dimethyl sulfoxide(DMSO)는 Junsei Chemical Co., Ltd.(Chuo-ku, Tokyo)에서 구입하였다. 실험에 사용된 3T3-L1 전지방세포는 Korea Cell Line Bank(KCLB, Seoul, Korea)에서 분양받아 사용하였다.
2. 진피 추출물(Citrus Peel Extract, CPE) 제조
감귤은 증류수로 3회 세척하고 껍질을 분리해내어 수득한 다음 절단하여 건조시켰다. 건조된 진피를 분쇄기로 분쇄한 후, 분쇄물 80 g에 증류수 800 mL를 첨가하고, 121℃에서 20 min 동안 가열하여 추출하였다. 수득한 추출물을 50 mL conical tube에 담아 25℃에서 2,500 rpm으로 5 min 동안 원심분리하여 추출액을 수득하고, 이를 여과하여 여과액을 수득하였다. 여과액은 —70℃에서 3 day 동안 냉동시킨 다음, 감압조건 하에서 4 day 동안 동결건조하여 동결건조물을 수득하였다. 추출 수율은 5.6%(w/w-dry weight)로 나타났다. 동결건조물을 —20℃에서 보관하며 실험에 사용하였다.
3. DPPH 라디칼 소거 활성 평가
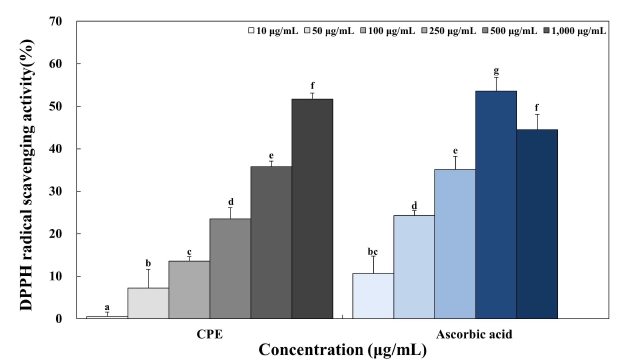
CPE의 항산화 활성은 2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거 활성을 측정하였다. 에탄올에 용해한 200 μM 농도의 DPPH 190 μL와 증류수를 이용하여 10, 50, 100, 250, 500 및 1,000 μg/mL로 희석한 진피 추출물을 96-well plate에 각각 10 μL를 넣고 혼합한 후, 37℃에서 30 min 동안 반응시켰으며 반응이 끝난 후 microplate reader(VersaMax, Molecular Devices, BaneBio, Sunnyvale, CA, USA)를 사용하여 517 nm에서 흡광도를 측정하였다. 대조군은 200 μM 농도의 DPPH 190 μL에 시료 대신 증류수 10 μL를 첨가하였고, DPPH 라디칼 소거능은 아래의 방법으로 계산하였다. 양성 대조군으로는 항산화제로 잘 알려진 ascorbic acid를 1, 5, 10, 25 및 50 μM의 농도로 단계 희석하여 비교하였다.
4. CPE의 세포독성 평가
CPE의 세포독성 평가는 3T3-L1 전지방세포를 이용하여 MTT assay를 통해 실시하였다. 50, 100, 200, 400, 600, 800 및 1,000 μg/mL의 농도로 희석한 CPE를 포함한 BCS-DMEM을 24 hr 동안 처리한 후, BCS-DMEM을 완전히 제거하고 MTT-media를 200 μg/mL 첨가한 다음 1 hr 동안 반응시켰다. 그 후, MTT-media를 완전히 제거하고 각 well에 DMSO를 500 μL씩 넣어 생성된 formazan을 녹여준 다음, 96-well plate에 100 μL씩 분주하여 570 nm의 흡광도를 microplate reader(VersaMax, Molecular Devices, BaneBio, Sunnyvale, CA, USA)를 통해 측정하여 세포 생존율(%)을 계산하였다.
5. 3T3-L1 전지방세포 배양 및 지방세포 분화
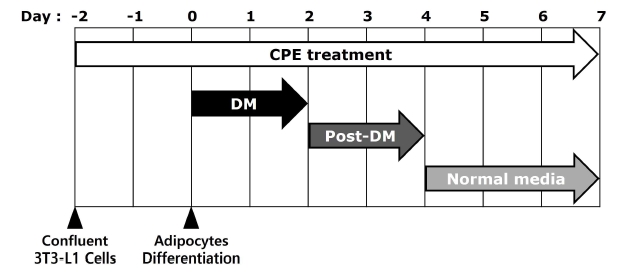
3T3-L1 전지방세포는 DMEM 배지에 10% BCS와 1% penicillin-streptomycin을 첨가하여 37℃, 5%의 CO2 환경에서 배양하였다. 세포배양접시에 3T3-L1 전지방세포가 confluent되었을 때를 day —2라고 표기하였다. 분화유도 배지(Differentiation medium; DM)를 이용하여 지방세포 분화유도를 시작한 날을 day 0이라고 표기하였으며, 분화유도 배지는 1% penicillin-streptomycin과 10% FBS가 첨가된 DMEM 배지에 5.2 μM의 DEX, 500 μM의 IBMX, 그리고 167 nM 농도의 insulin을 포함하여 day 0부터 day 2까지 48 hr 동안 처리하였고, 분화유도 후 배지(Post-differentiation medium; Post-DM)의 제조는 1% penicillin-streptomycin과 10% FBS가 첨가된 DMEM 배지에 167 nM 농도의 insulin만을 추가하여 day 2에서 day 4까지 처리하였다. 이후 DMEM 배지에 1% penicillin-streptomycin과 10% FBS를 첨가한 후 day 4에서 day 7까지 처리하였으며, day 7에 지방세포 분화를 종료하였다(Fig. 1).
6. 지방구 축적 억제 활성 평가
CPE를 3T3-L1 전지방세포에 50, 100, 200 및 400 μg/mL의 농도로 day —2에서 day 7까지 총 9 day 동안 처리하였으며, 분화유도가 종료되는 day 7에 ORO 염색을 실시하였다. 분화가 완료된 3T3-L1 지방세포는 30 min 동안 3.7%(v/v)의 formaldehyde를 사용하여 고정시켰으며, 고정된 3T3-L1 지방세포는 3 μg/mL ORO를 이용하여 15 min 동안 염색시켰다. 그 이후 지방세포 내 지방구와 결합된 ORO는 DMSO를 사용하여 용해시킨 다음 96-well plate의 1 well 당 100 μL씩 분주하여 microplate reader(VersaMax, Molecular Devices, BaneBio, Sunnyvale, CA, USA)를 이용하여 510 nm에서 흡광도를 측정하였다. 시료를 처리하지 않은 day 7의 3T3-L1 지방세포를 대조군으로 하여 지방 축적률(% of control)을 계산하였다. 또한 CPE의 처리가 3T3-L1 지방세포의 지방구 크기 및 수에 미치는 영향을 분석하였다. 생성된 지방구 크기 및 수는 day 7에 현미경을 통해 관찰하였다.
7. 통계분석
모든 데이터는 평균±표준편차로 표현하였고, 통계 처리는 Statistical Package for Social Science(Ver. 18, SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 각 항목은 일원 배치 분산분석(one-way ANOVA) 하였다. 각 구간의 유의성 차이는 Duncan’s test 및 Student’s t-test 방법에 따라 검증하였다(* p<0.05, ** p<0.01 및 *** p<0.001).
결과 및 고찰
1. DPPH 라디칼 소거 활성
DPPH 라디칼 소거 활성 시험법은 항산화 활성 측정에서 가장 많이 쓰이는 방법 중 하나로서 DPPH 라디칼은 자유라디칼로 특유의 진한 보라색이지만, 전자나 수소 원자에 의해 전자가 쌍을 이뤄 비라디칼이 되면서 특유의 진한 보라색이 노란색으로 변색되는 DPPH의 화학적 성질을 이용한 실험방법이다(Lee MY 등 2012). DPPH 라디칼 소거 활성측정을 통한 CPE의 항산화 활성은 10, 50, 100, 250, 500 및 1,000 μg/mL의 농도로 희석한 CPE와 항산화제로 잘 알려진 ascorbic acid를 1, 5, 10, 25 및 50 μM의 농도로 처리하여 비교하였다(Fig. 2). CPE는 농도 증가에 따라 0.54%, 7.25%, 13.55%, 23.48%, 35.77% 및 51.7%로 DPPH 라디칼 소거 활성이 증가하였으며, 양성대조군인 ascorbic acid는 농도에 따라 10.64%, 24.28%, 35.12%, 53.59% 및 44.51%의 라디칼 소거능을 나타냈다. 운향과 식물의 과실류 껍질의 항산화 효과에 대한 연구 중 Kim MK(2021)는 6종 운향과 식물 과실류 껍질 에탄올 추출물의 DPPH 라디칼 소거능은 1,000 μg/mL의 농도에서 각각 유자 9.9%, 자몽 7.6%, 레몬 24.7%, 밀감 10.2%, 오렌지 11.2%, 탱자 17.2%의 라디칼 소거능을 보였다고 보고하였으며 Choi MY 등(2021)은 감귤 에탄올 추출물의 DPPH 라디칼 소거능은 0.1, 0.5, 1 및 5 mg/mL의 농도에서 29.54%, 47.16%, 60.8% 및 76.70% 라디칼 소거능을 보고하였을 뿐만 아니라 Yi MR 등(2014)은 운향과 식물의 과실류 중 감귤의 과피에 식이섬유, 정유, 카로티노이드 및 플라보노이드 등의 생리활성 성분이 다량 함유되어 있으며, 과육보다 높은 항산화 활성을 나타낸다고 하였다. 따라서 본 실험에서 사용된 진피 추출물 또한 생리활성 물질이 다량 함유되어 있으며 천연 항산화 소재로서의 가능성이 높다고 사료된다.
2. 3T3-L1 세포에서 CPE 처리에 의한 세포독성
3T3-L1 전지방세포에서 CPE의 세포독성을 알아보기 위해 MTT assay를 실시하여 분석하였으며, 그 결과는 Fig. 3에나타내었다. 50, 100, 200, 400, 600, 800 및 1,000 μg/mL 농도의 CPE 추출물의 세포 생존율은 각각 96.62%, 91.43%, 101.19%, 93.14%, 73.74% 69.65% 및 73.26%의 세포 생존율을 나타내었으며, 세포 생존율이 80% 이하로 나타난 600, 800 및 1,000 μg/mL 농도를 제외한 50, 100, 200 및 400 μg/mL의 농도의 CPE 추출물에 대하여 항비만 활성 실험을 진행하였다.
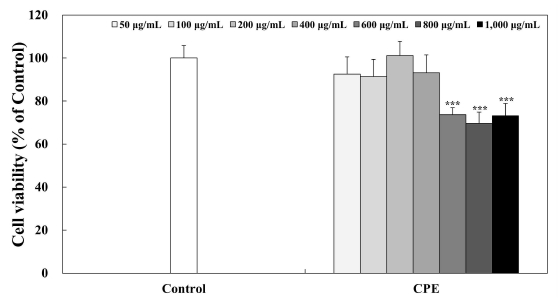
Effects of CPE treatment on 3T3-L1 viability.The 3T3-L1 preadipocytes were incubated with 10% BCS-DMEM containing citrus peel extracts for 24 hr to measure cell viability. The 3T3-L1 preadipocytes were quantified using microplate reader at 450 nm. Corresponding letters indicate significant differences by Student’s t-test (*** p<0.001).Control: 3T3-L1 preadipocytes, CPE: citrus peel extract.
3. 3T3-L1 세포에서 CPE의 Adipogenesis 억제 활성
비만 연구 분야에서 널리 사용되는 3T3-L1 전지방세포는 IBMX, insulin 및 dexamethasone 등과 같은 다양한 분화유도 인자와 호르몬에 의해 전지방세포에서 지방세포로 분화되어 세포 내에서 지방을 축적한다(Shon MS & Kim GN 2014). 전지방세포가 지방세포로 분화되는 과정인 adipogenesis는 비만과 밀접한 관련이 있으며, adipogenesis를 효과적으로 조절하는 것은 비만을 예방하고 치료하는 데 있어 중요한 부분이다(Kim KH 2009).
최근 연구에 의하면, 식물 유래의 폴리페놀이 adipogenesis 과정에 관여하는 주요한 전사인자들의 발현 조절을 통해 지방 축적 및 지방세포의 분화를 억제한다는 연구 결과가 보고되었다(Hsu CL & Yen GC 2007; Moon HS 등 2007; Kim NH 등 2018). CPE의 처리가 3T3-L1 세포의 adipogenesis 과정에 미치는 영향을 알아보기 위하여 50, 100, 200 및 400 μg/mL의 농도로 day —2에서 day 7까지 총 9 day 동안 처리한 후 day 7에 ORO 염색법을 실시하였을 때, 지방세포 분화를 유도한 대조군에서는 지방구가 다량으로 축적되었음을 확인할 수 있으며, 400 μg/mL 농도의 CPE를 처리하였을 경우 3T3-L1 세포의 분화를 억제하여 지방구의 생성을 저해하는 것으로 나타났다(Fig. 4). 또한, 3T3-L1 세포에 축적된 지방구를 ORO로 염색하고, 이를 DMSO로 용해하여 정량분석 한 결과, 대조군(100%)과 비교하여 400 μg/mL의 진피 추출물의 처리는 대조군 대비 약 32.03%의 3T3-L1 지방세포 분화를 억제한 것으로 나타났다. Jo HK 등(2015)의 연구에서도 진피 에탄올 추출물을 처리하였을 때 농도 의존적으로 비만을 유발하는 지방구의 형성을 억제하였다고 보고하였으며 이러한 결과는 CPE가 3T3-L1 세포의 지방세포 분화를 억제함으로써 항비만 활성을 나타낼 수 있다는 가능성을 보여주는 결과라고 생각된다. Kong CS 등(2010)은 3T3-L1 전지방세포가 지방세포로 분화되는 과정인 adipogenesis는 특정 유전자 발현에 대해 프로그램된 변화의 연속에 의해 유도된다고 보고하였으며 Kim KB & Jang SH(2014)는 C/EBPα, PPARγ 및 SREBP1과 같은 전사인자의 발현은 지방세포가 분화되는 동안 adipogenesis 과정을 위한 주요한 활성인자로 작용하며 전사인자들의 과발현은 지방세포의 분화를 가속화시킬 수 있다고 하였다. 따라서 CPE의 3T3-L1 전지방세포에서 지방세포로의 분화 억제 효과에 대한 adipogenesis 과정에 관여하는 핵심 전사인자들의 발현 조절 수준을 확인하는 추가적인 실험이 필요할 것으로 사료된다.
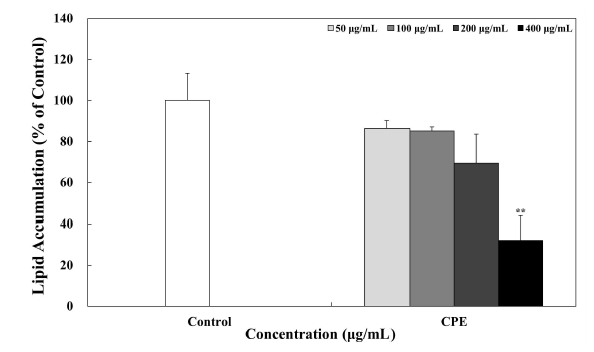
Inhibitory effects of CPE on 3T3-L1 adipogenesis.The levels of lipid accumulation of 3T3-L1 cells was evaluated by Oil Red O staining, and it was quantified using microplate reader at 510 nm. Corresponding letters indicate significant differences by Student’s t-test (** p<0.05).Control: mature 3T3-L1 adipocytes, CPE: citrus peel extract.
4. CPE의 처리가 3T3-L1 세포 내 지방구의 수 및 크기에 미치는 영향
전지방세포는 다양한 전사인자와 호르몬들에 의해 지방세포로 분화되면서 세포 내 지방을 생성하고 축적한다(Hwang DI 등 2019). 3T3-L1 지방세포를 CPE로 각각 50, 100, 200 및 400 μg/mL의 농도로 day —2에서 day 7까지 총 9 day 동안 처리한 후, 분화유도가 완료된 day 7에 ORO 염색법을 실시한 후 3T3-L1 지방세포 내의 축적된 지방구의 크기와 수를 현미경을 이용하여 관찰하였다(Fig. 5). 그 결과 분화를 유도하지 않은 전지방세포에서는 지방구가 발견되지 않았으나 분화를 유도한 지방세포 대조군은 많은 양의 지방구를 확인할 수 있었으며 특히, CPE의 처리에 의해 농도 의존적으로 지방구의 크기와 수가 감소하여 CPE가 항비만 활성이 높음을 확인할 수 있었다.
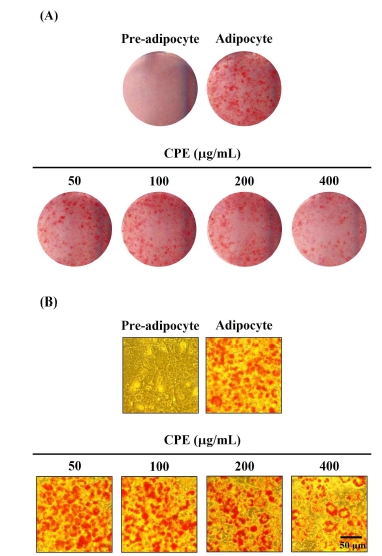
Effects of CPE treatment on the lipid accumulation of 3T3-L1 adipocytes.The 3T3-L1 preadipocytes were treated with 50, 100, 200 and 400 μg/mL of CPE from day —2 to day 7. Inhibitory effects of CPE treatment on the differentiation (A) number and size of lipid droplets (B) in ORO-stained 3T3-L1 cells were observed using scanner at day 7.Pre: 3T3-L1 preadipocytes, Adi: mature 3T3-L1 adipocytes, CPE: citrus peel extract.
요 약
본 연구에서는 가공 후 폐기되는 진피의 활용방안을 강구하기 위한 기초연구로써, 진피를 열수 추출하여 CPE를 제조한 후, 항산화 및 항비만 활성을 평가하고자 하였다. 항산화 실험으로 DPPH 라디칼 소거 활성 시험법을 통해 CPE는 10, 50, 100, 250, 500 및 1,000 μg/mL에서 농도 의존적으로 항산화 활성을 나타냈다. 그리고 3T3-L1 전지방세포에 CPE를 농도별로 처리하여 세포독성을 나타내지 않는 50, 100, 200 및 400 μg/mL 농도에서 CPE의 처리는 농도 의존적으로 adipogenesis과정을 조절하여 비만의 원인이 되는 지방구의 생성을 억제하였다. 본 연구를 종합해 볼 때, 가공 부산물로 폐기되는 진피의 항산화 및 항비만 기능성 식품의 천연 소재로 활용될 수 있다는 가능성을 보여주는 결과로 사료되며, 추후 진피의 주요 생리활성 물질과 adipogenesis 과정에 관여하는 핵심 전사인자들의 발현 조절 수준 확인에 대한 추가적인 실험이 수행되어야 할 것으로 판단된다.
References
- Ahn MS, Kim HJ, Seo MS (2007) A study on the antioxidative and antimicrobial activities of the Citrus unshju peel extracts. J Korean Soc Food Cult 22(4): 454-461.
-
Attie AD, Scherer PE (2009) Adipocyte metabolism and obesity. J Lipid Res 50(Suppl): S395-S399.
[https://doi.org/10.1194/jlr.R800057-JLR200]

- Barstard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, Capeau J, Feve B (2006) Recent advances in the relationship between obesity, inflammation and insulin resistance. Eur Cytokine Netw 17(1): 4-12.
- Choi MY, Park HJ, Kim JS, Kim MR (2021) Evaluation on antioxidative and antiaging effect of immature fruits from Citrus unshiu Markovich. Kor J Herbology 36(1): 77-85.
-
Dröge W (2002) Free radicals in the physiological control of cell function. Physiol Rev 82(1): 47-95.
[https://doi.org/10.1152/physrev.00018.2001]

-
Gardner PR, Fridovich I (1991) Superoxide sensitivity of the Escherichia coli aconitase. J Biol Chem 266(29): 19328-19333.
[https://doi.org/10.1016/S0021-9258(18)55001-8]

-
Hong YS, Kim KS (2016) Identification of volatile flavor compounds in Jeju citrus fruits. Korean J Food Preserv 23(7): 977-988.
[https://doi.org/10.11002/kjfp.2016.23.7.977]

-
Hsu CL, Yen GC (2007) Effects of flavonoids and phenolic acids on theinhibition of adipogenesis in 3T3-L1 adipocytes. J Agric Food Chem 55(21): 8404-8410.
[https://doi.org/10.1021/jf071695r]

- Hwang DI, Choi IH, Kim DY, Park SM, Kim HB, Li YL, Lee HM (2019) Inhibitory effects of Chrysanthemum boreale makino on 3T3-L1 preadipocyte differentiation and down-regulation of adipogenesis and lipogenesis. J Life Sci 29(3): 332-336.
-
Hwang HS, Kim SH, Yoo YG, Chu YS, Shon YH, Nam KS, Yun JW (2009) Inhibitory effect of deep-sea water on differentiation of 3T3-L1 adipocytes. Mar Biotechnol 11(2): 161-168.
[https://doi.org/10.1007/s10126-008-9131-8]

-
Hyon JS, Kang SM, Senevirathne M, Koh WJ, Yang TS, Oh MC, Jeon YJ, Kim SH (2010) Antioxidative activities of extracts from dried Citrus sunki and C. unshiu peels. J Korean Soc Food Sci Nutr 39(1): 1-7.
[https://doi.org/10.3746/jkfn.2010.39.1.001]

-
Hyun JM, Park KJ, Kim SS, Park SM, Lee YJ, An HJ (2015) Antioxidant and anti-inflammatory effects of solvent fractions from the peel of the native Jeju citrus ‘Hongkyool’ and ‘Pyunkyool’. J Life Sci 25(10): 1132-1138.
[https://doi.org/10.5352/JLS.2015.25.10.1132]

-
Ito N, Hirose M, Fukushima S (1986) Modifying effects of anti-oxidants on chemical carcinogenesis. Toxicol Pathol 14(3): 315-323.
[https://doi.org/10.1177/019262338601400305]

-
Jo HK, Han MH, Hong SH, Choi YH, Park C (2015) Ethanol extracts of citrus peel inhibits adipogenesis through AMPK signaling pathway in 3T3-L1 preadipocytes. J Life Sci 25(3): 285-292.
[https://doi.org/10.5352/JLS.2015.25.3.285]

-
Kang SI, Shin HS, Kim HM, Yoon SA, Kang SW, Ko HC, Kim SJ (2012) Callophyllis japonica extract improves high-fat diet-induced obesity and inhibits adipogenesis in 3T3-L1 cells. Anim Cells Syst 16(6): 447-454.
[https://doi.org/10.1080/19768354.2012.734257]

-
Kim KB, Jang SH (2014) Anti-obesity effect of EGCG and glucosamine-6-phosphate through decreased expression of genes related to adipogenesis and cell cycle arrest in 3T3-L1 adipocytes. J Nutr Health 47(1): 1-11.
[https://doi.org/10.4163/jnh.2014.47.1.1]

- Kim KH (2009) Perspective in regulation of adipogenesis by bioactive food components. Food Sci Ind 42(4): 51-57.
- Kim MK (2021) Comparison analysis of antioxidant effects from Rutaceae fruits. Journal of the Korea Society of Computer and Information 26(11): 157-163.
-
Kim NH, Jegal J, Kim YN, Heo JD, Rho JR, Yang MH, Jeong EJ (2018) Chokeberry extract and its active polyphenols suppress adipogenesis in 3T3-L1 adipocytes and modulates fat accumulation and insulin resistance in diet-induced obese mice. Nutrients 10(11): 1734.
[https://doi.org/10.3390/nu10111734]

-
Kong CS, Kim JA, Eom TK, Kim SK (2010) Phosphorylated glucosamine inhibits adipogenesis in 3T3-L1 adipocytes. J Nutr Biochem 21(5): 438-443.
[https://doi.org/10.1016/j.jnutbio.2009.01.018]

- Lee JH, An HJ, Lee SY, Choi YH, Lim BS, Kang YJ (2009) Change in quality characteristics of ‘setoka’ (Citrus spp.) using different storage methods. Korean J Food Preserv 16(5): 644-649.
-
Lee MY, Yoo MS, Whang YJ, Jin YJ, Hong MH, Pyo YH (2012) Vitamin C, total polyphenol, flavonoid contents and antioxidant capacity of several fruit peels. Korean J Food Sci Technol 44(5): 540-544.
[https://doi.org/10.9721/KJFST.2012.44.5.540]

-
Lowell BB, Spiegelman BM (2000) Towards a molecular understanding of adaptive thermogenesis. Nature 404(6778): 652-660.
[https://doi.org/10.1038/35007527]

-
Min B, Lee H, Song JH, Han MJ, Chung J (2014) Arctiin inhibits adipogenesis in 3T3-L1 cells and decreases adiposity and body weight in mice fed a high-fat diet. Nutr Res Pract 8(6): 655-661.
[https://doi.org/10.4162/nrp.2014.8.6.655]

-
Min HJ, Kim DH, Seo KI (2023) Biological activity of Euonymus alatus (Thunb.) Sieb. wing extracts. Korean J Food Preserv 30(2): 358-368.
[https://doi.org/10.11002/kjfp.2023.30.2.358]

-
Moon HS, Chung CS, Lee HG, Kim TG, Choi YJ, Cho CS (2007) Inhibitory effect of (−)-epigallocatechin-3-gallate on lipid accumulation of 3T3-L1 cells. Obesity 15(11): 2571-2582.
[https://doi.org/10.1038/oby.2007.309]

-
Naowaboot J, Chung CH, Pannangpetch P, Choi R, Kim BH, Lee MY, Kukongviriyapan U (2012) Mulberry leaf extract increases adiponectin in murine 3T3-L1 adipocytes. Nutr Res 32(1): 39-44.
[https://doi.org/10.1016/j.nutres.2011.12.003]

- Safer AM, al-Nughamish AJ (1999) Hepatotoxicity induced by the antioxidant food additive, butylated hydroxytoluene (BHT), in rats: An electron microscopical study. Histol Histopathol 14(2): 391-406.
- Shon MS, Kim GN (2014) Anti-oxidant and anti-obese activities of turmeric (Curcuma longa L.) extract in 3T3-L1 cells. Kor J Aesthet Cosmetol 12(2): 169-175.
-
Willcox JK, Ash SL, Catignani GL (2004) Antioxidants and prevention of chronic disease. Crit Rev Food Sci Nutr 44(4): 275-295.
[https://doi.org/10.1080/10408690490468489]

-
Yi MR, Hwang JH, Oh YS, Oh HJ, Lim SB (2014) Quality characteristics and antioxidant activity of immature Citrus unshiu vinegar. J Korean Soc Food Sci Nutr 43(2): 250-257.
[https://doi.org/10.3746/jkfn.2014.43.2.250]

-
Yoo SJ (2008) Pharmacological treatment of obesity. J Korean Endocr Soc 23(4): 223-233.
[https://doi.org/10.3803/jkes.2008.23.4.223]