
에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물의 간보호 활성
Abstract
The biological activity of Gryllus bimaculatus, an edible insect, was extracted using ionized calcium water and distilled water. The extraction yields for each solvent were similar at 16.60% and 16.22% (w/w-dry weight) for WEG (water extract of Gryllus bimaculatus) and IEG (ionized calcium solution extract of Gryllus bimaculatus). The DPPH radical scavenging activity was evaluated to determine the antioxidant activity of the extracts, and WEG (7.62%, 31.85%, 42.81%, 53.09%, and 63.35%) and IEG (4.82%, 16.41%, 28.23%, 37.87%, and 45.74%) eliminated DPPH radicals in a dose-dependent manner. In addition, the reducing power of the extracts was assessed by measuring their ability to reduce Cu2+ to Cu1+. WEG (3.54, 16.55, 31.22, 40.49, and 40.39 μM (copper (1) ion)) and IEG (2.74, 13.55, 26.29, 41.46, and 43.78 μM (copper (1) ion)) showed a dose-dependent reduction. Furthermore, the hepatoprotective effects of the extracts were confirmed by assessing the cell survival rate of HepG2 cells treated with WEG and IEG, both in the presence of ethanol and as a complex treatment. Therefore, the Gryllus bimaculatus extracts can be a functional food material because of their antioxidant and hepatoprotective effects.
Keywords:
antioxidant, liver protection, functional foods, edible insect, Gryllus bimaculatus서 론
식용곤충(edible insect)이란 식용을 목적으로 하는 곤충을 총칭하며 현재 아시아, 아프리카, 호주 및 남아메리카 등의 많은 지역에서 동물성 단백질, 필수아미노산 및 미량영양소섭취를 위해 메뚜기, 딱정벌레 그리고 흰개미 등의 다양한 곤충이 광범위하게 식용으로 이용되고 있다(Bukkens SGF 1997). 국제연합식량농업기구(Food and Agriculture Organization of the United Nations [FAO])에 따르면(Huis A 등 2013), 2050년에는 세계인구가 2010년 대비 두 배 이상의 식량이 필요할 것으로 예측하고 있으며 쌀, 보리 그리고 밀 등과 같은 전통적인 에너지 공급원과 축산류 및 가금류 등과 같은 단백질 공급원이 아닌 새로운 먹거리를 통해 앞으로의 식량문제를 해결해 줄 방안으로 식용곤충이 주목받고 있다(Durst PB 등 2010; Huis A 등 2013). FAO에서 식용곤충을 지목하는 이유를 경제적, 환경적 그리고 영양적 측면의 3가지 측면으로 구분하여 설명하고 있다(Kim HM 등 2015). 곤충은 가축에 비해 사육면적이 적게 소요되어 높은 토지 이용 효율을 보이며, 한 번에 수백여 개의 알을 낳아 세대 순환이 빠르므로 짧은 시간에 대량생산이 가능하고, 또한 동일 생산량이 필요할 경우 육류에 비해 매우 경제적이다. 그리고 영양적 측면으로는 소고기 및 닭고기 등 기존의 주요 육류 단백질원보다 풍부한 단백질을 가지고 있고, 불포화지방산이 총 지방산의 약 70%를 차지하고 있으며, 무기질 함량 또한 풍부하여 영양적 가치를 높게 평가하고 있다(Pemberton RW 1988; Bukkens SGF 1997; Kim HM 등 2015). 환경적 측면으로는 가축이 지구 전체 온실가스 발생량의 18% 이상을 배출하는 반면, 갈색거저리 유충 같은 경우 1 kg당 돼지의 10분의 1 정도의 온실가스를 배출함으로 친환경적이라 할 수 있다(Godfray HCJ 등 2010; Kim DS 등 2014; Lee JH 등 2016; Park KH & Kim GY 2018).
세계 곤충산업의 시장 규모는 증대되고 있으며 주요 시장 조사 기관에서는 2016∼2023년 연평균 성장률은 42%에 시장 규모는 5억 2,200만 달러의 규모를 예상하였다(Tomas W 2016). 특히 곤충자원을 이용한 의약품 개발, 신소재 개발 등 곤충을 이용하는 산업의 규모가 지속해서 성장하고 있다(Huis A 등 2013). 국내에서도 식용곤충의 활발한 연구가 진행되고 있으며 식품공전에는 7종의 식용곤충인 쌍별귀뚜라미(Gryllus bimaculatus)와 백강잠(Beauveria bassiana Vuill.), 메뚜기(Oxya japonica Thungberg), 갈색거저리 유충(Tenebrio molitor L.), 누에(Bombyx mori L.), 흰점박이꽃무지 유충(Protaetia brevitarsis L.) 그리고 장수풍뎅이 유충(Allomyrina dichotoma L.)이 식품 원료로 등록되어 있으며, 최근에는 아메리카왕거저리 유충(Zophobas atratus) 탈지 분말, 수벌번데기(Apis mellifera L.)와 풀무치(Locusta migratoria)가 한시적 식품 원료로 등재되었다(Ministry of Food and Drug Safety[MFDS] 2021).
그중 쌍별귀뚜라미는 메뚜기목 귀뚜라미속에 속하는 아열대성 곤충으로 대만, 일본, 인도, 아프리카에 주로 분포한다(Lee EA & Kwon OS 2013). 식용곤충 산업에 관한 관심이 높아지면서 가축의 사료, 약용 및 식용으로 활용할 수 있는 곤충 종 중에서 쌍별귀뚜라미는 62% 이상의 높은 단백질 함량으로 필수지방산과 불포화지방산이 많아 가공식품이나 식품 원료로 이용 가치가 높다(Park KT 2001). 한편 국내에서 쌍별귀뚜라미에 관한 연구로는 인슐린 결핍 당뇨 마우스에서 식용곤충 쌍별귀뚜라미 추출물의 항당뇨 활성과 전처리에 따른 쌍별귀뚜라미의 안전성 및 영양학적 평가 등이 있지만(Cho HT 등 2019; Lee JA & Kim AJ 2019), 이온화 칼슘 수용액으로 추출한 쌍별귀뚜라미의 간 보호 효과와 관련한 기능성 연구는 미비한 실정이다.
칼슘은 인체 내 무기질 중에서 가장 많은 양이 존재하며, 99%가 인산 칼슘염의 형태로 뼈와 치아에 저장되어 있고 나머지 1%는 혈액과 세포 속에 존재한다(Allen LH 1982). 체내에서 칼슘은 골격과 치아의 형성, 혈액 응고, 근육의 수축·이완, 신경 전달 작용, 신경흥분의 조절, 세포막의 투과성 조절, 비타민 B12의 흡수 및 세포막의 융합·분열 등에 광범위하게 작용하고 있다(Einhorn TA 등 1990). 또한 골다공증 등의 골 질환뿐만 아니라, 고콜레스테롤혈증, 동맥경화, 고지혈증, 고혈압 등을 감소시키는 데도 중요한 역할을 하고 있다(Sentipal JM 등 1991; Matkovic V & Ilich JZ 1993; Kim HS & Yu CH 1997). 체내에 부족한 칼슘을 보충하기 위해서는 칼슘 급원 식품의 섭취를 늘리거나, 칼슘보충제 또는 칼슘이 강화된 가공식품을 섭취하는 방법 등이 있지만, 시판되는 칼슘의 대부분은 불용성으로 섭취 후 체내에서 대부분 흡수가 되지 않고 그 흡수율이 섭취량보다 현저히 낮다(National Institutes of Health [NIH] 1994; Ministry of Health and Welfare [MHW] 1999). 이렇게 섭취한 칼슘이 체내로 흡수되기 위해서는 우선 위장 내에서 먼저 분해되고 용해되어 칼슘 이온으로 전리되어야 한다. 섭취한 칼슘이 장내에서 흡수되기 위해서 분해속도가 빠르고 용해도가 높을수록 흡수율이 증가하므로 칼슘을 이온 상태로 전리하여 섭취하는 것이 가장 좋은 방법으로 보고되고 있다(Lee SK & Park JH 2002).
따라서 본 실험에서는 쌍별귀뚜라미를 증류수와 이온화 칼슘 수용액으로 각각 추출물을 제조하여 추출 용매에 따른 항산화 활성을 평가하였다. 그리고 인간유래 HepG2 세포에서 쌍별귀뚜라미 추출물의 간 보호 효과를 확인하였으며 이는 이온화 칼슘 수용액과 식용곤충인 쌍별귀뚜라미 추출물을 활용한 식품 및 건강기능식품 개발을 위한 쌍별귀뚜라미 추출물의 가능성을 확인하고자 하였다.
재료 및 방법
1. 쌍별귀뚜라미 추출물(WEG, IEG) 제조
본 실험에서 쌍별귀뚜라미와 이온화 칼슘 수용액은 ㈜현대바이오(Suwon, Korea)에서 제공받아 사용하였다. 분쇄한 쌍별귀뚜라미 50 g에 증류수와 이온화 칼슘 수용액에 각각 1 L 씩 가하여 110℃에서 1 hr 동안 열수 추출하고 동결건조(PVTFD-10R, Ilshinbiobase, Dongducheon, Korea) 시킨 후 —20℃에 보관하며, 이후 분석에 사용하였다. 증류수에 추출한 쌍별귀뚜라미는 WEG(Water extract of Gryllus bimaculatus), 이온화 칼슘 수용액에 추출한 쌍별귀뚜라미는 IEG(Ionized calcium solution extract of Gryllus bimaculatus)로 명명하였다.
2. 쌍별귀뚜라미 추출물(WEG, IEG) 수율
쌍별귀뚜라미 50 g을 증류수와 이온화 칼슘 수용액에 각각 1 L씩 가하여 110℃에서 1 hr 동안 열수 추출하고 동결건조(PVTFD-10R, Ilshinbiobase, Dongducheon, Korea) 시킨 후, 무게를 측정하였다. 추출 수율(yield)은 백분율(%)로 표시하였다(Table 1).
3. DPPH 라디칼 소거 활성 평가
쌍별귀뚜라미 추출물 WEG와 IEG의 항산화 활성은 1.1-diphenyl-2-picryl-hydrazyl(DPPH) 라디칼 소거 활성을 측정하였다. 94% 에탄올에 용해한 200 μM의 DPPH 190 μL에 증류수에 희석한 귀뚜라미 시료를 10, 50, 100, 200 그리고 400 μg/mL로 단계 희석하여 각각 10 μL을 넣고 37℃의 incubator에서 30 min 동안 반응시켰다. 반응이 끝난 후 microplate reader(VersaMax, Molecular Devices, Sunnyvale, CA, USA)를 사용하여 517 nm에서 흡광도를 측정하였다. 대조군은 시료 대신에 에탄올에 용해한 200 μM의 DPPH 190 μL에 증류수 10 μL를 첨가하였고 DPPH 라디칼 소거능은 아래의 방법으로 계산하였다. 양성대조군으로는 항산화제로 잘 알려진 ascorbic acid(vitamin C)를 10, 50, 100, 200 그리고 400 μg/mL의 농도로 단계 희석하여 비교하였다.
4. 환원력 평가
쌍별귀뚜라미 추출물 WEG와 IEG의 환원력 측정을 위해 copper ion reduction 실험을 실시하였다. 증류수에 녹인 100 μM의 CuCl2 용액 20 μL와 250 μM의 neocuproine 80 μL, 10 mM potassium phosphate buffer(pH 7.4) 60 μL 그리고 쌍별귀뚜라미 추출물을 단계 희석한 시료 40 μL을 96-well plate에 10, 50, 100, 200 그리고 400 μg/mL 순서대로 분주한 후 실온에서 1 hr 동안 반응시켰다. 반응이 끝난 후 microplate reader(VersaMax, Molecular Devices, Sunnyvale, CA, USA)를 사용하여 454 nm에서 흡광도를 측정하였다. 대조군으로는 100 μM CuCl2 용액 20 μL와 250 μM 농도의 neocuproine 80 μL와 10 mM 농도의 potassium phosphate buffer 60 μL 그리고 CuCl2를 용해시킨 증류수 40 μL를 첨가하였다. 양성대조군으로는 ascorbic acid를 사용하였으며, 결과 값은 Cu+1/neocuproine의 extinction coefficient(7.95 × 103 M-1cm-1)를 사용하여 454 nm 흡광도로부터 계산된 Cu+1의 농도로서 환원력을 표시하였다.
5. HepG2 세포배양
본 실험에 사용된 인간 간암 세포주인 HepG2 세포는 American Type Culture Collection(ATCC, Rockville, MD, USA)에서 분양받아 사용하였다. HepG2 세포는 10%(v/v)의 fetal bovine serum(FBS)과 penicillin-streptomycin이 함유된 Dulbecco’s modified Eagle’s medium(DMEM) 배지에 배양하였으며, 5%의 CO2, 37℃의 환경에서 이틀에 한 번씩 FBS-DMEM 배지를 교체해 주었다.
6. 에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물(WEG, IEG) 전처리 효과
에탄올에 의해 유도된 HepG2 세포에 대한 쌍별귀뚜라미 추출물의 간 보호 효과를 확인하기 위해 200 μg/mL 농도의 추출물을 전처리한 후 7.5%(v/v) 에탄올을 처리하여 세포 생존율을 확인하기 위해 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) assay를 실시하였다. 쌍별귀뚜라미 추출물을 포함한 FBS-DMEM은 24 hr 처리 후 제거하였다. 그 후 24 hr 동안 7.5%(v/v)의 에탄올을 첨가한 DMEM 배지를 처리하였다. Ethanol-DEME 배지를 제거하고 200 μg/mL의 MTT-media(DMEM and MTT reagent dissolved in PBS, pH 7.4)를 첨가하여 1 hr 동안 처리하였다. MTT-media를 제거하고 용해되지 않는 MTT formazan은 700 μL의 DMSO를 가하여 녹여준 다음 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 570 nm의 흡광도로 측정하였다.
7. 에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물(WEG, IEG) 병행처리 효과
에탄올에 의해 유도된 HepG2 세포에 대한 쌍별귀뚜라미 추출물의 간 보호 효과를 확인하기 위해 200 μg/mL 농도의 추출물과 7.5%(v/v) 에탄올을 동시 처리하여 세포 생존율을 확인하기 위해 MTT assay를 실시하였다. 쌍별귀뚜라미 추출물을 포함한 FBS-DMEM과 7.5%(v/v)의 에탄올을 함께 처리하였으며, 24 hr 후 DEME 배지를 제거하고, 200 μg/mL MTT-media를 첨가하여 1 hr 동안 처리하였다. MTT-media를 제거하고 용해되지 않는 MTT formazan은 700 μL DMSO를 가하여 녹여준 다음, microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 570 nm의 흡광도로 측정하였다.
8. 통계분석
모든 데이터는 평균±표준편차로 표현하였다. 통계처리는 Statistical Package for Social Science(SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 각 항목은 일원 배치 분산 분석(one-way ANOVA) 하였고, 각 구간의 유의성 차이는 Duncan’s test 방법에 따라 각 구간의 유의성 차이를 검증하였다(p<0.05).
결과 및 고찰
1. DPPH 라디칼 소거 활성 평가
DPPH는 실온에서 안정하고 수용성 용매가 아닌 유기 용매에서 용해되며, 항산화 물질이 존재할 때 보라색이 노란색으로 옅어진다. DPPH 라디칼 소거 활성 측정법은 천연소재의 항산화 활성 측정에 적합하고 간단하며, 재현성이 좋아 항산화 활성 측정에 가장 많이 이용되는 실험 방법 중 하나이다(Abdalla AE & Roozen JP 1999). 쌍별귀뚜라미를 증류수와 이온화 칼슘 수용액으로 추출한 추출물인 WEG와 IEG의 항산화 활성을 평가하고 비교하기 위해 DPPH 라디칼 소거 활성을 평가 하였다. WEG와 IEG는 10, 50, 100, 200 그리고 400 μg/mL의 농도로 처리하였으며 양성대조군으로는 항산화제로 잘 알려진 ascorbic acid를 사용하였다(Fig. 1). 증류수로 추출한 WEG는 각각 7.62%, 31.85%, 42.81%, 53.09% 그리고 63.35%의 DPPH 라디칼 소거능을 나타냈다. 이온화 칼슘 수용액으로 추출한 IEG는 각각 4.82%, 16.41%, 28.23%, 37.87% 그리고 45.74%로 농도 의존적으로 DPPH 라디칼 소거 활성을 나타냈으나 증류수로 추출한 WEG보다 낮은 소거능을 나타냈다. 양성대조군인 ascorbic acid를 각각 10, 50, 100, 200 그리고 400 μg/mL의 농도로 시험했을 때 19.22%, 55.01%, 66.85%, 75.37% 그리고 80.30%의 DPPH 라디칼 소거 활성을 나타냈다. 양성대조군 ascorbic acid의 50 μg/mL의 농도와 WEG의 200 μg/mL의 농도에서 DPPH 라디칼이 유사한 정도의 소거 활성을 나타내었다. 현재 증류수와 이온화 칼슘 수용액으로 추출한 쌍별귀뚜라미의 항산화 활성에 대한 연구는 미비한 실정이다. 그러나 다른 종류의 식용곤충인 갈색거저리 유충 추출물의 DPPH 라디칼 소거능을 확인한 결과 1, 5 그리고 10 mg/mL에서 17.22%, 66.79%, 그리고 81.17%의 DPPH 라디칼 소거능을 나타내었다(Baek MH 등 2017). WEG와 IEG의 100 μg/mL의 농도에서는 각각 42.81%와 28.23%의 DPPH 라디칼 소거능을 나타냈고 갈색거저리 유충 추출물의 1 mg/mL에서는 17.22%로 WEG와 IEG보다 갈색거저리 유충 추출물의 농도가 10배 더 높지만 DPPH 라디칼 소거 활성은 WEG가 2배 이상, IEG는 약 1.6배 이상 높았음을 확인할 수 있었다. 따라서 쌍별귀뚜라미 추출물인 WEG와 IEG는 갈색거저리 유충 추출물보다 더 높은 수준의 DPPH 라디칼 소거능을 보이므로 자유 라디칼 제거에 의한 높은 항산화 활성을 기대할 수 있다. 선행연구(Kim SH 등 2020)에서 쌍별귀뚜라미는 아미노산의 조성이 우수하고, 분지아미노산도 함유되어 있으며, 지방 함량이 낮고, 항산화 활성이 높아 근감소 억제, 항산화 및 뷰티 푸드 관련 식품소재나 식품으로서의 활용가능성이 높다고 보고하였다.
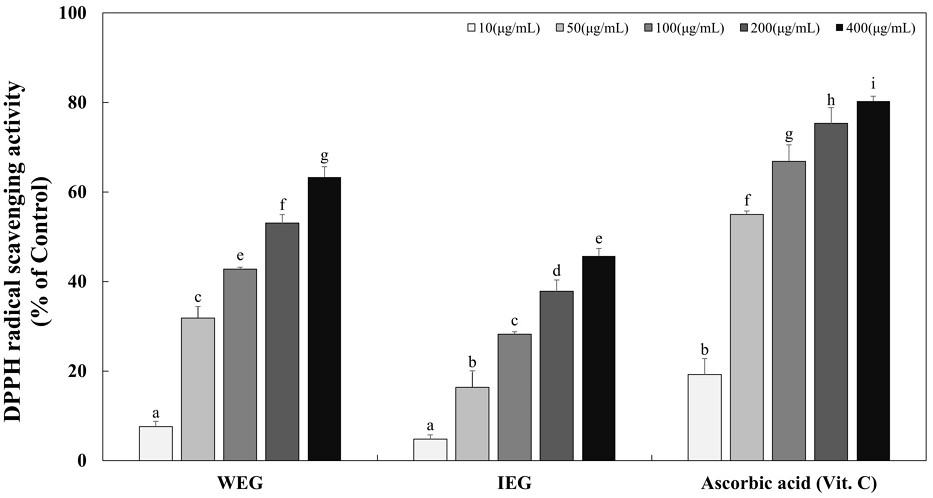
The DPPH radical scavenging activities of Gryllus bimaculatus extracts.Corresponding letters indicate significant differences among tested filtered water extracts and ionized calcium solution extracts of Gryllus bimaculatus based on ANOVA with Duncan’s multiple range test (p<0.05). Ascorbic acid (Vit. C) was used as a positive control in this assay.WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
2. 환원력 평가
Copper reduction assay는 환원제에 의해서 Cu2+을 Cu1+으로 환원되는 원리를 이용하여 항산화 활성을 측정하는 방법이다(Rhim TJ 등 2012). 환원력 측정은 항산화 활성과 밀접한 관련이 있는 항산화력 측정 방법으로 항산화 활성은 환원력에 의한 자유 라디칼 소거능으로 나타낸다(Siddhuraju P 등 2002). 항산화 물질의 환원제는 수소 원자를 제공하여 자유 라디칼 연쇄반응을 중단시킴으로써 환원력을 제공한다(Kumaran A & Karunakaran RJ 2007). 쌍별귀뚜라미 추출물들이 항산화 능력이 있는지 알아보기 위해 환원력을 측정하는 실험인 copper reduction assay를 실시하였다. 열수 추출 시 사용한 추출 용매를 증류수와 이온화 칼슘 수용액으로 하여 이들의 차이와 환원력을 평가하였다(Fig. 2). WEG와 IEG를 각각 10, 50, 100, 200 그리고 400 μg/mL의 농도로 하여 실험하였을 때, 증류수로 추출한 WEG는 3.54, 16.55, 31.22, 40.49 그리고 40.39 μM(copper(I) ion)이고 이온화 칼슘 수용액으로 추출한 IEG는 2.74, 13.55, 26.29, 41.46, 43.78 μM(copper(I) ion)으로 Cu2+을 Cu1+으로 환원하였다. 증류수로 추출한 WEG와 이온화 칼슘 수용액으로 추출한 IEG를 비교하였을 때, 추출 용매가 다르기 때문에 이온화 칼슘 수용액으로 추출한 IEG가 Cu2+을 Cu1+으로 환원시키는 환원력이 증류수로 추출한 WEG보다 더 높은 수준의 환원력을 나타냈다. 따라서 copper reduction assay는 추출 시 사용된 추출 용매가 이온화 칼슘 수용액일 때 Cu2+을 Cu1+으로 환원시키는 환원력이 더 높았고, WEG와 IEG 모두 농도 의존적으로 Cu2+을 Cu1+으로 환원시켰다. 양성대조군인 ascorbic acid는 10, 50, 100, 200 그리고 400 μg/mL의 농도에서 실험하였을 때 1.02, 2.97, 5.90, 12.13 그리고 23.57 μM(copper(I) ion)로 구리이온을 농도 의존적으로 환원시켰다. DPPH 라디칼 소거능과 마찬가지로 증류수와 이온화 칼슘 수용액으로 추출한 쌍별귀뚜라미의 항산화 활성에 대한 연구가 아직 미흡하다. 게다가 이온화 칼슘 수용액을 활용한 연구는 보고된 바 없다. 구리 환원력에 의한 항산화 반응은 수소 원자를 제공하는 유리라디칼의 연쇄반응으로 환원력의 세기가 높을수록 항산화 활성이 높다고 볼 수 있다(Sa YJ 등 2010). 이러한 결과는 쌍별귀뚜라미 추출물이 전자 및 수소의 전이 활성을 통해 자유 라디칼을 소거할 수 있다는 것을 의미하며 이는 천연 항산화 물질로서 활용될 전망이 크다.
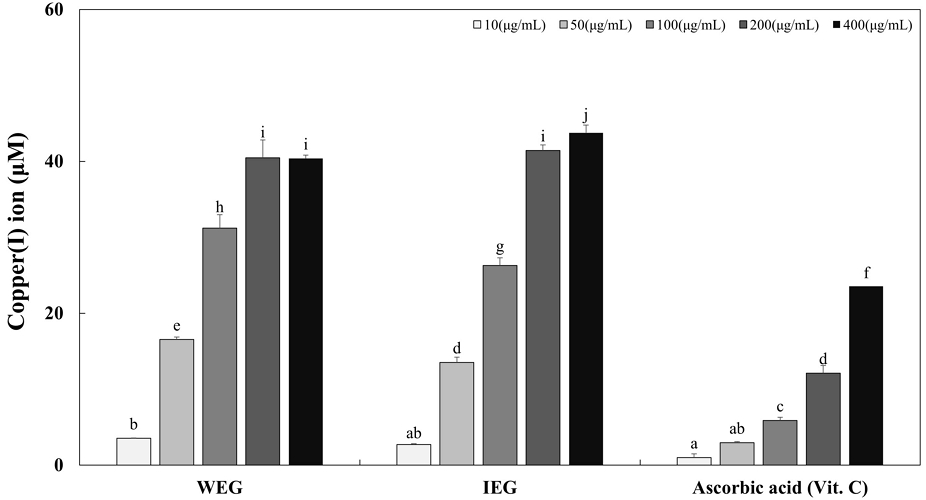
The reduction potential of Gryllus bimaculatus extracts.Corresponding letters indicate significant differences among tested filtered water extracts and ionized calcium solution extracts of Gryllus bimaculatus based on ANOVA with Duncan’s multiple range test (p<0.05). Ascorbic acid (Vit. C) was used as a positive control in this assay.WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
3. HepG2 세포에서의 쌍별귀뚜라미 추출물(WEG, IEG)의 세포 생존율 평가
쌍별귀뚜라미 추출물인 WEG와 IEG가 HepG2 세포에서 독성을 나타내는지 알아보기 위해 MTT assay를 실시하여 세포 생존율을 분석하였다(Fig. 3). 아무것도 처리하지 않은 대조군과 WEG와 IEG를 10, 50, 100, 200 그리고 400 μg/mL의 농도로 24 hr 처리하였을 때, WEG를 처리한 HepG2 세포의 생존율은 각각 107.55%, 105.27%, 99.51%, 105.15% 그리고 104.52%이고, IEG는 100.41%, 91.84%, 96.02%, 97.12% 그리고 107.52%였다. 결과적으로 400 μg/mL 이하의 농도에서 80% 이상의 세포 생존율을 나타냈으므로, 이후 실험에서는 200 μg/mL의 농도의 WEG와 IEG를 사용하였다.
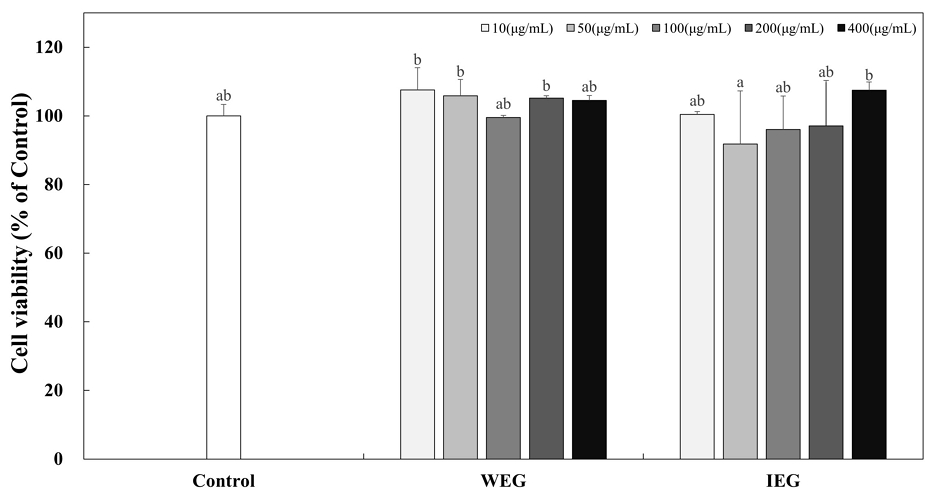
Effect of Gryllus bimaculatus extracts on the cell viability of HepG2 cells.Corresponding letters indicate significant differences between control and Gryllus bimaculatus extracts by ANOVA with Duncan’s multiple range test (p<0.05).WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
4. 에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물(WEG, IEG) 전처리의 간세포 보호 효과
에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물 전처리의 간세포 보호 효과를 알아보기 위해 HepG2 세포에 WEG와 IEG를 200 μg/mL의 농도로 24 hr 동안 전처리한 후 7.5%(v/v) 에탄올을 24 hr 동안 처리하여 세포 생존율을 확인하기 위해 MTT assay를 실시하였다(Fig. 4). 아무것도 처리하지 않은 대조군과 7.5%(v/v) 에탄올을 24 hr 처리하여 MTT assay를 실시하였을 때, 대조군 대비 7.5%(v/v) 에탄올 처리군에서 세포사멸이 일어났음을 확인할 수 있다. 또 7.5%(v/v) 에탄올을 24 hr 동안 처리한 그룹과 WEG와 IEG를 200 μg/mL를 전처리 후 7.5%(v/v) 에탄올을 처리한 그룹을 MTT assay를 실시했다. 7.5%(v/v) 에탄올 처리 그룹은 11.47%의 세포 생존율을 보였고, WEG와 IEG로 전처리하고 24 hr 후에 에탄올을 처리한 그룹은 20.35%와 27.86%의 세포 생존율을 나타냈다. 이러한 결과는 쌍별귀뚜라미 추출물은 간세포 보호 효과가 있음을 의미하고, 특히 이온화 칼슘 수용액으로 추출한 IEG를 전처리 했을 때, 간세포를 더 효과적으로 보호했음을 확인할 수 있었다. 이전의 연구에서 식용곤충인 갈색거저리 발효 추출물이 사염화탄소로 인해 낮아진 SOD, GSH-Px 및 GST 등의 항산화 효소를 활성화하여 간세포를 보호한다는 보고가 있었으며, 쌍별귀뚜라미 추출물 또한 이에 대한 추가 연구가 요구된다.
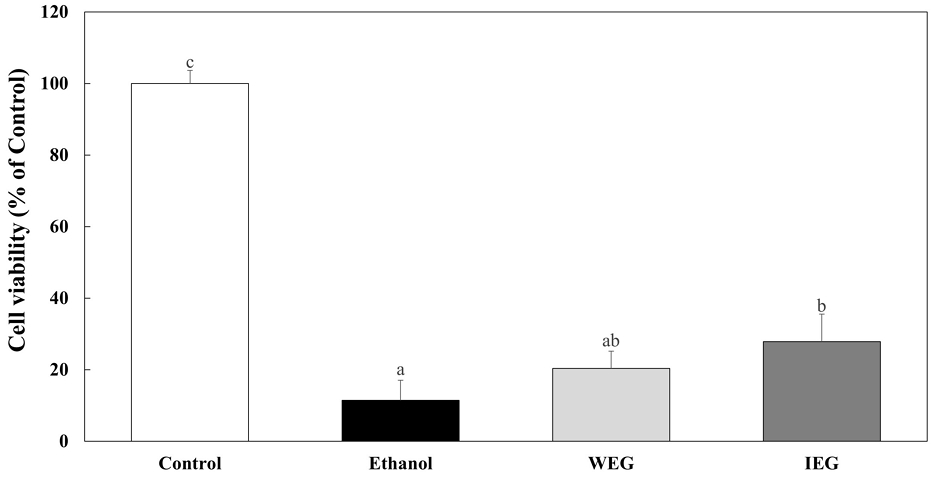
Effect of pre-treatment Gryllus bimaculatus extracts and ethanol on the cell viability of HepG2 cells.Corresponding letters indicate significant differences between control and Gryllus bimaculatus extracts by ANOVA with Duncan’s multiple range test (p<0.05).WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
5. HepG2 세포에서의 농도별 에탄올 처리에 대한 세포 생존율 평가
다양한 농도의 에탄올에 대한 세포 생존율을 확인하기 위해 HepG2 세포를 대상으로 MTT assay를 실시하였다(Fig. 5). 에탄올의 농도를 0%, 1%, 2.5%, 7.5% 그리고 10%(v/v)로 24 hr 처리하였을 때, HepG2 세포의 생존율은 각각 99.14%, 93.58%, 92.48%, 83.67% 그리고 4.68%였다. 2.5%, 7.5% 그리고 10%(v/v) 농도의 에탄올에서 유의적인 세포독성을 나타냈다. 따라서 추후 실험은 7.5%(v/v) 농도의 에탄올을 선택하여 사용하였다.
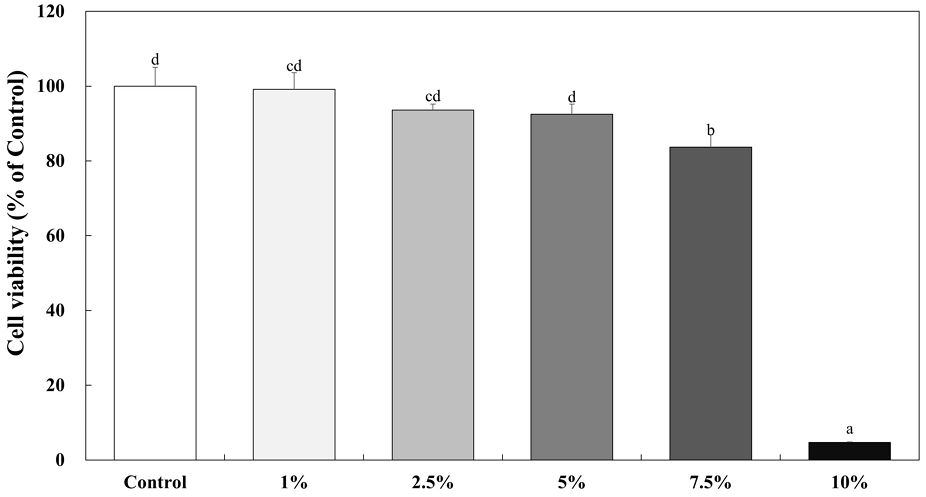
Effect of ethanol on the cell cytotoxicity of HepG2 cells.Corresponding letters indicate significant differences between control and ethanol treatment by ANOVA with Duncan’s multiple range test (p<0.05).WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
6. 에탄올로 유도한 HepG2 세포에서 쌍별귀뚜라미 추출물(WEG, IEG) 병행처리의 간세포 보호 효과
HepG2 세포에서 에탄올과 병행 처리한 쌍별귀뚜라미 추출물의 간세포 보호 효과를 알아보기 위해 HepG2 세포에 200 μg/mL의 농도의 WEG와 IEG와 7.5%(v/v) 에탄올을 24 hr 동안 처리하여 MTT assay를 실시하였다(Fig. 6). 아무것도 처리하지 않은 대조군과 7.5%(v/v) 에탄올만 24 hr 처리하여 MTT assay를 실시하였을 때 대조군 대비 7.5%(v/v) 에탄올 처리군에서 세포사멸이 일어났음을 확인할 수 있다. 또 7.5%(v/v) 에탄올만 24 hr 처리한 그룹과 200 μg/mL의 WEG와 IEG와 7.5%(v/v) 에탄올을 함께 처리한 그룹을 MTT assay를 실시하였다. 7.5%(v/v) 에탄올 처리 그룹은 53.17%의 세포 생존율을 보였고, WEG, IEG와 에탄올을 함께 처리한 그룹은 73.75%와 65.14%의 세포 생존율을 나타냈다. 선행연구(Sim Y 등 2020)에서 식용곤충인 갈색거저리와 동애 등에 유충 오일을 처리한 후 장내독소 및 염증인자인 TNF-α의 발현이 감소하였다고 보고되었으며, 쌍별귀뚜라미 분말과 분말 단백질 추출물의 발린, 루신, 이소루신 등의 아미노산 영양성분으로 인해 항산화 활성에 기여한다는 보고가 있었다(Kim SH 등 2020). 이러한 결과는 쌍별귀뚜라미 추출물과 에탄올을 동시 처리했을 때, 간세포 보호 효과가 있다는 것을 나타낸다. 또한 에탄올과 증류수로 추출한 WEG를 동시 처리했을 때, 에탄올만 처리한 군과의 유의적인 차이가 있음을 확인하였으므로 쌍별귀뚜라미 추출물은 간세포 보호에 효과가 있다고 사료된다.
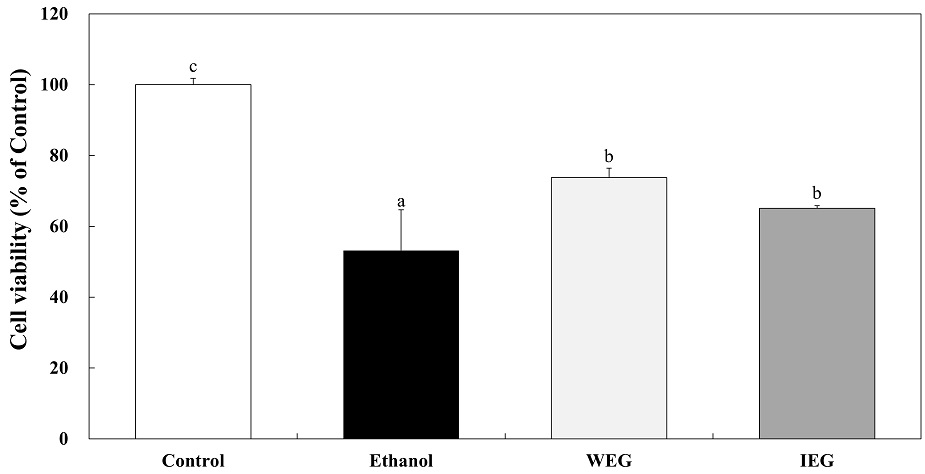
Effect of co-treatment Gryllus bimaculatus extracts and ethanol on the cell viability of HepG2 cells.Corresponding letters indicate significant differences between control and Gryllus bimaculatus extracts by ANOVA with Duncan’s multiple range test (p<0.05).WEG: Water extract of Gryllus bimaculatus, IEG: Ionized calcium water extract of Gryllus bimaculatus.
요 약
본 연구에서는 식용곤충 중 하나인 쌍별귀뚜라미를 이온화 칼슘수와 증류수로 추출하여 추출 용매에 따른 다양한 생리활성을 탐색하였다. 항산화 실험을 통해 이온화 칼슘수와 증류수로 추출한 쌍별귀뚜라미 추출물은 농도 의존적으로 항산화 활성을 나타냈다. 그리고 인간 간암 세포에서 쌍별귀뚜라미 추출물을 전처리하고 7.5%(v/v)의 에탄올을 처리했을 때 이온화 칼슘 수용액으로 추출한 IEG를 전처리 했을 때 간세포 보호효과를 확인할 수 있었다. 또한 쌍별귀뚜라미 추출물과 7.5%(v/v)의 에탄올을 동시 처리했을 때 증류수로 추출한 WEG는 7.5%(v/v) 에탄올만 처리한 군과의 유의적인 차이가 있음을 확인하였으므로 쌍별귀뚜라미 추출물은 간세포 보호에 효과가 있을 것으로 사료된다. 쌍별귀뚜라미 추출물은 항산화와 간 보호 효과의 건강기능식품 소재로써 활용될 수 있을 것으로 판단된다.
References
-
Abdalla AE, Roozen JP (1999) Effect of plant extracts on the oxidative stability of sunflower and emulsion. Food Chem 64(3): 323-329.
[https://doi.org/10.1016/S0308-8146(98)00112-5]

-
Allen LH (1982) Calcium bioavailability and absorption: A review. Am J Clin Nutr 35(4): 783-808.
[https://doi.org/10.1093/ajcn/35.4.783]

- Baek MH, Seo MC, Kim MA, Yun EY, Hwang JS (2017) The antioxidant activities and hair-growth promotion effects of Tenebrio molitor larvae extracts (TMEs). J Life Sci 27(11): 1269-1275.
-
Bukkens SGF (1997) The nutritional value of edible insects. Ecol Food Nutr 36(2-4): 287-319.
[https://doi.org/10.1080/03670244.1997.9991521]

-
Cho HT, Sim KS, Kim YA, Chang MH, Kim TW, Lee SH, Lee DH, Kim JH (2019) Anti-diabetic activity of edible insect Gryllus bimaculatus extracts in insulin-deficient diabetic mice. J Korean Soc Food Sci Nutr 48(10): 1165-1171.
[https://doi.org/10.3746/jkfn.2019.48.10.1165]

- Durst PB, Johnson DV, Leslie RN, Shono K (2010) Edible Forest Insects as Food: Human Bite Back. RAP Publication, Bangkok, Thailand, p 74.
-
Einhorn TA, Levine B, Michel P (1990) Nutrition and bone. Ortho Clin Nor Am 21(1): 43-50.
[https://doi.org/10.1016/S0030-5898(20)31564-9]

-
Godfray HCJ, Beddington JR, Crute IR, Haddad L, Lawrence D, Muir JF, Pretty J, Robinson S, Toulmin SMTC (2010) Food security: The challenge of feeding 9 billion people. Science 327(5967): 812-818.
[https://doi.org/10.1126/science.1185383]

- Huis A, Itterbeeck J, Klunder H, Mertens E, Halloran A, Muir G, Vantomme P (2013) Edible Insects Future Prospects for Food and Feed Security. FAO (Food and Agriculture Organization of the United Nations), Rome, Italy. p 59.
-
Kim DS, Shin KE, Lee W, Bae GK (2014) A study on the physicochemical and sensory characteristics of cod stock by hot water extraction time. Culi Sci & Hos Res 20(2): 89-99.
[https://doi.org/10.20878/cshr.2014.20.2.008]

-
Kim HM, Kim JN, Kim JS, Jeong MY, Yun EY, Hwang JS, Kim AJ (2015) Quality characteristics of patty prepared with mealworm powder. Korean J Food Nutr 28(5): 813-820.
[https://doi.org/10.9799/ksfan.2015.28.5.813]

- Kim HS, Yu CH (1997) The effect of calcium supplementation on the metabolism of sodium and potassium and blood pressure in college woman. Korean J Nutr 30(1): 32-39.
-
Kim SH, Kim YK, Han JS (2020) Antioxidant activities and nutritional components of cricket (Gryllus bimaculatus) powder and protein extract. Asian J Beauty Cosmetol 18(2): 163-172.
[https://doi.org/10.20402/ajbc.2020.0016]

-
Kumaran A, Karunakaran RJ (2007) In vitro antioxidant activities of methanol extracts of five Phyllanthus species from India. LWT-Food Sci Technol 40(2): 344-352.
[https://doi.org/10.1016/j.lwt.2005.09.011]

-
Lee EA, Kwon OS (2013) The effect of invasive cricket species, Gryllus bimaculatus on the survival of Korean cricket species, Teleogryllus emma. Korean J Ecology and Environment 46(1): 67-74.
[https://doi.org/10.11614/KSL.2013.46.1.067]

-
Lee JA, Kim AJ (2019) Safety and nutritional evaluation of Gryllus bimaculatus according to pre-treatments. J Korean Soc Food Sci Nutr 48(6): 640-648.
[https://doi.org/10.3746/jkfn.2019.48.6.640]

-
Lee JH, Lee JY, Whang JB, Nam JS, Han HK, Kim SM, Im JY, Choi YM, Kim HR, Kim SN (2016) Changes in food composition of Tenebrio molitor by life stage. Korean J Food Cook Sci 32(5): 656-663.
[https://doi.org/10.9724/kfcs.2016.32.5.656]

- Lee SK, Park JH (2002) Studies of egg-shell calcium(I)-The effects of elution condition of egg-shell calcium on elution quantity and ionization rate. J Food Hyg Saf 17(4): 183-187.
-
Matkovic V, Ilich JZ (1993) Calcium requirements for growth are current recommendations adequate. Nutr Rev 51(6): 171-180.
[https://doi.org/10.1111/j.1753-4887.1993.tb03097.x]

- Ministry of Food and Drug Safety (MFDS) (2021) Korea Food Code. https://www.mfds.go.kr/index.do, (accessed on 12. 4. 2023).
- Ministry of Health and Welfare (MOHW) (1999) Report on 1998 National Health and Nutrition Survey. Ministry of Health and Welfare, Seoul, Korea.
- National Institutes of Health (NIH) (1994) Optimal calcium intake. NIH Consens Statement 12(4): 1-31.
-
Park KH, Kim GY (2018) Quality and characteristics of manufacturing sunsik with edible insect (mealworm). Culi Sci & Hos Res 24(1): 13-23.
[https://doi.org/10.20878/cshr.2018.24.1.002]

- Park KT (2001) Insect Resources. World Science Publishing Company, Seoul, Korea. p 202.
- Pemberton RW (1988) The use of the thai giant waterbug, Lathocerus indicus (Hemipetera: Belostomatidae) as human food in California. Pan-Pac Entomol 64(1): 81-82.
-
Rhim TJ, Choi MY, Park HJ (2012) Antioxidative activity of Rumex crispus L. extract. Korean J Plant Res 25(5): 568-577.
[https://doi.org/10.7732/kjpr.2012.25.5.568]

- Sa YJ, Kim JS, Kim MO, Jeong HJ, Yu CY, Park DS, Kim MJ (2010) Comparative study of electron donating ability, reducing power, antimicrobial activity and inhibition of α-glucosidase by Sorghum bicolor extracts. Korean J Food Sci Technol 42(5): 598-604.
-
Sentipal JM, Wardlaw GM, Mahan J, Matkovic V (1991) Influence of calcium intake and growth indexes on vertebral bone mineral density young females. Am J Clin Nutr 54(2): 425-428.
[https://doi.org/10.1093/ajcn/54.2.425]

-
Siddhuraju P, Mohan PS, Becker K (2002) Studies on the antioxidant activity of Indian Laburnum (Cassia fistula L.): A preliminary assessment of crude extracts from stem bark, leaves, flowers, and fruit pulp. Food Chem 79(1): 61-67.
[https://doi.org/10.1016/S0308-8146(02)00179-6]

-
Sim Y, Kim D, Pyo SJ, Sohn HY, Jung C, Kim DK, Cho YE (2020) Oils from Tenebrio molitor and Hermetia illucens prevent binge alcohol-induced gut leakiness and hepatic inflammation. J Korean Soc Food Sci Nutr 49(11): 1175-1183.
[https://doi.org/10.3746/jkfn.2020.49.11.1175]

- Tomas W (2016) Insects as Food: Market Potential, Short Course & Workshop on Insect and Food and Feed. Kasetsart Univ., Bangkok.
