교반 및 초음파 추출에 따른 그물버섯의 생리 활성
 ; Kyung Ah Kim1
; Kyung Ah Kim1 ; Hajeong Kim2
; Hajeong Kim2 ; Yeeun Hong2
; Yeeun Hong2 ; Yugeong Jang2
; Yugeong Jang2 ; Yujeong Kim2
; Yujeong Kim2 ; Inhwa Han1, †
; Inhwa Han1, †
Abstract
This study examined the antioxidant and anti-inflammatory activities and the effects on cell viability of 80% ethanol extracts of cep mushroom (Boletus edulis), extracted using two different methods, stirring and ultrasound. Total phenolic and flavonoid contents and DPPH radical scavenging activities increased with increasing concentrations of the extracts. Total phenolic contents showed no significant difference between the extraction methods, but flavonoid contents of the extracts were higher in the extracts obtained by stirring. Conversely, the DPPH radical scavenging activities were higher in the ultrasound extracts. A dose-dependent reduciton in Cox-2 protein expression was determined in cells exposed to the ultrasound extracts, implying higher anti-inflammatory activity. Cell viabilities of Raw 264.7 macrophage cells treated with the extracts were obtained in the range of 82∼102% up to 400 μg/mL. However, the cell viability reduced to less than 70% after treatment with 800 μg/mL extracts. The cell viability results were similar for both extraction methods. Taken together, our results indicate that cep mushrooms possess these health-promoting effects and a suitable extraction method can be chosen to promote the physiological activity of cep mushrooms.
Keywords:
cep mushroom, Boletus edulis, antioxidant activity, anti-inflammatory activity, cell viability서 론
식생활이 서구화됨에 따라 나타나는 고지혈증, 고혈압, 당뇨병과 같은 생활습관병을 예방하기 위한 다양한 기능성 식품에 대한 소비가 늘고 있는데, 그 중 하나가 버섯이다. 버섯의 소비량은 2015년 464톤에서 2019년 985톤으로 2배 가까이 증가하였고, 2018년에 수입산 버섯의 소비량은 전체소비량의 14% 정도를 차지했다(KOSIS 2019). 식용버섯은 특유의 향과 맛을 가지며 높은 영양가에 비해 낮은 에너지 함량을 가진 우수한 식재료로 세계적으로 널리 이용되고 있고, 대부분 버섯의 자실체를 식용하며 땅 속 부분인 균사체는 버려진다(Falandysz J 2022). 식용이 가능한 버섯 중에서 혈행 개선 효과를 나타내는 영지버섯, 면역기능 개선 효과를 나타내는 상황버섯, 배변활동을 원활하게 하는 효과를 나타내는 목이버섯 식이섬유 등이 고시형 기능성 식품으로 인정받았다(KFDA 2021). 느타리버섯, 표고버섯 등도 항산화 효과 등 다양한 기능성에 대한 연구가 활발히 이루어지고 있다. 표고버섯 균사체의 면역증진 효과(Kang SJ 등 2022), 항염증 효과(Song CY 등 2022) 등이 보고되었으며, 느타리 버섯의 경우에도 항산화 활성(Park SH 등 2020), 혈당 상승 억제 효과(Bae SM 등 2016), 항암 활성(Choi HY & Ryu HS 2015) 등이 보고되었다. 또한 이러한 기능성을 가진 버섯을 첨가한 새로운 식품의 개발이 활발히 이루어지고 있는데, 분말이나 추출물의 형태로 표고버섯을 첨가한 양갱(Yun SW 등 2020), 파운드케이크(Lee KH 등 2021), 머핀(Kong CS 등 2019) 등이 보고되었다.
그물버섯(Boletus edulis)은 cep, porcini, penny bun 등의 이름으로 알려져 있으며, 외국에서는 잘 알려진 식용버섯으로(Tan Y 등 2022) 그물버섯의 자실체는 빵(bun) 모양의 갈색 머리와 연한 노란색(pale yellow) 대로 구성되어 있다. 그물버섯은 단백질, 불포화지방산, 무기질뿐만 아니라, 토코페롤 및 아스코르브산과 같은 비타민도 풍부하다(Song S 등 2023). 그물버섯이라는 이름을 가진 다양한 버섯이 알려져 있고, 국내에는 황소비단 그물버섯(Suillus bovinus)(Park YW 등 2020), 암갈색그물버섯(Boletus umbriniporus)(Lee YJ 등 2015), 젖비단 그물버섯(Suillus granulatus)(Kang HC 등 2001)의 생태 환경, 인공 재배 환경, 화학적 구성성분 등에 대한 연구가 보고되었으며, 기능성 연구로는 야생 버섯인 제주쓴맛 그물버섯(Tylopilus neofelleus) 메탄올 추출물이 147.2%의 높은 세포생존율을 보이고 NO 저해 효과를 보여 다른 야생 버섯에 비해 우수한 항염 효과를 보인 연구 결과(Noh HJ 등 2011)가 보고되었다.
그물버섯에 대한 연구로는 시중에서 구입한 그물버섯을 포함한 다양한 식용버섯의 메탄올 추출물에 대하여 기능성을 조사한 연구가 보고되었는데, 그물버섯의 DPPH 라디칼 소거 활성이 동충하초, 영지버섯 등 약용버섯에 비해서는 낮은 활성을 나타내었으나, 목이버섯, 느타리버섯에 비해서는 높은 소거 활성을 나타내었고, 인간 유래의 histiocytic leukemia에 대한 세포증식 억제 효과도 동충하초, 영지버섯에 비해 낮았으나, 목이버섯, 느타리버섯에 비하여 높게 나타나(Kim HJ 등 2005) 기능성을 가진 버섯의 가능성을 나타내었다.
식품의 기능성 향상을 위해 용매 추출과정에서 초음파를 적용한 연구가 보고되었는데, 초음파를 적용한 추출은 물질 이동 비율(mass transfer rate)과 수율을 증진시키며(Rokhina EV 등 2009), 세포벽의 파괴와 입자 크기를 감소시키는 효과를 통해 물질의 이동을 촉진할 수 있다(Shirsath SR 등 2012). 인도먹구슬나무(neem) 잎으로부터 페놀화합물 추출 시 초음파 추출이 교반 추출에 비해 더 높은 수율을 보였으며(Shewale SP 등 2022), 사과 껍질에서도 초음파 적용에 의해 플라보노이드 추출이 향상되었다고 보고되었다(Park NY 등 2022).
본 연구에서는 아직 국내에서 활발히 이용되고 있지 않은 그물버섯의 기능성에 대하여 알아보고, 추출 효과를 높이기 위해 초음파를 적용하여 추출 방법에 따른 차이를 확인하고자 한다. 식품 추출액의 수율을 높이기 위해 초음파 추출 방법은 다양한 식물성 식품에 적용되고 있는데(Park NY 등 2022), 그물버섯에 대한 연구는 매우 미흡한 실정이다. 이에 교반과 초음파를 각각 적용하여 그물버섯을 추출하고, 항산화와 항염 효과 및 세포독성 등이 추출 방법에 의해 영향을 받는지를 조사하여 더 우수한 효과를 나타내는 추출 방법을 조사하고자 하였다.
재료 및 방법
1. 그물버섯 추출액 제조
그물버섯은 건조 상태로 프랑스에서 수입된 제품(Borde, France)을 시중에서 구입하고 분말화하여 사용하였다. 80% ethanol 추출물이 물 추출물에 비해 높은 페놀화합물, 플라보노이드 함량과 항산화 효과를 나타내었다는 보고에 따라(Kim HJ 등 2015) 그물버섯 분말을 80% ethanol을 추출 용매로 하여 2가지 방법으로 추출하였다. 300 rpm에서 30분간 교반한 후 여과하여 여과액을 수집하는 과정을 3번 반복하여 교반 추출액을 준비하였고, 40 KHz 초음파기(DH.WUC. A03H, Daihan Scientific Co., Wonju, Korea)에서 15분간 처리한 후 여과하여 수집하는 과정을 3번 반복하여 초음파 추출액을 준비하였다. 추출액의 농도는 100 mg/mL로 맞추어 —20℃에서 보관하면서 생리활성 분석에 사용하였다.
2. 세포 배양
세포를 이용하는 실험은 Raw 264.7 대식세포를 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. 세포는 10% heat inactivated fetal bovine serum과 1% penicillin-streptomycin 용액, Dulbecco’s modified eagle 배지를 사용하여 37℃로 유지된 5% CO2 incubator에서 배양하였다. 배양용 플라스크에서 Raw 264.7 세포를 배양하고, 약 80% 이상 밀집하면 부착된 세포를 떼어낸 후 실험에 사용하였다.
3. 총 페놀 함량 측정
교반 추출 또는 초음파 추출로 준비된 그물버섯 추출액을 각각 1/2로 희석한 후 원액과 1/2 희석액에 대하여 총 페놀 함량을 측정하였다. 각 추출액의 총 페놀 함량은 Folin-Ciocalteu 방법을 변형하여 측정하였다(Kim HJ 등 2015). 추출액 0.1 mL를 2% Na2CO3 용액 10 mL와 충분히 혼합하고, 2분 후 50% Folin-Ciocalteu's 시약 0.1 mL를 추가하여 잘 섞어준 후 상온에서 30분 반응시킨 후 750 nm에서 흡광도를 측정하였다. 항산화, 항암 등 우수한 기능성을 가지 페놀화합물인 Ferulic acid(Tuli HS 등 2022)를 표준물질로 사용하여 μg Ferulic Acid Equivalent(FAE)/mL로 표시하였다.
4. 플라보노이드 함량 측정
그물버섯 추출액과 1/2로 희석한 추출액에 대하여 플라보노이드 함량을 측정하였다. 플라보노이드 함량은 그물버섯 추출액 0.2 mL를 diethylene glycol 2 mL, 1 N NaOH 0.2 mL와 잘 섞어 37℃의 water bath(B-491, Buchi labortechnik AG, Switzerland)에서 1시간 동안 반응을 진행시킨 후, 420 nm에서 흡광도를 측정하였다(NFRI 1990). 표준물질로 quercetin을 사용하여 μg QE/mL로 나타내었다.
5. DPPH 라디칼 소거 활성
그물버섯 추출액의 항산화 활성은 Blois MS(1958)의 방법을 변형한 2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거 활성법을 이용하여 측정하였다. 흡광도가 표준 검량 곡선의 범위에 포함되도록 추출액을 1/10, 1/20로 희석하여 실험하였다. 각 추출액 0.5 mL에 0.4 mM DPPH 용액 5 mL를 가하여 30분간 암실에 방치한 다음 517 nm에서 흡광도를 측정하였다. Trolox((±)-6-hydroxy-2,5,7,8-tetramethylchromane–2-carboxylic acid)를 표준 물질로 사용하여 μg Trolox Equivalent Antioxidant Capacity(TEAC)/mL로 표시하였다.
6. 항염증 활성
함염증 활성은 western blot으로 cyclooxygenase(Cox)-2의 활성을 측정하였다. Raw 264.7 대식세포를 6-well plate에서 16시간 동안 배양하고 그물버섯 추출물을 농도별(100, 200 μg/mL)로 희석한 후 세포를 각 추출물로 처리하였다. 24시간 후 LPS를 1 μg/mL 농도로 24시간 처리해준 후 PBS로 2번 세척해 주었다. Protease inhibitor(Roche, Mannheim, Germany)와 phosphatase inhibitor(Roche, Mannheim, Germany)가 포함된 lysis buffer(Thermo Fisher Scientific, Rockford, IL, USA)로 세포를 용해한 후 원심분리하여 단백질을 분리하였다. Bradford reagent를 사용하여 단백질을 정량한 후 30 μg의 단백질을 10% polyacrylamide gel에서 SDS-PAGE로 전기영동하였다. 분리된 단백질은 PVDF(polyvinylidene difluoride) membrane을 통해 5% skim milk를 첨가한 TBS(0.05% tween 20)에 옮겨 상온에서 1시간 동안 방치하였다. Cox-2의 발현량 확인을 위해 1차 항체로 anti-rabbit Cox-2(Cell Signaling Technology, Beverly, MA, USA)를 1/1,000로 희석하여 4℃에서 12시간 반응한 후 tris buffered saline Tween-20(TBS-T)으로 5분간 3회 세척하였다. 2차 항체는 horseradish peroxidase가 결합된 anti-rabbit IgG(Cell Signaling Technology)를 1/2,000로 희석하여 상온에서 1시간 반응시킨 뒤 TBS-T로 5분간 3회 세척하였다. 이후 membrane에 Ez WestLumi-plus(ATTO, Tokyo, Japan)를 처리하여 Chemi-doc(LuminoGraphⅡ, ATTO Co., Tokyo, Japan)을 사용해 단백질을 가시화하고, CS Analyzer 4(ATTO Co.)로 Cox-2와 β-actin 단백질 밴드를 정량하였다. Cox-2 단백질량은 β-actin 단백질량에 대한 백분율(%)로 나타내었다.
7. 세포 생존율
그물버섯의 세포 생존율에 대한 영향을 알아보기 위하여 WST assay를 이용하였다. Raw 264.7 대식세포를 2×105 cells/mL의 농도로 96 well plate에 100 μL씩 분주하여 37℃로 유지된 5% CO2 incubator에서 16시간 배양하였다. 추출액을 0.25 μm 필터로 여과시키고, 농도별(0, 100, 200, 400, 800 μg/mL)로 희석하여 세포에 추출액을 처리하였다. Raw 264.7 대식세포 생존율은 EZ-Cytox 키트를 이용하여 측정하였다. 24시간 동안 농도별로 추출물 처리한 세포에 LPS 1 μg/mL를 넣고 24시간 후, EZ-Cytox 키트의 manual에 따라 용액을 첨가하고, 3시간 배양 후에 450 nm에서 흡광도를 측정하였다. 세포 생존율은 그물버섯 추출액을 처리하지 않은 세포군(대조군)과 추출액 처리군의 비율을 백분율로 계산하였다.
8. 통계 처리
모든 실험 결과는 2회 이상 반복하여 그 값을 평균±표준편차로 표시하였으며, SPSS 26.0(IBM Corp., Armonk, NY, USA)을 이용하여 ANOVA로 분석한 뒤 p<0.05 수준에서 Duncan’s multiple range test로 차이를 검증하였다.
결과 및 고찰
1. 총 페놀 함량 측정
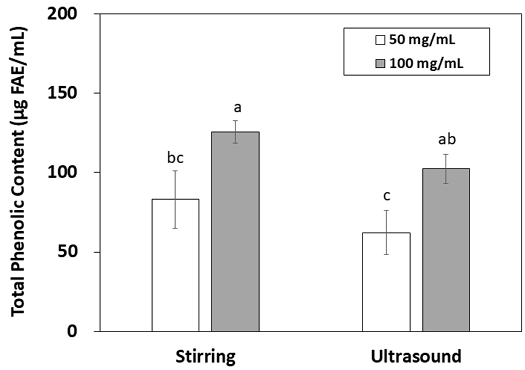
그물버섯을 교반과 초음파를 각각 적용하여 80% ethanol로 추출하여 측정한 총 페놀 함량은 Fig. 1과 같다. 총 페놀함량은 추출액의 농도가 증가함에 따라 교반과 초음파 추출 모두 증가하는 경향을 보였다. 교반 추출액은 100 mg/mL 농도에서 125.70 μg FAE/mL의 총 페놀 함량을 나타내었고, 초음파 방법은 같은 농도에서 102.37 μg FAE/mL를 나타내어 수치상으로 교반 방법이 초음파 방법에 비해 높은 총 페놀함량을 나타내었으나, 추출 방법에 따른 유의적인 차이는 나타나지 않았다(p>0.05). 페놀화합물은 식물성 식품에 포함되어 있는 대표적인 기능성 성분으로 항산화 효과뿐만 아니라, 당뇨병, 고혈압 등 심혈관 질환 등에 대해 유익한 효과를 나타내는 것으로 알려져 있다(Park HJ 등 2012). 식용 버섯에도 다양한 페놀 화합물이 포함되어 있다고 보고되었는데, 그물버섯에서도 양의 차이는 있으나 25가지 이상의 페놀 화합물이 존재한다고 알려졌다(Tan Y 등 2022). 루마니아에서 채취된 그물버섯 연구에서 4-hydroxybenzoic acid, cinnamic acid 등이 가장 많은 양을 차지하는 페놀 화합물로 보고되었으며(Fogarasi M 등 2018), 프랑스에서 채취된 그물버섯에서는 4-hydroxybenzoic acid, cinnamic acid, protocatechuic acid 등이 보고되었고 총 페놀화합물 함량은 28.56 mg GAE/g extract라고 보고하였다(Heleno SA 등 2011). 추출 용매나 추출 방법에 따라서 이러한 페놀화합물의 추출 수율이 영향을 받을 수 있는데, 그물버섯의 페놀화합물은 메탄올(18.96 mg gallic acid/g extract)이나 열수(17.22 mg gallic acid/g extract)에 의한 추출보다 에탄올에 의한 추출이 21.32 mg gallic acid/g extract로 더 높은 추출 수율을 나타내었다(Vamanu E & Nita S 2013). 추출 방법에서는 비비추속(genus Hosta)의 페놀화합물 추출 시 ultrasound와 reflux 추출 방법 사이에 유의적 차이가 없다고 보고되어(He J 등 2020) 본 연구 결과와 유사하였다.
2. 플라보노이드 함량 측정
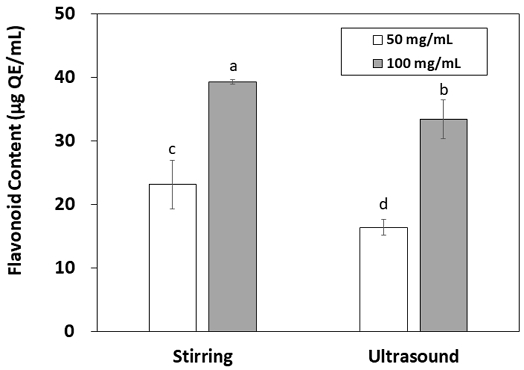
그물버섯 80% ethanol 추출액의 플라보노이드 함량은 Fig. 2와 같다. 플라보노이드는 flavones, isoflavones 등의 화합물을 포함하는 페놀화합물의 속하는 물질로(Pandey KB & Rizvi SI 2009) 총 페놀 함량과 마찬가지로 농도 증가에 따라 유의적으로 증가하였다(p<0.05). 플라보노이드도 항산화 효과뿐만 아니라, 항균, 항염, 면역증강 등의 효과가 있다고 알려져 있으며(Rice-Evans CA 등 1995; Park SY 등 2012), 식물체의 대표적인 색소화합물로 당과 결합한 배당체가 주 형태이다(Tsao R 2010). 총 페놀 함량의 경우, 추출 방법에 따른 유의적인 차이가 나타나지 않았으나(p>0.05), 플라보노이드 함량은 두 농도 모두 교반 추출에서 유의적으로 더 높은 값을 나타내었다(p<0.05). 교반 추출액은 100 mg/mL 농도에서 39.31 μg QE/mL, 초음파 추출액은 33.43 μg QE/mL의 플라보노이드 농도를 나타내었다. 루마니아에서 채취된 그물버섯에서 catechin, gallocatechin이 주요 플라보노이드로 보고되었으며(Fogarasi M 등 2018), 플라보노이드에 속하는 안토시아닌 함량이 에탄올을 추출 용매로 사용 시 16.99 mg/100 g으로 메탄올(11.98 mg/100 g), 열수(10.49 mg/100 g)에 비해 높게 나타났다(Vamanu E & Nita S 2013). Myricetin, rutium quercetin도 그물버섯에 존재하는 플라보노이드이다(Tan Y 등 2022). 추출 방법의 적용에 있어서는 시료에 따른 결과 차이를 보였는데, 비비추속(genus Hosta)의 플라보노이드 추출 수율는 ultrasound와 reflux 추출 방법 사이에 유의적 차이가 없었고(He J 등 2020), 70% 에탄올로 땅콩 껍질에서 플라보노이드를 추출 시 초음파를 적용하여 추출하였을 때 Soxhlet 또는 heat reflux를 적용한 추출보다 플라보노이드의 함량이 증가하였다(Liao J 등 2021). 본 연구에서 그물버섯은 교반 추출법이 초음파 추출법보다 높은 플라보노이드 함량을 보여 그물버섯의 플라보노이드는 교반 추출법에 의해 더 효과적으로 추출될 수 있음을 보여준다.
3. DPPH 라디칼 소거 활성
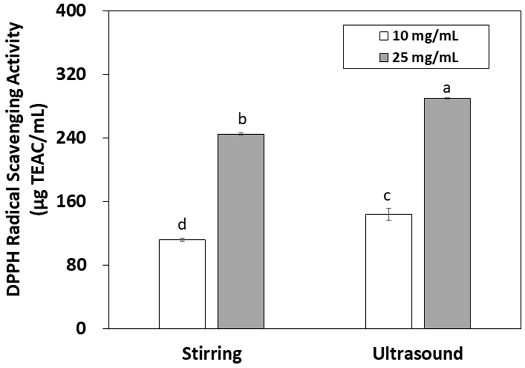
그물버섯 80% 에탄올 추출액의 DPPH 라디칼 소거 활성은 Fig. 3과 같다. 그물버섯 추출액의 라디칼 소거 활성도 총페놀 및 플라본이드 함량과 마찬가지로 농도에 따라 증가하는 경향을 나타내었다. DPPH 라디칼 소거 활성은 항산화 효과를 가진 물질이 DPPH 라디칼에 전자를 공여하여 환원시키는 능력을 측정하는 방법으로(Park HJ & Lee KY 2013) 그물버섯 추출액이 전자 공여 기작을 통해 항산화 효과를 나타낼 수 있음을 알 수 있다. 추출 방법에 따라서는 플라보노이드 함량과 달리 초음파 추출액이 25 mg/mL 농도에서 289.83 μg TEAC/mL, 교반 추출액이 245.03 μg TEAC/mL의 DPPH 라디칼 소거 활성을 나타내어 초음파 추출액이 유의적으로 더 높게 나타났다(p<0.05). 추출액 10 mg/mL 농도에서도 초음파 추출액의 라디칼 소거 활성이 더 높게 나타났다(p<0.05). 라디칼 소거활성을 나타내는 대표적인 물질은 플라보노이드를 포함하는 페놀화합물로 그물버섯의 경우 catechin, gallocatechin, myricetin, rutium quercetin 등의 플라보노이드(Fogarasi M 등 2018; Tan Y 등 2022)와 4-hydroxybenzoic acid, cinnamic acid, protocatechuic acid 등의 페놀화합물(Fogarasi M 등 2018; Heleno SA 등 2011)이 소거활성을 나타내는 것으로 보인다. 그러나 총 페놀이나 플라보노이드 함량 결과와 달리 초음파 추출액의 라디칼 소거 활성이 더 높게 나타난 결과는 그물버섯 추출액의 항산화 효과를 나타내는 성분으로 페놀화합물 외에 다른 물질이 존재함을 의미한다. 그물버섯의 경우, tocopherol, 비타민 C, polysaccharides의 함량이 높은데(Tan Y 등 2022), tocopherol과 비타민 C는 항산화 활성을 가진 비타민이며(Rhi JW & Shin HS 1996), 그물버섯에 존재하는 polysaccharides에 대한 황산화 활성도 보고되었다. 그물버섯으로부터 열수 추출한 polysaccharides의 농도가 증가할수록 superoxide 라디칼 소거 활성, 금속 chelating 활성 등이 증가하여(Zhang A 등 2011) 항산화 효과가 있음을 알 수 있다. 본 연구 결과에서 초음파 추출이 플라보노이드를 포함한 페놀 화합물과 polysaccharides 등 항산화물질의 추출로 인해 더 높은 라디칼 소거능을 나타낸 것으로 사료된다.
4. 항염증 활성
LPS를 처리하여 염증을 유도한 Raw 264.7 세포의 Cox-2 단백질의 발현 정도를 조사하여 그물버섯 80% 에탄올 추출액의 항염증 효과를 알아보고, 그 결과를 Fig. 4에 나타내었다. LPS는 그람음성균 세포막에 존재하는 물질로 염증 과정에서 Cox-2 단백질의 발현을 유도한다(Guzik TJ 등 2003). Cox-2는 염증 과정에서 자극이 주어지면 prostaglandin E2의 생성을 촉진하는 효소로 작용하므로 Cox-2 단백질의 발현 정도는 항염증 효과를 측정하는 지표로 사용된다(de Souza G 등 2021). Raw 264.7 세포에서 발현된 Cox-2 단백질을 western-blot으로 분리하여 정량한 결과, LPS를 처리하지 않은 세포에서는 발현되지 않았으며, 200 μg/mL 초음파 추출액에서 발현이 현저히 저하되었음이 관찰되었다(Fig. 4A). 발현된 Cox-2 단백질을 β–actin에 대한 %로 나타낸 결과, 교반 추출액은 100 μg/mL와 200 μg/mL 농도에서 유의적인 차이를 나타내지 않았으나(p<0.05), 초음파 추출액은 각각의 농도에서 94%, 62%를 나타내어 농도 증가에 따라 Cox-2 단백질의 발현이 감소하였다(p>0.05) (Fig. 4B). Cox-2 단백질의 발현 감소는 염증의 감소를 의미하므로 초음파 추출액의 경우 농도 증가에 따라 항염증 효과가 증가함을 보여준다. 따라서 교반 추출액에 비해 초음파 추출액의 항염증 효과가 더 높음을 보여준다.
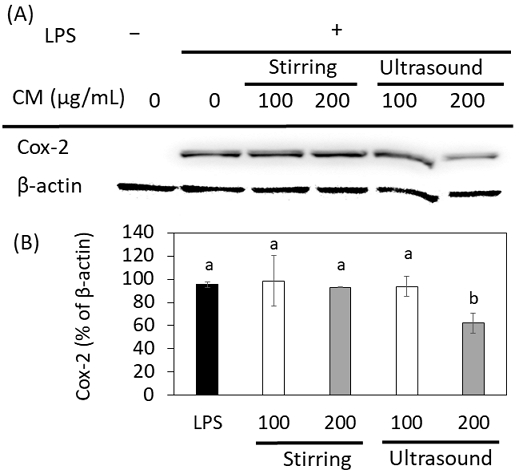
Cox-2 protein expression of Raw 264.7 macrophage cells treated with two different concentrations of 80% ethanol extracts of cep mushrooms (Boletus edulis) extracted with stirring or ultrasound.Values were expressed in mean±S.D. and they with a same letter are not significantly different by Duncan’s multiple range test at p<0.05.
Cox-2는 항염증 효과를 측정하기 위한 지표인자로 잘 알려져 있으나, 최근 연구에서 Cox-2의 overexpression이 림프 노드의 전이(lymph node metastases) 및 초기 암과도 관련성이 보고되었다(Triki M 등 2020). 따라서 Cox-2 단백질 발현 억제 효과는 항염증 효과뿐만 아니라, 항암 효과에 대한 가능성까지 제시하고 있다. 그물 버섯의 초음파 추출액은 농도 증가에 저해 효과의 증가를 보여 주어 그물버섯이 항염증 효과를 가지고 있음을 보여주었고, 항암 효과에 대한 가능성도 기대할 수 있을 것이다.
5. 세포 생존율
그물버섯 80% 에탄올 추출액 처리 시 Raw 264.7 대식세포의 생존율은 Fig. 5와 같다. 그물버섯 추출액을 100∼800 μg/mL의 농도 범위로 처리하였을 때 2가지 추출액 모두 200 μg/mL까지는 증가하고, 이후 감소하는 경향을 나타내었다. 가장 높은 생존율은 200 μg/mL에서 교반 추출물은 99.33%, 초음파 추출물은 102.92%로 나타났으나, 100, 200, 400 μg/mL에서 유의적인 차이는 나타나지 않았고(p>0.05), 2가지 추출 방법 모두 200, 400 μg/mL에 비해 800 μg/mL 처리 시 유의적으로 감소하였다(p<0.05). 이 중 100 μg/mL 초음파 추출물을 제외하고는 86% 이상의 생존율을 나타내었는데, 세포생존율이 85% 이상인 경우 세포 독성을 가지지 않는 것으로 판정되므로(Sandoval-Sicairos ES 등 2021) 본 실험 결과 그물버섯 추출액이 세포의 생존율을 유지하거나 높이는 효과를 가지나, 높은 농도에서는 오히려 독성을 나타낼 수 있음을 보여준다. 추출 방법에 따라서는 교반과 초음파 추출 사이에 유의적인 차이는 없었다(p>0.05). 그물버섯은 H2O2 처리된 Chinese Hamster V79 세포에 대해 동충하초에 비해서는 낮으나 영지버섯과 유사한 수준의 세포 생존율을 나타내었다(Kim HJ 등 2005). 이러한 연구 결과는 그물버섯이 적절한 농도의 그물버섯 처리 시 세포생존율을 높임을 보여준다. 대식세포는 면역 체계에서 체내로 침입하는 병원균을 막아주는 1차 방어선으로 작용하므로(Mun SK 등 2020) 대식세포의 세포 생존율 증가는 면역 기능의 향상으로 이어질 수 있다. 그러나 너무 많은 대식세포의 발현은 NO, prostaglandin E2, cytokine과 같은 염증 물질의 과다 생성으로 uncontrolled inflammation이 될 수 있다(Lim EH 등 2022). 본 연구 결과는 추출방법에 따른 유의적인 차이는 없었으나 그물버섯 추출액이 대식세포에 대해 세포 독성을 나타내지 않고, 대식세포의 활성을 유지할 수 있고, 더 나아가 면역기능에 도움을 줄 수 있음을 보여주었다.
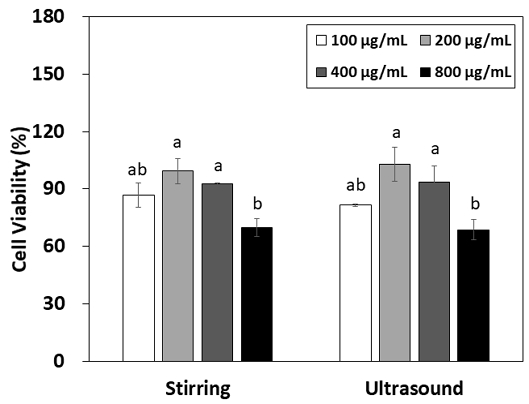
Cell viability of Raw 264.7 macrophage cells treated with various concentrations of 80% ethanol extracts of cep mushrooms (Boletus edulis) extracted with stirring or ultrasound.All values were expressed in mean±S.D. and they with a same letter are not significantly different by Duncan’s multiple range test at p<0.05.
요 약
본 연구는 80% ethanol을 용매로 하여 교반 추출과 초음파 추출의 2가지 방법을 적용한 그물버섯 추출액의 항산화와 항염 효과 및 세포생존율을 측정하여 기능성 식품으로서의 가능성을 확인하고, 추출 방법에 따른 기능성의 차이를 알아보고자 하였다. 총 페놀, 플라보노이드 함량과 DPPH 라디칼 소거 활성은 그물버섯의 농도가 증가함에 따라 증가하는 경향을 나타내었다. 추출 방법에 따라서는 총 페놀 함량은 유의적인 차이를 나타내지 않았으나, 플라보노이드 함량은 초음파 추출에 비해 교반 추출을 적용한 그물버섯 추출물이 높게 나타났고, DPPH 라디칼 소거 활성은 초음파 추출에 의한 추출물의 소거능이 더 높게 나타났다. 항염증 지표인 Cox-2 단백질은 세포에 처리한 초음파 추출액의 농도가 증가할수록 발현이 감소되어 그물버섯이 항염증 효과를 가짐을 나타내었다. 세포생존율은 그물버섯 추출액을 100∼800 μg/mL의 농도 범위로 처리하였을 때 교반과 초음파 추출액 모두 400 μg/mL까지 생존율이 유지되었고, 이후 감소하는 경향을 나타내어 해당 농도까지는 그물버섯 추출물이 세포 독성을 나타내지 않고 세포 활성을 유지하였다. 교반 추출액과 초음파 추출액 모두 항산화, 항염, 세포생존율 증진 효과를 나타내는 것으로 나타났으나 교반 추출액이 더 높은 플라보노이드 함량을 보였고, 초음파 추출액이 더 높은 DPPH 라디칼 소거 활성과 항염증 효과을 나타내어 추출 방법에 따라 기능성에 차이가 나타남을 알 수 있었다. 따라서 그물버섯의 기능성을 확인하였을 뿐만 아니라, 그물버섯의 목적하는 효과에 따라 추출방법을 선택하기 위한 자료로 활용될 수 있을 것이다.
References
-
Bae SM, Han SM, Lee YH, Jung YK, Ji JH, Lee JS (2016) Extraction and characterization of an antihyperglycemic α-glucosidase inhibitor from edible mushroom, Pleurotus cornucopiae. Microbiol Biotechnol Lett 44(2): 124-129.
[https://doi.org/10.4014/mbl.1602.02001]

-
Blois MS (1958) Antioxidant determination by the use of a stable free radical. Nature 181: 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Choi HY, Ryu HS (2015) Antioxidant and anticancer effects of water extract from Pleurotus ostreatus. Korean J Food Nutr 28(1): 60-65.
[https://doi.org/10.9799/ksfan.2015.28.1.060]

-
de Souza G, Silva RJ, Milián ICB, Rosini AM, de Araújo TE, Teixeira SC, Oliveira MC, Franco PS, da Silva CV, Mineo JR, Silva NM, Ferro EAV, Barbosa BF (2021) Cyclooxygenase (COX).2 modulates Toxoplasma gondii infection, immune response and lipid droplets formation in human trophoblast cells and villous explants. Scientific Reports 11: 12709.
[https://doi.org/10.1038/s41598-021-92120-3]

-
Falandysz J (2022) Nutritional and other trace elements and their associations in raw king bolete mushrooms, Boletus edulis. Int J Environ Res Public Health 19(1): 417.
[https://doi.org/10.3390/ijerph19010417]

-
Fogarasi M, Socaci SA, Dulf FV, Diaconeasa ZM, Farcas AC, Tofana M, Semeniuc CA (2018) Bioactive compounds and volatile profiles of five Transylvanian wild edible mushrooms. Molecules 23: 3272.
[https://doi.org/10.3390/molecules23123272]

- Guzik TJ, Korbut R, Adamek-Guzik T (2003) Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol 54(4): 469-487.
-
He J, Wu L, Yang L, Zhao B, Li C (2020) Extraction of phenolics and flavonoids from four Hosta species using reflux and ultrasound-assisted methods with antioxidant and α-glucosidase inhibitory activities. BioMed Res Int 2020: 6124253.
[https://doi.org/10.1155/2020/6124153]

-
Heleno SA, Barros L, Sousa MJ, martins A, Santos-Buelga C, Ferreira ICFR (2011) Targeted metabolites analysis in wild Boletus species. LWT 44: 1343-1348.
[https://doi.org/10.1016/j.lwt.2011.01.017]

- Kang HC, Yun BS, Yu SH, Yoo ID (2001) Chemical structures of compounds isolated from mushroom Suillus granulatus. Kor J Appl Microbiol Biotechnol 29(3): 149-154.
-
Kang SJ, Yang HY, Lee SJ, Kim JH, Hwang SJ, Hong SG (2022) Immunostimulatory effect of rice bran fermented by Lentinus edodes mycelia on mouse macrophages and splenocytes. J Korean Soc Food Sci Nutr 51(8): 743-750.
[https://doi.org/10.3746/jkfn.2022.51.8.743]

- KFDA (2021) Standards and Specifications of Health Functional Foods. Korean Food and Drug Administration, Korea. pp 148, 158, 183.
- Kim HJ, Bae JT, Lee JW, Hwangbo MH, Im HG, Lee IS (2005) Antioxidant activity and inhibitive effects on human leukemia cells of edible mushrooms extracts. Korean J Food Preserv 12(1): 80-85.
-
Kim HJ, Park BG, Han I (2015) Effect of drying and extraction methods on antioxidant activity of Gnaphalium affine D. DON. J Korean Soc Food Sci Nutr 44(5): 695-701.
[https://doi.org/10.3746/jkfn.2015.44.5.695]

-
Kong CS, Choi YJ, Oh JH, Lee JI, Park SY, Kim HR, Jeon BJ, Kim D, Jung KI (2019) Antioxidant activity of shiitake mushroom (Lentinus edodes) water extract and its quality characteristics effect in muffins. J Korean Soc Food Sci Nutr 48(10): 1079-1089.
[https://doi.org/10.3746/jkfn.2019.48.10.1079]

- KOSIS (2019) Korean Statistical Information Service. https://stat.kosis.kr, (accessed on 21. 10. 2022).
- Lee KH, Park HS, Lee MH (2021) Quality characteristics and functional analysis of pound cake added shiitake mushroom concentrate. Culi Sci & Hos Res 27(5): 40-51.
-
Lee YJ, Hwang BS, Song JG, Kim DW, Woo, EE, Lee IK, Yun BS (2015) An indole alkaloid from the fruiting body of Boletus umbriniporus. Kor J Mycol 43(1): 68-70.
[https://doi.org/10.4489/KJM.2015.43.1.68]

-
Liao J, Guo Z, Yu G (2021) Process intensification and kinetic studies of ultrasound-assisted extraction of flavonoids from peanut shells. Ultrason Sonochem 76: 105661.
[https://doi.org/10.1016/j.ultsonch.2021.105661]

-
Lim EH, Mun SK, Kim JJ, Chang DJ, Yee ST (2022) Anti-Inflammatory effects of Phlebia sp. extract in lipopolysaccharide-stimulated RAW 264.7 macrophages. BioMed Res Int 2022: 2717196.
[https://doi.org/10.1155/2022/2717196]

-
Mun SK, Kang KY, Jang HY, Hwang YH, Hong SG, Kim SJ, Cho HW, Chang DJ, Hur JS, Yee ST (2020) Atraric acid exhibits anti-inflammatory effect in lipopolysaccharide-stimulated RAW 264.7 cells and mouse models. Int J Molecular Sci 21(19): 7070.
[https://doi.org/10.3390/ijms21197070]

- NFRI (1990) Manuals of Quality Characteristic Analysis for Food Quality Evaluation (2). National Food Research Institute, Skuba, Japan. p 61.
- Noh HJ, Choi SI, Lee KH, Jang KY, Cho JH, Sung GH, Kim GS, Lee SE, Kim SY (2011) Anti-inflammatory effects of mushroom extracts in Korea. J Mushroom Sci Production 9(2): 84-86.
-
Pandey KB, Rizvi SI (2009) Plant polyphenols as dietary antioxidants in human health and disease. Oxidative Med Cell Longev 2(5): 270-278.
[https://doi.org/10.4161/oxim.2.5.9498]

-
Park HJ, Kang SA, Lee JY, Cho YJ (2012) Antioxidant activities of extracts from medicinal plants. Korean J Food Preserv 19(5): 744-750.
[https://doi.org/10.11002/kjfp.2012.19.5.744]

-
Park HJ, Lee KY. (2013) Evaluations on antioxidant effect of methanol extract from immature cotton boll. Korean J Plant Res 26: 426-432.
[https://doi.org/10.7732/kjpr.2013.26.4.426]

-
Park NY, Cho SD, Chang MS, Kim GH (2022) Optimization of the ultrasound‑assisted extraction of flavonoids and the antioxidant activity of Ruby S apple peel using the response surface method. Food Sci Biotech 31: 1667-1678.
[https://doi.org/10.1007/s10068-022-01150-8]

- Park SH, Lee JM, Lee SH (2020) Optimization of quantification method of Ergotioneine in Pleurotus eryngii var. ferulae and its anti-oxidant activity. J Soc Cosmet Scientists Korea 46(1): 49-55.
- Park SY, Chae KS, Son RH, Jung JH, Im YR, Kwon JW (2012) Quality characteristics and antioxidant activity of bokbunja (black raspberry) vinegars. Food Eng Prog 16(4): 340-346.
- Park YW, Lee HY, Koo CD (2020) Characteristics of Suillus bovinus fairy rings and genets associated with thinning intensity in Pinus densiflora forests. J Mushrooms 18(2): 125-134.
- Rhi JW, Shin HS (1996) Physicochemical properties of antioxidant fractions extracted from freeze-dried coffee by various solvents. Korean J Food Sci Technol 28(1): 109-116.
-
Rice-Evans CA, Miller NJ, Bolwell PG, Bramley PM, Pridham JB (1995) The relative antioxidant activities of plant derived polyphenolic flavonoids. Free Radic Res 22: 375-383.
[https://doi.org/10.3109/10715769509145649]

-
Rokhina EV, Lens P, Virkutyte J (2009) Low-frequency ultrasound in biotechnology: State of the art. Trends Biotechnol 27: 298-306.
[https://doi.org/10.1016/j.tibtech.2009.02.001]

-
Sandoval-Sicairos ES, Milán-Noris AK, Luna-Vital DA, Milán-Carrillo J, Montoya-Rodríguez A (2021) Anti-inflammatory and antioxidant effects of peptides released from germinated amaranth during in vitro simulated gastrointestinal digestion. Food Chem 343: 128394.
[https://doi.org/10.1016/j.foodchem.2020.128394]

-
Shewale SP, Kapadia M, Rathod VK, (2022) Intensification of total phenolic compounds extraction from Azadirachta indica (Neem) leaves by ultrasound. Chem Eng Process Process Intensif 181: 109090.
[https://doi.org/10.1016/j.cep.2022.109099]

-
Shirsath SR, Sonawane SH, Gogate PR (2012) Intensification of extraction of natural products using ultrasonic irradiations-a review of current status. Chem Eng Process Process Intensif 53: 10-23.
[https://doi.org/10.1016/j.cep.2012.01.003]

- Song CY, Oh TW, Kim HH, Lee YB, Jeong OK, Kim SG, Ha YL (2022) Anti-inflammatory efficacy of HK Shiitake mushroom mycelium in LPS-treated RAW 264.7 cells through down-regulation of NF-κB activation. J Life Sci 32(7): 491-500.
-
Song S, Zhuang J, Ma C, Feng T, Yao L, Ho CT (2023) Identification of novel umami peptides from Boletus edulis and its mechanism via sensory analysis and molecular simulation approaches. Food Chem 398: 133835.
[https://doi.org/10.1016/j.foodchem.2022.133835]

-
Tan Y, Zeng NK, Xu B (2022) Chemical profiles and health-promoting effects of porcini mushroom (Boletus edulis): A narrative review. Food Chem 390: 133199.
[https://doi.org/10.1016/j.foodchem.2022.133199]

-
Triki M, Kallel R, Feki J, Mellouli M, Charifi S, Ayadi L, Bodawara T (2020) Prognostic significance of E-cadherin and Cox 2 expression in Tunisian patients with colorectal mucinous adenocarcinoma. Ann Diag Path 49: 151624.
[https://doi.org/10.1016/j.anndiagpath.2020.151624]

-
Tsao R (2010) Chemistry and biochemistry of dietary polyphenols. Nutrients 2(12): 1231-1246.
[https://doi.org/10.3390/nu2121231]

-
Tuli HS, Kumar A, Ramniwas S, Coudhary R, Aggarwa D, Kumar M, Sharma U, Rarashar NC, Haque S, Sak K (2022) Ferulic acid: A natural phenol that inhibits neoplastic events through modulation of oncogenic signaling. Molecules 27: 7653.
[https://doi.org/10.3390/molecules27217653]

-
Vamanu E, Nita S (2013) Antioxidant capacity and the correlation with major phenolic compounds, anthocyanin, and tocopherol content in various extracts from the wild edible Boletus edulis mushroom. BioMed Res Int 2013: 313905.
[https://doi.org/10.1155/2013/313905]

-
Yun SW, Kim SJ, Kim MR (2020) Quality characteristics and antioxidant activities of yanggaeng added with Lentinus edodes powder. J East Asian Soc Diet Life 30(2): 162-171.
[https://doi.org/10.17495/easdl.2020.4.30.2.162]

-
Zhang A, Xiao N, He P, Sun P (2011) Chemical analysis and antioxidant activity in vitro of polysaccharides extracted from Boletus edulis. Int J Biol macormol 49(5): 1092-1095.
[https://doi.org/10.1016/j.ijbiomac.2011.09.005]