천도 신품종 ‘옐로드림’과 다른 복숭아 품종의 과실품질, 영양성분 및 생리활성 비교
 ; Jae-Hee Lee1, †
; Jae-Hee Lee1, † ; Ji-Sun Park1
; Ji-Sun Park1 ; Je-Chang Lee1
; Je-Chang Lee1 ; Ju-Hyun Kim1
; Ju-Hyun Kim1 ; Eun-Ha Chang2
; Eun-Ha Chang2 ; Jae-Hee Won2
; Jae-Hee Won2 ; Ki-Dong Hwang3
; Ki-Dong Hwang3 ; Jung-Hyun Kwon3
; Jung-Hyun Kwon3 ; Sung-Jong Kim4
; Sung-Jong Kim4
Abstract
We conducted a comparative analysis of the peel and flesh of the low-acidity nectarine cultivar ‘Yellow Dream,’ a recently developed peach variety gaining popularity in Korea for its edible peel and ease of consumption, to evaluate its nutritional and functional values. This analysis examined nutritional composition, mineral content, antioxidant activity, and cosmetic benefits such as whitening and anti-wrinkle effects, compared to existing clingstone peach cultivars. ‘Yellow Dream’ has an average fruit weight of 186.5±44.7 g, which is comparable to early-maturing clingstone cultivars such as ‘Chiyomaru’ (yellow flesh) and ‘Yumi’ (white flesh). It consistently achieves a sugar content above 11 °Brix while exhibiting notably low acidity, approximately 0.4%, unlike traditional nectarine varieties known for their pronounced sourness. Compared to the other cultivars, ‘Yellow Dream’ demonstrated significantly higher levels of crude protein and carbohydrates, particularly in its peel, which contained over 1.5 times the crude protein content of ‘Yumi’ and ‘Chiyomaru.’ The peel also exhibited elevated levels of minerals, polyphenols, and flavonoids, along with stronger antioxidant activity as measured by 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical scavenging assays. These findings suggest that ‘Yellow Dream,’ with its edible skin, is a rich source of bioactive compounds and nutrients. Its peel demonstrated superior tyrosinase and collagenase inhibitory activities, highlighting its potential as a whitening and anti-wrinkle agent. Notably, its collagenase inhibitory activity in both the peel and flesh was the highest among the tested cultivars, making it a promising raw material for cosmetics and functional health foods for whitening and wrinkle prevention.
Keywords:
‘Yellow Dream’, nectarine, nutritional composition, and bioactivity서 론
복숭아(Prunus persica L. Batsch)는 전 세계적으로 온대뿐만 아니라 아열대까지 폭넓게 분포하며 맛과 향, 그리고 높은 영양성분과 기능성 등으로 인해 선호도가 높은 과일이다(Manganaris GA 등 2023). 유전적 다양성이 높아서 과피에 발생하는 털 유무에 따라 유모계(peach)와 천도계(nectarine)로 크게 분류되며, 과육 색에 따라 황육계와 백육계 등으로 나뉘는 등 다양한 품종군이 재배되고 있다(Abbott AG 등 2008; Lee JC 2015). 이 중 과피에 털이 있는 유모계 품종군은 상대적으로 외부 해충이나 환경에 대한 보호 기작으로 재배가 용이한 반면, 생산자와 소비자에게 알레르기성 질병을 야기할 우려가 있고(Jin J 등 2021; Manganaris GA 등 2023), 껍질을 벗겨 먹어야 하는 등 식이 편의성이 낮은 단점이 있다(Han JS 등 1997; Seo HJ & Seo IH 2022). 천도계 품종의 경우 털이 없고, 껍질째 먹을 수 있어 소비하기에 편리하나 기존의 국내에서 주로 재배하는 천홍, 선프레, 환타지아 등의 주요 천도 품종의 산도는 0.8% 이상으로, 상대적으로 유모계 복숭아에 비하여 산미가 강하기 때문에 소비자 선호도가 낮고, 재배면적의 확대가 잘 이루어지지 않고 있다(Wi TS & Jo SJ 2016; Nam EY 등 2018; Kwon JH 등 2024). 또한 평균적으로 개화기가 유모계 품종보다 빠르고 내한성이 약한 품종이 많아 저온 및 동해 피해 우려가 있는 고위도 지역이나, 지대가 높은 곳에서는 재배 비중이 낮은 편이다. 최근 미국 등의 복숭아 육종 프로그램에서 ‘Arctic Snow’, ‘Amoore Sweet’, ‘Effie’와 같은 저산미 천도 품종이 육성되기 시작하였고(Manganaris GA 등 2023), 국내에서도 높은 당도와, 낮은 산도, 그리고 봄 서리를 피하기 위해 개화기가 늦은 내재해 천도 품종 육성을 연구하여, 최근 농촌진흥청(RDA) 국립원예특작과학원(NIHHS)에서 ‘옐로드림’(Nam EY 등 2018), ‘스위트퀸’(Kwon JH 등 2024), ‘이노센스’(Kwon JH 등 2023) 등의 신품종을 육성하였다. ‘옐로드림’과 ‘스위트퀸’은 황육계, ‘이노센스’는 백육계 품종으로 모두 낮은 산도와 풍부한 풍미를 지닌 단맛으로 유망한 신품종으로 평가되고 있다(Nam EY 등 2018; Kwon JH 등 2024). 이중 ‘옐로드림’ 은 ‘이노센스’, ‘스위트퀸’에 비하여 중북부지역에서 상대적으로 착과 안정성이 우수한 경향으로 나타난 바 있다(Jeong DE 등 2024). 2015년 이후 현재까지 국내 유모계 복숭아와 천도계 복숭아는 총 재배 면적의 각각 83%와 17% 수준을 유지하고 있으며, 천도 재배면적은 2022년 기준 3,454 ha(Statistics 2023)으로 낮은 편이다. 그러나 최근 국내 저산미 고당도의 천도 신품종 보급과 함께 재배면적이 지속적으로 증가하는 추세이며(KREI 2022), 천도계로 품종 전환 의향이 높아지는 이유로 소비자 선호도(41%), 더 높은 가격(8%) 등으로 나타나, 저산미 천도 품종을 중심으로 한 품종 변화 추이에 시장성이 가장 큰 요인으로 작용할 것으로 전망되고 있다(KREI 2024).
복숭아는 비타민 C, E, B 복합체 등이 풍부하고(Bento C 등 2020), 과일의 먹을 수 있는 부분 중 껍질 조직은 과육보다 비타민 C, 폴리페놀, 플라보노이드 함량 등이 더 높다(Liu H 등 2015; Bassi D 등 2016; Saidani F 등 2017; Bento C 등 2020; Cevallos-Casals BA 등 2006; Serra S 등 2020). 카로티노이드는 대부분의 Prunus 속 과일에서 독특한 노란색과 오렌지색을 나타내는 색소 그룹으로 황육계가 백육계 품종보다 약 10배 더 많으며(Manganaris GA 등 2023) 과육보다 과피에 더 많다고 보고된 바 있다(Liu H 등 2015). 펙틴이 풍부한 알카리성 식품으로 감미가 강하게 느껴지나 실제 평균 당도는 10 °Brix 내외 수준으로, 유기산, 단백질과 아미노산 등을 풍부하게 함유하는 건강식품이며, 식이섬유, 폴리페놀 등 다양한 기능성 성분을 포함하고 있어 미백, 주름 개선 등 피부 건강에 긍정적인 영향을 미치는 것으로 알려져 있다(Lee JC 2015; Manganaris GA 등 2023). 다양한 항산화 물질을 함유하고 있어 신체의 산화 스트레스를 줄이고 전반적인 건강 증진에 기여함으로써 기능성 식품 및 화장품 원료 소재로 활용하는 등의 다양한 연구 보고가 이루어져 있다(Lee JY & An BJ 2010; Lee JY & An BJ 2012; Son HU 등 2012; Choi MJ 2022). 그러나 기존의 복숭아 품종은 주로 껍질을 제거하고 과육을 섭취하는 경우가 많아, 껍질에 포함된 영양 성분을 충분히 활용하지 못하는 경우가 많으며, 특히 학교급식의 경우 털이 있는 유모계 품종의 경우 털 제거, 껍질 제거 등 작업 과정이 복잡하고, 알러지 유발 위험이 높아 천도계 품종을 선호하고 있다(Han JS 등 1997; Seo HJ & Seo IH 2022). 최근 단순한 맛과 식감 외에도 과일의 기능성과 영양학적 가치가 더욱 주목받고 있으며 껍질째 먹을 수 있는 천도의 기능성에 대한 관심도 높아지고 있다. 그러나 최신 육성 신품종에 대한 연구는 매우 부족한 실정이다.
따라서 본 연구는 중북부 지역에서 새롭게 떠오르는 저산미 천도 신품종 ‘옐로드림’의 생육 및 과실특성을 평가하고, 유사한 시기에 생산되는 기존의 유모계 주요 품종과의 부위별 영양성분 및 기능성 등을 비교함으로써 생산자 및 소비자에게 새로운 품종에 대한 정보를 제공하고, 이를 활용한 소재 개발 및 부가가치 향상 상품화 연구의 기초자료로 활용하고자 수행하였다.
재료 및 방법
1. 재배 관리, 수량 및 품질 조사
본 연구에 사용한 저산미 천도계 복숭아 품종은 중북부 지역에서 재배 적응성이 양호한 것으로 평가된(Jeong DE 등 2024) ‘옐로드림’과 유사한 시기에 수확이 가능한 유모계 품종 중에서 백육계 ‘유미’와 황육계 ‘치요마루’를 대조품종으로 선정하였다(Fig. 1). 각 품종별로 강원특별자치도농업기술원 과수시험포장(춘천시 신북읍 소재)과 같은 환경조건에서 재배한 6년생 나무를 선정하여 개화기와 적정 수확 시기를 모니터링하고, 성숙한 열매를 5일 간격으로 2회에 나누어 수확하여 과실 품질과 수량 특성을 조사하였다. 과실 품질은 품종별로 각각 4그루씩 나무별로 30개의 과실을 무작위로 샘플링 하여 평균 과중, 과고, 과폭, 당도(sugar content), 적정 산도(titratable acidity) 및 경도로 과실 품질을 조사하였다. 과일별 무게를 측정하고, 과실의 종경(과고)과 봉합선을 중심으로 최대 적도면 길이인 횡경(과폭)을 측정하였다. 당도는 과일의 봉합선 측면을 기준으로 2곳 이상을 채취하여 세절하고 수동식 착즙기에 시판 거즈(5 × 5 cm, 4겹)를 거름망으로 활용하여 착즙한 즙액을 디지털 당도 측정기(PAL-1, Atago, Tokyo, Japan)로 측정하였으며, 산 함량은 과즙 3 mL에 증류수 27 mL를 첨가한 용액을 산도 자동적정장치(Titroline 5000, Sl Analytics, Germany)를 이용하여 0.1 N NaOH 용액으로 적정하여 pH가 8.2가 될 때까지의 소요된 NaOH양을 malic acid를 기준으로 환산하여 측정하였다. 경도 측정은 8 mm aluminium cylinder probe를 장착한 물성측정기(CR-100, Sun Scientific, Tokyo, Japan)를 이용하여 시험속도 2 mm/s, 압축거리 8 mm, 변형률 20% 기준으로 조건을 설정하여 측정하였다.
2. 분석 전처리 및 추출물 제조
품종 및 부위별 생리활성을 비교하기 위하여 ‘옐로드림’, ‘유미’, ‘치요마루’ 각 품종별로 과일 500개씩 수확하여 핵(씨앗)을 제거한 후 과육과 과피를 분리하였다. 과육과 과피는 건조 전 생체중과, 동결건조(LP100, Ilsin Lab, Korea) 한 후에 건물중을 측정하여 건조비율을 산출하고, 40 mesh로 분쇄한 후에 분말시료를 밀봉하여 초저온냉동고(DF8524(JP), Ilshin BioBase, Dongducheon, Korea)에 —70℃ 조건에서 보관하여 사용하였다. 항산화, 미백, 주름개선 등의 기능성 평가 시험에 활용한 시료 추출물은 물 추출물과 에탄올 추출물로 각각 나누어서 시험을 진행하고 예비시험을 통하여 상대적으로 활성 평가가 우수한 용매를 선발하여, 항산화 시험은 에탄올 추출물을, 미백과 주름개선 기능성은 물 추출물을 활용하였다. 물 추출물은 분말시료 20 g에 증류수 200 mL 를 첨가하여 60℃ 온도 조건에서 초음파추출기(8510R-DTH, Bransonic, Danbury, CT, USA)로 6시간씩 2회 반복 추출하였다. 추출물을 rotary vacuum evaporator(N-21NS, EYELA, Tokyo, Japan)로 감압여과를 하여 완전농축 하였다. 농축액을 동결건조(LP-100, Ilsin Lab, Yangju, Korea)하여 —20 ℃ 에서 보관하고 기능성 평가 실험에 사용하였다. 에탄올 추출물은 분말시료 20 g에 에탄올 200 mL를 첨가하여 orbital shaker(SK71, JeioTech, Daejeon, Korea)에 120 rpm 조건으로 12시간 동안 총 2회 반복 추출하였으며, 물 추출과 같은 방식으로 농축하여 최종적으로 동결건조한 시료를 시험에 사용하였다.
3. 일반성분 및 무기성분 분석
일반 영양성분 분석은 수분, 단백질, 지방, 회분, 탄수화물, 식이섬유 함량을 측정했다. AOAC 법(AOAC 2000)에 따라서 수분함량 조사는 dry oven(OF-22, Jeio Tech, Daejeon, Korea)을 이용하여 105℃ 조건의 상압건조법을 이용하였다. 조지방 분석은 Soxhlet법으로 추출하여 조지방분석기를(Soxtec 8000, Foss, Hoganas, Sweden) 사용하여 분석하였으며, 조단백질은 Kjeldahl 법으로 자동단백질분석기(Kjeltec 8400, Foss, Hoganas, Sweden)를 사용하였고, 질소 환산계수를 6.25로 산출하였다. 조회분은 550℃ 조건의 직접회화법으로 정량하고, 총 탄수화물 함량은 전체 함량 100%를 기준으로 수분함량, 조회분, 조지방 및 조단백질 함량을 뺀 값으로 나타냈다. 불용성 식이섬유 함량은 AOAC법(AOAC 2000)의 효소중량법(Lee SH 등 2004)을 활용하여 조섬유 분석기(FibertecTM 1023, Foss, Hoganas, Sweden)를 이용하여 분석하였다(Park MH 등 2011). Phosphate buffer 50 mL에 시료 0.5 g을 현탁 후, Termamyl solution(Novozyme Nordisk, Denmark) 0.1 mL을 첨가하여 95℃ 수욕상에서 30분간 반응시킨 후 0.1 mL protease 용액을 첨가하여 60℃에서 30분간 반응시켜 냉각하고, amylo-glucosidase 0.3 mL을 첨가하고 60℃에서 30분간 반응시켜 전분과 단백질의 효소 가수분해 과정을 거친 후 감압 여과 후 여액과 잔사를 분리하여, 잔사는 증류수, 95% ethanol 및 acetone 순으로 세척하여 건조 후 함량을 구하고 각각 조회분과 조단백질을 측정한 후 감하여 불용성 식이섬유 함량을 분석하였다. 수용성 식이섬유는 불용성 식이섬유 측정과정에서 얻어진 여액 및 세척액을 60℃로 가열한 95% ethanol로 실온에서 1시간 침전시키고, 15 mL의 95% ethanol을 가한 뒤에 침전물과 용액을 여과하여 잔재물을 78% ethanol로 세척하고 95% ethanol 및 acetone 순으로 세척하여 건조한 다음, 각각 조회분과 조단백질을 측정한 후 감하여 수용성 식이섬유 함량을 분석하였다. 총 식이섬유는 불용성 식이섬유와 수용성 식이섬유를 합산하여 측정하였다. 무기성분의 분석은 원자흡광광도법(atomic absorption spectrophotometry; AAS)을 사용하여 분석하였고, Park MH 등(2011)의 습식분해법을 활용하여 70%의 과염소산(HClO4) 10 mL와 질산(HNO3) 10 mL를 사용하여 시료를 분해한 후 Ca, K, Mg, Na, Fe, Mn, Cu, P을 ICP(Integra Dual, GBC, Melbourne, Australia)로 분석하였다.
4. 항산화 활성 분석
총 폴리페놀 함량 측정은 Folin O & Denis W(1912) 방법을 응용하여 측정하였다. 에탄올 추출물 1 mL(농도 1 mg/mL)와 증류수 8 mL를 각각 15 mL 시험관에 첨가하고, 1N 농도의 Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Corporation, USA) 1 mL를 가하여 5분간 실온에서 반응시켰다. 반응액에 Na2CO3 포화용액 1 mL를 첨가한 후 실온에서 1시간 반응시켜 microplate reader(EPOCH2, BioTek, Vermont, USA)를 이용하여 760 nm에서 흡광도를 측정하였다. 표준물질은 Tannic acid를 사용하였으며, 농도별 검량선을 작성하여 에탄올 추출물의 총 폴리페놀 함량을 정량하였다.
총플라보노이드 함량 측정은 Zhishen J 등(1999)의 방법을 변형하여 에탄올 추출물 500 µL(농도 1 mg/mL)와 증류수 2 mL를 각각 15 mL 시험관에 첨가하고, 5%의 NaNO2 용액 150 µL를 첨가하여 실온에서 6분간 반응시킨 후에, 10% AlCl3 용액 150 µL를 첨가하여 다시 실온에서 5분간 방치하였다. 반응이 완료된 후에 1 M NaOH 1 mL를 첨가하여 잘 혼합하고 15분간 방치한 후, 510 nm에서 흡광도를 측정하였다. 표준물질은 Catechin을 사용하였으며, 농도별 검량선을 작성하고 총 플라보노이드 함량을 정량하였다.
1,1-Diphenyl-2-picrylhydrazyl(DPPH) 유효 라디칼 소거 활성은 Blois MS(1958) 방법으로 분석하였다. 96 Well plate에 에탄올 추출물 40 µL(농도 1 mg/mL) 와 0.2 mM DPPH 용액 160 µL를 넣고 상온에서 30분간 반응시킨 후에 microplate reader (EPOCH2, Bio Tek)를 이용하여 517 nm의 흡광도를 측정하였다. DPPH 유효 라디칼 소거능은 시료 첨가구와 무첨가구의 흡광도 차이를 백분율로 나타냈으며 대조구는 ascorbic acid를 사용하였고 각 시료에 대하여 3회 반복 측정하였다. 다양한 농도(0.01, 0.025, 0.05, 0.1, 1 mg/mL)의 ascorbic aicd 용액을 양성 대조군으로 사용하였으며, 품종 및 부위별 에탄올 추출물은 1, 2.5, 5, 10 mg/mL의 농도로 시험을 수행하여 각각의 DPPH 라디컬 소거 활성이 50%에 달하는 농도(IC50)를 결정하였다.
2,2′-Azino-bis-3-ethylbenzothiazoline-6-sulphonic acid(ABTS) 유효 라디칼 소거 활성은 Re R 등(1999)의 방법을 변형하여 분석하였다. 24 Well plate에 에탄올 추출물 20 µL(농도 1 mg/mL)와 7.4 mM ABTS 용액 300 µL를 혼합한 후 실온에서 20분 동안 반응시킨 후에, microplate reader (EPOCH2, BioTek)를 이용하여 734 nm의 흡광도를 측정하였다. ABTS 유효 라디칼 소거 활성은 시료와 무첨가구 사이의 흡광도 차이를 백분율로 나타내었으며, 대조구는 ascorbic acid를 사용하였고 각 시료에 대하여 3회 반복 측정하였다. 다양한 농도(0.01, 0.025, 0.05, 0.1, 1 mg/mL)의 ascorbic aicd 용액을 양성 대조군으로 사용하였으며, 품종 및 부위별 에탄올 추출물은 1, 2.5, 5, 10 mg/mL의 농도로 시험을 수행하여 각각의 ABTS 라디컬 소거 활성이 50%에 달하는 농도(IC50)를 결정하였다.
5. 미백 및 주름개선 기능성 비교
Tyrosinase 저해활성은 멜라닌 형성을 억제하는 미백 효과를 평가하는 실험으로 Masamoto Y 등(2003), Murata K 등(2022)의 분석방법을 변형하여 분석하였다. 실험에 사용한 kojic acid, L-3,4-dihydroxyphenylalanien(DOPA), tyrosinase, 0.1 M potassium buffer(pH 6.8)는 Sigma-Aldrich 사(St. Louis, MO, USA)로부터 구입하였다. 품종 및 부위별 물 추출물을 농도별로 각각 50 μL씩 준비하고, 대조군에는 0.1M potassium buffer 50 μL를 추가하였다. 실험구 칸에는 buffer 125 μL, blank 칸에는 buffer 150 μL를 넣은 후 각 칸에 10 mM L-Dopa 50 μL를 추가하고, 물 추출물 칸에만 tyrosinase 25 μL를 넣었다. 37℃에서 30분간 반응시킨 후, DOPA chrome을 475 nm에서 흡광도를 측정하여 물 추출물 용액의 첨가군과 무첨가군의 흡광도 감소율로 tyrosinase 효소 활성 저해율을 계산하였다. 다양한 농도의 Kojic acid 용액을 양성 대조군으로 사용하였으며, tyrosinase 저해의 50%에 필요한 농도(IC50)를 결정하였다.
복숭아 품종 및 부위별 피부 주름 개선 효과를 비교하기 위하여 MMP-1(collagenase) 활성 저해 효과를 측정하는 형광 분석법(Wang Y 등 1999; Park HJ & Jeong EJ 2021)을 변형하여 실시하였다. Collagenase Assay Kit(Invitrogen™, Thermo Fisher Scientific, USA, E12055)를 구입하여 dinitrophenyl quenching (DQ) collagen stock solution과 reaction buffer를 희석한 working solution을 제조하여 사용하였다. 96 well plate에 반응군은 각각의 물 추출물을 50 μL씩 넣고 대조군에는 효소액 대신 동량의 반응완충액(reaction buffer)을 50 μL 첨가하였다. 각각 DQ collagen을 20 μL씩 넣은 후에 working solution 30 μL를 가하고 빛을 차단한 상태로 실온에서 1시간 동안 반응시킨 후 흡수파장 485 nm와 방출파장 535 nm에서 형광분광광도계(FLUOstar Omega, BMG labtech, Germany)를 사용하여 형광값을 측정해 효소 억제율을 확인하였다. 농도별로 처리하여 MMP-1 활성을 50% 소거하는 농도(IC50)를 구하여 측정하였다.
6. 통계 분석
모든 실험의 결과는 3회 이상 반복하여 측정한 결과를 처리당 평균과 분산 값을 산출하여 통계분석을 수행하였다. 통계 분석에 사용한 프로그램은 Microsoft Excel 2018과 SAS 통계 package 프로그램(SAS 9.4, TS Level 1M7, Institute Inc., Cary, NC, USA)을 활용하였으며, ANOVA(analysis of variance)와 다중유의성검정(Duncan’s multiple range test(DMRT))을 유의 수준 5%에서 실시하여 각 처리 간 유의성을 검정하였다.
결과 및 고찰
1. 과실 품질 특성
2024년에 중북부 지역의 동일한 수형 및 환경 조건에서 재배한 6년생의 저산미 천도(nectarine) 신품종 ‘옐로드림’(황육)과 대조품종인 유모계(peach) ‘치요마루’(황육), ‘유미’(백육) 3품종의 숙기를 조사한 결과, 수확시기는 ‘유미’ 7월 1~11일, ‘치요마루’가 6월 28일~7월 10일, ‘옐로드림’이 7월 9~17일로 만개일 기준 성숙 소요일수가 100일 미만인 조생종 품종군으로 분류되었다(Lee JC 2015). 과실의 평균 과중은 ‘옐로드림’이 186.5±44.7 g, ‘치요마루’가 191.7±23.5 g, ‘유미’가 196.9±47.6 g으로 유사한 경향이었으며 당도의 경우 조생종의 적정 품질 기준인 11 °Brix 이상을 유지하는 것으로 나타났다(Table 1). 특히 황육계 털복숭아 ‘치요마루’ 품종이 다른 품종에 비하여 1~1.2 °Brix 높은 경향을 보였는데, 복숭아의 당도는 일반적으로 품종별 고유특성 외에 재배환경 조건에 따라 연차간 편차가 많으며, 특히 조생종 품종군의 경우 수확 전 100 mm 이상의 강우와 조우할 경우에 과실의 당도가 큰 폭으로 떨어져서 12 °Brix 이상을 유지하기 어려운 것으로 보고된 바 있다(Kwon JH 등 2009). 실제로 수확 전 지속된 고온과 많은 비 등의 환경조건으로 평년에 비하여 전반적으로 숙기가 빠르고, 과일 크기 및 당도가 평균적으로 낮은 경향을 보였으며, 이는 토양 수분환경이 건조한 조건보다 많은 조건에서 숙기가 빠르고 당도가 다소 낮아진다는 연구결과 와도 일치하는 경향이었다(Larson KD 등 1988; Lee SK 등 2023). 적정 산도의 경우 ‘옐로드림’이 ‘유미’보다는 다소 높으나, ‘치요마루’와는 유사한 0.4% 수준으로 나타나, 기존의 산도가 0.8% 이상으로 신 맛이 강한 천도 주요 품종군과 달리 맛에 대한 기호도가 우수하고, 털이 없어 껍질째 먹을 수 있는 식이 편이성이 높은 유망 신품종으로 판단되었다. 복숭아의 경도는 미숙과일 때는 단단하게 유지되다가 수확시기에 가까워지면서 연화가 이루어져서 경도가 낮아지는데, 성숙과의 경도는 ‘유미’, ‘옐로드림’, ‘치요마루’ 순으로 나타났으며, 천도 신품종 ‘옐로드림’은 ‘유미’보다 과육이 무르고, ‘치요마루’ 보다는 다소 단단한 중간 수준의 연육계 품종 특성을 보였다.
2. 일반 및 무기성분 분석
품종별 과피와 과육의 수분, 조단백질, 조지방, 조회분, 수용성, 불용성 및 총 식이섬유 함량은 Table 2에 나타내었다. 수분함량의 경우 모든 품종에서 과피보다 과육에서 더 높은 경향을 보인 반면, 조지방, 조단백질, 탄수화물 및 식이섬유 함량 등 다른 영양성분의 경우에는 Yellow Dream의 조회분을 제외하고는 과피에서 높고 과육이 낮은 경향을 보였다. 품종별로는 ‘옐로드림’이 조단백질, 탄수화물 함량의 경우 다른 품종에 비하여 유의적으로 높은 경향을 나타냈으며, 특히 조단백질의 경우 ‘유미’와 ‘치요마루’ 품종(0.46 g/100 g·FW) 대비 ‘옐로드림’의 과피 함량이 1.5배 이상(0.70 g/100 g·FW) 높았다. 이는 총 아미노산 함량이 유모계 백도, 황도에 비하여 천도계 황육 품종에서 1.6~1.9배 높은 경향이었다는 분석결과와 유사한 경향이었다(National Academy of Agricultural Sciences 2021). 과육의 식이섬유 함량 또한 ‘옐로드림’이 더 높은 경향을 보였다. 과피의 식이섬유는 수용성과 불용성 모두 과피에 털이 있는 ‘유미’와 ‘치요마루’가 더 높은 경향을 보였으나 두 품종은 대부분 과피를 제거한 과육 부분만을 생과로 활용하기 때문에 실질적인 과피의 식이섬유 함량은 천도 품종인 ‘옐로드림’에서만 유의미한 것으로 판단되었다. 실제로 국가정책수립, 식품 및 영양관련 연구 등의 여러 분야에 다양하게 활용되고 있는 제10개정판 「국가표준식품성분표」(National Academy of Agricultural Sciences 2021)에서도 천도 품종의 경우 과일 전중량 대비 폐기율이 7 g 내외 수준으로 핵 부분 외에 전체 과일을 활용하는 반면, 유모계 백도와 황도 품종의 평균 폐기량은 껍질을 포함하여 각각 19 g, 16 g 수준으로 2배 이상 높게 나타나, 천도 신품종 ‘옐로드림’의 영양학적 가치가 더 높은 것으로 판단되었다.
Chemical compositions of different peach cultivars grown in a single orchard in central-northern Korea
대부분의 무기성분의 경우에도 전반적으로 과육보다 과피에 함량이 더 유의적으로 높은 경향을 보였으며, 특히 칼슘 성분의 경우 과육 대비 과피에서 2.0~3.1배 수준으로 현저히 높은 것으로 나타났다(Table 3). 이는 여러 연구에서 껍질 조직이 과육보다 질소, 칼슘, 마그네슘, 철, 망간 함량이 유의미하게 더 높다는 보고(Başar H 2006; Manzoor M 등 2012; Saidani F 등 2017)와, 칼륨의 경우 과육과 과피 모두에서 우세한 수준으로 존재한다는 보고(Manzoor M 등 2012; Saidani F 등 2017)와도 유사한 경향이었다. 앞에서 언급한 식이섬유 함량과 유사하게 천도 품종 ‘옐로드림’ 품종이 상대적으로 과육 대비 과피의 증가 폭이 적은 편이나 껍질째 활용할 수 있는 특성을 고려할 경우 과육만 활용하는 유모계 품종에 비하여 우수한 영양성분 함량과 활용도를 가지는 것으로 사료되었다. 최근 필수 미네랄 등의 섭취를 정기적인 식단을 통해 가능하게 하는데 관심이 증가하고 있으며(Manganaris GA 등 2023), 과피에 많은 칼슘의 경우 세포와 체액의 중요한 구성요소로, 칼슘은 골격 발달과 성장에 중요한 요소 등으로 평가되고 있다.
3. 항산화활성 분석
폴리페놀과 플라보노이드 성분은 항산화 활성에 기여하는 대표적인 유효성분으로 폴리페놀은 페놀성 수산기를 통해 자유 라디칼을 안정화시키는 역할을 하며, 플라보노이드는 항산화 효소 활성 촉진, 금속 이온 킬레이트, 신호전달 경로 억제 등 여러 경로를 통하여 산화 스트레스를 경감하는 역할을 하는 것으로 보고되고 있다(Pietta PG 2000; Heim KE 등 2002). 품종 및 부위별 폴리페놀 및 플라보노이드 함량을 분석한 결과 품종보다 이용부위에 따른 영향이 더 컸으며, 과피 함량이 과육 함량보다 현저히 높은 경향을 보였다(Table 4). 총 폴리페놀 함량의 경우 가장 과육과 편차가 적었던 ‘옐로드림’ 품종에서도 과피에 1.5배(1,291.8 mg TAE·100 g -1) 더 높은 것으로 나타났으며, 유모계인 ‘치요마루’의 경우 1.9배(1,731.1 mg), ‘유미’는 1.74배(2,952.1 mg) 높은 것으로 나타났다. 품종 순으로는 ‘유미’ 품종이 상대적으로 페놀화합물 함량이 높은 경향으로 보였으며, 그 다음으로 ‘치요마루’, ‘옐로드림’ 순으로 나타났다. 총 플라보노이드 함량의 경우에도 총 폴리페놀 함량과 유사한 경향을 보여, 과육보다는 과피의 함량이 현저히 높았다. 이는 폴리페놀과 플라보노이드 등의 페놀화합물이 과육보다 과피에서 더 풍부한 것으로 보고된 여러 논문들과 유사한 경향으로 나타났으며(Cevallos-Casals BA 등 2006; Manzoor M 등 2012; Kwon JH 등 2015; Saldani F 등 2017; Serra S 등 2020), Kim CS 등(2019)의 연구에서도 성숙시기별 복숭아의 총페놀함량과 항산화능을 비교하여 껍질 비율이 높은 미숙과 단계의 항산화 활성이 더 우수한 것을 확인한 바 있다.
DPPH 유효 라디칼 소거능은 DPPH의 자유 라디칼이 항산화물질에 의하여 환원되어 짙은 보라색을 띄는 것이 노란색으로 변화하여 흡광도과 감소하는 원리를 이용하여 측정하는 것으로 복숭아의 부위별 추출물의 농도별 DPPH 유효 라디컬 소거능 검정을 통한 IC50값은 Table 4에 나타나 있다. DPPH 라디컬 소거능의 경우 과피 부분의 IC50 농도 값이 2.20~5.74 µg·mL-1 수준으로 3.52~8.52 µg·mL-1 수준의 과육보다 활성이 더 우수한 것으로 나타났다. ABTS 라디컬 소거능에서도 유사한 경향을 보여 모든 품종에서 과피의 IC50 농도가 낮은 경향을 확인하였으며, 품종간에는 ‘유미’, ‘치요마루’, ‘옐로드림’ 순으로 나타났다. 이는 총 폴리페놀 및 플라보노이드 함량의 분석결과와도 유사한 경향으로, DPPH와 ABTS 유효 라디컬 소거능은 항산화능을 가진 페놀성 물질 함량이 많을수록 활성이 증가한다는 보고(Rice-Evan CA 등 1997; Kim EJ 등 2012)와 일치하는 경향이었다. 복숭아는 섭취 시 혈장 내 활성 산소종(ROS) 생성을 줄이고 여러 만성 질환으로부터 보호효과가 있으며, 이러한 효과의 주요 요인은 페놀산, 플라보노이드 등(Dhingra N 등 2014)으로 보고된 바 있다. 부위간의 활성 차이뿐만 아니라 품종간의 편차가 큰 것은 복숭아 품종 간의 페놀화합물 함량 및 항산화 활성의 큰 차이가 존재한다는 연구(Kwon JH 등 2015; Saldani F 등 2017; Lara MV 등 2020)와도 유사한 경향으로 나타났다. 항산화 주요 활성 성분 중 하나인 비타민 C 또한 과일의 가식 부위 중 과육보다 과피 조직에 함량이 더 높고(Liu H 등 2015; Bassi D 2016; Saidani F 등 2017; Bento C 등 2022), 광, 기타 환경적 및 생물학적 요인에 의한 산화 스트레스로부터 보호하는 데 도움을 준다(Bassi D 2016)고 알려져 있다. 따라서 껍질을 벗기지 않고 복숭아를 섭취할 수 있는 천도계 품종군이 과피에 풍부한 영양성분과 항산화 등의 생리활성 천연물의 공급원으로서도 건강에 큰 이점을 제공할 수 있을 것으로 사료되었다.
4. 미백 및 주름개선 기능성 비교
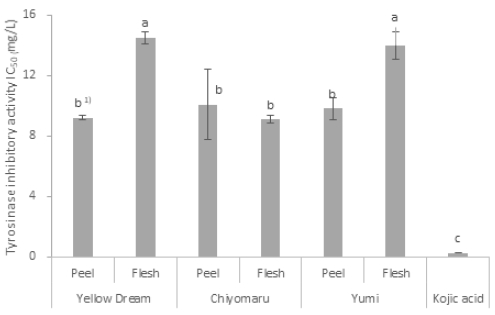
피부의 멜라닌 생성을 억제하여 미백에 매우 중요한 역할을 하는 Tyrosinase 저해활성을 평가하는 연구 등이 다양하게 진행되고 있다(Prota G 1980; Ma D 등 2017). Murata K 등(2022)은 안전하고 효과적인 새로운 미백 효능의 식물 소재를 발굴하기 위하여 타이로시나제 억제 활성을 분석한 결과 복숭아의 가지와 열매 등 여러 부위별 추출물에서 미백효능 활성 관련 (-)-prunin, persiconin, (+)-dihydrokaempferol, (-)-naringenin 등 4가지 flavanone을 확인한 바 있다. ‘치요마루’는 과피와 과육 모두 tyrosinase 저해활성이 우수한 경향이었으며, ‘옐로드림’, ‘유미’의 경우 과피가 과육에 비하여 현저히 우수한 경향을 나타냈다(Fig. 2). 과피가 과육에 비하여 tyrosinase 저해 활성이 우수한 특성은, 페놀류의 함량이 높을수록 tyrosinase 저해 효과가 높았다는 보고(Stirpe F & Corte ED 1969; Boissy RE & Manga P 2004) 등과 일치하는 경향인 반면, ‘치요마루’의 경우 과육과 과피 모두 tyrosinase 저해활성이 우수하고, 기존에 페놀류 성분함량이 가장 높았던 ‘유미’의 IC50 값(과피 9.8, 과육 14.0)보다 ‘옐로드림’의 IC50 값(과피 9.2, 과육 14.5)이 유사하거나 오히려 더 낮은 농도를 나타내어 저해활성이 우수한 경향을 보이는 것은 페놀류 외에 다른 ‘옐로드림’ 품종에 더 높은 유효성분 함량 등의 작용 요인이 있을 것으로 추정되어 향후 관련된 품종별 평가 연구 및 생리활성 물질의 탐색이 필요할 것으로 판단되었다.
Collagenase는 collagen을 분해하여 피부 노화 및 주름 생성에 중요한 기능을 하는 효소로 collagenase 저해활성을 평가함으로써 주름 개선 효능을 비교하는 데 유용하다(Kornicka K 등 2017). 복숭아의 조기 적과한 어린 열매의 항산화 및 주름생성 저해 활성을 평가하여 기능성 소재로 활용하는 방안에 대한 다양한 연구들이 이루어지고 있고, 기타 재배와 가공 과정에서 꽃, 잎, 줄기, 껍질, 과육 잔여물 및 씨앗 등의 부산물을 활용하는 경우에도 UV 차단 및 주름 방지 등 기능성 소재로 향장 산업 등에서 활용도가 높다는 보고가 있다(Manganaris GA 등 2023).
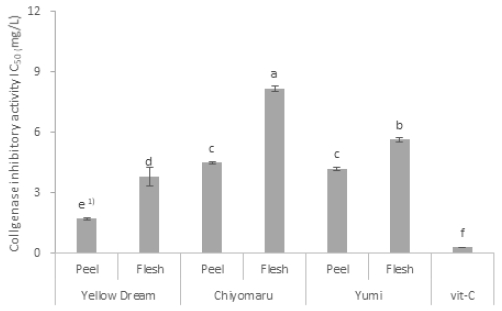
품종 및 부위별 Collagenase 저해활성을 비교분석 한 결과 타 품종 대비 ‘옐로드림’의 저해활성이 가장 우수하여 tyrosinase와 유사한 경향을 나타내었다(Fig. 3). 특히 ‘옐로드림’ 과피의 경우 IC50 값이 1.71, 과육의 경우 3.80으로 ‘치요마루’의 과육 8.17, ‘유미’의 5.65보다 현저히 낮은 농도로 collagenase 저해활성이 가장 높았으며, 기존의 효능이 우수할 것으로 기대되었던 과피 부위뿐만 아니라 과육의 경우에도 다른 품종의 과피보다도 활성이 우수한 것으로 나타나 천연 물질로 피부 미용 등에 효과적인 잠재적인 기능성 소재로도 유망할 것으로 판단되었다.
요약 및 결론
최근 국내 재배면적이 증가하고 있는 저산미 천도 신품종 ‘옐로드림’의 식품학적 가치 평가와 활용도 제고를 위한 기초자료를 얻기 위하여 기존의 유모계 품종과의 과피와 과육 부위별 영양성분 및 무기성분, 항산화 활성, 미백 및 주름개선 효과 등 다양한 기능성을 비교·분석하였다. 평균 과중은 ‘옐로드림’이 186.5±44.7 g으로 비슷한 숙기의 조생종 유모계 황육 ‘치요마루’, 백육 ‘유미’ 품종과 유사한 경향을 보였으며 당도의 경우에도 11 °Brix 이상을 유지하고, 기존의 산미가 강한 천도 주요 품종군과 달리 산도 0.4% 수준으로 낮은 특성을 보였다. 다른 품종에 비하여 ‘옐로드림’이 조단백질, 탄수화물 함량이 유의적으로 높은 경향을 나타냈으며, 조단백질의 경우 ‘유미’와 ‘치요마루’ 품종 대비 과피의 함량이 1.5배 이상 높았다. 기타 칼슘, 칼륨 등 주요 무기성분 및 총폴리페놀과 플라보노이드 등의 함량의 경우 과피에서 더 높았으며, DPPH, ABTS 소거활성의 경우에도 같은 경향을 보였다. 따라서 껍질을 벗기지 않고 복숭아를 섭취할 수 있는 천도 품종 ‘옐로드림’이 과피에 풍부한 영양성분과 항산화 등의 생리활성 공급원으로서 효과적인 것으로 사료되었다. 또한 미백과 주름개선 효능평가로 주로 활용하는 tyrosinase와 collagenase 저해활성은 ‘옐로드림’ 과피에서 가장 우수한 것으로 나타났으며, 특히 collagenase 저해 활성의 경우 ‘옐로드림’의 과피와 과육에서 모두 가장 우수한 것으로 평가됨에 따라 향후 미백, 주름방지 등을 활용한 화장품 및 건강기능식품 등의 소재로 유망할 것으로 사료되었다.
Acknowledgments
본 연구결과는 농촌진흥청 공동연구사업(과제명: 저산미 달콤한 천도 및 자두 신품종 이용촉진사업, 과제번호 PJ015094)의 지원에 의하여 이루어진 것입니다.
References
-
Abbott AG, Arus P, Scorza R (2008) Genetic engineering and genomics. Vol 4. pp 85-105. In: The peach botany, production and uses. Layne DR, Bassi D (eds). CABI, Cambridge, MA, USA.
[https://doi.org/10.1079/9781845933869.0085]

- AOAC (2000) Official method of analysis. 17th ed. Association of Official Analytical Chemists, Washington DC. pp 1-26.
-
Başar H (2006) Elemental composition of various peach cultivars. Sci Hortic 107(3): 259-263.
[https://doi.org/10.1016/j.scienta.2005.08.004]

-
Bassi D, Mignani I, Spinardi A, Tura D (2016) Peach (Prunus persica (L.) Batsch). pp 535-571. In: Nutritional composition of fruit cultivars. Simmonds MSJ, Preedy VR (eds). Academic Press, London, UK.
[https://doi.org/10.1016/B978-0-12-408117-8.00023-4]

-
Bento C, Gonçalves AC, Silva B, Silva LR (2022) Peach (Prunus persica): Phytochemicals and health benefits. Food Rev Int 38(8): 1703-1734.
[https://doi.org/10.1080/87559129.2020.1837861]

-
Blois MS (1958) Antioxidant determinations by the use of a stable free radical. Nature 181(4617): 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Boissy RE, Manga P (2004) On the etiology of contact/occupational vitiligo. Pigment Cell Res 17(3): 208-214.
[https://doi.org/10.1111/j.1600-0749.2004.00130.x]

-
Cevallos-Casals BA, Byrne D, Okie WR, Cisneros-Zevallos L (2006) Selecting new peach and plum genotypes rich in phenolic compounds and enhanced functional properties. Food Chem 96(2): 273-280.
[https://doi.org/10.1016/j.foodchem.2005.02.032]

-
Chen WC, Tseng TS, Hsiao NW, Lin YL, Wen ZH, Tsai CC, Lee YC, Lin HH, Tsai KC (2015) Discovery of highly potent tyrosinase inhibitor, T1, with significant anti-melanogenesis ability by zebrafish in vivo assay and computational molecular modeling. Sci Rep 5: 7995.
[https://doi.org/10.1038/srep07995]

-
Choi MJ (2022) Prunus persica L., Nelumbo nucifera, Hibiscus mutabilis L., Agastache rugosa, Wolfiporia extensa Extracts to improve skin wrinkles. Asian J Beauty Cosmetol 20(1): 11-19.
[https://doi.org/10.20402/ajbc.2021.0236]

-
Dhingra N, Sharma R, Kar A (2014) Towards further understanding on the antioxidative activities of Prunus persica fruit: A comparative study with four different fractions. Spectrochim Acta A Mol Biomol Spectrosc 132: 582-587.
[https://doi.org/10.1016/j.saa.2014.05.008]

-
Folin O, Denis W (1912) On phosphotungastic-phosphomolybdic compounds as color reagents. J Biol Chem 12(2): 239-243.
[https://doi.org/10.1016/S0021-9258(18)88697-5]

- Han JS, Hong SO, Kim JS, Han JP, Kim NS (1997) Frequency of food allergy in Korea and the causative food allergens. J Korean Soc Food Sci Nutr 26(1): 1-9.
-
Heim KE, Tagliaferro AR, Bobilya DJ (2002) Flavonoid antioxidants: Chemistry, metabolism and structure-activity relationships. J Nutr Biochem 13(10): 572-584.
[https://doi.org/10.1016/S0955-2863(02)00208-5]

-
Jeong DE, Kim JH, Kim BO, Cho YJ (2024). Effects on antioxidant, whitening, and anti-wrinkle improvement of ethanol extracts from fermented Trigonotis radicans var. sericea by Lactobacillus brevis. Food Sci Preserv 31(1): 173-182.
[https://doi.org/10.11002/fsp.2024.31.1.173]

- Jeong HN, Lee JC, Kim JH, Lee KO, Chang EH, Won JH, Hwang KD, Kwon JH, Kim SJ (2024) Comparison of fruit set and fruit quality characteristics of new varieties of sweet nectarine in the northern region. Hortic Sci Technol 42(Suppl Ⅰ)): 115.
-
Jin J, Gan K, Zhao L, Jia H. Zhu Y, Li X, Yang Z, Ye Z, Cao K, Wang Z, Yu M, Zhang Y, Ma Z, Liu H, Arús P, Akkerdaas JH, Gao Z, van Ree R (2021). Peach allergen Pru p 1 content is generally low in fruit but with large variation in different varieties. Clin Transl Allergy 11(3): e12034.
[https://doi.org/10.1002/clt2.12034]

-
Kim CS, Lee SH, Chung SK (2019) Physicochemical characteristics and antioxidant capacities of peach fruits in the development stages. Food Sci Preserv 26(2): 174-178.
[https://doi.org/10.11002/kjfp.2019.26.2.174]

-
Kim EJ, Choi JY, Yu MR, Kim MY, Lee SH, Lee BH (2012) Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants. Korean J Food Sci Technol 44(3): 337-342.
[https://doi.org/10.9721/KJFST.2012.44.3.337]

-
Kornicka K, Nawrocka D, Lis-Bartos A, Marędziak M, Marycz K (2017) Polyurethane-polylatide-based material doped with resveratrol decreased senescence and oxidative stress of adipose-derived mesenchymal stromal stem cell (ASCs). RSC Adv 7(39): 24070-24084.
[https://doi.org/10.1039/C7RA02334K]

- KREI (2022) Agricultural outlook 2022 Korea. Vol 16. pp 599-636. In: Fruit supply trends and outlook. Kim WT, Lee MS, Lee HI, Yun SW, Kang HJ (eds). Korea Rural Economic Institute, Naju, Korea.
- KREI (2024) Agricultural outlook 2024 Korea. Vol 14. pp 509-558. In: Fruit supply trends and outlook. Kim WT, Kim HJ, Kim SY, Lee HI, Kang JS, Kim JY (eds). Korea Rural Economic Institute, Naju, Korea.
- Kwon JH, Jun JH, Kang SJ, Lee HC, Kim MJ, Jeong KH, Yeo BY, Hong SS (2009) Collection, Evaluation, and Conservation of Peach Genetic Resources. In: Collection and Evaluation of Stone Fruit Genetic Resources. National Institute of Horticultural and Herbal Science, Suwon. pp 626-648.
-
Kwon JH, Jun JH, Nam EY, Chung KH, Hong SS, Yoon IK, Yun SK, Kwack YB (2015) Profiling diversity and comparison of Eastern and Western cultivars of Prunus persica based on phenotypic traits. Euphytica 206(2): 401-415.
[https://doi.org/10.1007/s10681-015-1494-0]

-
Kwon JH, Nam EY, Jun JH, Chung KH, Yun SK, Kim SJ, Lee JH, Hwang KD, Jeong NH (2024) ‘Sweet Queen’ nectarine. HortScience 59(2): 164-166.
[https://doi.org/10.21273/HORTSCI17384-23]

- Kwon JH, Nam EY, Jun JH, Lee JH, Hwang KD, Jeong NH, Kim SJ (2023) ‘Innosence’ nectarine. Hortic Sci Technol 41(Suppl Ⅰ): 103.
-
Lara MV, Bonghi C, Famiani F, Vizzotto G, Walker RP, Drincovich MF (2020) Stone fruit as biofactories of phytochemicals with potential roles in human nutrition and health. Front Plant Sci 11: 562252.
[https://doi.org/10.3389/fpls.2020.562252]

-
Larson KD, Dejong TM, Johnson RS (1988) Physiological and growth responses of mature peach trees to postharvest water stress. J Am Soc Hortic Sci 113(3): 296-300.
[https://doi.org/10.21273/JASHS.113.3.296]

- Lee JC (2015) New Technique of Peach Cultivation. Seonjinmunhwasa, Korea. pp 37-101.
-
Lee JY, An BJ (2010) Whitening and anti-wrinkle effects of prunus persica flos. J Appl Biol Chem 53(3): 154-161.
[https://doi.org/10.3839/jabc.2010.028]

-
Lee JY, An BJ (2012) Whitening and anti-wrinkling effects of fractions from prunus persica flos. Microbiol Biotechnol Lett 40(4): 364-370.
[https://doi.org/10.4014/kjmb.1207.07007]

- Lee SH, Park HJ, Cho SM (2004) Analysis of dietary fibers and its biofunctional effect. Korean J Crop Sci 49(1): 23-30.
-
Lee SK, Cho JG, Jeong JH, Lee DY, Han JH, Jang SH, Ryu SH, Kim HT, Kang SH (2023) Analysis of fruit quality and productivity of ‘Kawanakajima Hakuto’. J Bio-Env Con 32(4): 475-483.
[https://doi.org/10.12791/KSBEC.2023.32.4.475]

-
Liu H, Cao J, Jiang W (2015) Evaluation and comparison of vitamin C, phenolic compounds, antioxidant properties and metal chelating activity of pulp and peel from selected peach cultivars. LWT-Food Sci Technol 63(2): 1042-1048.
[https://doi.org/10.1016/j.lwt.2015.04.052]

-
Lyu J, Liu, X Bi, JF, Jiao Y, Wu XY, Ruan W (2017) Characterization of Chinese white-flesh peach cultivars based on principle component and cluster analysis. J Food Sci Technol 54(12): 3818-3826.
[https://doi.org/10.1007/s13197-017-2788-0]

-
Ma D, Tu ZC, Wang H, Zhang L, He N, McClements DJ (2017) Mechanism and kinetics of tyrosinase inhibition by glycolic acid: a study using conventional spectroscopy methods and hydrogen/deuterium exchange coupling with mass spectrometry. Food Funct 8(1):122-131.
[https://doi.org/10.1039/C6FO01384H]

- Manganaris GA, Costa G, Crisosto CH (2023) Peach. Vol 11. pp 226-260. In: Peach fruit quality: Components, composition, and nutritional and health benefits. Reig G, Cisneros-Zevallos L, Costa G, Crisosto CH (eds). CABI, Boston, MA, USA.
-
Manzoor M, Anwar F, Mahmood Z, Rashid U, Ashraf M (2012) Variation in minerals, phenolics and antioxidant activity of peel and pulp of different varieties of peach (Prunus persica L.) fruit from Pakistan. Molecules 17(6): 6491-6506.
[https://doi.org/10.3390/molecules17066491]

-
Masamoto Y, Ando H, Murata Y, Shimoishi Y, Tada M, Takahata K (2003) Mushroom tyrosinase inhibitory activity of esculetin isolated from seeds of Euphorbia lathyris L. Biosci Biotechnol Biochem 67(3): 631-634.
[https://doi.org/10.1271/bbb.67.631]

-
Murata K, Suzuki S, Miyamoto A, Horimoto M, Nanko S, Mori D, Kanamaru H, Endo Y (2022) Tyrosinase inhibitory activity of extracts from Prunus persica. Separations 9(5): 107.
[https://doi.org/10.3390/separations9050107]

- Nam EY, Jun JH, Kwon JH, Yun SK, Yoon IK, Chung KH, Kim SJ (2016) A new white nectarine ‘Seolhong’. Korean J Hortic Sci Technol 34(Suppl Ⅰ): 161.
-
Nam EY, Kwon JH, Jun JH, Chung KH, Yun SK, Kim SJ, Do YS (2018) ‘Yellow Dream’ nectarine. HortScience 53(12): 1911-1914.
[https://doi.org/10.21273/HORTSCI13212-18]

- National Academy of Agricultural Sciences (2021) 10th Revision Korean Food Composition Table. Sammi Design Publishing Co., Ltd., Korea. pp 176-177.
-
Park HJ, Jeong EJ (2021) Study for whitening effect, antioxidant and anti-wrinkle activity of tapioca-unhulled barley dried Distiller’s grains with solubles. J Kor Soc Cosmetol 27(6): 1447-1452.
[https://doi.org/10.52660/JKSC.2021.27.6.1447]

-
Park MH, Choi BG, Lim SH, Kim KH, Heo NK, Yu SH, Kim JD, Lee KJ (2011) Analysis of general components, mineral contents, and dietary fiber contents of synurus deltoides. J Korean Soc Food Sci Nutr 40(11): 1631-1634.
[https://doi.org/10.3746/jkfn.2011.40.11.1631]

-
Pietta PG (2000) Flavonoids as antioxidants. J Nat Prod 63(7): 1035-1042.
[https://doi.org/10.1021/np9904509]

-
Prota G (1980) Recent advances in the chemistry of melanogenesis in mammals. J Invest Dermatol 75(1): 122-127.
[https://doi.org/10.1111/1523-1747.ep12521344]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26: 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Rice-Evans CA, Miller NJ, Paganga G (1997) Antioxidant properties of phenolic compounds. Trends Plant Sci 2(4): 152-159.
[https://doi.org/10.1016/S1360-1385(97)01018-2]

-
Saidani F, Giménez R, Aubert C, Chalot G, Betrán JA, Gogorcena Y (2017) Phenolic, sugar and acid profiles and the antioxidant composition in the peel and pulp of peach fruits. J Food Compos Anal 62: 126-133.
[https://doi.org/10.1016/j.jfca.2017.04.015]

-
Seo HJ, Seo IH (2022) Monitoring of dust concentration generated during peach sorting operations. J Bio-Env Con 31(3): 237-245.
[https://doi.org/10.12791/KSBEC.2022.31.3.237]

-
Serra S, Anthony B, Masia A, Giovannini D, Musacchi S (2020) Determination of biochemical composition in peach (Prunus persica L. Batsch) accessions characterized by different flesh color and textural typologies. Foods 9(10): 1452.
[https://doi.org/10.3390/foods9101452]

-
Son HU, Lee SH, Kim MA, Park HJ, Lee SH (2012) Comparison of melanogenesis-inhibiting activity by extracts of Prunus persica flower and calyx. Food Sci Preserv 19(6): 946-950.
[https://doi.org/10.11002/kjfp.2012.19.6.946]

- Statistics Korea (2023) Korean Statistical Information Service. https://kosis.kr/eng, (accessed on 30. 12. 2024).
-
Stirpe F, Corte ED (1969) The regulation of rat liver xanthine oxidase: Conversion in vitro of the enzyme activity from dehydrogenase (Type D) to oxidase (Type O). J Biol Chem 244(14): 3855-3863.
[https://doi.org/10.1016/S0021-9258(17)36428-1]

-
Wang Y, Johnson AR, Ye QZ, Dyer RD (1999) Catalytic activities and substrate specificity of the human membrane type 4 matrix metalloproteinase catalytic domain. J Biol Chem 274(46): 33043-33049.
[https://doi.org/10.1074/jbc.274.46.33043]

- Wi TS, Jo SJ (2016) The analysis of consumer and distribution market trend in fruit (in Korean). pp 41-53. In: The prediction of purchase behavior of horticultural and herbal crops. National Institute of Horticultural and Herbal Science, Wanju, Korea.
-
Zhishen J, Mengcheng T, Jianming W (1999) The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food Chem 64(4): 555-559.
[https://doi.org/10.1016/S0308-8146(98)00102-2]