3T3-L1 지방세포 모델에서 애플망고(Mangifera indica L. Irwin) 잎 추출물의 항산화 및 항비만 활성 평가
Abstract
Mango (Mangifera indica L. Irwin) leaves are a rich source of bioactive compounds, including flavonoids, glucose, xylose, and mangiferin. Among these, mangiferin is particularly noted for its diverse health-promoting properties, such as antidiabetic, immunomodulatory, and antioxidant effects. Despite these benefits, mango leaves remain underutilized, and are often considered agricultural bio-waste. This study explores the potential of mango leaves as a functional ingredient by examining the antioxidant and anti-adipogenic activities of mango leaf water (MLW) extract and 70% ethanol mango leaf extract (MLE). The antioxidant activity of these extracts was assessed using total phenolic content (TPC), DPPH radical scavenging activity, and copper(II) reduction potential assays. Both MLW and MLE demonstrated dose-dependent antioxidant properties. Notably, MLE showed higher activity in TPC and DPPH radical scavenging compared to MLW. Additionally, MLW exhibited a higher copper(II) reduction potential than ascorbic acid at a concentration of 100 μg/mL. The anti-adipogenic effects of MLW and MLE were evaluated by treating 3T3-L1 preadipocytes from day —2 to day 6, followed by Oil Red O staining to measure lipid accumulation. At a concentration of 100 μg/mL, MLW reduced lipid accumulation by 68.19%, whereas MLE inhibited lipid accumulation by 82.26% compared to mature adipocytes. These results indicate that mango leaf extracts hold promise as natural functional food ingredients for addressing oxidative stress and preventing obesity. Further research is needed to investigate the molecular mechanisms underlying the effects of MLW and MLE, particularly their influence on the transcription factors involved in adipogenesis.
Keywords:
antioxidant, obesity, adipogenesis, 3T3-L1, Mangifera indica L. Irwin서 론
인체에서 과도하게 생성된 활성산소종(reactive oxygen species)은 단백질과 DNA 등을 손상시켜 노화를 촉진하거나 염증 발생 등을 유도한다고 알려져 있어, 활성산소를 효과적으로 조절하는 것은 건강을 유지하는 데 필수적이다(Quan T & Fisher GJ 2015; Han EJ 등 2021). 활성산소종은 체내의 여러 대사과정에서 끊임없이 생성되고, 체내에서 생성되는 활성산소종과 생체 항산화 방어 시스템 간의 항상성이 깨지게 되면 산화적 스트레스로 인한 당뇨, 노화 그리고 비만과 같은 각종 만성 퇴행성 질병들을 야기한다(Halliwill B 1996). 특히 지방세포에서 과도하게 생성되는 활성산소종은 3T3-L1 지방전구세포를 지방세포로의 분화를 촉진하고 지방세포 주변의 대식세포를 자극하여 또 다른 활성산소종을 생성하기 때문에 비만의 주요한 원인 중에 하나라고 보고 된 바 있다(Yamashita A 등 2008). 따라서 항비만 연구에 있어 항산화 활성을 동시에 평가하는 것은 효과적인 항비만 소재를 탐색하는 데 중요한 요소이다(Im JH 등 2023).
비만은 신체 에너지의 소비량보다 에너지를 과잉 섭취하였을 때 체내에 지방이 점차적으로 축적되어 체중이 증가하는 상태로 영양적, 유전적, 사회적 그리고 환경적 요인 등 다양한 원인들이 관여한다(Chua SC 1997). 비만이 발생하는 원인으로는 과도한 식이섭취뿐만 아니라 신체활동의 부족, 잘못된 생활 습관, 유전적 원인 그리고 내분비 기능 이상 질환 등이 있으며 과도한 지방세포의 숫자와 크기 증가로 지방을 축적하게 된다(Kedare SB & Singh RP 2011; Bae CR 등 2013). 비만은 당뇨병을 포함한 고혈압, 고지혈증, 동맥경화 그리고 관절염 등의 다양한 질병의 발생과 관련성이 있다고 알려져 있다(Ahn JY 등 2010). 이러한 비만 치료에 사용되는 치료법에는 비약물요법인 식사요법, 행동요법과 약물요법인 식욕 억제제, 영양소 흡수 저해제와 같은 방법이 사용되고 있다. 비만 치료 약물로는 Orlistat(Xenical®), Natrexone/bupropion(Contrave®), Pentermine/topiramate(Qsymia®) 그리고 Liraglutide(Saxenda®) 등이 있으나 구강건조, 이상감각, 현기증, 오심, 구토 그리고 설사 등 부작용을 동반하고 있어 비교적 체내에서 안전하고 부작용이 적은 천연물을 이용한 항비만 기능성 소재를 개발하는 연구가 활발하게 진행되고 있다(Ji HH 등 2012; Son JW 2022).
망고는 옻나무과(Anacardiaceae)의 망고속(Mangifera)에 속하는 다년생의 열대 과일나무로 그중 애플망고는 붉은색의 사과와 유사한 모양의 망고 품종 중 하나이다(Reddeman RA 등 2019). 망고의 잎은 길이가 30 cm 정도로 길고, 대표적인 망고 잎의 성분으로는 망기페린(mangiferin)을 포함하여 phenolic acid, protocatechuic acid, α-pinene 그리고 β-pinene(VI) 등이 있다(Gu TG 등 2014; Alañon ME 등 2019; Choi YS 등 2020). 애플망고(Mangifera indica L. Irwin)의 성분 중 폴리페놀 화합물인 망기페린은 항산화, 항당뇨, 소염, 면역조절 기능 그리고 항암 활성 등의 다양한 생리활성을 가진 것으로 알려져 있다(Zou TB 등 2014). 망고 잎에서 추출한 안토시아닌은 당뇨성 혈관종과 당뇨성 망막증에 대해 긍정적인 효과가 있다고 보고되었으며, 강한 항산화 작용으로 장기와 혈관 등에 손상을 입히는 활성산소를 제거하는 데 도움이 된다고 알려져 있다(Bailey AJ 등 1974). 그리고 망고 잎 열수 추출물이 모유두 세포에서 탈모 관련 유전자인 5α-reductase의 발현 수준을 감소시켜 탈모치료제로서의 가능성을 시사한 연구가 보고되었다(Choi YS 등 2021). 또한 애플망고 잎 추출물이 항산화 그리고 대식세포에서 염증반응을 유도하는 iNOS와 COX-2의 발현을 저해한다는 선행연구가 이루어져 있지만(Yoo DH & Lee IC 2020), 애플망고 잎의 비만과의 관련성을 보고한 연구는 미비한 실정이다.
따라서 본 연구에서는 애플망고 잎을 증류수와 주정으로 각각 추출하여 항산화 활성을 평가하고, 3T3-L1 지방전구세포에서 애플망고 잎 추출물의 지방축적억제 활성을 확인하여 애플망고 잎 추출물의 천연 항비만 소재로서의 활용 가능성을 탐색하고자 하였다.
재료 및 방법
1. 실험 재료
본 실험에서 사용한 애플망고 잎은 이성고 농장(Haman, Korea)에서 제공받아 사용하였다. Potassium phosphate monobasic, 94.5%(v/v) ethanol 그리고 potassium phosphate dibasic anhydrous는 Daejung Chemicals & metals Co., Ltd.(Siheung, Korea)에서 구매하였다. Dimethyl sulfoxide(DMSO)는 Junsei Chemical Co., Ltd.(Tokyo, Japan)에서 구매하였으며 Folin & Ciocalteu’s phenol reagent, 3-isobutyl-1-methylxanthine(IBMX), sodium carbonate, ascorbic acid, neocuproine, 2,2-diphenyl-1-picrylhydrazy(DPPH), gallic acid, copper(II) chloride, Oil Red O(ORO), insulin, dexamethasone(DEX) 그리고 formaldehyde는 Sigma-Aldrich(St. Louis, MO, USA)에서 구매하였다. Phosphate-buffered saline(PBS), fetal bovine serum(FBS), Dulbecco’s Modified Eagle’s Medium(DMEM), trypsin-ethylenediaminetetraacetic acid(EDTA) 그리고 penicillin-streptomycin은 WELGENE Inc.(Seoul, Korea)에서 구매하였으며 bovine calf serum(BCS)은 Gibco BRL.(Carlsbad, CA, USA)에서 구입하였다.
2. 애플망고 잎 추출물 제조
애플망고 잎은 55℃에서 dry oven(MOV-212F-PK, PHC Holdings Corporation, Tokyo, Japan)을 이용하여 48 hr 동안 건조시킨 후 분쇄하였으며 분쇄한 애플망고 잎은 열수와 70%(v/v) 주정으로 추출한 후 추출액은 5 μm 종이 필터를 이용하여 여과하였다. 애플망고 잎의 추출 수율은 열수 추출이 19.07%(w/w-dry weight), 70%(v/v) 주정 추출이 20.06%(w/w-dry weight)로 나타났으며 이들 추출물은 MLW(water extract of mango leaf)와 MLE(70% ethanol extract of mango leaf)로 명명하였다. 각 추출물은 동결건조 후 —20℃에서 보관하며 항산화 및 항비만 실험에 사용하였다.
3. 총 페놀 함량
총 페놀 함량을 측정하기 위해 MLW와 MLE를 DMSO로 용해하여 각각 10, 25, 50 그리고 100 μg/mL의 농도로 준비하고, 200 μL 씩 2 mL microcentrifuge tube에 첨가하였다. 이후, 추출물에 94.5%(v/v) ethanol 200 μL, 증류수 1,000 μL, 50%(v/v) Folin-Ciocalteu 시약 100 μL를 차례로 추가한 후 5 min 동안 반응시켰다. 이후 Na2CO3 200 μL를 넣고 vortexing 한 후, 빛이 차단된 상태에서 1 hr 동안 반응시켰다. 반응 후, 96-well plate에 200 μL씩 첨가하여 725 nm로 설정한 microplate reader(Molecular Devices, Sunnyvale CA, USA)를 이용하여 흡광도를 측정하였다. 총 페놀 함량 측정을 위해 gallic acid를 DMSO에 용해하여 표준곡선을 작성하였으며, 표준곡선의 방정식은 y=0.0387x—0.0407이며 R2값은 0.9989이다. 총 페놀 함량은 표준곡선 방정식에 대입하여 gallic acid equivalent(GAE)로 환산하여 μg GAE/mL로 나타내었다.
4. DPPH Radical 소거 활성
MLW와 MLE의 항산화 활성을 측정하기 위해 2,2-diphenyl-1-picrylhydrazyl(DPPH)를 이용하여 DPPH radical 소거 활성 실험을 진행하였다. DPPH 시약을 94.5%(v/v) ethanol에 용해시키고 냉장 온도에서 빛을 차단하여 1 hr 동안 안정화한 후 실험에 사용하였다. 96-Well plate에 증류수를 이용해 10, 25, 50 그리고 100 μg/mL로 희석한 MLW와 MLE를 각각 20 μL씩 첨가하고 안정화시킨 0.2 mM DPPH를 190 μL씩 첨가하였다. 시약을 첨가한 후 빛을 차단하고 37℃ 조건에서 30 min 동안 반응시켰다. 반응시킨 후 517 nm로 설정한 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 흡광도를 측정하였다. 양성 대조군으로는 ascorbic acid를 증류수로 용해시켜 추출물과 같은 농도로 희석하여 사용하였으며 양성 대조군과 추출물의 DPPH radical 소거 활성은 다음식을 이용하여 계산하였다.
5. 환원력
MLW와 MLE의 환원력을 확인하기 위해 copper(II) reduction potential 실험을 진행하였다. 96-Well plate에 증류수로 용해한 1 mM CuCl2를 20 μL와 10 mM potassium phosphate buffer를 60 μL씩 첨가하였다. 이후, 증류수를 이용해 10, 25, 50 그리고 100 μg/mL의 농도로 희석한 MLW와 MLE를 각각 40 μL씩 추가하고, 10 mM potassium phosphate buffer를 용매로 하여 제조한 0.625 mM neocuproine 용액을 80 μL씩 첨가한 후 1 hr 동안 실온에서 반응시켰다. 반응이 끝난 후 454 nm로 설정한 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 96-well plate에 각각의 용액의 흡광도를 측정하였다. 결과값은 흡광도 값으로부터 계산된 Cu1+의 농도로 표시하였으며 Cu1+/neocuproine의 extinction coefficient(7.95 × 103M—1cm—1)를 이용하였다. 양성 대조군은 앞 실험과 동일한 ascorbic acid를 증류수로 용해하여 추출물과 같은 농도로 희석하여 사용하였다.
6. 3T3-L1 지방전구세포의 배양 및 지방세포 분화
본 실험에 사용한 3T3-L1 지방전구세포는 American Type Culture Collection(ATCC, Rockvilie, MD, USA)에서 분양받아 사용하였다. 3T3-L1 지방전구세포는 10% BCS와 1% penicillin-streptomycin을 DMEM에 혼합한 배지를 이용하여 37℃, 5% CO2의 조건으로 설정한 incubator에서 배양하였다. 3T3-L1 지방전구세포가 confluent 상태가 되었을 때를 day —2라 표기하였으며 confluent 2일 후 분화유도 배지(differentiation medium; DM)로 교체하였다. 분화유도 배지는 10% FBS와 1% penicillin-streptomycin을 혼합한 DMEM에 500 μM의 IBMX, 167 nM insulin 그리고 5.2 μM의 DEX를 첨가하여 48 hr 동안 처리하였다. 분화유도 후 배지(post-differentiation medium; Post-DM)는 10% FBS와 1% penicillin-streptomycin이 혼합된 DMEM에 167 nM insulin만 첨가하여 day 2에서 day 4까지 처리하였다. Day 4 이후에는 10% FBS와 1% penicillin-streptomycin이 혼합된 DMEM 배지를 이용하여 day 6에 지방세포 분화유도를 종료하였다(Fig. 1).
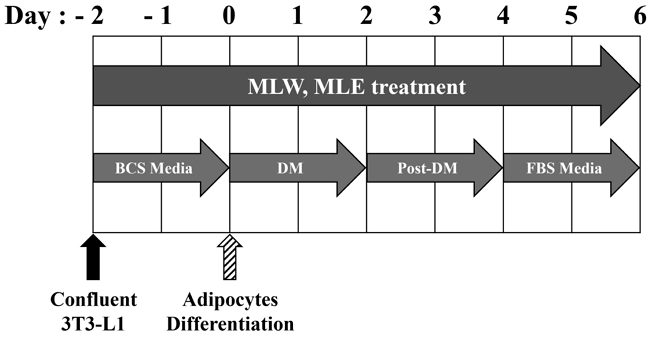
Scheme of 3T3-L1 differentiation and treatment with MLW and MLE.DM: differentiation medium consist of FBS-DMEM, 5.2 μM dexamethasone, 0.5 mM IBMX and 167 nM insulin, Post-DM: post-differentiation medium consist of FBS-DMEM and 167 nM insulin, MLW: Water extract of mango leaf, MLE: 70% Ethanol extract of mango leaf.
7. 지방 축적 억제 활성 평가
MLW와 MLE를 3T3-L1 지방전구세포에 10, 50 그리고 100 μg/mL의 농도로 day —2부터 day 6까지 처리하였으며, 분화유도가 종료되는 day 6에 ORO staining을 실시하였다. 분화유도가 종료된 3T3-L1 지방세포는 PBS로 1회 washing하고 3.7%(v/v) formaldehyde를 사용하여 30 min 동안 고정하였으며, 3 μg/mL ORO를 처리하여 15 min 동안 염색시켰다. 염색이 끝난 후 증류수를 이용해 5회 washing 한 후 scanner와 현미경을 이용하여 관찰하였다. 또한 염색된 지방세포에 DMSO를 200 μL 첨가하여 지방세포 내의 ORO를 용해한 후 96-well plate에 100 μL씩 첨가하여 510 nm로 설정한 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 흡광도를 측정하였다. MLW와 MLE를 처리하지 않은 3T3-L1 지방세포를 대조군으로 사용하여 MLW와 MLE 처리에 의한 지방 축적 수준을 확인하였다.
8. 통계분석
모든 데이터는 3회 반복으로 실험한 후 평균±표준편차로 나타내었으며 Statistical Package for Social Science(Ver. 18, SPSS Inc., Chicago, IL, USA)를 이용하여 통계를 분석하였다. Total phenolic contents(TPC), DPPH radical 소거 활성 그리고 copper(II) reduction potential 실험은 일원 배치 분산분석(one-way ANOVA)을 실시한 후, Duncan’s test를 통해 유의수준 p<0.05 수준에서 유의성을 검증하였으며, ORO staining은 Student’s t-test를 이용하여 분석하였다(*p<0.05, **p<0.01 그리고 ***p<0.001).
결과 및 고찰
1. 총 폴리페놀 함량
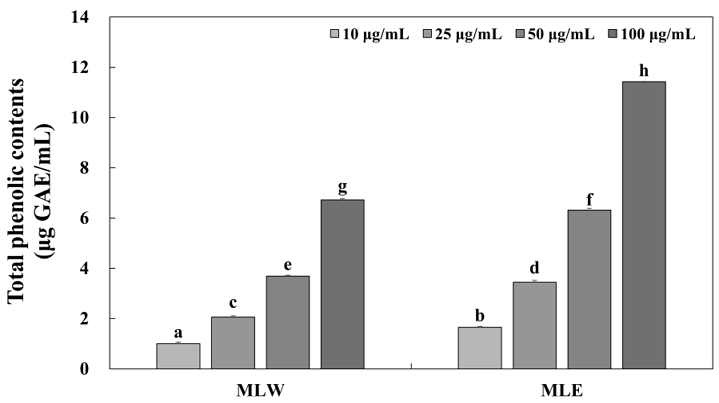
폴리페놀계 화합물은 식물에 특유의 색을 부여하고, 산화-환원 반응에서 기질로 작용하는 두 개 이상의 phenolic hydroxyl기를 포함한 방향족 화합물을 의미한다(Kim SS 등 2018). 주요 성분으로는 탄닌과 플라보노이드가 있으며, 항산화, 고혈압 억제, 항암 그리고 항비만 등 다양한 생리활성을 나타낸다(Yoshizawa S 등 1987). 페놀계 화합물의 함량이 증가할수록 항산화 활성이 증가한다는 연구 결과에 기반하여 total phenolic contents 실험을 진행하였다(Choi SY 등 2005; Chen HY & Yen GC 2007). MLW와 MLE를 10, 25, 50 그리고 100 μg/mL의 농도로 희석하여 사용하였으며 gallic acid를 표준물질로 이용하였다. TPC 결과 MLW의 총 폴리페놀 함량은 1.01, 2.07, 3.70 그리고 6.72 μg GAE/mL로 나타났으며, MLE는 1.65, 3.45, 6.31 그리고 11.43 μg GAE/mL로 나타났다(Fig. 2). MLW와 MLE 처리군에서 모두 농도 의존적으로 총 폴리페놀 함량이 증가하는 것을 확인하였다. Yoo DH & Lee IC(2020)의 선행연구에서도 애플망고 잎을 열수와 에탄올로 추출한 후 폴리페놀 함량을 측정하였을 때 추출 용매를 에탄올로 사용한 경우 더 많은 폴리페놀 함량을 보였다는 연구 결과가 있으며, 본 연구 결과에서도 주정 추출물이 열수 추출물보다 더 많은 폴리페놀을 함유하고 있다는 것을 확인하였다.
2. DPPH Radical 소거 활성
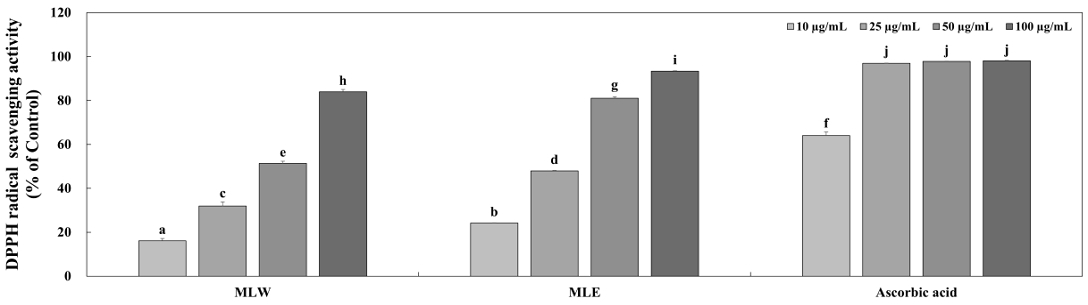
DPPH는 안정적인 radical을 가지고 있으며, 이는 방향성 아민과 페놀성 화합물을 포함하는 천연 성분의 항산화 활성을 평가하는 데 주로 사용되고 있다(Lee CH 등 2011). DPPH의 radical을 제거함으로써 자색에서 노란색으로 변화하는 원리를 이용하는 방법으로, 지방질의 산화뿐만 아니라 생체 내에서 발생하는 free radical로 인해 발생하는 노화의 억제를 평가하는 척도로도 활용되며, 측정 방법이 비교적 간단하여 항산화 활성을 평가하는데 많이 사용된다(Blois MS 1958; Amasa W 등 2012). 본 실험에서는 MLW와 MLE를 DMSO로 10, 25, 50 그리고 100 μg/mL의 농도로 희석하여 사용하였으며, DPPH radical 소거 활성 실험을 통해 두 추출물의 항산화 활성을 측정하였다. 열수 추출물 MLW는 각각 16.10%, 31.90%, 51.34% 그리고 83.96%의 DPPH radical 소거 활성을 나타냈으며, 70%(v/v) 주정 추출물 MLE는 24.19%, 47.97%, 81.01% 그리고 93.37%의 활성을 나타냈다(Fig. 3). 양성대조군으로 이용한 ascorbic acid는 시료와 동일한 농도로 실험을 진행하였으며 25 μg/mL의 농도에서 96% 이상의 높은 DPPH radical 소거 활성을 나타냈다. 본 실험결과, MLW와 MLE는 모두 ascorbic acid에 비해 상대적으로 낮은 활성을 보였으나, 농도 의존적으로 DPPH radical 소거 활성이 증가하는 것을 확인하였다. 선행연구(Yoo DH & Lee IC 2020)에서 에탄올로 추출한 애플망고 잎이 열수로 추출한 애플망고 잎보다 높은 DPPH radical 소거 활성이 있는 것으로 나타났으며 본 연구에서도 선행연구와 동일하게 주정으로 추출한 애플망고 잎이 열수로 추출한 애플망고 잎보다 더 높은 DPPH radical 소거 활성을 보였다. 선행연구와 본 연구의 결과에 따라, 애플망고 잎을 열수를 용매로 사용하여 추출한 것보다 주정을 용매로 사용하여 추출하였을 때 더 다양한 항산화 물질이 추출되었을 것으로 판단된다. Itoh K 등(2020)의 선행연구에서 망고의 잎뿐만 아니라 망고의 종자, 과육, 껍질, 가지 그리고 꽃 추출물을 이용하여 항산화 활성을 평가하였으며, 망고의 잎에서 높은 DPPH radical 소거 활성이 나타난 것을 확인하였다. 본 연구와 선행연구의 결과를 바탕으로 애플망고의 잎은 과육, 껍질, 가지, 꽃 그리고 종자 추출물에 비하여 더 많은 항산화 성분을 함유하고 있으며, 이에 따라 애플망고 잎 추출물이 천연 항산화 소재로 사용될 수 있다는 가능성을 보여주는 결과라 생각된다.
3. 환원력
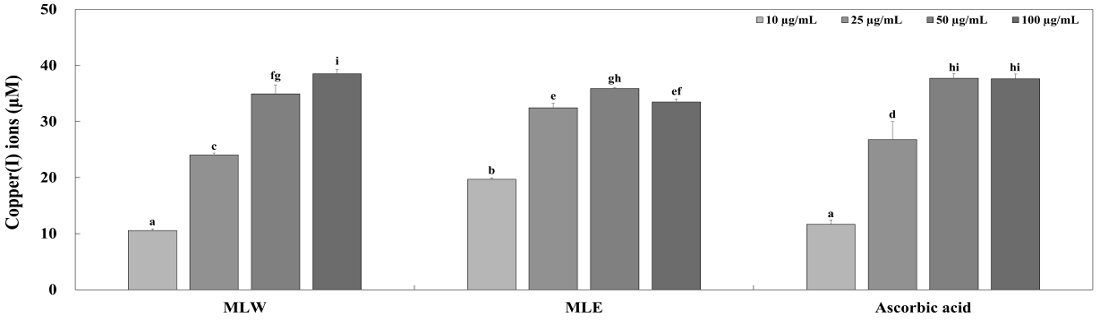
환원력은 산화적 스트레스를 유발하는 활성산소종과 free radical에 전자를 제공하는 능력으로, 이러한 작용은 항산화 활성의 중요한 작용기전으로 알려져 있다(Huang D 등 2005; Yang EY 2022). 본 연구에서는 Cu2+을 Cu1+으로 환원시키는 원리를 이용하여 reduction potential을 측정하였다. MLW와 MLE는 DMSO를 이용하여 10, 25, 50 그리고 100 μg/mL의 농도로 희석하여 사용하였으며 실험의 결과 MLW와 MLE는 모두 Cu2+을 Cu1+으로 환원시켰으며, MLW는 10, 25, 50 그리고 100 μg/mL의 농도에서 환원된 Cu1+의 농도가 10.56, 24.01, 34.92 그리고 38.51 μM이었다. MLE는 동일한 농도에서 환원된 Cu1+의 농도가 19.69, 32.43, 35.89 그리고 33.47 μM 이었다(Fig. 4). 양성대조군으로 사용된 ascorbic acid는 시료와 동일한 농도로 실험을 진행하였으며, 50 μg/ mL의 농도에서 환원된 Cu1+의 농도는 37 μM 이상으로 나타났다. 열수 추출물 MLW는 농도 의존적으로 환원력이 증가하였으며, 100 μg/mL의 농도에서는 양성대조군인 ascorbic acid보다 더 높은 환원력을 나타냈다. Oyaizu M(1986)과 Moon GS 등(2003)은 환원력이 일반적으로 radical 소거 활성과 유사한 양상을 나타낸다고 보고하였으며, DPPH radical 소거 활성과 환원력 모두 농도 의존적으로 증가하는 양상을 나타냈다. 또한, Heo SJ 등(2011)은 일부 높은 농도에서 환원되는 반응을 감소하는 효과가 있을 것이라고 보고하였으며, MLE의 환원력도 100 μg/mL의 농도에서 환원되는 반응이 감소되었을 것이라 사료된다. 환원력 실험의 결과, MLW와 MLE 모두 높은 항산화 활성을 지니고 있으며 천연 항산화 물질로서 활용 가능성을 제시한다.
4. 3T3-L1 세포에서 애플망고 잎 추출물의 Adipogenesis 억제 활성
3T3-L1 지방전구세포는 DEX, IBMX 그리고 insulin 등과 같은 다양한 분화유도 인자와 호르몬에 의해 지방세포로 분화되며 비만을 연구하는 분야에서 가장 많이 사용되고 있다. 지방전구세포에서 지방세포로 분화되는 과정인 adipogenesis는 비만과 깊은 연관이 있으며, 이를 효과적으로 제어하는 것은 비만 예방에서 중요한 역할을 한다(Kim KH 2009; Shon MS & Kim GN 2014). 최근 연구에서는 특정 식물 추출물, 플라보노이드 그리고 카로티노이드 같은 천연 항산화 물질이 비만 예방과 치료에 효과적일 수 있음을 보여주고 있으며, 비만 관련 질병의 예방에 기여할 수 있다는 연구 결과가 보고되었다(Bonomini F 2023). MLW와 MLE의 항산화 활성을 기반하여, 3T3-L1 지방전구세포에서 MLW와 MLE가 adipogenesis에 미치는 영향을 평가하기 위해 10, 50 그리고 100 μg/mL의 농도로 희석한 MLW와 MLE를 분화기간인 day —2에서 day 6까지 총 8일 동안 처리하였다. 분화기간 day 6에 ORO staining을 진행하여 정성분석 하였으며(Fig. 5A, 5B), DMSO를 이용해 염색된 지방세포를 용해하여 정량분석을 수행하였다(Fig. 5C). 추출물을 처리하지 않은 대조군에서는 지방이 다량 축적된 반면, MLW 처리군에서는 60.02%, 59.82% 그리고 68.19%의 지방 축적 억제율을 보였으며, MLE 처리군은 66.09%, 70.51% 그리고 82.26% 지방 축적 억제율을 나타내었다. MLW와 MLE 처리군 모두 100 μg/mL의 농도에서 가장 높은 지방 축적 억제 활성을 나타내었으며, MLE 처리군은 농도 의존적으로 지방 축적 억제율이 증가하였다. 망고 잎 추출물을 이용한 선행연구 중 Sferrazzo G 등(2019)은 본 연구의 결과와 유사하게 망고 잎 에탄올 추출물에서 추출물을 처리하지 않은 대조군에 비하여 유의적으로 지방 축적을 억제하였다고 보고하였으며, Pratelli G 등(2022)은 망고 씨앗 추출물과 망고 껍질 추출물도 본 연구의 결과와 유사하게 100 μg/mL의 농도에서 효과적으로 지방 축적을 억제하였다고 보고하였다. Ntambi JM & Kim YC(2000)는 3T3-L1 지방전구세포가 adipogenesis 과정에서 C/EBPβ, C/EBPδ, PPARγ 그리고 C/EBPα와 같은 전사인자들이 지방세포의 분화와 성숙에 중요한 역할을 하며, adipogenesis의 다양한 단계에서 서로 상호작용하여 지방축적을 촉진한다고 보고했다. 따라서 MLW와 MLE가 지방 축적을 억제하는 과정에서 핵심 전사인자의 발현 수준을 확인하기 위한 추가적인 실험이 필요한 것으로 판단된다.
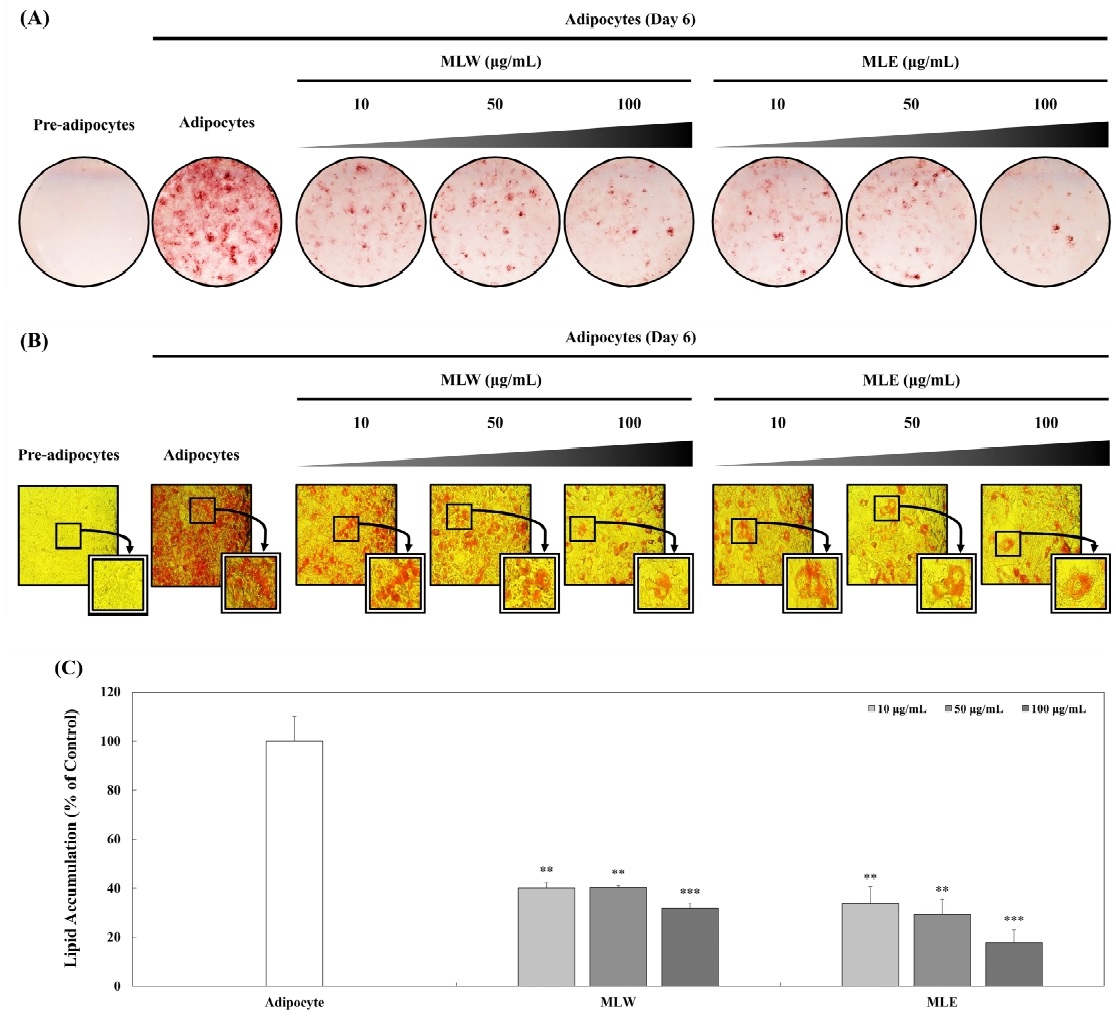
Oil Red O staining of 3T3-L1 adipocytes to assess lipid accumulation.(A) Lipid accumulation in 3T3-L1 adipocytes in the presence or absence of MLW and MLE analyzed by photomicrography. (B) Microscopic visualization of lipid droplets in differentiated 3T3-L1 adipocytes. (C) Quantitative measurement of lipid accumulation using absorbance of Oil Red O staining. Each distinct letter show on the graph represents a significant difference determined by Student’s t-test (** p<0.01 and *** p<0.001).MLW: Water extract of mango leaf, MLE: 70% Ethanol extract of mango leaf.
5. 3T3-L1 세포 내 지방구 관찰
지방전구세포는 IBMX, DEX 그리고 insulin과 같은 분화유도 인자에 의해 지방세포로 분화되며 세포 내에 지방구를 생성하고 축적한다(Hwang DI 등 2019). 분화유도가 끝난 3T3-L1 지방세포를 ORO로 염색한 후 MLW와 MLE가 지방구의 수와 크기에 미치는 영향을 알아보기 위해 현미경으로 관찰하였다. 추출물을 처리하지 않고 분화유도만 시킨 대조군은 다수의 지방구가 생성된 것을 확인하였다. MLW와 MLE를 처리하고 분화유도를 한 처리군에서는 지방구의 수와 크기가 대조군에 비하여 줄어들었으며, 이 중 MLE는 농도 의존적으로 지방구의 수와 크기를 감소시켰다(Fig. 5A, 5B). 비파잎과 비파씨를 메탄올로 추출하여 지방 축적 억제 효과를 확인한 Min OJ 등(2010)은 추출물을 처리한 처리군이 추출물을 처리하지 않은 대조군에 비하여 지방구의 수가 감소한 것을 확인하였으며, 비파잎 추출물이 비파씨 추출물보다 지방 축적 억제에 더 효과적이라고 보고하였다. 본 연구에서도 잎 추출물인 MLW와 MLE가 추출물을 처리하지 않은 대조군에 비하여 지방구의 수와 크기를 감소시켰으며 이러한 결과는 애플망고 잎 추출물의 항비만 소재로서의 가능성을 시사한다.
요 약
본 연구에서는 애플망고 잎의 항산화 및 항비만 활성을 평가하고 기능성 소재로서의 가능성을 탐색하였다. 애플망고 잎 추출물의 항산화 활성을 확인하기 위해 TPC, DPPH radical 소거 활성 실험 그리고 reduction potential 실험을 진행하였다. TPC, DPPH radical 소거 활성 실험에서는 MLW와 MLE 모두 농도 의존적으로 항산화 활성을 나타냈으며, reduction potential 실험에서는 MLW 처리군이 농도 의존적으로 항산화 활성이 증가할 뿐만 아니라 100 μg/mL에서 양성대조군인 ascorbic acid보다 더 높은 항산화 활성을 타나내었다. 이와 같은 항산화 활성을 기반으로 ORO를 통해 항비만 활성을 평가하였으며 MLW와 MLE 모두 adipogenesis 과정을 조절해 지방의 축적을 억제하였다. MLW와 MLE 처리군은 대조군에 비하여 지방구의 수와 크기를 감소시켰으며, 100 μg/mL에서는 가장 높은 지방 축적 억제 활성을 나타내었다. 본 연구를 통해서 폐기되는 애플망고 잎이 항산화 및 항비만에 효과적임을 시사하며, 애플망고 잎이 천연 기능성 식품의 소재로서 활용될 수 있는 잠재력을 보여준다. 추후 애플망고 잎이 함유한 물질과 adipogenesis 과정에 관여하는 전사인자들의 발현 수준을 확인하기 위한 추가적인 실험이 진행되어야 할 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 지역특화작목기술개발 “기후변화 대응 망고산업 육성”(과제번호 RS-2022-RD010236)의 연구비 지원에 의해 수행하였음.
References
-
Ahn JY, Lee HJ, Kim SN, Ha TY (2010) Curcumin-induced suppression of adipogenic differentiation is accompanied by activation of Wnt/beta-catenin signaling. Am J Physiol Cell Physiol 298(6): C1510-C1516.
[https://doi.org/10.1152/ajpcell.00369.2009]

-
Alañon ME, Oliver-Simancas R, Gómez-Caravaca AM, Arráez-Román D, Segura-Carrtero A (2019) Evolution of bioactive compounds of three mango cultivars (Mangifera indica L.) at different maturation stages analyzed by HPLC-DAD-q-TOF-MS. Food Res Int 125: 108526.
[https://doi.org/10.1016/j.foodres.2019.108526]

-
Amasa W, Santiage D, Mekonen S, Ambelu A (2012) Are cosmetics used in developing countries safe? Use and dermal irritation of body care products in Jimma Town, Southwestern Ethiopia. J Toxicol 2012: 204830.
[https://doi.org/10.1155/2012/204830]

-
Bae CR, Kwon DY, Cha YS (2013) Anti-obesity effects of salted and unsalted doenjang supplementation in C57BL/6J mice fed with high fat diet. J Korean Soc Food Sci Nutr 42(7): 1036-1042.
[https://doi.org/10.3746/jkfn.2013.42.7.1036]

-
Bailey AJ, Robins SP, Balian G (1974) Biological significance of the intermolecular crosslinks of collagen. Nature 251(5471): 105-109.
[https://doi.org/10.1038/251105a0]

-
Blois MS (1958) Antioxidant determinations by the use of a stable free radical. Nature 181(4617): 1198-1200.
[https://doi.org/10.1038/1811199a0]

-
Bonomini F (2023) Antioxidants and obesity. Int J Mol Sci 24(16): 12832.
[https://doi.org/10.3390/ijms241612832]

-
Chen HY, Yen GC (2007) Antioxidant activity and free radical-scavenging capacity of extracts from guava leaves. Food Chem 101(2): 686-694.
[https://doi.org/10.1016/j.foodchem.2006.02.047]

- Choi SY, Lim SH, Kim JS, Ha TY, Kim SR, Kang, KS, Hwang IK (2005) Evaluation of the estrogenic and antioxidant activity of some edible and medicinal plants. Korean J Food Sci Technol 37(4): 549-556.
- Choi YS, Kim EM, Choi SK, Lee WH, Han HS, Kim KK (2020) Investigation of the effect of blueberry hydrothermal extracts on myoblast differentiation. Kor J Herbol 35(3): 25-32.
- Choi YS, Kim EM, Lee SH, Han HS, Kim KK (2021) Investigation on the effect of water extracts of Mangifera indica leaves on the hair loss-related genes in human dermal papilla cells. Kor J Herbol 36(3): 39-46.
-
Chua SC Jr (1997) Monogenic models of obesity. Behav Genet 27(4): 277-284.
[https://doi.org/10.1023/A:1025679728948]

- Gu TG, Yoo IS, Park AN (2014) Antioxidant effects of bioactive mango leaves. J Korean Soc Cosmetol 20(5): 847-851.
-
Halliwell B (1996) Antioxidant in human health and disease. Annu Rev Nutr 16(1): 33-50.
[https://doi.org/10.1146/annurev.nu.16.070196.000341]

-
Han EJ, Kim SY, Han HJ, Kim HS, Kim KN, Fernando IPS, Madusanka DMD, Dias MKHM, Cheong SH, Park SR, Han YS, Lee KH, Ahn G (2021) UVB protective effects of Sargassum horneri through the regulation of Nrf2 mediated antioxidant mechanism. Sci Rep 11: 9963.
[https://doi.org/10.1038/s41598-021-88949-3]

-
Heo SJ, Ahn HY, Kang MJ, Lee JH, Cha JY, Cho YS (2011) Antioxidative activity and chemical characteristics of leaves, roots, stems and fruits extracts from Acanthopanax senticosus. J Life Sci 21(7): 1052-1059.
[https://doi.org/10.5352/JLS.2011.21.7.1052]

-
Huang D, Ou B, Prior RL (2005) The chemistry behind antioxidant capacity assays. J Agric Food Chem 53(6): 1841-1856.
[https://doi.org/10.1021/jf030723c]

- Hwang DI, Choi IH, Kim DY, Park SM, Kim HB, Li YL, Lee HM (2019) Inhibitory effects of Chrysanthemum boreale makino on 3T3-L1 preadipocyte differentiation and down-regulation of adipogenesis and lipogenesis. J Life Sci 29(3): 332-336.
- Im JH, Lim JS, Han XG, Men X, Oh G, Cho GH, Choi SI, Hwang WS, Lee OH (2023) Antioxidant activity and anti-obesity effects of mixture of Brassica juncea and black rice bran. Korean J Food Nutr 36(4): 244-252.
-
Itoh K, Matsukawa T, Okamoto M, Minami K, Tomohiro N, Shimizu K, Kajiyama S, Endo Y, Matsuda H, Shigeoka S (2020) In vitro antioxidant activity of Mangifera indica leaf extracts. J Plant Stud 9(2): 39-45.
[https://doi.org/10.5539/jps.v9n2p39]

-
Ji HH, Jeong HY, Jin SJ, Kwon HJ, Kim BW (2012) Inhibition of adipocyte differentiation by methanol extracts of Oenanthe javanica seed in 3T3-L1 preadipocyte. J Life Sci 22(12): 1688-1696.
[https://doi.org/10.5352/JLS.2012.22.12.1688]

-
Kedare SB, Singh RP (2011) Genesis and development of DPPH method of antioxidant assay. J Food Sci Technol 48(4): 412-422.
[https://doi.org/10.1007/s13197-011-0251-1]

- Kim KH (2009) Perspective in regulation of adipogenesis by bioactive food components. Food Sci Ind 42(4): 51-57.
-
Kim SS, Park JY, Lee WC, Park CY, Ko BH, Jeon YA, Park KJ, An HJ, Kang SB, Yun SH, Choi YH, Lee YJ (2018) Memory enhancing activity of extract of new citrus cultivar ‘Shinyegam’ in mice. Food Sci Preserv 25(7): 855-862.
[https://doi.org/10.11002/kjfp.2018.25.7.855]

-
Lee CH, Shin SL, Kim NR, Hwang JK (2011) Comparison of antioxidant effects of different Korean pear species. Korean J Plant Res 24(2): 253-259.
[https://doi.org/10.7732/kjpr.2011.24.2.253]

- Min OJ, Oh J, Kim HA, Kim MS, Baek HY, Kim YJ, Rhyu DY (2010) Effect of Eriobotrya japonica leaf and seed extracts on adipogenesis. Kor J Pharmacogn 41(4): 270-274.
- Moon GS, Ryu BM, Lee MJ (2003) Components and antioxidative activities of Buchu (Chinese chives) harvested at different times. Korean J Food Sci Technol 35(3): 493-498.
-
Ntambi JM, Kim YC (2000) Adipocyte differentiation and gene expression. J Nutr 130(12): 3122S-3126S.
[https://doi.org/10.1093/jn/130.12.3122S]

-
Oyaizu M (1986) Studies on products of browning reaction; Antioxidative activities of products of browning reaction prepared from glucosamine. Jpn J Nutr Diet 44(6): 307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Pratelli G, Carlisi D, D’Anneo A, Maggio A, Emanuele S, Palumbo Piccionello A, Giuliano M, De Blasio A, Calvaruso G, Lauricella M (2022) Bio-waste products of Mangifera indica L. reduce adipogenesis and exert antioxidant effects on 3T3-L1 cells. Antioxidants 11(2): 363.
[https://doi.org/10.3390/antiox11020363]

-
Quan T, Fisher GJ (2015) Role of age-associated alterations of the dermal extracellular matrix microenvironment in human skin aging: A mini-review. Gerontology 61(5): 427-434.
[https://doi.org/10.1159/000371708]

-
Reddeman RA, Glávits R, Endres JR, Clewell AE, Hirka G, Vértesi A, Béres E, Szakonyiné IP (2019) A toxicological evaluation of mango leaf extract (Mangifera indica) containing 60% mangiferin. J Toxicol 2019: 4763015.
[https://doi.org/10.1155/2019/4763015]

-
Sferrazzo G, Palmeri R, Vanella L, Parafati L, Ronsisvalle S, Biondi A, Basile F, Li Volti G, Barbagallo I (2019) Mangifera indica L. leaf extract induces adiponectin and regulates adipogenesis. Int J Mol Sci 20(13): 3211.
[https://doi.org/10.3390/ijms20133211]

- Shon MS, Kim GN (2014) Anti-oxidant and anti-obese activities of turmeric (Curcuma longa L.) extract in 3T3-L1 cells. Kor J Aesthet Cosmetol 12(2): 169-175.
-
Son JW (2022) Recent advances in anti-obesity drugs. J Korean Diabetes 23(2): 113-127.
[https://doi.org/10.4093/jkd.2022.23.2.113]

-
Yamashita A, Soga Y, Iwamoto Y, Asano T, Li Y, Abiko Y, Nishimura F (2008) DNA microarray analyses of genes expressed differentially in 3T3-L1 adipocytes co-cultured with murine macrophage cell line RAW264.7 in the presence of the toll-like receptor 4 ligand bacterial endotoxin. Int J Obes 32(11): 1725-1729.
[https://doi.org/10.1038/ijo.2008.153]

- Yang EY (2022) Physiological activities analysis of thunberg fruit (Rosa multiflora) and quality characteristics of beverage added with fermented extract. Ph D Dissertation Sookmyung Women’s University, Seoul. p 107.
- Yoo DH, Lee IC (2020) Antioxidant effect and iNOS, COX-2 expression inhibition on RAW 264.7 cell of Mangifera indica L. leafs. J Life Sci 30(9): 783-790.
-
Yoshizawa S, Horiuchi T, Fujiki H, Yoshida T, Okuda T, Sugimura T (1987) Antitumor promoting activity of (−)-epigallocatechin gallate, the main constituent of “Tannin” in green tea. Phytother Res 1(1): 44-47.
[https://doi.org/10.1002/ptr.2650010110]

-
Zou TB, Xia EQ, He TP, Huang MY, Jia Q, Li HW (2014) Ultrasound-assisted extraction of Mangiferin from Mango (Mangifera indica L.) leaves using response surface methodology. Molecules 19(2): 1411-1421.
[https://doi.org/10.3390/molecules19021411]