김치 유래 γ-Aminobutyric Acid 생산 유산균 : 잠재적 사이코바이오틱스


Abstract
γ-Aminobutyric acid (GABA) functions as the primary inhibitory neurotransmitter in mammals, numerous studies have demonstrated that direct ingestion of GABA effectively induces natural sleep and alleviates stress. Low doses of GABA reduce stress by modulating the autonomic nervous system, while high doses do so by modulating the central nervous system. The oral administration of GABA-producing lactic acid bacteria (LAB) to experimental animals has been shown to promote mental health and ameliorate neurological disorders, such as essential tremor and depression, and to have positive effects on diabetes, fibromyalgia, chronic fatigue, and pain in experimental animals. Consequently, diet supplementation with GABA-producing LAB offers a potential means of treating mental health and neurological disorders in humans. Furthermore, supplementation with GABA-producing LAB might have sleep-inducing and stress-relieving effects akin to those observed after GABA consumption. Numerous LAB strains in kimchi produce diverse metabolites, and a significant proportion generate GABA. Although further animal and clinical studies are required, kimchi-sourced GABA-producing LAB appear to be potential psychobiotics.
Keywords:
γ-aminobutyric acid, kimchi, psychobiotics, lactic acid bacteria서 론
γ-Aminobutyric acid(GABA)는 글루탐산 탈탄산효소(Glutamate decarboxylase; GAD)에 의해 L-글루탐산의 α-탈탄산 반응으로 생성되는 비단백질 아미노산으로, 화학식은 C4H9NO2이고 분자량은 103.120 g/mol이다. 감자의 괴경에서 그 존재가 처음 발견되었고(Steward FC 등 1949), 이어서 포유류의 중추신경계에 그램당 1 mg의 높은 농도로 GABA가 존재한다는 것이 확인되었지만 그 생물학적 중요성은 확인되지 못했다(Roberts E & Frankel S 1950). 이후 GABA가 포유류의 신경전달에서 주요 억제성 신경전달 물질로서 대뇌피질의 20∼44%에서 작용하는 중요한 역할을 한다는 사실이 확인되면서 GABA에 대한 관심이 증폭되었다(Roberts E & Eidelberg E 1960; DeFelipe J 1993).
GABA는 신경세포에서 방출되는 신경전달물질로 뉴런(neuron)에서 다른 뉴런으로 정보를 전달하며 소포(vesicles)라고 불리는 축삭 말단(axon terminal)의 막 주머니에 저장된다. 각 소포에는 수천 개의 GABA분자가 존재하는데, 뉴런에 의한 GABA 방출을 위해 소포는 신경 세포막과 융합하여 세포 외 배출을 통해 GABA를 방출하는데, 방출된 GABA는 시냅스(synapse) 사이공간을 가로질러 시넵스이후신경세포(postsynaptic neuron)로 확산된다. 인체에서 GABA는 GABA 수용체에 결합하여 억제 시냅스에서 작용하며, 이러한 결합은 이온 채널을 열어 칼륨 이온이 세포 밖으로, 염소이온이 세포 안으로 흘러가도록 한다(Cellot G & Cherubini E 2014). 이러한 작용은 막전위의 역전위를 유발하는 과분극을 일으키고 뉴런의 흥분성을 감소시킨다. GABA 수용체에 결합하지 못한 GABA는 시냅스틈새에 존재하는 효소에 의해 분해 되거나 수송체나 재흡수펌프를 통한 능동수송으로 시냅스 이전 축삭말단(presynaptic axon terminal)으로 재흡수 된다(Sarasa SB 등 2020). GABA는 뇌뿐만 아니라 췌장의 랑게르한스섬(islets of Langerhans, pancreatic islets)에 존재하는 인슐린(insulin) 생산 베타세포에서도 높은 수준으로 생산되는데, 인슐린과 함께 생산되어 이웃 알파세포의 표면에 존재하는 GABA 수용체에 결합하여 글루카곤 분비를 억제한다. 베타 세포(β-cell)의 복제와 생존은 GABA에 의해 촉진될 수 있으며 알파세포(α-cell)가 베타세포로 전환되는 데에도 도움을 준다(Al-Kuraishy HM 등 2021; Dastgerdi AH 등 2021).
세계보건기구에 따르면 전세계 성인 인구의 5%가 우울증(depressive disorder)을 겪고 있으며 있으며 이들 중 상당수는 불안증(anxiety disorder)도 함께 겪고 있다(Evans-Lacko S 등 2018). 이는 우울증을 앓고 있는 사람들의 건강뿐만 아니라 삶의 질에도 부정적인 영향을 미치며 직장에서의 생산성 저하와 복지 및 의료 비용 등의 사회적 비용을 증가시킨다(Chisholm D 등 2016). 현재까지 연구에 따르면 우울증과 불안증은 심리적, 환경적, 유전적, 생물학적 요인의 상호작용에 의해 유발되는 것으로 알려져 있으며, 이러한 장애를 치료할 수 있는 많은 치료 방법이 존재한지만 이러한 치료법은 효과가 나타나기까지 오랜 시간이 소요되고 기분변화, 수면패턴의 변화, 의존성 및 중독, 신체 다른 부위의 건강에 영향을 유발하는 경우가 많다(Bueno-Antequera J & Munguía-Izquierdo D 2020; Penninx BW 등 2021). 어떤 환자들은 장질환과 정신 질환이 공존하는 경우가 흔한데, 이는 중추신경계와 위장관이 밀접한 관련이 있음을 시사한다(Wasilewski A 등 2015). 장내세균과 뇌의 관계에 대한 수많은 연구결과가 쏟아지고 있는데, 이는 소위 장-뇌 축(gut-brain axis)으로 불려지는 양방향 통신 시스템을 통해 장과 장내미생물 그리고 뇌가 서로 소통 할 수 있다는 가설을 뒷받침한다(Rhee SH 등 2009). 이 신호전달 시스템은 완전하게 밝혀지지 않았지만 신경, 내분비, 면역 및 대사경로를 포함한 복잡한 메커니즘으로 구성되어 있다(El Aidy S 등 2015). 병원성 장내세균이 인간의 정신과정에 영향을 미칠 수 있다는 것은 이전부터 알려져 있었으나 정신건강에 긍정적인 영향을 미칠 수 있는 몇몇 세균의 존재는 최근 들어서 밝혀지고 있다. 이런 세균들은 사이코바이오틱스(psychobiotics)라고 불려지고 있는데, ‘정신적 문제를 가지고 있는 환자가 적절한 양을 섭취했을 때 정신건강상의 이점을 가져다주는 살아있는 생명체’로 정의된다(Dinan TG 등 2013). ‘숙주의 건강에 도움을 주는 살아있는 생명체로 정의되는 프로바이오틱스(probiotics)의 일종인 사이코바이오틱스는 GABA나 세로토닌(serotonin, 5-hydroxytryptamine)과 같은 신경활성물질을 생산하고 전달함으로써 장-뇌 축에 작용할 수 있다. 일부 유산균과 Bifidobacterium은 뇌에서 많은 생리적 심리적 과정을 조절하는 주요 억제성 신경전달 물질인 GABA를 생산, 분비할 수 있다. GABA에 의해 조절되는 이 시스템의 기능장애는 불안과 우울증과 같은 정신질환과 관련이 매우 깊으며(Schousboe A & Waagepetersen HS 2007), 이들 미생물이 생산한 GABA가 장-뇌 축에 영향을 미칠 수 있다는 주장이 제기되었다(Roshchina VV 2010). 앞서 언급했듯이 우울증과 불안증은 전 세계적으로 유병률이 높은 질환이며 이를 치료할 수 있는 다양한 치료 옵션이 존재하지만, 대부분의 치료에는 바람직하지 않은 2차 부작용이 수반된다. 따라서 이러한 우울증이나 불안증뿐만 아니라 수면장애, 스트레스 등에 효과를 보일 수 있는 사이코바이오틱스의 개발은 정신 장애를 예방하고 치료하는 더욱 안전하고 새로운 접근방식이 될 수 있다(Foster JA & McVey Neufeld KA 2013).
김치는 다양한 유산균에 의한 자연적 젖산발효가 일어나는 한국인의 식이에서 매우 중요한 채소발효식품으로, 유산균에 의한 다양한 대사산물들이 생산된다. 그 중에서도 인체의 건강에 영향을 끼칠 수 있는 GABA, 오르니틴(ornithine), 세포외 다당류(exopolysaccharides: EPS) 등을 생산하는 유산균이 다량 포함되어 있어, 기능성 유산균을 분리하기 위한 좋은 분리원이기도 하다(Lee SJ 등 2021). 본 총설은 주요억제성 신경전달 물질인 GABA가 수면, 스트레스 등의 정신건강에 미치는 영향과 GABA를 생산하는 유산균을 사이코바이오틱스로 적용하기 위한 동물연구, 그리고 그 사이코바이오틱스의 후보가 될 수 있는 김치 유래 GABA 생산균주들에 대해서 살펴볼 것이다.
GABA 투여가 정신건강에 미치는 영향
GABA는 포유류의 중추신경계 외에도 차, 토마토, 콩, 발아 쌀, 일부 발효 식품 등 다양한 식품에 자연적으로 존재하기 때문에 정상적인 식단을 통해서도 얻을 수 있다(Diana M 등 2014; Rashmi D 등 2018). 그러나 특별히 GABA 함량을 강화하기 위해 설계된 식품이 아닌 일반적인 식품의 GABA 함량은 기능성을 발휘하기에는 부족한데, 100 mg의 GABA를 섭취하기 위해서는 다른 식품에 비해 상대적으로 GABA 함량이 높은 익히지 않은 시금치를 2.34 kg이나 섭취하여야한다. 따라서 GABA 투여를 통해 정신건강에 미치는 효과를 살펴본 대부분의 연구들은 미생물을 통해 생합성한 GABA를 사용하거나 특정한 조건에서 GABA 함량을 증가시킨 천연식품을 사용하였으며 정신건강에 미치는 영향에 관한 연구는 주로 수면과 스트레스에 끼치는 영향에 대한 연구들이다.
GABA의 섭취가 수면에 미치는 영향에 대한 연구는 일본에서 활발하게 진행되었다. 폐경 후의 여성에게 GABA가 풍부한 탈지 미강(1일 GABA 섭취량: 26.4 mg)을 섭취시켰을 때 대조군에 비해 68%의 수면 장애 점수 개선율을 나타내었다(Okada T 등 2000). GABA를 함유한 초콜릿(GABA함량: 100 mg) 또는 위약 초콜릿을 38명의 노인에게 4주간 섭취 시켰을 때 위약 그룹에 비해 수면의 질이 개선되고 야간뇨의 빈도가 감소했다고 보고하고 있다(Yamatsu A 등 2013). 미생물 발효로 생산된 GABA 100 mg과 개정향풀(Apocynum venetum) 잎 추출물 50 mg을 각각 투여하거나 동시에 경구투여 하였을 때, GABA 섭취그룹에서는 수면 대기 시간이 3.5분 단축되었고 개정향풀 잎 추출물 섭취그룹은 비렘수면(Non-REM(rapid eye movement)) 시간이 7.6% 증가하였으며 동시 투여한 그룹에서는 수면 대기시간이 대조군에 비해 4.3분 단축되고 비렘수면 시간이 5.1% 증가하여 GABA는 빨리 잠이 들도록 돕고, 개정향풀 잎 추출물은 깊은 수면을 유도하는 것으로 나타났다(Yamatsu A 등 2015). 또한 후속연구에서 100 mg의 GABA와 4.7 mg의 글루탐산(glutamic acid)등을 함유한 GABA 파우더를 경구투여 한 후 뇌파검사와 혈중 GABA 농도를 측정한 결과 각성 점수가 개선되고 수면 잠복기가 단축되었으며 비렘수면의 증가를 나타내었으며, 혈중 GABA의 농도는 경구 섭취 후 빠르게 증가하였고 섭취후 30분 후에 가장 높게 나타났다가 60분이 지나면 급격히 감소하였다(Yamatsu A 등 2016). 국내에서 불면증 증상을 호소하는 40명의 환자를 대상으로 발효 현미 배아에서 추출한 고농도 GABA를 4주간 경구 투여하였을 때(1일 GABA 섭취량: 300 mg), 수면잠복기가 치료 전 13.4±15.7분에서 치료 후 5.7±6.2분으로 감소했다. 또한 수면 효능은 GABA 투여군에서만 79.4±12.9%에서 86.1±10.5%로 증가하였다(Byun JI 등 2018). GABA 섭취가 수면에 미치는 영향에 대한 여러 연구들을 종합적으로 살펴보았을 때, 비렘수면 시간의 증가에 대한 결과들은 같은 연구그룹의 동일한 투여 요법을 사용한 연구에서도 다른 결과를 보이는 등 일관된 결과를 보여주지 못한 것으로 보인다(Yamatsu A 등 2015; Yamatsu A 등 2016). 반면에 수면 잠복기의 감소는 여려 연구에서 일관된 결과를 나타내었다. 이러한 결과는 GABA가 주로 수면 시작과 이른밤에 발생하는 수면의 초기 단계에 영향을 미치지만 밤 늦게 발생하는 수면 단계에서는 영향을 미치지 않는 것으로 보이며, GABA 섭취 시 혈중 GABA 농도가 60분 후에 급격히 감소하는 사실로 설명이 가능하다. 따라서 GABA의 섭취는 수면 유지보다는 자연스러운 수면 유도에 더 효과적이라고 할 수 있다(Hepsomali P 등 2020). 이러한 수면 유도 효과에 따라 국내에서도 2022년 발효 GABA 분말이 수면의 질 개선에 도움을 줄 수 있는 개별인정형 건강기능식품 원료로 등재되었으며 일일 섭취량은 375 mg이다.
GABA 섭취가 스트레스에 미치는 영향을 조사한 연구들은 수면연구보다 더 많은 연구가 수행되었다. 13명의 피험자를 대상으로 GABA 섭취가 뇌파에 미치는 영향을 평가한 결과, GABA 섭취가 알파파를 유의미하게 증가시키고 베타파는 감소시켰는데 GABA가 이완을 유도하고 불안을 감소시킬 수 있다는 것을 나타낸다(Abdou AM 등 2006). 또한 고소공포증이 있는 8명의 피험자를 대상으로 피험자에게 스트레스를 줄 수 있는 현수교를 건너는 스트레스 상황에 놓이게 하여 타액의 IgA 수치를 모니터링 한 결과, 위약그룹에서는 IgA 수치가 감소한 반면 GABA 섭취군에서는 유의미하게 높은 수치를 나타내어 GABA가 천연 이완제로 작용할 수 있음을 시사하였다(Abdou AM 등 2006). 하룻밤 금식 후 생합성 GABA 30 mg을 함유한 캡슐을 식후 섭취한 후 30분 및 60분 동안 투여 전후에 심박수 변동성 파워 스펙트럼 분석을 통해 자율신경계 활동을 평가한 결과 총 파워는 30분 및 60분 후에 증가였고, 고주파 파워는 30분 후에 기준치에 비해 증가하였다(Fujibayashi M 등 2008). GABA 31.8 mg이 함유된 식물성 정제를 건강한 성인에게 섭취하게 하였을 때 대조군은 심박수가 증가하였지만 GABA 투여군에서는 심박수 증가가 나타나지 않았으며, 심박 변이도를 측정하였을때 저주파/고주파의 비율이 대조군은 급격하게 증가한 반면 GABA 식물성 정제 섭취군에서는 약간의 증가만을 나타내었다(Okita Y 등 2009). 만성피로 진단을 받은 피험자들에게 GABA가 함유된 음료를 음용하게 한 후 산술 과제인 우치다-크래펠린 정신진단 테스트(Uchda-Kraepelin performance test)를 활용하여 스트레스를 유발시켰을 때 0 mg, 25 mg GABA 함유 음료를 음용한 그룹들과 달리 50 mg GABA를 섭취한 그룹에서 시각 아날로그 척도와 기분상태 프로파일검사 모두에서 심리적 피로도가 유의적으로 낮게 나타났으며, 신체적 피로의 지표인 크로모그라닌 A(chromogranin A)수치와 스트레스 호르몬인 코르티솔(cortisol) 수치가 0 mg 섭취 그룹에 비해 GABA 섭취군에서 유의적으로 낮게 나타났다(Kanehira T 등 2011). 성인 63명을 대상으로 GABA 100 mg이 함유된 캡슐을 섭취하였을 때 우치다-크래펠린 정신진단 테스트를 진행하며 뇌파를 측정한 결과 GABA 섭취 30분 후 알파파와 베타파 밴드의 파워를 감소시켰는데, 이는 GABA가 정신적 과제로 인해 유발된 스트레스를 완화했을 수 있음을 시사한다(Yoto A 등 2012). 생합성 GABA를 활용한 4주간의 중재 연구에서 위약 투여 그룹에서 GABA 사용 2주 및 4주 후에 코르티솔 수치가 증가하는 것이 관찰되었지만, GABA 투여 그룹에서는 증가가 나타나지 않아 스트레스를 억제하는 것으로 나타났다(Yamatsu A 등 2013). GABA 농축장치를 활용하여 고함량의 GABA가 포함된 백미를 제조하여 8주 동안 매일 섭취하였을 때(1일 GABA 섭취량: 16.8 mg) 일반 백미를 섭취한 그룹(1일 GABA 섭취량: 4.1 mg)에 비해 코르티솔의 혈중 농도가 감소하고 지방의 이화과정에 관여하는 아디포넥틴(adiponectin) 수치가 증가하는 경향을 나타내었다(Yoshida S 등 2015). GABA 강화 우롱차(2.01 mg GABA/200 mL)와 일반 우롱차(0.25 mg GABA/200 mL)를 스트레스가 낮은 그룹과 높은 그룹에 음용하게 하였을 때, GABA 강화 우롱차 섭취는 즉각적인 스트레스 점수를 유의미하게 감소시키고 심박변이도를 유의미하게 개선했다(Hinton T 등 2019). 경구 GABA 섭취가 스트레스에 끼치는 영향에 대한 연구를 종합해 보면 자율신경계와 중추신경계의 스트레스 마커들이 GABA 섭취로 개선되는 것이 확인 되었는데 30 mg까지의 저용량 섭취는 자율신경계 스트레스 마커에 영향을 미치고, 100 mg까지의 고용량에서는 중추신경계 스트레스 마커에 영향을 미치는 것으로 보인다. 또한 천연식품에 존재하는 GABA를 섭취하는 경우보다 생합성 GABA를 섭취하는 경우에 더 많은 용량을 투여하여야 같은 효과를 나타낸다는 것도 확인되었다. 이는 천연식품에 같이 존재하는 다른 생리활성 성분에 의한 상승효과일 수 있다.
GABA 생산 유산균의 사이코바이오틱스로의 적용
GABA를 직접 섭취하였을 경우에 기대할 수 있는 여러 가지 생리적인 기능들은 GABA를 생산하는 살아있는 유산균을 섭취하였을 경우에도 같은 생리적인 효과를 발휘할 것으로 기대할 수 있다. GABA 생산 유산균이 장에 도달하여 잘정착한다면 식품으로 섭취하는 단백질에 포함된 L-glutamate를 전구체로 장에서 GABA를 생산할 수 있을 것이다. 물론 산성 조건에서 GAD가 최적의 활성을 나타내기 때문에(Sarasa SB 등 2020; Yogeswara IBA 등 2020), 장내 환경에서 시험관에서 같이 높은 수율로 GABA를 생산하지 못할 가능성이 크다. 그러나 작은 양의 GABA가 장내에서 생산되더라도, 장내에 정착한 유산균은 지속적으로 GABA를 생산할것으로 예상되기 때문에 동물실험과 임상실험으로 그 효과를 검증할 필요성이 있다. 현재까지 사이코바이오틱스로서의 효과를 규명하기 위해 GABA 생산 유산균을 인체에 투여한 임상 실험에 대한 보고는 없으며 실험동물에 GABA 생산 유산균을 투여한 몇 가지 연구가 존재한다.
본태성 진전(essential tremor) 환자의 장내 미생물은 정상인에 비해 GABA 생성 능력이 떨어지고, 분변의 GABA 농도가 감소하는 것으로 확인되었으며, 본태성 진전 환자의 장내 미생물을 본태성 진전 쥐 모델에 이식하면 떨림 지속 시간이 연장되고 운동성이 저하되는 것으로 나타나 장내 미생물과의 연관성이 제기되었다. 우수한 GABA 생산능력을 보인 Lactiplantibacillus plantarum L5를 본태성 진전 마우스에게 경구 투여하면 떨림의 정도가 현저히 감소하고 운동 능력과 파지력이 향상되었다(Zhong HJ 등 2023). 또한 L5의 투여는 장내 미생물 구성을 재구성시키고 장점막의 미생물총의 GABA 생산 능력을 보충하며 소뇌의 GABA 농도를 증가시키고 중추 신경계의 염증을 감소시키는 것으로 나타났다(Zhong HJ 등 2023).
MSG(monosodium L-glutamate)가 포함된 합성배지에서 배양 6시간만에 GAD operon이 활성화되면서 GABA를 생산하고, 내산성 메커니즘 유전자들이 동시에 활성화되는 것으로 열려진 Levilactobacillus brevis Lbr-6108TM(이전 이름: Lactobacillus brevis DCP 6108)을 투여한 스트렙토조토신(streptozotocin) 유도 당뇨쥐에서 혈중 포도당 수치가 당뇨대조군에 비해 유의적으로 감소하는 것이 나타나 GABA 생산프로바이오틱스의 투여가 당뇨에도 효과를 보일 수 있는 가능성이 제시되었다(Marques TM 등 2016; Banerjee S 등 2021). 또한 식이요법으로 대사기능 장애를 유발한 마우스에 Lev. brevis Lbr-6108TM이나 Lev. brevis DSM32386과 같은 GABA 생성 균주를 투여는 혈장 콜레스테롤 제거율이 개선되고, 강제 수영 테스트 중 절망과 같은 행동의 감소, 기저코르티코스테론(corticosterone) 생성 감소 등의 대사 장애 및 우울증과 같은 행동이상의 개선할 수 있는 잠재력을 보였다(Patterson E 등 2019). 우울증과 관련된 또다른 연구로는 효율적으로 GABA를 생산하는 Lacti. plantarum 90sk와 Bifidobacterium adolescentis 150 균주를 2주간 투여한 BALB/c 마우스가 강제 수영 테스트에서 우을증과 유사한 행동이 감소하였으며, 그 효과는 선택적 세로토닌 재흡수 억제제인 플루옥세틴(fluoxetine)과 유사한 것으로 나타났다(Yunes RA 등 2020).
섬유 근육통, 만성 피로 및 통증이 있는 일부 환자의 경우 glutamate의 혈중 농도가 정상인에 비해 더 높게 나타나는데, GABA 생산능력이 높은 B. adolescentis IPLA60004 균주와 GAD가 없는 B. adolescentis LGM10502를 마우스에 각각 투여하였을 때 IPLA60004 균주 투여군에서는 혈중 glutamate가 유의미하게 감소했으나, LGM10502 균주 투여군에서는 감소를 나타내지 않았다(Royo F 등 2023). 또한 GABA 생성균주를 투여하면 비-GABA 생성 균주를 투여한 동물에서 관찰된 것과는 다른 특정 패턴의 장내 미생물 조절이 발생한다는 것이 확인되어, B. adolescentis IPLA60004 투여로 인해 혈청 Glutamate 수치를 낮추는 데 기여하는 메커니즘이 GABA 생성 균주로 인한 장내균총의 변화가 원인일 것으로 추정하였다(Tamés H 등 2024). B. adolescentis IPLA60004 균주를 활용한 발효유를 제조하는 연구도 진행되었는데, MSG의 GABA 전환율이 최대 70%에 달해 높은 GABA 농도와 살아있는 B. adolescentis IPLA60004 균주를 포함하는 발효유를 제조 가능했다(Tamés H 등 2023).
김치 유래 GABA 생산 유산균과 그 응용
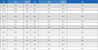
미생물 중 GABA를 생산하는 주요 종은 유산균이며, 발효식품에 분리되는 Levi. brevis가 가장 중요한 종이다. 미생물에서 GABA는 혐기성 조건에서 GAD에 의한 L-glutamate의 비가역적 탈탄산 반응으로 생성되며, 이 반응은 주로 산성의 환경 조건에서 이루어진다. GAD 활성의 최적 pH는 일반적으로 4.0∼5.5이며, 활성을 위해서 pyridoxal 5-phosphate가 보조인자로 필요하다(Cui Y 등 2020; Yogeswara IBA 등 2020). 유산균에서 GABA 생성은 산성스트레스 반응의 일부인데, L-glutamate를 GABA로 전환함으로써 카르복실기를 하나 제거할 수 있어 세포 내부의 양성자 숫자를 줄임으로서 세포내 pH가 낮아지는 것을 막을 수 있는 효과가 발휘되게된다(Sarasa SB 등 2020; Yogeswara IBA 등 2020; Fig. 1). 발효되어 섭취하기 최적기인 김치의 pH는 4.2∼4.4로 알려져 있는데(Kim J 등 2012), 이러한 조건은 GABA를 생산하는 유산균들의 GAD의 활성이 최적인 상태라고 할 수 있다. 따라서 GABA를 생성하는 많은 유산균들이 김치로부터 분리되는데, Lactococcus lactis(Hwang E & Park JY 2020), Lacti. plantarum(Park SY 등 2013a; Park SY 등 2013b; Park SY 등 2014; Kim J 등 2022), Latilactobacillus sakei(Yu JJ & Oh SH 2011), Lentilactobacillus buchneri(Cho YR 등 2007; Cho SY 등 2011), Leuconostoc mesenteroides(Ahn J & Park JY 2023), Lev. brevis(Lim SI 등 2013; Seo MJ 등 2013; Binh TT 등 2014; Wu Q & Shah NP 2015; Lim HS 등 2017; Kim YL 등 2023), Levilactobacillus zymae(Park JY 등 2014) 등이 보고되었다(Table 1). 김치에서 분리된 유산균들의 GABA 생산능은 2.0∼430.6 mM로 종과 균주에 따라 생산능에 큰 차이를 보였다. 그러나 각각의 연구에서 사용된 배양조건(온도, 배양시 pH 등)과 첨가된 GABA 전구체(MSG 혹은 L-glutamate)의 농도, GABA 함량 측정 방법(HPLC 혹은 GABase 측정법) 등이 모두 다르기 때문에 보고된 내용만으로 생산력을 직접 비교하는 것은 무리가 따르는데, 같은 Lev. brevis라하더라도 GABA 생산능이 9.5∼430.6 mM로 큰 차이를 보인것도 이에 기인할 가능성이 존재한다.
김치에는 다양한 GABA 생산 유산균이 존재하기 때문에 이들 중에서 장내에 GABA를 공급함으로써 장-뇌 축에 긍정적인 영향을 끼칠 수 있는 잠재적 사이코바이오틱스 후보자를 선발하여 적용하는 연구들이 최근에 보고되고 있는데, Lacti. plantarum FBT215(Kim J 등 2022), Leu. mesenteroides K1627(Ahn J & Park JY 2023), Lactococcus spp. K1180(Ahn J & Park JY 2024) 등이 이러한 시도의 일환이었다. 또한 GABA 생산 유산균을 김치 종균으로 사용함으로써 GABA 함량이 높은 김치를 개발하려는 연구들도 상당히 진행되었는데, Lati. sakei OPK 2-59 균주를 종균으로 MSG를 0.1% 첨가한 김치를 김치냉장고에서 보관했을 때 21일째에 GABA 함량이 18 mg/100 g으로 종균없이 MSG만 첨가한 김치보다 3배 더 높았다(Seok JH 등 2008). GABA 생산 Lenti. buchneri를 종균으로 30℃에서 발효하여 제조한 신김치는 61.65 mg/100 g의 GABA 함량을 나타내어 종균을 첨가하지 않은 신김치(8.1 mg/100 g)보다 8배나 높은 GABA 함량을 나타내었다. Lev. zymae GU240 균주를 종균으로 사용하고 GABA 전구체로 L-glutamate, MSG, 또는 다시마 추출물을 각각 첨가하여 —1℃에서 20주 동안 발효를 하였을 때, 발효 8주차에 종균과 GABA 전구체 무첨가 대조군 김치와 종균만 첨가된 김치는 GABA 함량이 62.0 mg/100 g과 58.9 mg/100 g으로 비슷한 수준의 GABA 함량을 나타내었지만, 1% MSG와 종균을 함께 첨가한 김치는 120.3 mg/100 g의 GABA 함량을 나타내 약 2배 정도 높게 나타났다. 다시마 추출물을 첨가한 경우는 76.3 mg/100 g의 함량을 나타내 GABA 함량 증가는 미미하였다(Lee KW 등 2018). Leu. mesenteroides K1627 균주의 경우 종균으로 김치발효를 실시한 연구 결과는 없으나, GABA 함량이 높은 기능성 김치 제조용 종균개발의 잠재성은 매우 높다(Ahn J & Park JY 2023). Leu. mesenteroides는 김치 발효에서 젖산뿐만 아니라 만니톨(mannitol)과 같은 대사산물을 생산하여 시원한 단맛을 부여하기 때문에 김치 발효 종균으로 이상적이다(Jung JY 등 2012). 또한 Leu. mesenteroides K1627 균주는 과다한 젖산의 생산으로 김치를 산패시킬 수 있는 것으로 알려진 Lacti. plantarum, Lactiplantibacillus pentosus, Lati. sakei 등의 동종 젖산 발효 유산균을 저해할 수 있는 것으로 확인되어 그 보존성도 우수할 것으로 기대되고 있다(Ahn J & Park JY 2023). 앞으로 사이코바이오틱스로 김치에서 분리된 GABA 생산 유산균을 직접 동물이나 인간에게 투여하거나, 김치 종균으로 사용하여 생산한 고 함량 GABA 김치의 섭취의 효과에 대한 후속 연구가 지속적으로 축적된다면 김치에서 분리된 GABA 생산 유산균의 활용범위는 더 넓어질 것으로 기대된다.
결 론
GABA의 직접적인 섭취는 인체에 자연스러운 수면 유도에 효과적이고, 스트레스 완화에 도움을 준다는 다양한 연구 결과를 볼 수 있다. 특히 GABA의 저용량 섭취는 자율신경계를 조절하여 스트레스를 완화시킬 수 있고, 고용량 섭취시에는 중추신경계에 영향을 주어 스트레스를 감소시킬 수 있는 것으로 보인다. GABA 생산능이 있는 유산균을 실험동물에게 경구투여하였을 때 본태성 진전, 우울증과 같은 정신건강과 신경계 질환에 효과를 보였으며, 실험동물에서 당뇨, 섬유근육통, 만성피로 및 통증에도 효과를 나타내었다. 따라서 GABA 생산능이 있는 유산균을 섭취하였을 때 인체에서도 정신건강과 신경계 질환에 긍정적인 효과를 기대할 수 있는 사이코바이오틱스로서 적용 가능성은 매우 높다. 뿐만 아니라 GABA 생산능이 있는 유산균을 인체에 적용했을 때, GABA를 직접 섭취했을 때 기대할 수 있었던 자연스러운 수면 유도나 스트레스 완화 효과 또한 기대할 수 있을 것이다. 김치에는 다양한 대사산물을 만들어내는 유산균이 다수 존재하고 이들 중에서는 GABA를 생산하는 유산균들도 많이 존재한다. 앞으로 많은 동물실험과 임상연구가 필요하지만, 김치 유래 GABA 생산 유산균들은 사이코바이오틱스로서 잠재적 가능성이 풍부하다고 할 수 있다.
References
-
Abdou AM, Higashiguchi S, Horie K, Kim M, Hatta H, Yokogoshi H (2006) Relaxation and immunity enhancement effects of γ-aminobutyric acid (GABA) administration in humans. Biofactors 26(3): 201-208.
[https://doi.org/10.1002/biof.5520260305]

-
Ahn JH, Park JY (2023) Potential of γ-aminobutyric acid-producing Leuconostoc mesenteroides strains isolated from Kimchi as a starter for high-γ-aminobutyric acid Kimchi fermentation. Prev Nutr Food Sci 28(4): 492-501.
[https://doi.org/10.3746/pnf.2023.28.4.492]

-
Ahn JH, Park JY (2024) Isolation of γ-aminobutyric acid (GABA)-producing Lactococcus spp. strains from Kimchi and their potential as probiotics. J Korean Soc Food Sci Nutr 53: in press.
[https://doi.org/10.3746/jkfn.2024.53.2.190]

- Al-Kuraishy HM, Hussian NR, Al-Naimi MS, Al-Gareeb AI, Al-Mamorri F, Al-Buhadily AK (2021) The potential role of pancreatic γ-aminobutyric acid (GABA) in diabetes mellitus: A critical reappraisal. Int J Prev Med 12: 19.
-
Banerjee S, Poore M, Gerdes S, Nedveck D, Lauridsen L, Kristensen HT, Jensen HM, Byrd PM, Ouwehand AC, Patterson E, Morovic W (2021) Transcriptomics reveal different metabolic strategies for acid resistance and gammaaminobutyric acid (GABA) production in select Levilactobacillus brevis strains. Microb Cell Fact 20(1): 173.
[https://doi.org/10.1186/s12934-021-01658-4]

-
Binh TTT, Ju WT, Jung WJ, Park RD (2014) Optimization of γ-amino butyric acid production in a newly isolated Lactobacillus brevis. Biotechnol Lett 36(1): 93-98.
[https://doi.org/10.1007/s10529-013-1326-z]

-
Bueno-Antequera J, Munguía-Izquierdo D (2020) Exercise and depressive disorder. Adv Exp Med Biol 1228: 271-287.
[https://doi.org/10.1007/978-981-15-1792-1_18]

-
Byun JI, Shin YY, Chung SE, Shin WC (2018) Safety and efficacy of gamma-aminobutyric acid from fermented rice germ in patients with insomnia symptoms: A randomized, double-blind trial. J Clin Neurol 14(3): 291-295.
[https://doi.org/10.3988/jcn.2018.14.3.291]

-
Cellot G, Cherubini E (2014) GABAergic signaling as therapeutic target for autism spectrum disorders. Front Pediatr 2: 70.
[https://doi.org/10.3389/fped.2014.00070]

-
Chisholm D, Sweeny K, Sheehan P, Rasmussen B, Smit F, Cuijpers P, Saxena S (2016) Scaling-up treatment of depression and anxiety: A global return on investment analysis. Lancet Psychiatry 3(5): 415-424.
[https://doi.org/10.1016/S2215-0366(16)30024-4]

-
Cho SY, Park MJ, Kim KM, Ryu JH, Park HJ (2011) Production of high γ-aminobutyric acid (GABA) sour Kimchi using lactic acid bacteria isolated from Mukeunjee Kimchi. Food Sci Biotechnol 20(2): 403-408.
[https://doi.org/10.1007/s10068-011-0057-y]

- Cho YR, Chang JY, Chang HC (2007) Production of γ-aminobutyric acid (GABA) by Lactobacillus buchneri isolated from Kimchi and its neuroprotective effect on neuronal cells. J Microbiol Biotechnol 17(1): 104-109.
-
Cui Y, Miao K, Niyaphorn S, Qu X (2020) Production of gamma-aminobutyric acid from lactic acid bacteria: A systematic review. Int J Mol Sci 21(3): 995.
[https://doi.org/10.3390/ijms21030995]

-
Dastgerdi AH, Sharifi M, Soltani N (2021) GABA administration improves liver function and insulin resistance in offspring of type 2 diabetic rats. Sci Rep 11(1): 23155.
[https://doi.org/10.1038/s41598-021-02324-w]

-
DeFelipe J (1993) Neocortical neuronal diversity: Chemical heterogeneity revealed by colocalization studies of classic neurotransmitters, neuropeptides, calcium-binding proteins, and cell surface molecules. Cereb Cortex 3(4): 273-289.
[https://doi.org/10.1093/cercor/3.4.273]

-
Diana M, Quílez J, Rafecas M (2014) Gamma-aminobutyric acid as a bioactive compound in foods: A review. J Funct Foods 10: 407-420.
[https://doi.org/10.1016/j.jff.2014.07.004]

-
Dinan TG, Stanton C, Cryan JF (2013) Psychobiotics: A novel class of psychotropic. Biol Psychiatry 74(10): 720-726.
[https://doi.org/10.1016/j.biopsych.2013.05.001]

-
El Aidy S, Dinan TG, Cryan JF (2015) Gut microbiota: The conductor in the orchestra of immune–neuroendocrine communication. Clin Ther 37(5): 954-967.
[https://doi.org/10.1016/j.clinthera.2015.03.002]

-
Evans-Lacko S, Aguilar-Gaxiola S, Al-Hamzawi A, Alonso J, Benjet C, Bruffaerts R, Chiu WT, Florescu S, de Girolamo G, Gureje O, Haro JM, He Y, Hu C, Karam EG, Kawakami N, Lee S, Lund C, Kovess-Masfety V, Levinson D, Navarro-Mateu F, Pennell BE, Sampson NA, Scott KM, Tachimori H, Ten Have M, Viana MC, Williams DR, Wojtyniak BJ, Zarkov Z, Kessler RC, Chatterji S, Thornicroft G (2018) Socio-economic variations in the mental health treatment gap for people with anxiety, mood, and substance use disorders: Results from the WHO World Mental Health (WMH) surveys. Psychol Med 48(9): 1560-1571.
[https://doi.org/10.1017/S0033291717003336]

-
Foster JA, McVey Neufeld KA (2013) Gut-brain axis: How the microbiome influences anxiety and depression. Trends Neurosci 36(5): 305-312.
[https://doi.org/10.1016/j.tins.2013.01.005]

-
Fujibayashi M, Kamiya T, Takagaki K, Moritani T (2008) Activation of autonomic nervous system activity by the oral ingestion of GABA. J Jpn Soc Food Sci 61(3): 129-133.
[https://doi.org/10.4327/jsnfs.61.129]

-
Hepsomali P, Groeger JA, Nishihira J, Scholey A (2020) Effects of oral gamma-aminobutyric acid (GABA) administration on stress and sleep in humans: A systematic review. Front Neurosci 14: 923.
[https://doi.org/10.3389/fnins.2020.00923]

-
Hinton T, Jelinek HF, Viengkhou V, Johnston GA, Matthews S (2019) Effect of GABA-fortified Oolong tea on reducing stress in a university student cohort. Front Nutr 6: 27.
[https://doi.org/10.3389/fnut.2019.00027]

-
Hwang EY, Park JY (2020) Isolation and characterization of gamma-aminobutyric acid (GABA)-producing lactic acid bacteria from Kimchi. Curr Top Lact Acid Bact Probiotics 6(2): 64-69.
[https://doi.org/10.35732/ctlabp.2020.6.2.64]

-
Jung JY, Lee SH, Lee HJ, Seo HY, Park WS, Jeon CO (2012) Effects of Leuconostoc mesenteroides starter cultures on microbial communities and metabolites during Kimchi fermentation. Int J Food Microbiol 153(3): 378-387.
[https://doi.org/10.1016/j.ijfoodmicro.2011.11.030]

-
Kanehira T, Nakamura Y, Nakamura K, Horie K, Horie N, Furugori K, Sauchi Y, Yokogoshi H (2011) Relieving occupational fatigue by consumption of a beverage containing γ-amino butyric acid. J Nutr Sci Vitaminol 57(1): 9-15.
[https://doi.org/10.3177/jnsv.57.9]

-
Kim JS, Bang JH, Beuchat LR, Kim HK, Ryu JH (2012) Controlled fermentation of Kimchi using naturally occurring antimicrobial agents. Food Microbiol 32(1): 20-31.
[https://doi.org/10.1016/j.fm.2012.05.007]

-
Kim JG, Lee MH, Kim MS, Kim GH, Yoon SS (2022) Probiotic properties and optimization of gamma-aminobutyric acid production by Lactiplantibacillus plantarum FBT215. J Microbiol Biotechnol 32(6): 783-791.
[https://doi.org/10.4014/jmb.2204.04029]

-
Kim YL, Nguyen TH, Kim JS, Park JY, Kang CH (2023) Isolation of γ-aminobutyric acid (GABA)-producing lactic acid bacteria with anti-inflammatory effects from fermented foods in Korea. Ferment 9(7): 612.
[https://doi.org/10.3390/fermentation9070612]

-
Lee KW, Shim JM, Yao Z, Kim JA, Kim JH (2018) Properties of Kimchi fermented with GABA-producing lactic acid bacteria as a starter. J Microbiol Biotechnol 28(4): 534-541.
[https://doi.org/10.4014/jmb.1709.09011]

-
Lee SJ, Jeon HS, Yoo JY, Kim JH (2021) Some important metabolites produced by lactic acid bacteria originated from Kimchi. Foods 10(9): 2148.
[https://doi.org/10.3390/foods10092148]

-
Lim HS, Cha IT, Roh SW, Shin HH, Seo MJ (2017) Enhanced production of gamma-aminobutyric acid by optimizing culture conditions of Lactobacillus brevis HYE1 isolated from Kimchi, a Korean fermented food. J Microbiol Biotechnol 27(3): 450-459.
[https://doi.org/10.4014/jmb.1610.10008]

-
Seo MJ, Lee JY, Nam YD, Lee SY, Park SL, Yi SH, Lee MH, Roh SW, Choi HJ, Lim SI (2013) Production of γ-aminobutyric acid by Lactobacillus brevis 340G isolated from Kimchi and its application to skim milk. Food Eng Prog 17(4): 418-423.
[https://doi.org/10.13050/foodengprog.2013.17.4.418]

-
Marques TM, Patterson E, Wall R, O'Sullivan O, Fitzgerald GF, Cotter PD, Dinan TG, Cryan JF, Ross RP, Stanton C (2016) Influence of GABA and GABA-producing Lactobacillus brevis DPC 6108 on the development of diabetes in a streptozotocin rat model. Benef Microbes 7(3): 409-420.
[https://doi.org/10.3920/BM2015.0154]

-
Okada T, Sugishit T, Murakami T, Murai H, Saikusa T, Horino T, Onoda A, Kajimoto O, Takahashi R, Takahashi T (2000) Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration. J Jpn Soc Food Sci Technol 47(8): 596-603.
[https://doi.org/10.3136/nskkk.47.596]

-
Okita Y, Nakamura H, Kouda K, Takahashi I, Takaoka T, Kimura M, Sugiura T (2009) Effects of vegetable containing gamma-aminobutyric acid on the cardiac autonomic nervous system in healthy young people. J Physiol Anthropol 28(3): 101-107.
[https://doi.org/10.2114/jpa2.28.101]

-
Park JY, Jeong SJ, Kim JH (2014) Characterization of a glutamate decarboxylase (GAD) gene from Lactobacillus zymae. Biotechnol Lett 36(9): 1791-1799.
[https://doi.org/10.1007/s10529-014-1539-9]

-
Park SY, Kim KS, Lee MK, Lim SD (2013a) Physiological characteristics and GABA production of Lactobacillus plantarum K255 isolated from Kimchi. Food Sci Anim Resour 33(5): 595-602.
[https://doi.org/10.5851/kosfa.2013.33.5.595]

-
Park SY, Lee JW, Lim SD (2014) The probiotic characteristics and GABA production of Lactobacillus plantarum K154 isolated from Kimchi. Food Sci Biotechnol 23(6): 1951-1957.
[https://doi.org/10.1007/s10068-014-0266-2]

- Park SY, Shim HY, Kim KS, Lim SD (2013b) Physiological characteristics and GABA production of Lactobacillus plantarum K74 isolated from Kimchi. J Dairy Sci Biotechnol 31(2): 143-152.
-
Patterson E, Ryan PM, Wiley N, Carafa I, Sherwin E, Moloney G, Franciosi E, Mandal R, Wishart DS, Tuohy K, Ross RP, Cryan JF, Dinan TG, Stanton C (2019) Gammaaminobutyric acid-producing lactobacilli positively affect metabolism and depressive-like behaviour in a mouse model of metabolic syndrome. Sci Rep 9(1): 16323.
[https://doi.org/10.1038/s41598-019-51781-x]

-
Penninx BW, Pine DS, Holmes EA, Reif A (2021) Anxiety disorders. Lancet 397(10277): 914-927.
[https://doi.org/10.1016/S0140-6736(21)00359-7]

-
Rashmi D, Zanan R, John S, Khandagale K, Nadaf A (2018) γ-aminobutyric acid (GABA): Biosynthesis, role, commercial production, and applications. Stud Nat Prod Chem 57: 413-452.
[https://doi.org/10.1016/B978-0-444-64057-4.00013-2]

-
Rhee SH, Pothoulakis C, Mayer EA (2009) Principles and clinical implications of the brain–gut–enteric microbiota axis. Nat Rev Gastroenterol Hepatol 6(5): 306-314.
[https://doi.org/10.1038/nrgastro.2009.35]

-
Roberts E, Frankel S (1950) Gamma-aminobutyric acid in brain: Its formation from glutamic acid. J Biol Chem 187(1): 55-63.
[https://doi.org/10.1016/S0021-9258(19)50929-2]

-
Roberts E, Eidelberg E (1960) Metabolic and neurophysiological roles of γ-aminobutyric acid. Vol II. pp 279-332. In: International review of neurobiology. Pfeiffer CC, Smythies JR (eds). Academic Press, New York, NY, USA.
[https://doi.org/10.1016/S0074-7742(08)60125-7]

-
Roshchina VV (2010) Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells. pp 17-52. In: Microbial endocrinology: Interkingdom signaling in infectious disease and health. Lyte M, Freestone PPE (eds). Springer, New York, NY, USA.
[https://doi.org/10.1007/978-1-4419-5576-0_2]

-
Royo F, Tames H, Bordanaba-Florit G, Cabrera D, Azparren-Angulo M, Garcia-Vallicrosa C, Margolles A, Ruiz L, Ruas-Madiedo P, Falcon-Perez JM (2023) Orally administered Bifidobacterium adolescentis diminishes serum glutamate concentration in mice. Microbiol Spectr 11(4): e05063-22.
[https://doi.org/10.1128/spectrum.05063-22]

-
Sarasa SB, Mahendran R, Muthusamy G, Thankappan B, Selta DRF, Angayarkanni J (2020) A brief review on the non-protein amino acid, gamma-amino butyric acid (GABA): Its production and role in microbes. Curr Microbiol 77(4): 534-544.
[https://doi.org/10.1007/s00284-019-01839-w]

-
Schousboe A, Waagepetersen HS (2007) GABA: Homeostatic and pharmacological aspects. Prog Brain Res 160: 9-19.
[https://doi.org/10.1016/S0079-6123(06)60002-2]

-
Seo MJ, Nam YD, Lee SY, Park SL, Yi SH, Lim SI (2013) Expression and characterization of a glutamate decarboxylase from Lactobacillus brevis 877G producing γ-aminobutyric acid. Biosci Biotechnol Biochem 77(4): 853-856.
[https://doi.org/10.1271/bbb.120785]

- Seok JH, Park KB, Kim YH, Bae MO, Lee MK, Oh SH (2008) Production and characterization of Kimchi with enhanced levels of γ-aminobutyric acid. Food Sci Biotechnol 17(5): 940-946.
- Steward FC, Thompson JF, Dent CE (1949) γ-aminobutyric acid: A constituent of the potato tuber? Science 110(2861): 439-440.
-
Tamés H, Sabater C, Margolles A, Ruiz L, Ruas-Madiedo P (2023) Production of GABA in milk fermented by Bifidobacterium adolescentis strains selected on the bases of their technological and gastrointestinal performance. Food Res Int 171: 113009.
[https://doi.org/10.1016/j.foodres.2023.113009]

-
Tamés H, Sabater C, Royo F, Margolles A, Falcón JM, Ruas-Madiedo P, Ruiz L (2024) Mouse intestinal microbiome modulation by oral administration of a GABAproducing Bifidobacterium adolescentis strain. Microbiol Spectr 12(1): e02580-23.
[https://doi.org/10.1128/spectrum.02580-23]

-
Wasilewski A, Zielińska M, Storr M, Fichna J (2015) Beneficial effects of probiotics, prebiotics, synbiotics, and psychobiotics in inflammatory bowel disease. Inflamm Bowel Dis 21(7): 1674-1682.
[https://doi.org/10.1097/MIB.0000000000000364]

-
Wu Q, Shah NP (2015) Gas release-based prescreening combined with reversed-phase HPLC quantitation for efficient selection of high-γ-aminobutyric acid (GABA)-producing lactic acid bacteria. J Dairy Sci 98(2): 790-797.
[https://doi.org/10.3168/jds.2014-8808]

- Yamatsu A, Yamashita Y, Horie K, Takeshima K, Horie N, Masuda K, Yamane T, Kim M (2013) Beneficial action of GABA on sleep and frequent night urination in the elderly. Jpn Pharmacol Ther 41(10): 985-988.
-
Yamatsu A, Yamashita Y, Maru I, Yang J, Tatsuzaki J, Kim M (2015) The improvement of sleep by oral intake of GABA and Apocynum venetum leaf extract. J Nutr Sci Vitaminol 61(2): 182-187.
[https://doi.org/10.3177/jnsv.61.182]

-
Yamatsu A, Yamashita Y, Pandharipande T, Maru I, Kim M (2016) Effect of oral γ-aminobutyric acid (GABA) administration on sleep and its absorption in humans. Food Sci Biotechnol 25(2): 547-551.
[https://doi.org/10.1007/s10068-016-0076-9]

-
Yogeswara IBA, Maneerat S, Haltrich D (2020) Glutamate decarboxylase from lactic acid bacteria—A key enzyme in GABA synthesis. Microorganisms 8(12): 1923.
[https://doi.org/10.3390/microorganisms8121923]

-
Yoshida S, Haramoto M, Fukuda T, Mizuno H, Tanaka A, Nishimura M, Nishihira J (2015) Optimization of a γ-aminobutyric acid (GABA) enrichment process for Hokkaido white rice and the effects of GABA-enriched white rice on stress relief in humans. J Jpn Soc Food Sci Technol 62(2): 95-103.
[https://doi.org/10.3136/nskkk.62.95]

-
Yoto A, Murao S, Motoki M, Yokoyama Y, Horie N, Takeshima K, Masuda K, Kim M, Yokogoshi H (2012) Oral intake of γ-aminobutyric acid affects mood and activities of central nervous system during stressed condition induced by mental tasks. Amino Acids 43(3): 1331-1337.
[https://doi.org/10.1007/s00726-011-1206-6]

- Yu JJ, Oh SH (2011) γ-aminobutyric acid production and glutamate decarboxylase activity of Lactobacillus sakei OPK2-59 isolated from Kimchi. Korean J Microbiol 47(4): 316-322.
-
Yunes RA, Poluektova EU, Vasileva EV, Odorskaya MV, Marsova MV, Kovalev GI, Danilenko VN (2020) A multistrain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects. Probiotics Antimicrob Proteins 12(3): 973-979.
[https://doi.org/10.1007/s12602-019-09601-1]

-
Zhong HJ, Wang SQ, Zhang RX, Zhuang YP, Li L, Yi SZ, Li Y, Wu L, Ding Y, Zhang J, Xie X, He XX, Wu Q (2023) Supplementation with high-GABA-producing Lactobacillus plantarum L5 ameliorates essential tremor triggered by decreased gut bacteria-derived GABA. Transl Neurodegener 12(1): 58.
[https://doi.org/10.1186/s40035-023-00391-9]