단삼분획물의 항산화 및 항염 활성
Abstract
In this study, the antioxidant activities of solvent fractions obtained from the hot water extract of Salvia miltiorrhiza were investigated according to the polarity. The studies of DPPH radical scavenging activity, ABTS radical scavenging activity, superoxide anion radical scavenging activity, hydrogen peroxide scavenging activity, hydroxyl radical scavenging activity, nitric oxide radical scavenging activity, and reducing power confirmed the highest antioxidant activity in the n-butanol (n-BuOH) fraction. The highest Fe2+ chelating activity was obtained in the ethyl acetate (EtOAc) fraction, which was converse to the radical scavenging activity. Solvent fractions of Salvia miltiorrhiza hot water extract with effective antioxidant activity and the n-BuOH fraction which showed the highest antioxidant activity were applied to an in vitro experiment to confirm the effect of regulating inflammation. In addition, the highest total polyphenol content was also obtained in the n-BuOH fraction (111.97±0.41 mg GAE/). The antioxidant and anti-inflammatory activities of the n-BuOH fraction were determined to be associated with the total polyphenol content. Antioxidant activity is effective in removing harmful free radicals. Considering the results of this study, we conclude that Salvia miltiorrhiza has the potential to be applied as a functional food material for eliminating reactive oxygen species.
Keywords:
Salvia miltiorrhiza Bunge, antioxidant activity, radical scavenger, oxidative stress, reactive oxygen species서 론
인체에는 생명유지를 위해 에너지 공급과 생화학적 산화반응이 지속적으로 일어나며 이 과정에서 상당량의 활성산소들이 발생된다(Halliwell B 등 1992).
활성산소(reactive oxygen species; ROS)는 생명유지에 절대적으로 필요한 물질이지만 체내 효소계, 환원 대사, 광화학반응 등의 각종 대사과정에서 생성된 반응성 높은 산화물질로 hydrogen peroxide(H2O2), hydroxyl radical(·OH), superoxide anion radical(·O2—), singlet oxygen(1O2) 등으로 다양하게 존재하며(Halliwell B 등 1992; Dröge W 2002), 외부 항원 방어 및 세포 성장 촉진 역할 등의 정상적인 기능을 하는 필수 요소로 자기방어 제거 기작에 의해 산화 촉진물질(proxidant)과 산화 억제물질(antioxidant)이 적절한 균형을 이루고 있으나 각종 물리적, 화학적 요인에 의해 균형이 무너지게 되면 인체는 산화적 스트레스에 노출된다(Aust SD 등 1993; Stohs SJ 1995; Pastore S & Korkina L 2010).
산화적 스트레스는 지질 과산화, 세포막과 단백질 분해, 효소의 불활성화, DNA 합성 억제 등의 원인으로 유전자의 손상이 일어나고 건강에 해로운 영향을 미치며 다양한 염증성 질환, 조기 피부 노화의 결과를 일으킨다(Mukherjee A & Agrawal M 2017; Ngoc LTN 등 2017; Yang HS 등 2023).
항산화 물질은 생체막 및 체내 지방의 산화를 방지하여 세포 기능 저하 및 노화를 억제 또는 지연시킬 수 있다(Bang JE 등 2009). 활성산소 제거를 위한 합성 항산화제는 항산화 활성과 경제적 측면에서 이용되어 왔으나(Kim YJ 등 2018), 생체 효소나 지방에 대한 변이원성 및 독성, 발암성 등 안정성의 문제가 알려져 있다. 합성 항산화제를 대체할 수 있는 안전하고 응용 가능성이 높은 식물 유래 천연 항산화제에 대한 관심은 세계적으로 증가하고 있으며, 천연물에 함유되어 있는 유효성분, 효능에 대한 연구가 활발히 이루어지고 있다(Kim HK 등 2004). 천연물에 존재하는 폴리페놀 화합물은 항염, 항산화, 항암, 노화 등의 각종 질환 예방에 도움이 되는 생리활성물질으로 알려져 있다(Proestos C & Varzakas T 2017).
천연물 중 약용식물은 예로부터 현재까지 약리학적 효능이 우수하여 질병 치료 및 예방목적으로 사용되고 있으며, 일부 약용식물에 함유된 유용 성분 및 천연 항산화 물질에 대한 생리활성 효과의 가치가 중요하게 인지되고 있어 연구가 활발히 이루어지고 있다(Loliger J 1991; Lee SE & Cho SI 2015). 약용식물의 페놀 성분 중 산화 환원 특성은 산화적 스트레스를 막아주는 역할로 알려져 있고, 노화 및 활성 산소종과 같은 다양한 질환의 원인 감소와 연관되어 있다고 보고되었다(Shahidi F 등 1992; Lee SE & Cho SI 2015).
단삼(Salvia miltiorrhiza Bunge)은 꿀풀과(Labiatae) 단삼 속(genus Salvia)에 속한 다년생 초본으로 중국이 원산지이며 우리나라에서는 강원도, 경상북도에서 일부 재배하고 있는 약초이다. 단삼의 약리작용으로는 해열작용, 항균작용, 소염작용, 콜레스테롤 저하, 혈압 강하, 간 기능 활성화 등이 보고되어 있으며(Choi HY & Han YS 2003), 단삼의 뿌리 부분은 식품에 제한적으로 사용할 수 있는 원료로 식품공전에 수록되어 있어 식품의 부원료로 사용할 수 있다(MFDS 2022). 단삼의 활성에 관하여 많은 선행 연구가 보고되었으며 항균 활성(Kwang JS & Baek SH 2003), 항바이러스 효과(Wu BW 등 2007), 유방암 예방(Shon YH 등 2007), 항노화 활성(Guonan & Lee JA 2022), 식도염 억제 효과 및 암세포 이주 억제 효과(Kwon JY 등 2022) 등 다양한 질환에 대해서 효과가 있음이 보고되고 있다. 단삼의 성분으로는 salvianolic acids 등을 포함하는 phenolic 화합물과 tanshinones 성분 등을 포함하는 diterpenoid 화합물이 있으며 그 외에도 vitamin E, tannin, ursolic acid 등이 알려져 있다(Hu P 등 2005). Salvianolic acids는 항산화 효과(Zhang H 등 2014), 혈전증 및 항염증 효과(Zhang Z 등 2020)가 보고되었다. 또한 tanshinones는 항암 및 항염 효과(Gong Y 등 Qü2012), 항-종양 활성(Park SG 등 2009), 순환계 혈행개선(Lee WY 등 2010) 등의 효과가 보고되었다. 이와 같이 단삼의 항산화 효과 및 항염증 효과에 관한 선행연구가 많이 진행되었으나 항산화 효과의 메커니즘에 대한 연구는 이루어지지 않았기 때문에 본 연구에서는 단삼 열수추출물의 용매 분획물을 이용하여 다양한 활성산소종에 대한 항산화 효과를 검증한 후 항염 활성의 실험을 통해 항산화 관련 기능성 식품 소재로서의 활용 가능성을 확인하고자 하였다.
재료 및 방법
1. 실험 재료 및 추출물 제조
본 실험의 재료인 단삼은 삼홍건재약업사(Namyangju, Korea)의 온라인 매장인 한약재 시장에서 중국산을 구입하여 사용하였다. 단삼은 물에 세척한 후 식품건조기(LD918, Lequip, Korea)를 이용하여 50℃에서 24시간 건조한 후 믹서기로 분말화하여 시료로 사용하였다. 단삼 열수 추출물은 단삼 분말 60 g에 증류수 600 mL를 가한 후 100℃에서 3시간 동안 추출하였으며, 30%, 50% 및 70% 에탄올 추출물은 발효주정(Ethanol Supplies World Co., Ltd., Jeonju, Korea)을 구입하였으며, 단삼 분말 60 g에 30%, 50% 및 70% 발효주정 600 mL를 가한 후 60℃의 항온수조에서 3시간 동안 초음파를 가하여 추출하였다. 추출물은 감압여과 장치를 이용하여 여과한 후, 회전 진공 농축기(EYELA, Rikakikai Co., Tokyo, Japan)를 이용하여 40∼45℃에서 감압 농축한 후 동결건조하여 분말로 회수하였다. 추출 수율은 추출 전 시료의 중량에 대한 동결건조 후 시료의 중량을 백분율로 환산하여 수율을 계산하였다. 단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물의 수율은 48.7%, 36.4%, 38.1% 및 34.7%로 나타났다.
2. 추출물의 용매 분획
동결 건조한 단삼 열수 추출물 5 g을 증류수 50 mL에 용해시키고 분획 깔때기를 이용하여 용매의 극성도 순으로 동량의 ethyl acetate(EtOAc)로 3회 반복 추출 후 분획하여 남은 잔류물에 n-butanol(n-BuOH)을 첨가하여 동일방법으로 추출 및 분획하여 물 잔류물을 회수하였다(Fig. 1). 분리된 각각의 유기용매층을 감압 농축시키고 동결 건조하여 분말 형태로 회수하였으며, 단삼 열수 추출물의 EtOAc, n-BuOH 및 water(H2O) 분획물의 수율은 단삼 열수 추출물 5 g 기준으로 6.35%, 16.85% 및 64.17%로 H2O 분획물의 수율이 가장 높게 나타났으며, 용매 분획물은 —20℃에서 보관하면서 실험에 사용하였다.
3. 항산화 활성
DPPH radical 소거 활성 측정은 Blois MS(1958)의 방법을 일부 변형하여 측정하였다. 단삼 추출물 및 분획물 200 μL에 0.1 mM 1,1-diphenyl-2-picrylhydrazyl(DPPH) 용액 2.0 mL를 혼합하여 실온 암소에서 30분간 반응시킨 후 분광광도계(V-1600, Labinno, Japan)를 사용하여 517 nm에서 흡광도를 측정하였으며, L-ascorbic acid(Sigma Aldrich Co., St. Louis, MO, USA)를 DPPH radical 소거 활성 비교를 위한 양성 대조구로 사용하였다. 다음과 같은 계산식에 의해 농도에 따른 DPPH radical 소거 활성을 백분율(%)로 산출하였으며, DPPH radical을 50% 저해하는 농도(IC50)를 추가적으로 계산하였다.
- A: 단삼 추출물 및 분획물 첨가구의 흡광도
- B: 단삼 추출물 및 분획물 무첨가구의 흡광도
ABTS radical 소거 활성 측정은 Roberta R 등(1999)의 방법을 일부 변형하여 측정하였다. 7.0 mM 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS)와 2.45 mM potassium persulphate(K2S2O8)를 2:1(v/v)로 혼합하여 실온 암소에서 14∼16시간 동안 반응시켜 cation radical을 형성시켰다. 반응액을 734 nm에서 흡광도 값이 0.70±0.02가 되도록 증류수로 희석하였다. 희석한 ABTS 용액 2.0 mL에 단삼 분획물 20 μL를 첨가 후 혼합하여 실온에서 6분간 반응시킨 다음 734 nm에서 흡광도를 측정하였으며, trolox(Sigma Aldrich Co., St. Louis, MO, USA)를 ABTS radical 소거 활성 비교를 위한 양성 대조구로 사용하였다. 농도에 따른 ABTS radical 소거 활성은 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
Superoxide anion radical 소거 활성은 Fontana M 등(2001)의 방법을 일부 변형하여 사용하였다. Phenazine methosulfate-Nicotinamide adenine dinucleotide(PMS/NADH) 시스템을 이용하여 nitro blue tetrazolium(NBT)의 환원생성물인 purple formazan을 측정하였다. 단삼 분획물 400 μL에 100 mM phosphate buffer(pH 7.4) 400 μL, 365 μM NADH 400 μL, 250 μM NBT 400 μL, 75 μM PMS 400 μL를 혼합한 후 실온에서 5분간 반응시켜 562 nm에서 흡광도를 측정하였으며, 양성 대조구는 quercetin(Sigma Aldrich Co., St. Louis, MO, USA)를 사용하였다. 농도에 따른 superoxide anion radical 소거 활성은 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
Hydrogen peroxide 소거 활성은 Long LH 등(1999)의 방법을 일부 변형하여 측정하였다. 단삼 분획물 100 μL에 500 μM H2O2 100 μL를 혼합한 후 상온에서 30분 동안 반응시켰다. 반응액에 methanol 20 μL와 FOX 시약4.4 mM BHT 용액, 2.5 M sulfuric acid(H2SO4)에 녹인 1 mM xylenol orange와 2.56 mM ammonium ferrous sulfate[(NH4)2Fe(SO4)2] 용액 혼합물(9:1 v/v) 1.8 mL를 혼합하여 상온에서 30분 동안 반응시킨 다음 560 nm에서 흡광도를 측정하였으며, sodium pyruvate(Kanto Chemical Co., Inc., Japan)를 hydrogen peroxide소거 활성 비교를 위한 양성 대조구로 사용하였다. 농도에 따른 hydrogen peroxide 소거 활성은 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
Hydroxyl radical 소거 활성은 Chung SK 등(1997)의 방법을 일부 변형하여 사용하였다. Hydroxyl radical 소거 활성은 2-deoxyribose의 분해물을 thiobarbituric acid(TBA)와 축합 반응시킴으로써 생성되는 thiobarbituric acid reactive substances(TBARS)양을 측정하는 원리를 이용하여 Fe3+-ascorbate-EDTA-H2O2 system에서 Fenton 반응으로 생성시켜 유리된 OH radical을 측정하였다. 19.6 mM 2-deoxy-d-ribose 100 μL, 280 mM potassium phosphate buffer(pH 7.4) 100 μL, 10 mM ferric chloride(FeCl3) 100 μL, 700 μM ethylenediaminetetraacetic acid(EDTA) 100 μL, 7 mM H2O2 100 μL, 700 μM L-ascorbic acid 100 μL와 단삼 분획물 200 μL를 첨가하여 37℃에서 1시간 동안 반응시켰다. 반응액에 2.8%(w/v) trichloroacetic acid(TCA) 1 mL와 1%(w/v) TBA 1 mL를 첨가한 후 90℃ 항온수조에서 15분간 반응시킨 다음 실온에서 냉각시켜 532 nm에서 흡광도를 측정하였으며, mannitol(Samchun Pure Chemical Co., Ltd., Korea)을 hydroxyl radical 소거 활성 비교를 위한 양성 대조구로 사용하였다. Deoxyribose 분해 저해도는 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
Nitric oxide radical 소거 활성은 Garratt DC(1955)의 방법을 이용하여 측정하였다. 30 mM sodium nitroprusside(SNP) 300 μL, phosphate buffer saline(PBS, pH 7.4) 200 μL, 단삼 분획물 200 μL를 넣어 총 700 μL의 반응액을 만든 다음 25℃에서 150분 동안 반응시켰다. 반응액에 sulfanilic acid 용액[20%(v/v) glacial acetic acid(CH3COOH)에 녹인 0.33% (w/v) sulfanilamide 용액] 1.0 mL를 넣고 5분 동안 반응시켜 diazonium salt을 생성한 후, 0.1% (w/v) N-(1-naphthyl)ethylenediamine dihydrochloride(NED) 용액 1.0 mL를 첨가하여 25℃에서 30분간 반응시켜 azo dye를 형성시켜 540 nm에서 흡광도를 측정하였으며, curcumin(Sigma Aldrich Co., St. Louis, MO, USA)을 양성 대조구로 사용하였다. Nitric oxide 저해 활성은 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
각 단삼 분획물의 환원력은 Oyaizu M(1986)의 방법을 일부 변형하여 측정하였다. 단삼 분획물 0.5 mL에 0.2 M phosphate buffer(pH 6.6) 0.5 mL, 1%(w/v) potassium hexacyanoferrate[K3Fe(CN)6] 0.5 mL를 넣고 50℃에서 20분간 반응시켰다. 반응액에 10%(w/v) TCA 1.0 mL를 첨가하여 반응을 정지시킨 후 3,000 rpm에서 15분간 원심분리하였다. 상층액 1.0 mL을 취하여 증류수 0.5 mL와 0.1%(w/v) FeCl3 0.5 mL를 첨가하여 실온에서 10분 동안 반응시킨 후 700 nm에서 흡광도를 측정하였다. BHT(Junsei Chemical Co., Ltd., Japan)를 환원력을 비교하기 위한 양성대조구로 사용하였으며, 선행연구(Kim JH 등 2019)를 참고하여 단삼 분획물의 흡광도 값을 환원력으로 나타내었다.
Fe2+ chelating 활성은 Haro-Vicente JF 등(2006)의 방법을 일부 변형하여 측정하였다. 단삼 추출물 100 μL, 40 mM HEPES buffer(pH 7.2) 1.0 mL, 62.5 μM ferrous sulfate(FeSO4·7H2O) 500 μL와 300 μM ferrozine 500 μL을 혼합하여 실온에서 20분간 반응시킨 후 562 nm에서 흡광도를 측정하였다. EDTA(Sigma Aldrich Co., St. Louis, MO, USA)를 Fe2+ chelating 활성 비교를 위한 양성대조구로 사용하였다. Fe2+ chelating 활성은 DPPH radical 소거 활성과 같은 계산식으로 산출하였다.
4. 항염 활성
본 실험에 사용한 RAW264.7 세포는 한국 세포주 은행(Korea Cell Line Bank, Korea)으로부터 분양받아 10%(v/v) fetal bovine serum(FBS) 및 1%(v/v) penicillin이 포함된 RPMI 1640 배지(GIBCO, NY, USA)를 사용하여 37℃, 5% CO2 세포배양기(Thermo scientific, Waltham, MA, USA)에서 24시간 동안 배양하였으며 계대 배양은 2회 이상 진행하여 세포를 안정화시켰다.
RAW264.7 세포 생존율을 알아보기 위한 세포독성(cytotoxicity)의 측정은 MTT방법을 이용하여 측정하였다. 48-well plate에 RAW264.7 세포를 2 × 105 cells/well 농도로 첨가하여 3시간 동안 안정화시킨 후, 단삼 n-BuOH 분획물을 50, 100, 200 및 500 μg/mL 농도로 처리하여 24시간 동안 배양하였다. 배양된 세포를 새로운 배지로 교환한 후 MTT(5 mg/mL) 용액을 50 μL를 첨가하고 30분 동안 배양하여 formazan 생성을 유도하였다. 생성된 formazan을 일정량의 dimethyl sulfoxide(DMSO)로 용해시킨 뒤 100 μL를 취하여 96-well plate에 분주한 후 ELISA reader(Molecular Devices)를 사용하여 540 nm에서 흡광도를 측정하였다. 단삼 n-BuOH 분획물을 첨가하지 않은 대조군의 흡광도 값을 세포 생존율 100%로 보고 다음과 같은 계산식에 의해 세포 생존율을 백분율로 산출하였다.
- A: 단삼 n-BuOH 분획물의 흡광도
- B: 단삼 n-BuOH 분획물 무첨가구의 흡광도
Nitric oxide(NO) 생성 억제 효과는 Griess reagent을 이용하여 생성된 NO양을 간접적으로 측정하였다. RAW264.7 세포(5 × 105 cells/mL)에 단삼 n-BuOH 분획물을 50, 100 및 200 μg/mL 농도로 첨가한 후 산화질소(nitric oxide, NO) 생성을 위한 1 μg/mL lipopolysaccharide(LPS)를 처리하여 24시간 동안 배양하였다. 세포배양 상층액 50 μL와 0.1 mM Griess 시약[1%(w/v) sulfanilamide, 5%(v/v) phosphoric acid(H3PO4)에 녹인 0.1%(w/v) N-1-naphthylethylenediamine] 50 μL을 혼합하여 96-well plate에 10분간 반응시킨 다음 ELISA reader(Molecular Devices)를 이용하여 540 nm에서 흡광도를 측정하였다. 생성된 NO양은 sodium nitrie(NaNO2)를 이용하여 작성한 표준곡선으로부터 계산하였으며, 단위는 μM로 나타내었다.
5. 총 폴리페놀 함량
총 폴리페놀 함량은 Folin O & Denis W(1912)의 방법을 일부 변형하여 측정하였다. 단삼 분획물 0.5 mL에 0.2 N Folin-Ciocalteu reagent 2.5 mL를 첨가하여 5분 동안 반응시킨 다음 7.5%(w/v) sodium carbonate(Na2CO3) 2 mL를 첨가하여 실온 암소에서 1시간 동안 반응시킨 다음 765 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 표준물질로 gallic acid(Samchun Pure Chemical Co., Ltd., Korea)를 이용하여 작성한 표준곡선으로부터 함량을 계산하였으며 단위는 mg GAE(gallic acid equivalent)/g로 나타내었다.
6. 통계 분석
실험 결과는 SPSS ver.12.0 통계 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하였고, 모든 실험은 3회 반복하여 평균±표준편차(Mean±S.D.)로 계산하였다. 실험군 간의 유의성 검증을 위한 통계분석은 일원 배치 분산 분석(ANOVA, One-way analysis of variance test)을 실시하였으며, 유의성이 있는 경우 p<0.05 수준에서 다중 범위 시험법(Duncan’s multiple range test)을 이용하여 사후 검정하였다.
결과 및 고찰
1. 단삼 용매별 추출물의 항산화 활성
단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물의 농도에 따른 DPPH radical 소거 활성을 분석한 결과는 Table 1과 같다. 양성대조구로는 L-ascorbic acid를 사용하여 DPPH radical 소거 활성을 비교하였으며 단삼 용매별 추출물은 양성대조구인 L-ascorbic acid보다 낮은 소거 활성을 보였으나 100, 200 및 400 μg/mL의 농도가 증가함에 따라 유의적으로 증가하였다. 단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물은 19.89±0.25∼39.21±0.19, 15.80±0.32∼35.07±0.25, 14.99±0.25∼34.43±0.19 및 15.76±0.88∼29.81±0.25%의 DPPH radical 소거 활성을 나타냈다. DPPH radical을 50% 저해하는 농도인 IC50을 산출한 결과 L-ascorbic acid는 67.29±0.23 μg/mL, 단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물의 IC50은 566.68±4.09, 632.23±9.26, 639.22±6.57 및 829.57±35.81 μg/mL로 확인되었다. 단삼 열수 추출물은 30%, 50% 및 70% 에탄올 추출물보다 유의적으로 더 높은 DPPH radical 소거 활성을 나타냈다. Ju JC 등(2006)은 단삼의 열수 추출물과 합성 항산화제인 BHT를 비교한 결과, 단삼의 열수 추출물이 BHT보다 유의적으로 높은 DPPH radical 소거 활성을 나타낸다고 보고하였고 추출용매가 상이하여 본 연구결과와 비교하기에는 어렵지만 Kim YH 등(2003)은 단삼 99% 에탄올 추출물의 DPPH radical 소거 활성이 8.27 μg/mL으로 ascorbic acid(9.48 μg/mL)와 비슷한 수치를 나타낸다고 보고하였으나 본 연구결과 단삼 용매별 추출물의 IC50은 양성대조구 L-ascorbic acid(67.29±0.23 μg/mL) 보다 높은 값을 나타내어 선행연구와는 다른 경향의 결과를 나타냈다. 단삼의 재배지역에 따른 DPPH radical 소거 활성은 재배지역에 따라 상당한 차이를 보인다고 Yang EJ 등(2007)은 보고하였으며, 재배시기 또는 실험조건의 차이로 추정된다. 본 연구 결과를 통해 단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물 중 DPPH radical 소거 활성은 단삼 열수 추출물이 가장 높은 항산화 효과를 나타냈으며 유효성분은 극성인 물질로 사료되어 단삼 열수 추출물의 용매 분획에 따라 항산화 활성의 차이가 있을 것으로 판단하였다.
2. 단삼 열수 추출물의 용매 분획물에 의한 항산화 및 항염 활성
단삼 용매 분획물의 DPPH radical을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 2(A)와 같다. 양성대조구 L-ascorbic acid는 70.21±0.52 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 417.91±4.83, 313.37±2.06 및 827.26±3.36 μg/mL로 확인되었다. 단삼 용매 분획물의 DPPH radical 소거 활성 결과 n-BuOH 분획물에서 가장 높은 항산화 효과를 나타냈다. 항산화 성분은 화합물의 용해도에 따라 극성이 다른 용매에서 추출된다고 Lapornik B 등(2005)은 보고하였으며 Choi JI 등(2009)은 칠면조 분획 추출물이 수소 공여체로 작용하는 많은 수산기가 포함되어 있어 산화의 원인인 free radical을 안정화시켜 항산화 활성을 나타냈다고 보고하였다. 항산화 활성은 식물의 2차 대사산물인 페놀성 화합물과 상관관계가 있다고 보고한 바 있으며(Azuma K 등 1999), Kim SS 등(2019)은 하례조생 추출물의 총 폴리페놀 함량이 증가할수록 radical 소거 활성이 증가하였다고 보고하였다.
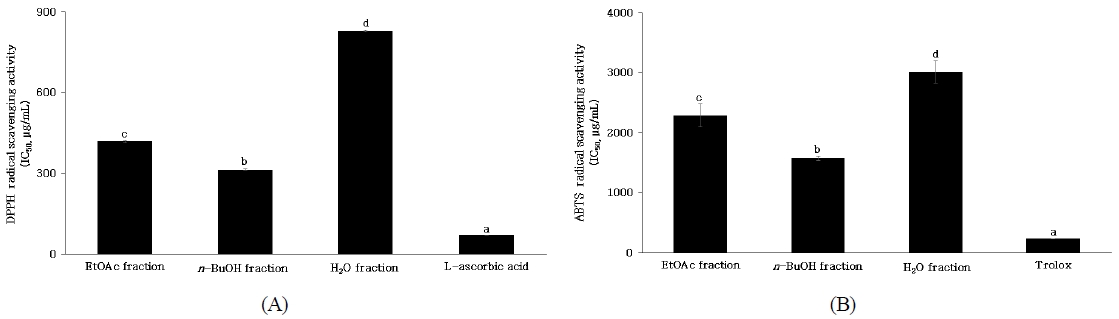
IC50 values of DPPH radical scavenging activities (A) and ABTS radical scavenging activities (B) of ethyl acetate, n-butanol and water fractions of hot water extract from Salvia miltiorrhiza.a∼d Means with different superscripts on the graph are significantly different (p<0.05). Values are mean±S.D. of 3 experiments.
단삼 용매 분획물의 ABTS radical을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 2(B)와 같다. 양성대조구 trolox는 230.43±1.49 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 2,287.14±192.67, 1,568.60±35.69 및 3,002.72±187.08 μg/mL로 확인되었으며, n-BuOH 분획물에서 가장 높은 ABTS radical 소거 활성을 나타냈다. DPPH는 free radical 소거 활성, ABTS는 cation radical 소거 활성을 측정한 방법으로, 두 기질과 반응물과의 결합 정도가 다르기 때문에 radical 소거 활성능력에 차이가 있으나 유사한 경향을 나타낸다고 보고하였다(Shin JH 등 2010). 본 연구 결과 선행연구와 같은 경향으로 DPPH radical 소거 활성과 같이 농도가 증가할수록 유의적으로 증가하는 경향을 보였으나 radical 소거 활성 능력에 차이를 나타냈다.
체내의 free radical인 superoxide anion radical은 산소에 전자 한 개가 공급되어 만들어지는 것으로 활성산소 중 가장 먼저 생성되며, 강한 산화 작용으로 지질 과산화를 유발하여 직·간접적으로 세포 손상을 유발한다고 보고되어 있다(Campos Chiste R 등 2015; Hayyan M 등 2016). 일반적으로는 항산화 금속효소인 superoxide dismutase(SOD)의 작용에 의하여 superoxide anion radical의 산화환원반응을 촉매하여 hydrogen peroxide로 전환시키며(Fridovich I 1997), 생성된 hydrogen peroxide는 peroxide나 catalase 등에 의하여 불활성화시킬 수 있어 독성으로부터 세포를 방어하는 역할을 한다고 알려져 있으나 hydrogen peroxide 과량 생성으로 일부 전환되지 못할 경우 전자를 하나를 더 받아 hydroxyl radical 형성 및 산화적 스트레스가 발생하게 된다고 알려져 있다(Marklund S & Marklund G 1974; Benov L 등 1988). 단삼 용매 분획물의 superoxide anion radical을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 3(A)와 같다. 양성대조구 quercetin은 218.30±11.52 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 93.90±1.80, 82.76±1.41 및 155.57±1.98 μg/mL로 확인되었다. Quercetin은 bioflavonoid 중 하나로 식물색소의 일종으로 세포와 조직에서 항산화 효과를 나타내며(David AVA 등 2016; Remigante A 등 2022), Qi W 등(2022)은 quercetin이 GSH 합성을 유도하여 활성산소를 제거할 수 있다고 보고하였다. 본 연구 결과 단삼 용매 분획물 모두 양성대조구인 quercetin보다 높은 superoxide anion radical 소거 활성을 나타냈으며 그 중 n-BuOH 분획물이 가장 효과적인 것으로 확인되었다.
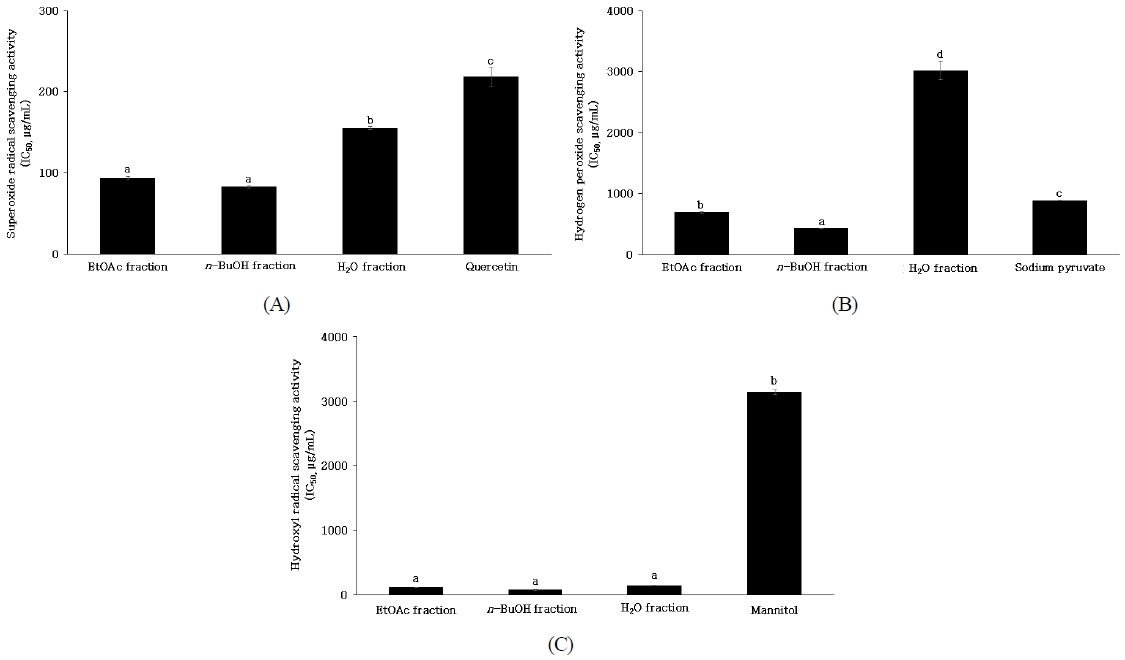
IC50 values of superoxide radical scavenging activities (A), hydrogen peroxide scavenging activities (B) and hydroxyl radical scavenging activities (C) of ethyl acetate, n-butanol and water fractions of hot water extract from Salvia miltiorrhiza.a∼d Means with different superscripts on the graph are significantly different (p<0.05). Values are mean±S.D. of 3 experiments.
단삼 용매 분획물의 hydrogen peroxide을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 3(B)와 같다. 양성대조구 sodium pyruvate는 886.23±5.19 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 698.83±15.74, 430.91±2.47 및 3,019.79±149.62 μg/mL로 확인되었으며, EtOAc 및 n-BuOH 분획물은 양성대조구 sodium pyruvate보다 높은 소거활성을 나타냈다. 본 연구 결과 n-BuOH 분획물이 가장 높은 hydrogen peoxide 소거 활성을 나타냈으며, 용매 분획 과정에서 항산화 활성을 가지는 성분이 n-BuOH 분획물에 함유되어 용해 분획물 중 가장 높은 항산화 효과를 나타낸 것으로 판단된다. Kim WI & Kim WH(2002)은 단삼 추출물이 사람의 소장 상피세포에서 유래한 Caco-2세포에서 hydrogen peroxide에 의한 세포 손상을 방지하였다고 보고하였으므로 n-BuOH 분획물의 hydrogen peroxide 소거 활성은 소장 상피세포의 세포 손상을 방지할 수 있을 것으로 기대된다.
단삼 용매 분획물의 hydroxyl radical을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 3(C)와 같다. 양성대조구 mannitol은 3,141.21±37.52 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 120.75±0.85, 85.08±6.36 및 150.07±3.93 μg/mL로 확인되었다. Bu HJ 등(2004)은 hydroxyl radical 소거 활성에 대한 항산화 효과는 항산화제로서 그 가치가 크다고 보고하였으며, 본 연구 결과 n-BuOH 분획물의 hydroxyl radical 소거 효과는 천연 항산화제로서 체내의 산화적 스트레스를 감소할 수 있을 것으로 사료된다.
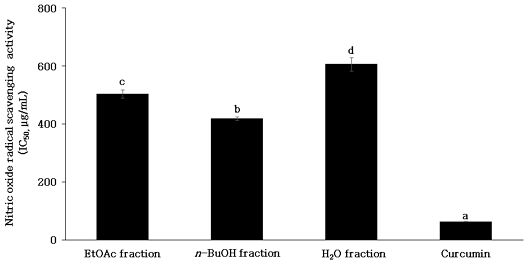
Nitric oxide(NO)는 높은 반응성을 가진 활성산소 중 하나로 세포 내 L-arginine으로부터 nitric oxide synthase(NOS)에 의하여 생성되며 세포사멸 조절, 혈압조절, 신경전달 물질 등 체내의 생리적 균형을 유지하는데 중요한 역할을 한다고 알려져 있다(Snyder SH & Bredt DS 1992; Bogdan C 2001). NO의 과도한 생성은 대식세포의 과다 발현으로 세포 염증, 자가면역 질환을 유발하거나 superoxide anion과 반응하여 활성질소종인 peroxynitrite를 생성한다(Xu W 등 2002). Peroxynitrite는 독성이 강한 산화제로 지질 과산화, 세포독성을 일으켜 생식세포에 산화 손상을 유도하여 DNA 손상 등에 영향을 주는 것으로 보고되고 있으며(Beckman JS 등 1990; Sivaranjani N 등 2013), nitric oxide radical 소거 활성은 산화 억제 활성을 간접적으로 측정하는데 활용되고 있는 방법이다(Sueishi Y 등 2011). 단삼 용매 분획물의 nitric oxide radical을 50% 저해하는 농도인 IC50을 산출한 결과는 Fig. 4와 같다. 양성대조구 curcumin은 63.86±0.76 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 504.83±14.39, 418.69±6.19 및 606.51±24.08 μg/mL로 확인되었다. 본 연구결과 n-BuOH 분획물이 가장 높은 nitric oxide radical 소거활성을 나타내었으며, 단삼의 메탄올 추출물이 농도 의존적으로 LPS로 유도된 NO 생성량을 억제한다고 Yun HJ 등(2007)은 보고하였다. Nitric oxide radical 소거 효과는 세포 내에서 NO 생성 억제에 대한 항염 효과를 유도할 수 있을 것으로 기대된다.
Reducing power는 ferric chloride(Fe3+)가 항산화 물질과의 반응을 통해 ferrous chloride(Fe2+)로 환원되는 활성을 흡광도로 측정하는 방법으로 환원력이 클수록 높은 흡광도 값을 나타낸다(Kim HK 등 1995; Kim JH 등 2019). 환원력은 활성 산소종 및 free radical에 전자를 공여하는 능력으로 DPPH radical과 관련이 있으며(Choi YM 등 2007), 페놀 함량 및 항산화 활성과 상관관계를 나타낸다고 보고되어 있다(Pérez-Fons L 등 2010; Lee JB 등 2011). 단삼 용매 분획물의 농도에 따른 reducing power를 분석한 결과는 Fig. 5와 같다. 단삼 용매 분획물은 양성대조구인 BHT보다 낮은 활성을 보였지만 모든 시료에서 100, 200 및 400 μg/mL의 농도가 증가함에 따라 유의적으로 증가하였다. BHT는 0.799±0.006∼1.73±0.006, 단삼 용매 분획물은 n-BuOH > EtOAc > H2O의 순으로 0.428±0.003∼0.863±0.003, 0.412±0.002∼0.766±0.003 및 0.363±0.003∼0.536±0.004의 흡광도 값을 나타냈다. 본 연구결과 단삼 용매 분획물의 환원력 중 n-BuOH 분획물의 환원력이 가장 높았으며, n-BuOH 분획물의 높은 환원력은 높은 항산화 활성을 나타내는 것으로 판단된다. Ju JC 등(2006)은 16종의 한약재 열수 추출물의 환원력 분석 결과 단삼을 포함한 16종 한약재 모두 BHT보다 낮은 환원력을 나타냈다고 보고하였다.
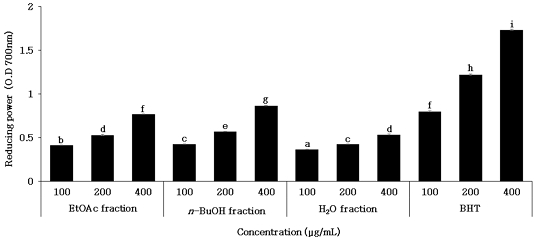
Reducing powers of ethyl acetate, n-butanol and water fractions of hot water extract from Salvia miltiorrhiza.The data represent the absorbance vlaues acquired in reducing power assay with EtoAc, n-BuOH and H2O fractions of hot water extract from Salvia miltiorrhiza. a∼i Means with different superscripts on the graph are significantly different (p<0.05). Values are mean±S.D. of 3 experiments.
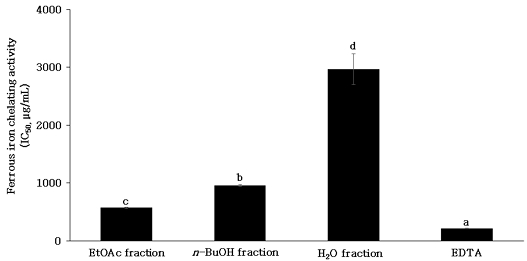
Fe2+ chelating 활성은 ferrozine이 Fe2+와 반응하여 복합체를 형성하면 붉은색을 나타내는데, chelating 효과를 가진 성분을 첨가하면 Fe2+ 이온 제거 및 Fe2+-ferrozine 복합체의 형성을 억제하여 발색이 저해되는 원리를 이용한 것으로(Gülçin İ등 2005), chelating 활성이 높을수록 낮은 흡광도의 값을 나타내게 된다. Fe2+, Cu2+과 같은 금속 이온은 단일 전자를 이동시킬 수 있어 세포 내 산화물을 형성하여 지질 산화의 촉매로 작용할 수 있고 hydroxyl radical, superoxide radical 등의 생성을 촉진하여 지질 산화를 유발하므로(Aboul-Enein AM 등 2003; Saiga AI 등 2003), 금속 이온의 제거는 금속 촉매제로 인한 free radical의 생성을 억제하여 지질 산화를 방지할 수 있는 주요 방법 중 하나이다(Xu XM 등 2007). 단삼 용매 분획물의 Fe2+ chelating 활성에 대한 IC50을 산출한 결과는 Fig. 6과 같다. 양성대조구 EDTA는 215.25±3.13 μg/mL, 단삼 EtOAc, n-BuOH 및 H2O 분획물의 IC50은 572.72±7.69, 957.76±10.4 및 2,965.78±207.11 μg/mL로 나타났다. EDTA는 금속 chelate 화합물이며 강력한 chelate로 작용함으로써 식물의 납 흡수 억제 및 식품의 산화를 방지하는 역할을 한다고 알려져 있다(Mahoney JR 등 1986; Tandy S 등 2006). Fe2+ chelating 활성은 radical 소거 활성과 상관관계가 낮은 것으로 보고되어 있다(Graf E & Eaton JW 1990). 본 연구 결과 Fe2+ chelating 활성은 EtOAc 분획물에서 가장 우수한 것으로 나타나 radical 소거 활성과는 상반된 결과를 나타냈다. 따라서 n-BuOH 분획물의 항산화 활성은 Fe2+ chelating 활성에 의해서 나타난 것이 아님이 확인되었으며, 아마도 항산화성분이 전자 및 수소를 공여하므로 나타난 것으로 사료된다.
높은 항산화 효과를 나타낸 단삼 n-BuOH 분획물의 세포 독성을 평가하기 위한 RAW 264.7 세포의 세포 생존율은 Fig. 7과 같다. 대조구는 n-BuOH 분획물을 첨가하지 않은 실험구의 흡광도 값을 세포 생존율 100%로 하였으며, n-BuOH 분획물은 50, 100, 200 및 500 μg/mL농도에서 110.99±1.06, 99.57±0.38, 97.97±0.84 및 87.25±1.29%의 세포 생존율을 나타냈다. Yun HJ 등(2007)은 단삼 메탄올 추출물의 세포독성 결과 700 μg/mL 농도에서 세포 생존율에 영향을 주지 않았다고 보고하였으나 본 연구 결과 500 μg/mL 농도 세포 생존율에 영향을 주는 것으로 확인되어 선행연구와 다른 경향의 결과를 나타냈으며, 이는 실험방법 및 용매에 따른 차이로 사료된다. 세포의 생존율이 90% 이상으로 나타나면 세포독성을 유발하지 않는다고 판단하였으며, n-BuOH 분획물 50∼200 μg/mL농도로 NO 생성 억제 효과의 실험을 진행하였다.
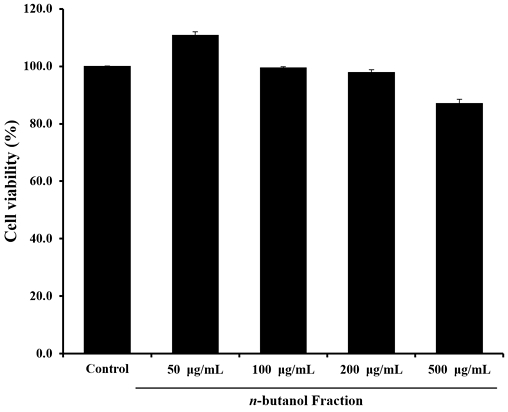
Effect of n-butanol (n-BuOH) fraction of hot water extract from Salvia miltiorrhiza on viability of RAW 264.7 cells.RAW 264.7 cells were treated with indicated concentrations of n-butanol fraction of hot water extract from Salvia miltiorrhiza. Viability was determined by MTT assay. Values are mean±S.D. of 3 experiments.
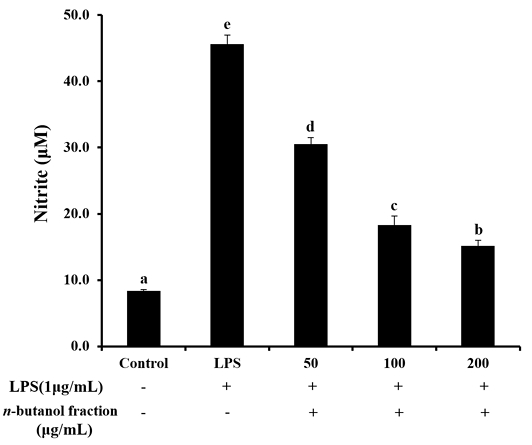
단삼 n-BuOH 분획물이 LPS로 활성화된 RAW264.7 세포의 NO 생성 억제 효과는 Fig. 8과 같다. 대조구, LPS 단독 처리구, 50, 100 및 200 μg/mL 농도의 n-BuOH 분획물은 8.4±0.2, 45.6±1.3, 30.5±1.0, 18.3±1.3 및 15.2±0.8 μM을 나타내었으며, n-BuOH 분획물 첨가 농도에 따라 유의적으로 높은 NO 생성 억제 효과를 나타냈다. 염증반응은 미생물, 화합물 등에 의해 자극이 가해진 후의 인체의 방어기전으로, 대식세포는 면역기능, 염증반응을 조절하며, 항상성 유지에 있어 중요한 역할을 한다(Higuchi M 등 1990; Yoo HJ 등2008). LPS는 그람음성균의 세포벽에 존재하는 내독소(endotoxion)로, LPS에 의해 ROS, NO, PGE2 등과 같은 염증성 매개인자들의 생성을 증가시켜 염증 유도 물질로 알려져 있으며(Guha M & Mackman N 2001), 항산화제는 염증반응을 효과적으로 억제시켜 항염 등에 효과가 있다고 보고되어 있다(Tsai SH 등 1999). 가장 강력한 항산화 효과를 보인 n-BuOH 분획물을 사용하여 RAW264.7 세포에 처리한 결과 NO 생성 억제 효과를 나타내어 항염 효과가 있는 것으로 판단되며, 다른 염증성 대사산물에서도 유의적인 효과를 나타낼 것으로 사료된다.
본 연구는 단삼 용매 분획물의 항산화 활성에 대한 총 폴리페놀 함량의 연관성을 목적으로 총 폴리페놀 함량을 측정하였으며 결과는 Table 2와 같다. EtOAc, n-BuOH 및 H2O 분획물의 총 폴리페놀 함량은 111.45±0.39, 146.61±1.17 및 70.30±0.80 mg GAE/g으로 나타났다. Kim EY 등(2004)은 20종의 약용식물 추출물의 총 폴리페놀 및 총 플라보노이드 함량 측정 결과 총 폴리페놀의 함량이 높은 시료에서 항산화 활성이 뛰어났다고 보고하였다. 본 연구 결과 총 폴리페놀함량은 n-BuOH 분획물이 가장 높은 함량을 나타냈고, H2O 분획물이 가장 낮은 총 폴리페놀 함량을 나타내었다. 총 폴리페놀 함량의 다른 경향은 추출 용매 등에 따라 차이가 날 수 있다고 보고되어 있다(Seo SY 등 2017). n-BuOH 분획물의 높은 총 폴리페놀 함량은 단삼에 존재하는 여러 가지 페놀성 화합물들은 수용성 페놀 화합물일 것으로 판단하였다.
요 약
본 연구는 단삼을 용매별 추출 및 분획하여 항산화 및 항염 활성을 확인하기 위해 화학적인 반응 및 in vitro의 방법으로 수행하였다.
단삼 열수 추출물, 30%, 50% 및 70% 에탄올 추출물의 DPPH radical 소거 활성을 측정한 결과, 단삼 열수 추출물의 IC50이 566.68±4.09 μg/mL로 가장 높은 소거 활성을 나타내어 유효성분은 극성인 물질로 사료된다. 따라서 단삼 열수 추출물을 EtOAc, n-BuOH 및 H2O로 분획하여 항산화 활성을 측정하였다. 단삼 열수 추출물의 용매 분획물은 superoxide anion radical에서 양성대조구 quercetin보다, hydroxyl radical 소거 활성에서 양성대조구 mannitol보다 높은 소거 활성을 보였으며 단삼 용매 분획물 중 n-BuOH 분획물이 가장 강한 항산화 효과를 나타내었고, Fe2+chelating 활성 효과는 EtOAc 분획물에서 가장 우수한 것으로 나타나 n-BuOH 분획물의 항산화 활성은 Fe2+ chelating 활성에 의해서 나타난 것이 아님을 확인하였다. 가장 높은 항산화 활성을 보인 n-BuOH 분획물을 in vitro 실험에 적용하여 염증 조절 능력에 대한 효과를 확인한 결과, MTT 실험 결과에서 n-BuOH 분획물은 200 μg/mL 농도까지는 독성을 나타내지 않았으나, 500 μg/mL 농도에서는 87.25±1.29%로 독성을 나타냄을 확인하였다. Nitric oxide(NO) 생성 억제 효과에서는 농도 의존적으로 감소하였으며, n-BuOH 분획물은 200 μg/mL의 농도에서 15.2 μM로 LPS 단독 처리구(45.6 μM)에 비하여 유의적으로 NO 생성을 억제함을 확인하였다. 단삼 열수추출물의 용매 분획물 중 n-BuOH 분획물의 총 폴리페놀 함량이 146.61±1.17 mg GAE/g으로 가장 높게 나타난 결과는 단삼의 항산화 활성성분이 수용성 페놀화합물로 판단하였으며, 이는 기능성 식품소재로 활용도가 높을 것으로 기대되는 바이다.
References
- Aboul-Enein AM, El Baz FK, El-Baroty GS, Youssef AM, Abd El-Baky HH (2003) Antioxidant activity of algal extracts on lipid peroxidation. J Med Sci 3(1): 87-98.
-
Aust SD, Chignell CF, Bray TM, Kalyanaraman B, Mason RP (1993) Free radicals in toxicology. Toxicol Appl Pharmacol 120(2): 168-178.
[https://doi.org/10.1006/taap.1993.1100]

-
Azuma K, Nakayama M, Koshioka M, Ippoushi K, Yamaguchi Y, Kohata Y, Yamauchi Y, Kohata K, Yamauchi Y, Ito H, Higashio H (1999) Phenolic antioxidants from the leaves of Corchorus olitorius L. J Agric Food Chem 47(10): 3963-3966.
[https://doi.org/10.1021/jf990347p]

- Bang JE, Choi HY, Kim SI (2009) Anti-oxidative activity and chemical composition of various Heracleum moellendorffii Hance extracts. Korean J Food Preserv 16(5): 765-771.
-
Beckman JS, Beckman TW, Chen J, Marshall PA, Freeman BA (1990) Apparent hydroxyl radical production by peroxynitrite: Implications for endothelial injury from nitric oxide and superoxide. Proc Natl Acad Sci 87(4): 1620-1624.
[https://doi.org/10.1073/pnas.87.4.1620]

-
Benov L, Sztejnberg L, Fridovich I (1998) Critical evaluation of the use of hydroethidine as a measure of superoxide anion radical. Free Radic Biol Med 25(7): 826-831.
[https://doi.org/10.1016/S0891-5849(98)00163-4]

-
Blois MS (1958) Antioxidant activity determination by the use of a stable free radical. Nature 181: 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Bogdan C (2001) Nitric oxide and the immune response. Nat Immunol 2(10): 907-916.
[https://doi.org/10.1038/ni1001-907]

- Bu HJ, Lee HJ, Yoo EK, Jung DS, Riu KZ, Lee SJ (2004) Antioxidant effects and inhibitory effect on NO synthesis by extracts of Canavalia lineata. Kor J Pharmacogn 35(4): 338-345.
-
Campos Chiste R, Freitas M, Zerlotti Mercadante A, Fernandes E (2015) Superoxide anion radical: Generation and detection in cellular and non-cellular systems. Curr Med Chem 22(37): 4234-4256.
[https://doi.org/10.2174/0929867322666151029104311]

-
Choi HY, Han YS (2003) Isolation and identification of antimicrobial compound from Dansam (Salvia miltiorrhiza Bunge). J Korean Soc Food Sci Nutr 32(1): 22-28.
[https://doi.org/10.3746/jkfn.2003.32.1.022]

-
Choi JI, Kim YJ, Kim JH, Song BS, Yoon YH, Byun MW, Kown JH, Chun SS, Lee JW (2009) Antioxidant activites of the extract fractions from Sunaeda japonica. J Korean Soc Food Sci Nutr 38(2): 131-135.
[https://doi.org/10.3746/jkfn.2009.38.2.131]

-
Choi YM, Jeong HS, Lee, JS (2007) Antioxidant activity of methanolic extracts from some grains consumed in Korea. Food Chem 103(1): 130-138.
[https://doi.org/10.1016/j.foodchem.2006.08.004]

-
Chung SK, Osawa T, Kawakishi S (1997) Hydroxyl radical scavening effect of spices and scavengers from brown mustard. Biosci Biotechnol Biochem 61(1): 118-123.
[https://doi.org/10.1271/bbb.61.118]

-
David AVA, Arulmoli R, Parasuraman S (2016) Overviews of biological importance of quercetin: A bioactive flavonoid. Pharmacogn Rev 10(20): 84-89.
[https://doi.org/10.4103/0973-7847.194044]

-
Dröge W (2002) Free radicals in the physiological control of cell function. Physiol Rev 82(1): 47-95.
[https://doi.org/10.1152/physrev.00018.2001]

-
Folin O, Denis W (1912) On phosphotungstic-phosphomolybdic compounds as color reagents. J Biol Chem 12(2): 239-243.
[https://doi.org/10.1016/S0021-9258(18)88697-5]

-
Fontana M, Mosca L, Rosei MA (2001) Interaction of enkephalins with oxyradicals. Biochem Pharmacol 61(10): 1253-1257.
[https://doi.org/10.1016/S0006-2952(01)00565-2]

-
Fridovich I (1997) Superoxide anion radical (O2-.), superoxide dismutases, and related matters. J Biol Chemi 272(30): 18515-18517.
[https://doi.org/10.1074/jbc.272.30.18515]

- Garratt DC (1955) The Quantitative Analysis of Drugs. Chapman and Hall Ltd., Tokyo, Japan. pp 456-458.
-
Gong, Y, Li Y, Abdolmaleky HM, Li L, Zhou JR (2012) Tanshinones inhibit the growth of breast cancer cells through epigenetic modification of Aurora A expression and function. PloS One 7(4): e33656.
[https://doi.org/10.1371/journal.pone.0033656]

-
Graf E, Eaton JW (1990) Antioxidant functions of phytic acid. Free Radic Biol Med 8(1): 61-69.
[https://doi.org/10.1016/0891-5849(90)90146-A]

-
Guha M, Mackman N (2001) LPS induction of gene expression in human monocytes. Cell Signal 13(2): 85-94.
[https://doi.org/10.1016/S0898-6568(00)00149-2]

-
Gülçin İ, Berashvili D, Gepdiremen A (2005) Antiradical and antioxidant activity of total anthocyanins from Perilla pankinensis decne. J Ethnopharmacol 101(1-3): 287-293.
[https://doi.org/10.1016/j.jep.2005.05.006]

- Guonan, Lee JA (2022) Effects of solvents on the anti-aging activity of Salvia miltiorrhiza extract. J Converg Inf Technol 12(5): 290-297.
- Halliwell B, Gutteridge JM, Cross CE (1992) Free radicals, antioxidants, and human disease: Where are we now? J Lab Clin Med 119(6): 598-620.
-
Haro-Vicente JF, Martinez-Gracia C, Ros G (2006) Optimisation of in vitro measurement of available iron from different fortificants in citric fruit juices. Food Chem 98(4): 639-648.
[https://doi.org/10.1016/j.foodchem.2005.06.040]

-
Hayyan M, Hashim MA, AlNashef IM (2016) Superoxide ion: Generation and chemical implications. Chemi Rev 116(5): 3029-3085.
[https://doi.org/10.1021/acs.chemrev.5b00407]

-
Higuchi M, Higashi N, Taki H, Osawa T (1990) Cytolytic mechanisms of activated macrophages. Tumor necrosis factor and Larginine -Dependent mechanism acts as synergistically as the major cytolytic mechanisms of activated macrophages. J Immunol 144(4): 1425-1431.
[https://doi.org/10.4049/jimmunol.144.4.1425]

-
Hu P, Liang QL, Luo GA, Zhao ZZ, Jiang ZH (2005) Multi-component HPLC fingerprinting of Radix Salviae Miltiorrhizae and its LC-MS-MS identification. Chem Pharm Bull 53(6): 677-683.
[https://doi.org/10.1248/cpb.53.677]

-
Ju JC, Shin JH, Lee SJ, Cho HS, Sung NJ (2006) Antioxidant activity of hot water extracts from medicainal plants. J Korean Soc Food Sci Nutr 35(1): 7-14.
[https://doi.org/10.3746/jkfn.2006.35.1.007]

- Kim EY, Baik IH, Kim JH, Kim SR, Rhyu MR (2004) Screening of the antioxidant activity of some medicinal plants. Korean J Food Sci Technol 36(2): 333-338.
- Kim HK, Kim YE, Do JR, Lee YC, Lee BY (1995) Antioxidative activity and physiological activity of some Korean medicinal plants. Korean J Food Sci Technol 27(1): 80-85.
- Kim HK, Kwon YJ, Kim YE, Nahmgang B (2004) Changes of total polyphenol content and antioxidant activity of aster scaber thunb extracts with different microwave assisted extraction conditions. Korean J Food Preserv 11(1): 88-93.
- Kim JH, Cho HD, Won YS, Park WL, Min HJ, Han SH, Moon KD, Seo KI (2019) Antioxidant and α-glucosidase inhibition activity of solvent fractions from Prunus mume ethanol extract. J Life Sci 29(10): 1111-1119.
-
Kim SS, Park KJ, Yun SH, Choi YH (2019) Bioactive compounds and antioxidant capacity of domestic citrus cultivar ‘Haryejosaeng’. Korean J Food Preserv 26(6): 681-689.
[https://doi.org/10.11002/kjfp.2019.26.6.681]

- Kim WI, Kim WH (2002) Beneficial effect of Salviae miltiorrhizae Radix (SR) on H2O2-induced cell death in intestinal epithelial cells. J Korean Med 23(3): 164-173.
- Kim YH, Han YS, Paik JE, Song TH (2003) Screening of antioxidant activity in Dansam (Salvia miltiorrhiza) and additional effect on the shelf-life and the characteristics of Yakgwa. Korean J Food Cook Sci 19(4): 463-469.
- Kim YJ, Kim SY, Jeong MJ, Lee UT, Choo ST, Youn SN, Kim MR (2018) Antioxidant effect of ethanol extract from Plantaginis Herba. Korean J Herbolgy 33(3): 37-43.
- Kwang JS, Baek SH (2003) Cytotoxicity and antimicrobial effects of extracts from Salvia miltiorrhiza. Kor J Pharmacogn 34(4): 293-296.
-
Kwon JY, An SH, Kong KH (2022) Inhibitory effects of Dansam and Dansam-eum on reflux esophagitis and migration of cancer cells. J Int Korean Med 43(6): 1162-1185.
[https://doi.org/10.22246/jikm.2022.43.6.1162]

-
Lapornik B, Prošek M, Wondra AG (2005) Comparison of extracts prepared from plant by-products using different solvents and extraction time. J Food Eng 71(2): 214-222.
[https://doi.org/10.1016/j.jfoodeng.2004.10.036]

- Lee JB, Park HK, Lee JS, Kim MH (2011) Studies on antioxidant activity, total flavonoids and polyphenols, and reducing power in Yakju with different ratios of dandelion root. J East Asian Soc Diet Life 21(6): 882-887.
-
Lee SE, Cho SI (2015) Anti-inflammatory effects of Salviae miltiorrhizae Radix extract on RAW264.7 cell. via anti-oxidative activities. Kor J Herbology 30(4): 89-94.
[https://doi.org/10.6116/kjh.2015.30.4.89.]

-
Lee WY, Cheung CC, Liu KW, Fung KP, Wong J, Lai PB, Yeung JH (2010) Cytotoxic effects of tanshinones from Salvia miltiorrhiza on doxorubicin-resistant human liver cancer cells. J Nat Prod 73(5): 854-859.
[https://doi.org/10.1021/np900792p]

- Loliger J (1991) The use of antioxidants in food. In: Aruoma OI, Halliwell B (eds). Free radicals and food additives. Taylor and Francis, London, pp 121-150.
-
Long LH, Evans PJ, Halliwell B (1999) Hydrogen peroxide in human urine: Implications for antioxidant defense and redox regulation. Biochem Biophys Res Commun 262(3): 605-609.
[https://doi.org/10.1006/bbrc.1999.1263]

-
Mahoney JR, John R, Graf E (1986) Role of alpha tocopherol, ascorbic acid, citric acid and EDTA as oxidants in model systems. J Food Sci 51(5): 1293-1296.
[https://doi.org/10.1111/j.1365-2621.1986.tb13108.x]

-
Marklund S, Marklund G (1974) Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem 47(3): 469-474.
[https://doi.org/10.1111/j.1432-1033.1974.tb03714.x]

- Ministry of Food and Drug Safety (MFDS) (2022) Food Code. https://various.foodsafetykorea.go.kr, (accessed on 30. 12. 2022).
-
Mukherjee A, Agrawal M (2017) World air particulate matter: Sources, distribution and health effects. Environ Chem Lett 15(2): 283-309.
[https://doi.org/10.1007/s10311-017-0611-9]

-
Ngoc LTN, Park DS, Lee YG, Lee YC (2017) Systematic review and meta-analysis of human skin diseases due to particulate matter. Int J Environ Res Public Health 14(12): 1458.
[https://doi.org/10.3390/ijerph14121458]

-
Oyaizu M (1986) Studies on products of browning reaction antioxidant activities of products of browning reaction prepared from glucosamine. Jap J Nutr Diet 44(6): 307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

- Park SG, Shin MS, Choi JB, Kim SJ (2009) Anti-cancer effects Salvia miltiorrhiza, Carydalis turtschaminovii, Reynoutria elliptica herbal acupuncture on solid tumor of rats induced by injection of RK3E-ras cells. J Korean Med Rehabil 19(1): 91-102.
-
Pastore S, Korkina L (2010) Redox imbalance in T cell-mediated skin diseases. Mediators Inflamm 2010: 1-9.
[https://doi.org/10.1155/2010/861949]

-
Pérez-Fons L, GarzÓn MT, Micol V (2010) Relationship between the antioxidant capacity and effect of rosemary (Rosmarinus officinalis L.) polyphenols on membrane phospholipid order. J Agric Food Chem 58(1): 161-171.
[https://doi.org/10.1021/jf9026487]

- Kim HK, Kwon YJ, Kim YE, Nahmang B (2004) Changes of total polyphenol content and antioxidant activity of aster scaber thunb extracts with different microwave assisted extraction conditions. Korean J Food Preserv 11(1): 88-93.
-
Proestos C, Varzakas T (2017) Aromatic plants: Antioxidant capacity and polyphenol characterisation. Foods 6(4): 28.
[https://doi.org/10.3390/foods6040028]

-
Qi W, Qi W, Xiong D, Long M (2022) Quercetin: Its antioxidant mechanism, antibacterial properties and potential application in prevention and control of toxipathy. Molecules 27(19): 6545.
[https://doi.org/10.3390/molecules27196545]

-
Remigante A, Spinelli S, Basile N, Caruso D, Falliti G, Dossena S, Morabito R (2022) Oxidation stress as a mechanism of aging in human erythrocytes: Protective effect of quercetin. Int J Mol Sci 23(14): 7781.
[https://doi.org/10.3390/ijms23147781]

-
Roberta R, Nicoletta P, Anna P, Anath P, Min Y, Catherine RE (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26(9-10): 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Saiga AI, Tanabe S, Nishimura T (2003) Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment. J Agric Food Chem 51(12): 3661-3667.
[https://doi.org/10.1021/jf021156g]

-
Seo SY, Park YG, Jang YS, Ka KH (2017) Antioxidant properties of Lentinula edodes after sawdust bag cultivation with different oak substrates. Kor J Mycol 45(2): 121-131.
[https://doi.org/10.4489/KJM.20170015]

-
Shahidi F, Janitha PK, Wanasundara PD (1992) Phenolic antioxidants. Crit Rev Food Sci Nutr 32(1): 67-103.
[https://doi.org/10.1080/10408399209527581]

-
Shin JH, Lee HG, Kang MJ, Lee SJ, Sung NJ (2010) Antioxidant activity of solvent fraction from black garlic. J Korean Soc Food Sci Nutr 39(7): 933-940.
[https://doi.org/10.3746/jkfn.2010.39.7.933]

- Shon YH, Cho HJ, Kim MK, Jung EJ, Nam KS (2007) Effect of ethanol extract from Salvia miltiorrhiza on chemoprevention and metastasis of breast cancer. Kor J Pharmacogn 38(1): 62-66.
-
Sivaranjani N, Rao SV, Rajeev G (2013) Role of reactive oxygen species and antioxidants in atopic dermatitis. J Clin Diagn Res 7(12): 2683-2685.
[https://doi.org/10.7860/JCDR/2013/6635.3732]

-
Snyder SH, Bredt DS (1992) Biological roles of nitric oxide. Sci Am 266(5): 68-71.
[https://doi.org/10.1038/scientificamerican0592-68]

-
Stohs SJ (1995) The role of free radicals in toxicity and disease. J Basic Clin Physiol Pharmacol 6(3-4): 205-228.
[https://doi.org/10.1515/JBCPP.1995.6.3-4.205]

-
Sueishi Y, Hori M, Kita M, Kotake Y (2011) Nitric oxide (NO) scavenging capacity of natural antioxidants. Food Chem 129(3): 866-870.
[https://doi.org/10.1016/j.foodchem.2011.05.036]

-
Tandy S, Schulin R, Nowack B (2006) The influence of EDDS on the uptake of heavy metals in hydroponically grown sunflowers. Chemosphere 62(9): 1454-1463.
[https://doi.org/10.1016/j.chemosphere.2005.06.005]

-
Tsai SH, Lin-Shiau SY, Lin JK (1999) Suppression of nitric oxide synthase and the down-regulation of the activation of NFkB in macrophages by resveratrol. Br J Pharmacol 126(3): 673-680.
[https://doi.org/10.1038/sj.bjp.0702357]

-
Wu BW, Pan TL, Leu YL, Chang YK, Tai PJ, Lin KH, Horng JT (2007) Antiviral Effects of Salvia miltiorrhiza (Danshen) Against Enterovirus 71. Am J Chin Med 35(1): 153-168.
[https://doi.org/10.1142/S0192415X07004709]

-
Xu W, Liu LZ, Loizidou M, Ahmed M, Charles IG (2002) The role of nitric oxide in cancer. Cell Res 12(5): 311-320.
[https://doi.org/10.1038/sj.cr.7290133]

-
Xu XM, Jun JY, Jeong IH (2007) A study on the antioxidant activity of Hae-Songi mushroom (Hypsizigus marmoreus) hot water extracts. J Korean Soc Food Sci Nutr 36(11): 1351-1357.
[https://doi.org/10.3746/jkfn.2007.36.11.1351]

- Yang EJ, Seon YK, Seo YS, Shin BY (2017) Component analysis and comparison of biological activities of Salvia miltiorrhiza bunge from different cultivation regions. J Korean Soc Food Sci Nutr 46(8): 929-936.
-
Yang HS, Hwang IG, Choi AJ, Choe JS (2023) Neuroprotective effect of Deodeok (Codonopsis lanceolata) bud extracts in H2O2-stimulated SH-SY5Y cells. J Nutr Health 56(2): 140-154.
[https://doi.org/10.4163/jnh.2023.56.2.140]

-
Yoo HJ, Kang HJ, Song YS, Park EH, Lim CJ (2008) Anti-angiogenic and anti-inflammatory activities of Lonicera japonica extract. J Pharm Pharmacol 60(6): 779-786.
[https://doi.org/10.1211/jpp.60.6.0014]

- Yun HJ, Heo SK, Yun HJ, Park WH, Park SD (2007) Anti-inflammatory effect of Salviae miltiorrhizae Radix. Kor J Herbology 22(4): 65-73.
-
Zhang H, Liu YY, Jiang Q, Li KR, Zhao YX, Cao C, Yao J (2014) Salvianolic acid A protects RPE cells against oxidative stress through activation of Nrf2/HO-1 signaling. Free Radic Biol Med 69: 219-228.
[https://doi.org/10.1016/j.freeradbiomed.2014.01.025]

-
Zhang Z, Zhang D, Ma M, Sun L (2020) Protective and potential mechanism of salvianolic acid B on sodium laurate-induced thromboangiitis obliterans in rats. Phytomedicine 66: 153110.
[https://doi.org/10.1016/j.phymed.2019.153110]