
발효 이고들빼기(Youngia denticulata Houtt Kitamura) 에탄올 추출물이 알코올 투여로 손상시킨 흰쥐의 간독성 해소 효과
Abstract
This study was performed to investigate the hepatotoxicity reducing effect of ethanol extracts from Youngia denticulata Houtt Kitamura (YD) fermented by Aspergillus oryzae, which is well known as a Korean traditional meju microbe. Experimental rats were divided into 4 diets groups (six rats/group) (NC: normal control group, EC: ethanol supplemented control group, ENY: ethanol extracts 0.5% supplemented diets of the non-fermented YD group, EFY: ethanol extracts 0.5% supplemented diets of the fermented YD group). After feeding them for four weeks, the activities GOT and GPT in serum, contents of neutral lipid, total cholesterol, LPO and GSH, and activities of XO (O type) enzyme, SOD and GST in liver tissue were observed. Compared to the NC group, the GOT and GPT activities in the EC group were markedly increased by 87.91% and 57.02%, and the contents of neutral lipid, total cholesterol and LPO were increased by 77.51%, 18.56% and 193.86%, respectively. On the other hand, the GSH content was decreased by 29.52%. The activities of SOD and GST which are anti-oxidation-related enzymes, were decreased by 42.78% and 0.94%, respectively, compared to the NC group, but the XO (O type) enzyme activity was significantly increased by 70.83%. These results confirmed that the liver tissue and anti-oxidation system of the EC group had been damaged. Compared to the EC group, the GOT and GPT activities of the ENY and EFY groups were significantly decreased by 24.73∼41.99% and 22.91∼30.11%, respectively. The contents of neutral lipid, total cholesterol and LPO were decreased by 16.65∼33.33%, 22.44∼23.11% and 63.34∼66.13%, respectively, but the GSH content was significantly increased by 24.61∼35.60%. The GST activity was not significantly affected, but the SOD activity was significantly increased by 214.94∼261.19%. The XO (O type) enzyme activity was significantly decreased by 40.34∼51.20%. Compared to the ENY group, the GOT and GPT activities of the EFY group were significantly decreased by 22.93% and 9.34%, respectively. The plasma contents of neutral lipid, total cholesterol and LPO were decreased by 20.01%, 0.86% and 7.59%, respectively. The SOD activity was significantly increased by 21.52%, and the XO (O type) enzyme activity was decreased by 18.19%. Given decreasde TG, total cholesterol, LPO contents of liver tissue, GOT, GPT and XO activity, and increased SOD activity, these study results that ethanol extracts from fermented Youngia denticulata Houtt Kitamura may be effective in reducing hepatotoxicity.
Keywords:
Youngia denticulata Houtt Kitamura, fermentation, Aspergillus oryzae, hepatotoxicity, anti-oxidation-related enzymes activity서 론
경제성장과 생활수준의 향상으로 기호식품의 소비가 증가하고 있으며, 주류의 소비량도 2006년 이후 줄곧 증가추세에 있다. 주류의 1인당 소비량(Korean National Statistical Office 2016)은 맥주 149병, 소주 63병, 전통주 33병, 양주 3병, 와인 2병으로 높으며, 여성용 술의 소비량 또한 늘어나고 있어 건강에 대한 경각심을 주고 있다. 급․만성 음주는 간, 신장 및 뇌 등 장기에 손상을 유발하며, 간염과 간경화를 유도해 사망을 초래하는 것으로 알려져 있다(Lieber CS 1997; Arteel G 등 2003; Williams R 2006). 일반적으로 섭취된 에탄올은 신속하게 흡수되어 주로 간에서 alcohol dehydrogenase(ADH)에 의해 acetaldehyde로, 다시 aldehyde dehydrogenase(ALDH)에 의해 acetic acid로 산화되어 에너지를 생산하며, 일부는 호흡기를 통해 배설된다(Cunninghm CC & Bailey SM 2001; Lieber CS 2004; Das SK & Vasudevan DM 2007). 에탄올에 의한 장기 조직의 손상은 다양하고 복잡한 기전을 통하여 야기되는데, 대사과정 중에 ADH와 ALDH에 의해 생성된 NADH은 NADH/NAD+의 비율을 증가시키며, 고 젖산혈증으로 체액의 산성화와 지방산의 합성증가에 따른 지방간 생성이 우려되고 있다(Lieber CS 1997; Cederbaum AI 1991; Lieber CS 1992; Lands WEM 등1999; Mantle D & Preedy VR 1999; Das SK 등2005). 음주로 인한 간독성 해소의 가장 이상적인 방법은 대사를 촉진시키는 것(Niemela O 등 1987; Lin RC 등 1988; Fang JL & Vaca CE 1997; Mello T 등 2008)으로 숙취해소와 장기손상을 경감 또는 예방하기 위한 다양한 의약품과 건강기능식품이 국내외적으로 개발․판매되고 있으나, 실제적으로 효과가 뚜렷한 제품을 찾기는 매우 어려운 것이 현실이다.
이고들빼기는 씀바귀, 고들빼기, 왕고들빼기, 민들레와 함께 국화과에 속하는 식물로서, 우리나라의 산야에 널리 분포된 식물(Song JT 등 1989) 중의 하나이다. 국화과 식물 중에서 씀바귀는 해열, 건위, 조혈, 당뇨, 간질환 등 각종 생활습관병의 치료에 이용되고 있으며(Baek GY 2000), 황달(Jin JI 1985; Kim JG 1989), 혈중 지질의 감소 및 항당뇨(Choi JS 등 1990; Choi JS 등 1991), 항돌연변이 및 항암활성(Kim SH 1995)이 있는 것으로 보고되고 있다. 왕고들빼기는 HIV 및 간염바이러스 증식을 억제하며(Piras G 등 1997; Yamamoto Y 등 1999; Kim YH 2004), 고들빼기는 항암효과(Choi JS 등 1991; Kim MJ 등 1997)와 혈중 콜레스테롤 감소 및 간 손상억제 효과가 있으며(Bae SJ 등 1997), 이고들빼기 및 고들빼기 성분이 급성 에탄올 독성을 완화시켜 줄 수 있다(Son JC 등 2012)고 보고한 바 있다.
최근에는 한약재류를 비롯하여 각종 산 야채를 여러 가지 미생물을 이용하여 발효시킴으로써 약리적 효과가 증진된다는 사실들이 알려져 있다(Ann HY 2014; Kang YH 등 2015; Kim YJ 등 2012). Lee 등은 Monascus pilosus 발효 뽕잎차 열수 추출물이 체중감소 효과와 간 조직 손상을 예방하고 경감시킨다(Lee 등 2013)고 하였고, Lee J 등(2010)은 Aspergillus oryzae 생균이 동물의 장내에서 Lactobacillus속 미생물의 기질로 사용되어 유해한 세균류에 대한 항균작용을 높이고, 소화를 증진하며, 체내 콜레스테롤을 감소시킨다고 하였다. 또 Aspergillus oryzae를 이용한 발효물은 항돌연변이원성, 항암성, 면역체계 활성화를 통한 생체방어기능, 항고혈압 등 다양한 생리활성을 나타내며(Chirtchai P 등 2011), 이를 이용하여 발효시킨 도라지, 울금, 귤피는 항비만 및 간 보호효과가 있다(Kang YH 등 2015; Jeon HJ 등 2014; Kim YJ 등 2012). Aspergillus oryzae는 WHO에서 GRS(Generally Regarded as Safe)로 인정된 미생물(Machida M 등 2008)로 우리나라에서는 간장, 된장, 고추장, 발효주 제조에 널리 사용되어 왔다(Hong KJ 등 2004; Marui J 등 2013).
이고들빼기는 국화과 식물 중에서 약리적 효과가 가장 높아 민간에서 즐겨 애용(Kim JG 1992)하여 왔으나, 이에 대한 연구는 많지 않고, 특히 이고들빼기 발효물을 이용한 연구는 매우 미흡한 실정이다.
따라서 본 연구에서는 국화과 식물 중 과학적인 연구가 미흡한 이고들빼기를 Aspergillus oryzae로 발효시킨 후, 얻은 에탄올 추출물이 알코올로 손상시킨 흰쥐의 간 해독에 미치는 영향을 조사하기 위하여 간 손상 지표로 널리 사용(Park JK 등 2008; De Ritis R 등 1965; Lieber CS 1985; Han EK 등 2009)되고 있는 혈중 glutamic oxaloacetic transaminase(GOT) 및 glutamic pyruvic transaminase(GPT)의 활성을 조사하는 한편, 간조직의중성지질(TG), 총콜레스테롤, lipid peroxide(LPO), 조직손상을 방어하거나 경감시키는 효과가 있는(Wang RS 등 1999) glutathione(GSH) 함량을 측정하였으며, 독성으로부터 생체를 보호(Forrnan HJ & Fridovich 1973; Bompart GJ 등 1990)하는 항산화계효소로 superoxide dismutase(SOD) 및 glutathione S-transferase(GST)의 활성과 체내에서 활성산소종을 생성시키는 효소로 간을 비롯한 생체 내 조직을 손상(Hashim MS 등 2005; Kundu TK 등 2007)시키고, 노화와 생활습관병 유발의 원인이 되는(Lee K 1991; Hashim MS 등 2005; Ham YK & Kim SW 2004) 산화계 효소인 xanthin oxidoreductase(XO)의 O type 효소의 활성을 조사하였다.
재료 및 방법
1. 재료
본 실험에 사용한 실험재료는 2013년 8월에 경상북도 상주시의 산야에 자생하는 이고들빼기(Youngia denticulata Houtt Kitamura)를 잎과 뿌리를 함께 채취한 후, 흐르는 수돗물로 깨끗이 세척한 다음 50℃의 건조기에서 수분함량이 5%가 되게 충분히 건조시켰다. 다음에 Food Mixer(HNF-1710, Hanil Electric Co. Ltd, Seoul, Korea)로 50 mesh로 분쇄하여 폴리에틸렌 백에 넣어 4℃에 두면서 실험재료로 사용하였다. 발효용 As- pergillus oryzae는 메주제조용의 황국균을 NH 마켓에서 구입하여 사용하였다.
2. 발효
이고들빼기 시료 1 kg을 약 3 L들이 플라스틱 용기(지름 60 cm, 높이 20 cm)에 넣은 후, 황국균 분말 1 g을 골고루 혼합한 수돗물 700 mL를 부어 잘 혼합하였다. 다음에 폴리에틸렌필름으로 덮은 후, 25℃의 정온실에서 7일간 발효시켰다. 그런 후에 3 L들이 폴리프로필렌 백에 약 500 g 씩 담아 120℃에서 1시간 동안 살균하고, 약 100 g 씩 덩이로 만들어 1개월간 건조, 숙성시켜 실험재료로 사용하였다(이하 발효 이고들빼기 또는 fermented YD). 대조구는 Aspergillus oryzae를 첨가하지 않은 동일한 이고들빼기를 상기와 동일한 조건으로 증자하여 건조시킨 것(이하 비발효 이고들빼기 또는 non-fermented YD)을 사용하였다.
3. 추출물의 제조
발효 또는 비발효 이고들빼기 각 100 g씩에 70% 에탄올 2 L씩을 가하여 냉각관을 부착한 추출장치를 사용하여 80∼90℃에서 10시간 동안 가열 추출하였다. 다음에 3겹의 면포로 여과하여 얻은 여액을 감압농축장치(Strike 300, Sterpoglass, Italy)를 이용하여 70 Brix의 아주 걸쭉한 농축액으로 제조하였다. 이 농축액은 동결건조하여 원료 kg 당 약 40 g의 건조물을 얻었다.
4. 동물실험 및 식이조성
실험동물은 6주령의 평균체중이 150±10 g의 수컷 흰쥐(Sprague-Dawly SPF/VAF outbred rats, Orient, Korea)를 1주일간 환경에 적응시킨 후 정상대조군(NC), 에탄올대조군(EC), 에탄올 급여 및 비발효 이고들빼기 추출물 0.5% 첨가식이 급여군(ENY), 에탄올 급여 및 발효 이고들빼기 추출물 0.5% 첨가식이 급여군(EFY)의 4개 군(6마리/군)으로 나누어 4주간 사육하였다. 실험식이의 조성은 Table 1과 같다. 4주간 사육한 실험동물은 Khanal T 등(2009)의 방법으로 공복 상태에서 1일 1회, 2일간 50% 에탄올 용액을 체중 kg당 5 g씩 경구투여하였으며, 마지막 투여 후 12시간이 경과한 다음 처치하였다. 사육장은 스테인리스 스틸 케이지를 사용하고, 온도 및 습도는 23±2℃, 60±5%로 조정하고, 명암주기는 12시간 간격으로 설정하고, 물과 사료의 섭취는 자유 섭취시켰다.
5. 체중증가율의 측정
체중증가율은 전 실험 기간을 통하여 매일 일정한 시간에 측정하였으며, 초기체중에 대하여 실험을 행한 4주간 동안 증가한 체중을 환산하였다.
6. 측정용 시료의 조제
실험식이로 4주간 사육한 흰쥐를 물은 자유롭게 먹게 하고, 12시간동안 절식시킨 후 에테르 마취 하에서 복부대동맥으로부터 채혈한 다음, 빙냉의 생리식염수로 간을 관류하고 장기를 적출한 후, 습기를 제거하여 무게를 측정하였다. 성분 및 효소활성 측정용 시료의 조제는 적출한 간 조직에 phosphate 완충용액(pH 7.4)을 가한 후, Polytron Homogenizer(PT-3100, Brinkmann, USA)를 사용하여 균질액을 조제한 후 —40℃ 빙냉고에 보관하면서 시액으로 사용하였다. 채취한 혈액은 실온에서 응고시킨 다음 4℃, 2,500 rpm으로 20분간 원심분리하여 혈청을 분리한 후, —40℃에 두면서 분석용 시료로 사용하였다.
7. 간 조직의 지질함량 측정
Folch 등(1957)의 방법에 따라 chloroform:methanol(2:1) 혼합액에 간 조직 마쇄액 일정량을 가해 잘 혼합한 다음, 방치하여 분리된 유기용매 부분 일정량을 취해 질소가스 존재 하에서 휘발시킨 후 혈청 중성지질(TG) 측정용 kit 시약(AM 157SK, Asan Pharm Co, Ltd, Seoul, Korea)과, total cholesterol 측정용 kit 시약(AM 202-K, Asan Pharm, Co, Ltd, Seoul, Korea)으로 각각 측정하였다.
8. LPO 및 GSH의 함량 측정
LPO(lipid peroxide)의 함량은 Satoh(1978)의 방법에 따라 간조직 균질액에 thiobarbituric acid(TBA) 용액을 가하여 반응시킨 후 n-butanol을 가해 이행되는 TBA-reactive substance의 흡광도를 532 nm에서 측정, 분자흡광계수, ε=1.5×105M—1cm—1를 이용하여 함량을 산출하였으며, 간 조직 g당 nmole로 나타내었다. 간 조직 glutathione(GSH)의 함량은 Ellman(1959)의 방법에 따라 적출한 동물의 간 조직 균질액에 2-nitrobenzoic acid를 가해 생성되는 thiophenol의 함량을 측정하였으며, 간조직 g당 환원형 글루타치온 μmole로 나타내었다.
9. GOT 및 GPT의 측정
혈청 중의 GOT와 GPT 활성은 Reitman-Frankel 법(1957)에 따라 조제된 kit(Young-Dong Pham, Seoul, Korea)를 사용하여 측정하였다.
10. SOD 및 GST의 측정
SOD 및 GST의 측정은 알코올을 투여하면서 4주간 실험식이를 행한 후, 간 조직의 SOD 및 GST 활성을 측정하였다. SOD 활성은 Martin JP 등(1987)의 방법에 따라 superoxide anion radical에 의해 hematoxylin으로부터 생성되는 hematin을 560 nm에서 측정하였으며, hematoxylin의 자동산화를 50% 억제하는 단백질의 mg으로 나타내었다. GST 활성도는 Habig WH 등(1974)의 방법에 따라 효소에 의해 기질인 1-chloro-2, 4-dinitrobenzene과 reduced glutathione이 반응하여 생성되는 thioether의 흡광도를 340 nm에서 측정한 다음, 흡광계수(ε=9.5M—1cm—1)를 이용하여 활성도를 계산하였으며, 분당 단백질 1 mg이 생성시킨 thioether의 nmole로 나타내었다.
11. XO의 측정
XO의 O type 효소의 활성은 Stirpe F와 Della Corte의 방법(1969)에 따라 NADH를 첨가하지 않은 상태에서 생성되는 uric acid의 함량을 292 nm에서 측정하였으며, 활성도는 분당 단백질 1 mg이 기질인 xanthine으로부터 생성되는 uric acid의 양을 nmole로 나타내었다.
12. 통계처리
모든 실험은 실험동물 6마리에 대하여 각각 측정하였으며, 평균과 표준편차로 나타내었다. 유의성은 SPSS(Statistical Package for the Social Science, SPSS Inc, version 20.0 Chicago, IL, USA)를 이용하여 Duncan’s multiple range test를 행하여 p<0.05 수준에서 유의성을 검정하였다.
결과 및 고찰
1. 체중과 간의 중량
알코올을 투여하면서 4주간 실험식이를 행한 후, 체중증가량과 체중에 대한 간의 중량 %를 조사한 결과는 Fig. 1과 같다. 체중의 증가량은 에탄올 대조군(EC)이 정상군(NC)에 비하여 29.69%가 감소하였다. 그러나 비발효 이고들빼기 추출물 첨가군(ENY)과 발효 이고들빼기 추출물 첨가군(EFY)에서는 모두 EC군에 비하여 유의한 증가를 보여 에탄올에 대한 독성을 경감시키는 것으로 나타났다. 그리고 ENY군과 EFY군 모두 에탄올 대조군인 EC군에 비하여는 유의적인 체중증가를 나타내었으나, ENY군은 정상군에 미치지는 못했으며, EFY군은 정상군과의 유의차를 보이지 않았다. 즉, 발효 이고들빼기 추출물을 급여한 군이 비발효 이고들빼기 추출물을 급여한 군에 비하여 에탄올에 대한 독성을 경감시키는 효과가 큰 것으로 나타났다. 이와 같은 결과는 M. purpureus 발효시킨 참당귀 분말을 알코올로 간독성을 유도한 흰쥐에 급여하였을 때의 체중 증감과 유사한 결과를 보여주고 있다(Ahn HY 등 2013).
한편, 체중에 대한 간의 중량 %는 EC군이 정상군에 비하여 27.81%가 증가되었다. 또, ENY군은 정상군에 비하여 19.53%가 증가되어 증가율로 볼 때, ENY군이 에탄올 투여로 인한 간의 비대현상을 완화시키는 효과가 있는 것으로 추측되나, 유의적인 차이는 보이지 않았다. 반면에, EFY군은 ENY군과는 유의적인 차이를 보이지 않았으며, 정상군과 차이를 보이지 않아 결과적으로 발효시킨 경우에 효과가 큼을 나타내었다.
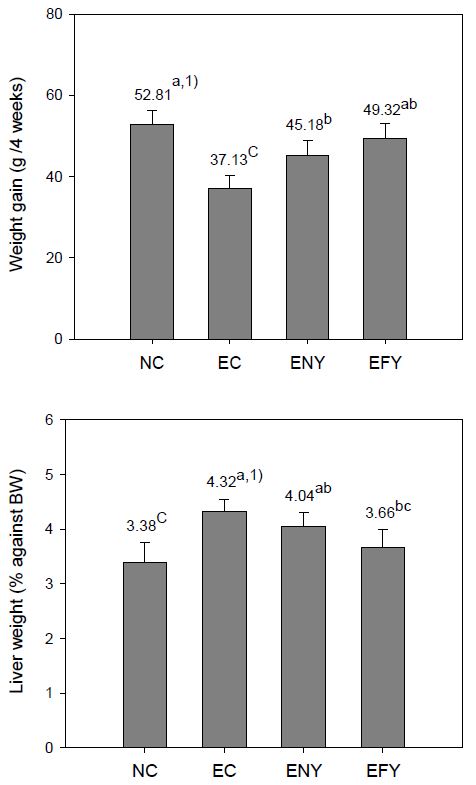
Effects of fermented YD (Youngia denticulata Houtt Kitamura) diets on weight gain and liver weight of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼c) indicates significant differences (p<0.05).
2. GOT 및 GPT 활성
알코올을 투여하면서 4주간 실험식이를 행한 후, 혈청의 GOT 및 GPT의 활성을 측정한 결과는 Fig. 2와 같다. GOT 활성은 에탄올 대조군인 EC군의 경우, 정상군(NC)에 비해 87.91% 높았으며, ENY군은 EC에 비해 크게 떨어졌으나, 정상군에 비해서는 41.44%가 높았다. 반면에, 발효 이고들빼기 추출물 첨가군인 EFY군은 EC군보다 41.99% 낮았고, ENY군과도 유의적으로 낮은 값을 나타내었으며, 정상군과는 비슷한 수준을 보였다. 이러한 결과는 EC군이 알코올 섭취로 인해 간장이 비대해짐으로써 간 조직의 손상이 나타난 것으로 생각되며, 발효 이고들빼기 추출물 식이군이 비발효 식이군에 비하여 알코올 식이로 유도된 간 조직 손상을 크게 완화시킨 것으로 보인다. 혈중 GPT 활성은 EC군이 정상군에 비해 57.01%가 높았다. ENY군과 EFY군은 EC군에 비하여 각각 22.91%, 30.11%로 유의적으로 낮았으며, EFY군은 ENY군과 유의적인 차이를 보이지 않았다. EFY군과 ENY군은 정상군과 뚜렷한 차이를 보이지 않았다. 이러한 결과는 알코올에 의한 간 손상 유발 흰쥐의 고들빼기 식이 급여군에서 GPT 활성이 낮게 나타났다는 Bae SJ 등(1997)의 결과와 유사하며, 급성 에탄올 투여 흰쥐의 이고들빼기 잎과 뿌리의 에탄올 추출물 식이 급여군에서 ALT 활성이 정상군과 비슷한 수준으로 나타났다는 Son JC 등(2012)의 결과와 유사하나, 본 연구에서의 발효 이고들빼기군의 GPT 활성이 낮게 나타난 것은 발효에 의해 간 손상을 회복시키는 효과가 비발효군보다 더욱 크다는 것을 나타낸 것이라 하겠다.
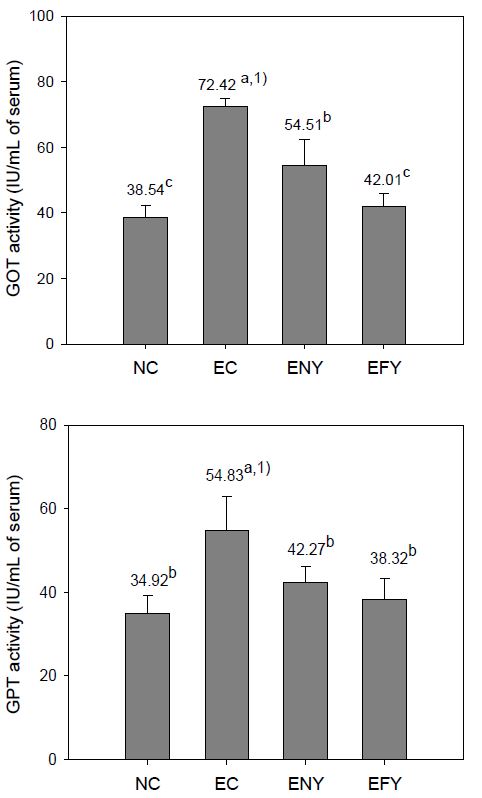
Effects of fermented YD diets on GOT and GPT activity of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼c) indicates significant differences (p<0.05).
3. 간 조직의 LPO 및 GSH의 함량
알코올을 투여하면서 4주간 실험식이를 행한 후, 간조직의 LPO 및 GSH 함량을 측정한 결과는 Fig. 3과 같다. LPO 함량은 EC군이 NC군에 비하여 293.87%나 증가하였다. ENY군과 EFY 군도 EC군에 비하여 각각 36% 및 34% 수준으로 크게 감소하였으나, 상호간의 유의적인 차이는 없었다. 특히 두 군 모두 정상군과 비슷한 수치를 보여 알코올로 인하여 생성되는 지방의 과산화 현상을 감소시키는 효과가 있었다. 간 조직의 GSH 함량은 EC군이 NC군에 비하여 30%가 감소하였으나, ENY군 및 EFY군은 EC군에 비하여 각각 24.6%와 35.6% 증가하였다. 또, EFY 군은 ENY군에 비하여 8.8%의 유의적인 증가를 나타내어, 비발효 경우에 비하여 조직손상을 방어하는 효과가 큼을 나타내었다. GSH는 조직손상을 방어하거나 경감시키는 효과가 있고(Wang RS 등 1999), 체내에서 과산화지질을 무독화시키며(Ohkawa H 등 1979), LPO의 생성을 억제하고, LPO가 분해되어 aldehydes, ketones 및 lactones 등 독성물질을 생성하여 세포조직의 손상과 노화의 촉진현상을 방어한다(Wang RS 등 1999). 즉, EC군은 정상군에 비해 간 조직 내 GSH 함량이 유의적으로 감소하였고, EFY군은 ENY군보다 유의적으로 높은 값을 나타내어, 비발효 경우에 비하여 조직손상을 방어하는 효과가 큼을 나타내었으며, 또 발효 군의 GSH의 함량이 정상군 수준으로 회복됨에 따라 발효이고들빼기 추출물이 LPO 함량은 감소시키면서 결과적으로 독성물질을 무독화하는 GSH 함량을 증가시키는 좋은 효과가 있음을 알 수 있다.
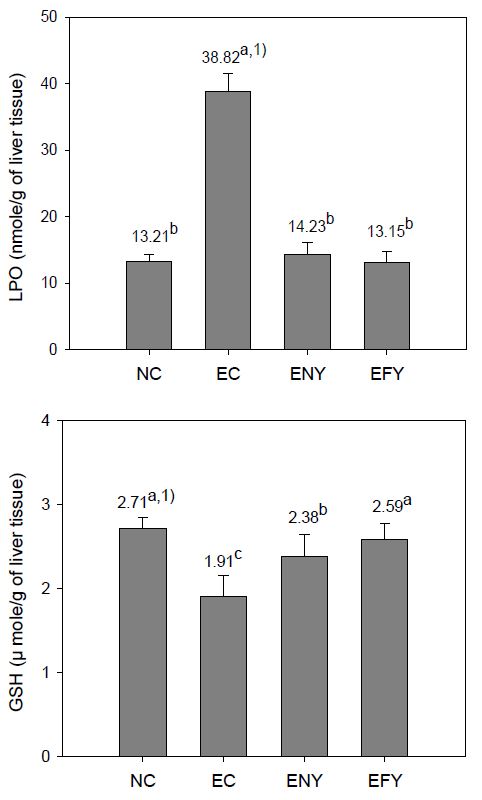
Effects of fermented YD diets on LPO and GSH content of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼c) indicates significant differences (p<0.05).
4. 간 조직의 중성지질 및 총콜레스테롤 함량
알코올을 투여하면서 4주간 실험식이를 행한 후, 간 조직의 중성지질 및 총콜레스테롤의 함량을 측정한 결과는 Fig. 4와 같다. 에탄올만 급성적으로 경구 투여한 EC군에서는 NC군에 비해 간 조직의 중성지방 함량이 77.5% 높았다. EFY군은 알코올로 인해 증가된 EC군의 중성지방을 33.3% 감소시킨 반면, ENY군은 16.6%를 감소시켜 발효군이 비발효군에 비하여 효과가 큼을 나타내었다. EC 군에서 간 조직 중성지방의 함량이 NC군에 비하여 77.5%나 증가된 것은 에탄올의 급성독성에 의해 나타난 현상으로 사료된다. 또, ENY군은 EC군보다 16.65% 낮은 수준을 보였으나, 유의성은 나타나지 않아 이고들빼기 잎과 뿌리추출물에서 유의적인 효과가 있었다는 Son JC 등(2012)의 연구결과와 다소 차이가 있었다.
한편, EFY군의 중성지질함량은 ENY군의 79.99% 수준으로 유의적인 감소를 보였다. 이러한 결과는 Ahn HY 등(2013)이 Monascus purpureus로 발효시킨 당귀분말을 알코올 투여 흰쥐에게 8주간 급여한 결과, 알코올 대조군에 비하여 중성지질함량이 유의적으로 감소하였다(28.1%)는 결과와 유사한 것으로 발효에 의해 간 조직의 중성지질 감소 효과가 큼을 나타낸 결과라 할 수 있다.
총콜레스테롤 함량은 EC군이 NC군에 비하여 18.6%가 높았으나, EFY군과 ENY군 모두 EC군에 비해 각각 23.11% 및 22.44% 낮았다. 이러한 결과는 Aspergillus oryzae로 발효시킨 울금을 알코올 투여 흰쥐에 급여하였을 때 총콜레스테롤 함량에는 영향을 미치지 않았다는 결과와는 상이하나, 중성지방을 감소시켰다는 결과와는 유사하였다(Kim YJ 등 2012).
일반적으로 에탄올의 섭취는 간 조직의 중성지방과, 혈중 총콜레스테롤의 함량을 증가시키는 것으로 알려져 있다(Khanal T 등 2009; Zeng T 등 2008; Ryle PR 등 1986; Demori I 등 2006; Choi JS 등 2006).
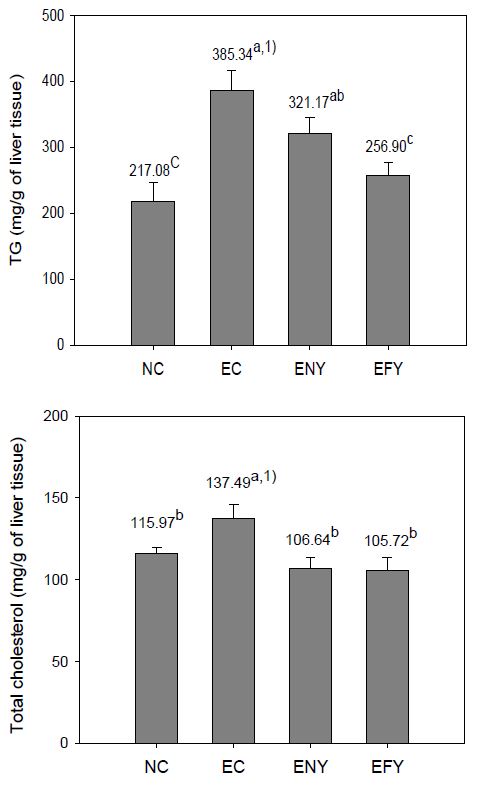
Effects of fermented YD on triglyceride and total cholesterol content of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼c) indicates significant differences (p<0.05).
5. SOD 및 GST 활성
알코올을 투여하면서 4주간 실험식이를 행한 후, 간 조직의 SOD 및 GST 활성을 측정한 결과는 Fig. 5와 같다. 간 조직 SOD의 활성은 EC군이 NC군에 비해 57.22%가 낮았으나, EFY군과 ENY군은 EC군에 비해 각각 161.19% 및 114.94%로 높았으며, EFY군이 ENY군보다 121.52%나 유의적으로 높았다. SOD는 superoxide radical을 HO2로 전환시키며, 생성된 H2O2는 GSH-Px와 catalase의 작용으로 무독의 H2O로 배설됨으로써 산소독성으로부터 생체를 보호한다(Forrnan HJ & Fridovich(1973)고 하였고, 또 Hilton JW 등(1980)은 에탄올 섭취 후 생성되는 활성산소를 체내에서 제거하기 위해 간 조직의 SOD가 증가한다고 한 바, 본 연구결과 SOD 활성이 유의적으로 높게 나타난 발효 이고들빼기 식이군이 비발효군에 비하여 알코올에 의해 생성된 독성으로부터 세포를 보호하는 효과가 큼을 알 수 있었다.
GST는 항산화 활성을 가지는 효소로 독성물질과 발암성 물질 등의 대사산물과 내인성 독소 중 친전자성 물질에 의하여 환원형 glutathione과 함께 glutathione thioester(R-S-G)의 생성반응을 촉매한다(Bompart GJ 등 1990). 본 실험에서 GST 활성은 실험군간 유의적인 차이를 보이지 않았다.
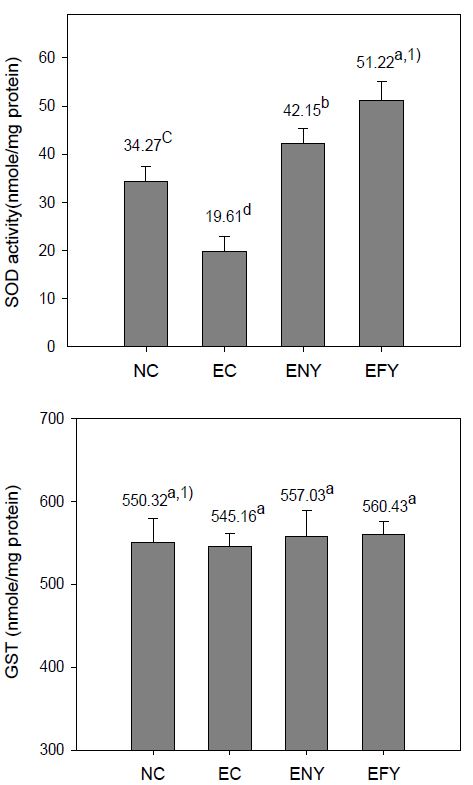
Effects of fermented YD on SOD and GST activity of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼c) indicates significant differences (p<0.05).
6. XO(O type)효소의 활성
알코올을 투여하면서 4주간 실험식이를 행한 후, 간 조직의 XO(O type)효소의 활성을 측정한 결과는 Fig. 6과 같다. EC군의 효소의 활성은 38.42 nmole/mg protein으로 NC군에 비하여 70.8% 높았으나, ENY군과 EFY군은 각각 22.92 및 18.75 nmole/mg protein로 EC군에 비하여 각각 40.34% 및 51.20%가 낮았으며, ENY군과 EFY군의 유의적인 차이는 없었다. 그리고 ENY군과 EFY군 모두 정상군과 유사하거나 그 이하의 활성을 나타내었다.
XO(O type)효소는 체내에서 활성산소종을 생성시키는 효소로 간을 비롯한 생체 내 조직을 손상시키는 작용을 하며(Hashim MS 등 2005; Kundu TK 등 2007), 지질산화, 노화 등에 관여할 뿐만 아니라, 각종 성인병 유발의 원인(Lee K 1991; Hashim MS 등 2005; Ham YK & Kim SW 2004)이 되므로 생체 내 XO 의 활성을 저해시킬 수 있는 polyphenol 또는 flavonoid 등을 비롯한 각종 phytochemicals에 대한 연구가 많이 이루어지고 있는데, 특히 이들 소재를 발효시킴으로서 glycoside 형태로 존재하는 polyphenol성 물질을 활성이 높은 aglycone으로 전환시킴으로써 기능성이 증진(Lee SI 등 2014)된다고 한 바 본 연구 결과에서도 발효군의 XO(O type) 효소의 활성이 EC군보다 월등히 낮고, 정상군과 비발효군보다 낮게 나타난 것은 이고들빼기의 polyphenol성 물질이 발효에 의해 활성이 높은 aglycone으로 전환됨에 따른 기능성 증진효과라 생각된다.
이상의 실험결과를 종합해 볼 때 Aspergillus oryzae로 발효시킨 이고들빼기의 에탄올 추출물은 알코올로 유도된 간손상 흰쥐에 대하여 간 조직 TG와 총콜레스테롤 및 LPO의 함량을 감소시키고, GOT, GPT 및 XO의 활성감소와 동시에 SOD 활성을 높임으로써 비발효 이고들빼기보다 간의 해독효과가 큰 것으로 판단된다.
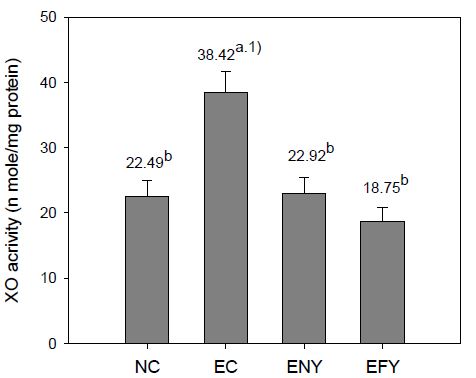
Effects of fermented YD on XO (O type enzyme) activity of ethanol-treated rats fed for 4 weeks.Abbreviations: BW; body weight, NC; normal control group, EC; ethanol supplemented control group, ENY; ethanol extracts 0.5% supplemented diets of non-fermented YD, EFY; ethanol extracts 0.5% supplemented diets of fermented YD.1) Values are mean (n=6). Different superscripts on the letters (a∼b) indicates significant differences (p<0.05).
요 약
Aspergillus oryzae로 발효시킨 이고들빼기의 에탄올 추출물이 알코올성 간독성을 유발한 SD계 흰쥐에 미치는 영향을 조사하였다. 실험군은 정상대조군(NC), 에탄올대조군(EC), 에탄올급여 및 비발효 이고들빼기 추출물 0.5% 첨가식이 급여군(ENY), 에탄올급여 및 발효 이고들빼기 추출물 0.5% 첨가식이 급여군(EFY)의 4개군(6마리/군)으로 나누어 4주간 사육하였으며, 혈청과 간 조직의 주요 지표 성분과 항산화 및 산화관련 효소활성을 측정하였다. 그 결과, EC군이 NC군에 비하여 혈중 GOT 및 GPT 활성은 각각 87.90% 및 57.02%가 높았다. 간 조직의 중성지질과 총콜레스테롤 함량은 각각 77.51% 및 18.56%, LPO 함량은 193.86%가 높았다. 반면에 GSH 함량은 29.52% 낮았다. 또, 항산화계 효소인 SOD 및 GST 활성은 각각 42.78% 및 0.94% 낮게 나타났으며, XO(O type)효소활성은 70.83% 높았다. 이로써 알코올 급여군은 전형적인간 손상과 함께 항산화계에도 손상이 있음을 나타내었다.
ENY 및 EFY군은 EC군과 비교하여 GOT 및 GPT 활성은 각각 24.73∼41.99% 및 22.91∼30.11%가 낮았고, 중성지질함량은 16.65∼33.33%, 총콜레스테롤 함량은 22.44∼23.11%, LPO 함량은 63.34∼66.13%가 감소한 반면, GSH 함량은 24.61∼35.60% 증가하였다. 또, GST 활성은 유의적인 차이를 보이지 않았으나, SOD 활성은 각각 214.94% 및 261.19% 높았다. 또, XO(O type) 효소활성은 40.34∼51.20% 감소하였다. EFY군은 ENY군에 비하여 GOT 및 GPT활성은 각각 22.93%, 9.34% 낮았고, 혈중 중성지질과 총콜레스테롤 및 LPO 함량은 각각 20.01%, 0.86% 및 7.59%가 낮았다. 그리고 SOD 및 GST활성은 각각 21.52% 및 0.6%가 높았고, XO(O type) 효소의 활성은 18.19% 낮았다.
이상의 결과, 발효 이고들빼기 추출물이 알코올로 유도된 간 손상 흰쥐에 대하여 간 조직 TG와 총콜레스테롤 및 LPO의 함량을 감소시키고, GOT, GPT 및 XO의 활성감소와 동시에 SOD활성을 높임으로써 간의 해독효과가 큰 것으로 판단되며, 이러한 결과는 향후 발효 이고들빼기의 성분들을 이용한 기능성식품의 개발과 이를 위한 기초자료로 활용할 수 있을 것으로 사료된다.
REFERENCES
-
Ahn, HY., Park, KR., Kim, YR., Yoon, KH., Kim, JW., Cho, YS., (2013), Effects of Monascus-fermented Angelica gigas Nakai on the contents of serum lipid and tissue lipid peroxidation in alcohol feeding rats, J of Life Science, 23(11), p1371-1380.
[https://doi.org/10.5352/JLS.2013.23.11.1371]

- Ahn, HY., (2014), Effect of fermeneted Angelica gigas Nakai on hepatotoxicity and oxidative stress in the rat, Ph D Dissertation, Dong A University, Pusan, p170-186.
- Arteel, G., Marsano, L., Mendez, C., Bentley, F., McClain, C., (2003), Advances in alcoholic liver disease, Best Pract Res Clin Gastroenterol, 17(1), p625-647.
- Bae, SJ., Kim, NH., Ha, BJ., Jung, BM., Roh, SB., (1997), Effects of Godulbaegi (Ixeris sonchifolia H.) diet on enzyme activities of CCl4 induced hepatotoxicity in rats, J Korean Nutr, 30(1), p19-24.
- Bae, SJ., Kim, NH., Ha, BJ., Jung, BM., Roh, SB., (1997), Effects of Godulbaegi leaf extracts on CCl4 induced hepatotoxicity in rats, J Korean Soc Food Sci Nutr, 26, p137-143.
- Baek, GY., (2000), Effect of hot water extracts from Plantago asiatica var. densiuscula Pilg ilg, Ixeris dentata Nakai and Morus alba L. on detoxication of liver in CCL4 treated rats, Ph D Dissertation, Daegu Catholic University, Daegu, p30-45.
-
Bompart, GJ., Prevot, DS., Bascands, JL., (1990), Rapid automated analysis of glutathione reductase, peroxidase and S-transferase activity: Application to cisplatin-induced toxicity, Clin Bio Ilem, 23, p501-510.
[https://doi.org/10.1016/0009-9120(90)80039-L]

- Cederbaum, AI., (1991), Micrisimal generation of reactive oxygenspecies and their possible role in alcohol hepatotoxicity, Alcohol Suppl, 1, p291-296.
- Chirtchai, P., Chaiyavat, C., Sunee, T., Somsak, V., Wonnop, PS., (2011), 8-Hydroxygenistein formation of soybean fermented with Aspergillus oryzae BCC 3088, Afr J Agric Res, 6, p785-789.
- Choi, JS., Chung, HY., Young, HS., (1990), Aprelinary study on hypocholesterolemia and hypoglycemic activities of some medical plants, Kor T Pharmacogn, 21, p153-156.
-
Choi, JS., Young, HS., Kim, BW., (1991), Hypoglycemic and hypolipidemic effects of Ireris dentata in diabetes rats, Arch Pharm Res, 13, p269-274.
[https://doi.org/10.1007/BF02856534]

-
Choi, JS., Yoon, TJ., Kang, KR., Lee, KH., Kim, WH., Suh, YH., Song, J., Jung, MH., (2006), Glycoprotein isolated from Acanthopanax senticosus protects against hepatotoxicity induced by acute and chronic alcohol treatment, Biol Pharm Bull, 29, p306-314.
[https://doi.org/10.1248/bpb.29.306]

-
Cunningham, CC., Bailey, SM., (2001), Ethanol consumption and liver mitochondria function, Biol Signals Recept, 10, p271-282.
[https://doi.org/10.1159/000046892]

- Das, SK., Nayak, P., Vasudevan, DM., (2005), Consequences of ethanol consumption, J Indian Soc Toxicol, 1, p1-10.
-
Das, SK., Vasudevan, DM., (2007), Alcohol-induced oxidative stress, Life Sci, 81, p177-187.
[https://doi.org/10.1016/j.lfs.2007.05.005]

-
Demori, I., Voci, A., Fugassa, E., Burlando, B., (2006), Combined effects of high-fat diet and ethanol induce oxidative stress in rat liver, Alcohol, 40, p185-191.
[https://doi.org/10.1016/j.alcohol.2006.12.006]

- De Ritis, R., Giusti, G., Prccinino, F., Cacciatore, L., (1965), Biochemical laboratory tests in viral hepatitis and other hepatic diseases: Evaluation and follow-up, Bull World Health Organ, 32, p59-72.
-
Ellman, GL., (1959), Tissue sulfhydryl group, Arch Biochem Biophys, 82(1), p70-77.
[https://doi.org/10.1016/0003-9861(59)90090-6]

-
Fang, JL., Vaca, CE., (1997), Detection of DNA adducts of acetaldehyde in peripheral white blood cells of alcohol abusers, Carcinogenesis, 18, p627-632.
[https://doi.org/10.1093/carcin/18.4.627]

- Folch, J., Less, M., (1957), A simple method for the isolation and purification of total lipids from animal tissues, J Biolchem, 226(1), p497-509.
-
Forrnan, HJ., Fridovich, I., (1973), Superoxide dismutase: A comparison of rate constants, Arch Biochem Biophys, 158, p396-402.
[https://doi.org/10.1016/0003-9861(73)90636-X]

- Habig, WH., Pabist, M., Jakoby, WB., (1974), Glutathione-S-transferase: The frrst enzymatic steps in mercapturic acid forrnation, J Biol Chem, 249, p7130-7135.
- Ham, YK., Kim, SW., (2004), Protective effects of plant extract on the hepatocytes of rat treated with carbon tetrachloride, J Korean Soc Food Sci Nutr, 33(3), p1246-1251.
- Han, EK., Jin, YX., Yoo, YS., Jung, EJ., Lee, JY., Chung, CK., (2009), Effect of Artemisia capillaris and Paecilomyces japonica on the reduction of hepatotoxicity and lipid metabolism induced by ethanol, J Korean Sic Food Sci Nutr, 38(1), p1016-1023.
-
Hashim, MS., Lincy, S., Remya, V., Teena, M., Anila, L., (2005), Effect of polyphenolic compounds from Coriandrum sativum on H2O2-induced oxidative stree in human lympocytes, Food Chem, 92(4), p653-660.
[https://doi.org/10.1016/j.foodchem.2004.08.027]

- Hilton, JW., Hodson, PV., Slinger, SJ., (1980), The requirement and toxicity of selenium in rainbow trout (Salmo gairdneri), J Nutr, 110, p2527-2535.
-
Hong, KJ., Lee, CH., Kim, SW., (2004), Aspergillus oryzae CB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals, J Med Food, 7, p403-435.
[https://doi.org/10.1089/jmf.2004.7.430]

-
Jeon, HJ., Yu, S., Kim, SH., Park, SK., Choi, HD., Kim, KY., Lee, SY., Chun, SS., Ahn, SC., (2014), Antiobesty effect of Citrus peel extract fermented with Aspergillus oryzae, J Life Sci, 24, p827-836.
[https://doi.org/10.5352/JLS.2014.24.8.827]

- Jin, JI., (1985), Encyclopedia of Chinese Medical Science Ⅲ. Chinese Dictionary Association, Published by Song-Ak, p130.
-
Kang, YH., Kim, K., Kim, TW., Yang, CS., Choe, M., (2015), Evaluation of the anti-obesity activity of Platycodon grandiflorum root and Curcuma Ionga root fermented with Aspergillus oryzae, Korean J Food Sci Technol, 47(1), p111-118.
[https://doi.org/10.9721/KJFST.2015.47.1.111]

-
Khanal, T., Choi, JH., Hwang, YP., Chung, YC., Jeong, HG., (2009), Saponins isolated from the root of Platycodon grandiflorum protect against acute ethanol-induced hepatotoxicity in mice, Food Chem Toxicol, 47, p530-535.
[https://doi.org/10.1016/j.fct.2008.12.009]

- Kim, MJ., Lee, E., Cha, BC., Choi, MY., Rhim, TJ., Park, HJ., (1997), Serum cholesterol lowering effect of triterpene acetate obtained from Lactuca indica, Korean J Pharmacogn, 28, p21-25.
- Kim, JG., (1989), Illustrated Natural Drugs Encyclopedia, Published by Nam-San Dang, p58-60.
- Kim, JG., (1992), Illustrated Natural Drugs Encyclopedia(Color edition), Published by Nam-San Dang, Korea, 1, p42-47.
- Kim, SH., (1995), Inhibitory effects of Ixeris dentata on the mutagenicity of aflatoxin B1, N-methyl-N'-nitro-N-nitrosoguanidine and the growth of MG-63 human osteosarcoma cells, J Korean Soc of Food Sci Nutr, 24(2), p305-320.
- Kim, YH., (2004), Anti-HBV viral multiplication by the extracts of Lactuca indica, J Natual Sciences, Suwon University, 3(2), p237-244.
-
Kim, YJ., You, YH., Jun, WJ., (2012), Hepatoprotective activity of fermented Curcuma longa L. on galactosamine-intoxicated rats, J Korean Soc Food Sci Nutr, 41(6), p790-795.
[https://doi.org/10.3746/jkfn.2012.41.6.790]

- Korean National Statistical Office, (2016), Statistics Index of Alcohol Delivery Amount in 2014, http://www.index.go.kr/main/eachDtlpageDetail.do?idx-cd=2824 Accessed 2016.
-
Kundu, TK., Hille, F., Velayutham, M., Zweier, JL., (2007), Characterization of superoxide production from aldehyde oxidase: An important source of oxidants in biological tissues, Arch Biochem Biophys, 460, p113-121.
[https://doi.org/10.1016/j.abb.2006.12.032]

- Lands, WEM., Pawlosky, RJ., Salem, N., (1999), Alcoholism, antioxidant status and essential fatty acids, In Antioxidant Status, Diet, Nutrition and Health, Papas, AM. ed, CRC Press, Boca Raton, FL, USA, p299-344.
-
Lee, J., Jeong, JY., Cho, YS., Park, SK., Kim, K., Kim, MJ., Lee, MK., (2010), Effect of young Phragmites communis leaves powder on lipid metabolism and erythrocyte antioxidant enzyme activities in highfat diet fed mice, J Korean Soc Food Sci Nutr, 39(5), p677-683.
[https://doi.org/10.3746/jkfn.2010.39.5.677]

-
Lee, K., (1991), Developmental aspects of experimental pulmonary oxygen toxicity, Free Rad Biol, 11, p463-494.
[https://doi.org/10.1016/0891-5849(91)90062-8]

-
Lee, SI., Lee, YK., Kim, SD., Lee, IA., Choi, JK., Suh, JW., (2013), Effects of hot-water extract of mulberry leaf tea fermented by Monascus pilosus on body weight and hepatic antitoxidant enzyme activities in mouse fed a normal diet, J Korea Academia-Industrial Cooperation Society, 14(11), p5646-5657.
[https://doi.org/10.5762/KAIS.2013.14.11.5646]

- Lee, SI., Lee, YK., Kim, SD., Cheng, JH., Yang, SH., Suh, YJ., (2014), Xanthine and aldehyde oxidase inhibitory activities, and antihyperuricemic effects of fermented Smilax china L. leaf extracts and fractions, J Appl Biol Chem, 57(1), p53-59.
-
Lieber, CS., (2004), Alcoholic fatty liver: Its pathogenesis and mechanism of progression to inflammation and fibrosis, Alcohol, 34, p9-19.
[https://doi.org/10.1016/j.alcohol.2004.07.008]

-
Lieber, CS., (1997), Ethanol metabolism, cirrhosis and alcoholism, Clin Chim Acta, 257, p59-84.
[https://doi.org/10.1016/S0009-8981(96)06434-0]

-
Lieber, CS., (1992), Medical and Nutritional Complications of Alcoholism: Mechanisms and Management, Plenum Press, New York, NY, USA, p515-530.
[https://doi.org/10.1007/978-1-4615-3320-7]

-
Lieber, CS., (1985), Alcohol and the liver: Metabolism of ethanol, metabolism effects and pathogenesis of injury, Acta Med Scand Suppl, 703, p11-55.
[https://doi.org/10.1111/j.0954-6820.1985.tb08903.x]

-
Lin, RC., Smith, RS., Lumeng, L., (1988), Detection of a proteinacetaldehyde adduct in the liverof rats fed alcohol chronically, J Clin Invest, 81, p615-619.
[https://doi.org/10.1172/JCI113362]

-
Machida, M., Tamada, O., Gomi, K., (2008), Genomics of Aspergillus oryzae: learning from the history if koji mold and exploration of its future, DNA Res, 15, p173-183.
[https://doi.org/10.1093/dnares/dsn020]

- Mantle, D., Preedy, VR., (1999), Free radicals as mediators of alcohol toxicity, Adverse Drug React Toxicol Rev, 18, p235-252.
-
Marui, J., Tada, S., Fukuoka, M., Wagu, T., Shiraishi, Y., Kitamoto, N., Sugomoto, T., Hattori, R., Suzuki, S., Kusumoto, K., (2013), Reduction of the degradation activity of umami-enhancing purinic ribonucleotide supplement in miso by the targeted suppression of acid phosphatases in the Aspergillus oryzae starter culture, Int J Food Microbiol, 166, p238-243.
[https://doi.org/10.1016/j.ijfoodmicro.2013.07.006]

-
Martin, JP., Dailey, JM., Sugarmanand, E., (1987), Negative and positive assays of superoxide dismutase based on hematoxylin autoxidant, Arch Biochem Biophys, 255, p329-336.
[https://doi.org/10.1016/0003-9861(87)90400-0]

-
Mello, T., Ceni, E., Surrenti, C., Galli, A., (2008), Alcohol induced hepatic fibrosis: Role of acetaldehyde, Mol Aspects Med, 29, p17-21.
[https://doi.org/10.1016/j.mam.2007.10.001]

-
Niemala, O., Klajner, F., Orrego, H., Vidins, E., Blendis, L., Israel, Y., (1987), Antibodies against acetaldehyde-modified protein epitopes in human alcoholics, Hepatology, 7, p1210-1214.
[https://doi.org/10.1002/hep.1840070607]

-
Ohkawa, H., Ohishi, N., Yagi, K., (1979), Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction, Anal Biochem, 95(2), p351-358.
[https://doi.org/10.1016/0003-2697(79)90738-3]

-
Park, JK., Park, CM., Kim, JJ., Song, YS., (2008), Hepatoprotective activity of dandelion (Taraxacum officinale) water extract against D-galactosamine-induced hepatitis in rats, J Korean Soc Nutr, 37, p177-183.
[https://doi.org/10.3746/jkfn.2008.37.2.177]

-
Piras, G., Makino, M., Baba, M., (1997), Sho-saiko-to, a traditional kampo medicine, enhances the anti-HIV-1 activity of lamivudine (3TC) in vitro, Micorbio Immunol, 41(10), p835-839.
[https://doi.org/10.1111/j.1348-0421.1997.tb01937.x]

-
Reitman, S., Frankel, S., (1957), A colorimetric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminase, Am J Clin Pathol, 28, p56-63.
[https://doi.org/10.1093/ajcp/28.1.56]

-
Ryle, PR., Chakraborty, J., Thomson, AD., (1986), The role of the hepatocellular redox state in the hepatic triglyceride accumulation following acute ethanol administration, Biochem Phamacol, 35, p3159-3164.
[https://doi.org/10.1016/0006-2952(86)90402-8]

-
Satoh, K., (1978), Serum lipid peroxide in cerebrovascular disorders determined by a new colorimetric method, Czlinica Chimica Acta, 90(1), p37-43.
[https://doi.org/10.1016/0009-8981(78)90081-5]

- Son, JC., Kim, SH., Lee, SI., Lee, YK., Kim, SD., (2012), Effect of ethanol extracts of Youngia denticulata and Youngia sonchifolia on the serum and hepatic lipids and activities of ethanol metabolizing enzymes in acute ethanol-treated rats, J Korean Soc Food Sci Nutr, 41(2), p187-204.
- Song, JT., Jeong, HB., Kim, BW., So, HS., (1989), Plant Large Handbook (resources side), Il-Dong Publishing Co, Incheon, Korea, p334-336.
- Stirpe, F., Della Corte, E., (1969), The regulation of rat liver xanthine oxidase. Conversion in vitro of the enzyme activity from dehydrogenase(type D) to oxidase (type O), J Biol Chem, 244(14), p3855-3863.
- Wang, RS., Nakajima, T., Honma, T., (1999), Different change patterns of the isozymes of cytochrome P450 and glutathione S-transferase in chemically induced liver damage in rat, Ind Health, 37(4), p440-448.
-
Williams, R., (2006), Global challenges in liver disease, Hepatology, 44, p521-526.
[https://doi.org/10.1002/hep.21347]

- Yamamoto, Y., Yasuoka, A., Tachikawa, N., Reruya, K., , Genka., Yamaguchi, M., Yasuoka, C., Kikuchi, Y., Aoki, M., Okas, S., (1999), Mitigation of hepatocellular injury caused by HAART with glycyrrhizin compound in patients co-infected wth HIV and HCV, Jpn J Infect Dis, 52, p248-249.
-
Zeng, T., Guo, FF., Zhang, CL., Zhao, S., Dou, DD., Gao, XC., Xie, KG., (2008), The anti-fatty liver dffects of garlic oil on acute ethanol-exposed mice, Chem Biol Interact, 176, p234-242.
[https://doi.org/10.1016/j.cbi.2008.07.004]

