
새싹보리 클로로필의 색 안정화
Abstract
To improve the color stability of chlorophyll in young barley leaf used as functional green biomaterial, the absorption spectrum, color values, and antioxidative activities of young barley leaf (YBL) treated with zinc ion solutions were investigated. The small pieces of fresh YBL in aqueous solution mixtures were autoclaved twice at 110℃ for 30 min (pH 5). Distilled water (BLA), 0.01% zinc chloride (BLAZ), 0.01% zinc citrate (BLAC), and 0.01% zinc lactate (BLAL) solutions were used. Treated YBL powders were extracted with 80% EtOH for 4 h. Chlorophyll a and b contents differed with different treatments. BLA decreased chlorophyll a and b contents, whereas others were maintained. Absorbance spectrums of chlorophyll at 400∼700 nm showed different maximum peak wavelengths. After heating in acidic and neutral solutions (pH 3, 5, and 7), the colors of YBL and BLA changed from green to olive green, whereas BLAZ, BLAC, and BLAL remained green color. The antioxidative activities showed higher values in YBL extract than in treated extracts. From the above results, autoclaved YBL in zinc solution would increase the color stability and maintain green color regardless of acid and heat treatments.
Keywords:
Young barely leaf, color stability, chlorophyll, zinc citrate서 론
최근에는 소비자들이 안전하고 건강기능성 물질을 함유한 식품에 많은 관심을 가지고 있어, 자연에서 얻을 수 있는 식품 소재 중에 식물성 식품에서 유래된 파이토케미칼인 색소물질이 많은 관심을 받고 있다(Lee IS 등 2008; Senklang P & Anprung P 2010b; Ozkan G & Bilek SE 2015). 색의 종류가 다양하나, 인체에 대한 독성이나 발암성을 가지고 있는 합성색소와 달리 식물성 식품에서 유래된 천연 색소물질은 비타민, 미네랄, 폴리페놀 화합물을 비롯한 여러 가지 생리활성을 나타낼 수 있는 성분을 가진 장점을 가지고 있으며, 안전하기 때문에, 천연색소에 대한 선호도와 수요가 날로 증가하고 있다(Lee NY 등 2010). 하지만 천연 색소는 가공 시에 열을 가하거나 특정 첨가물, pH의 변화, 산소 접촉 등에 의해 색의 변화가 일어날 수 있어 사용이 어려운 단점이 있기 때문에, 이를 보완하는 연구가 계속해서 이루어지고 있다.
특히, 클로로필은 채소나 과일 등에서 유래된 천연색소로 식품산업에서 많이 이용되고 있지만, 열이나 빛, 산소, 산, 효소 등에 의해서 색이 변하기 때문에, 품질이나 소비자기호도에 안 좋은 영향을 미칠 수 있다(Laborde LF & Elbe JH 1990; Senklang P & Anprung P 2010a; Senklang P & Anprung P 2010b; Ozkan G & Bilek SE 2015). 클로로필은 포피린 링 중앙에 마그네슘(Mg) 이온이 결합된 형태의 구조를 가지고 있으며, 클로로필 a, b, c, d 등의 타입으로 구성되어 있다. 육지식물에 존재하는 포피린 계열 클로로필에는 C-3 탄소에 메틸 그룹을 가지고 있는 클로로필 a와 포르밀기가 결합되어 있는 클로로필 b가 있다(Ferruzzi MG 등 2002; Koca NK 등 2006; Nurha- yati N & Suendo V 2011). 클로로필 a는 광합성 작용에 의해 에너지를 생산하며, 잎에서부터 추출되었을 때 불안정한 특성을 가지고 있는 것으로 알려져 있다(Nurhayati N & Suendo V 2011). 클로로필 색소는 60℃ 이상의 열을 가하거나 약산으로 처리하면 올리브그린색인 pheophytin을 형성하게 되고, 계속해서 산으로 처리하면 갈색물질인 pheophorbide를 형성한다(Ngo T & Zhao Y 2007; Oh HI 등 2008; Senklang P & Anprung P 2010a). 또한 클로로필에 효소인 chlorophyllase나 알칼리 처리 시 청록색의 methyl chlorophyllide를 형성하는데, 이것에 다시 산이 작용하면 pheophorbide를 형성할 수 있다. 이처럼 클로로필 색소는 pH, 열 등의 가공 처리에 따라서 색 변화 양상이 있기 때문에 식품 가공에 있어서 소재로 사용하기 위해서는 가공 과정에서 색 변화를 최소화하고, 저장 중에도 변화하지 않도록 이를 안정화시키는 연구가 필요하다.
클로로필 색소를 안정화시키기 위한 연구는 다양하게 이루어져 왔는데, 특히 클로로필 색소의 포피린 링 구조 안에 있는 Mg 이온을 아연(Zn)이나 구리(Cu) 이온으로 대체시켜 Zn- 혹은 Cu-pheophytin 복합체를 만들어 색소를 안정화 시키는 연구가 지속적으로 이루어져 왔다. Zn-pheophytin 복합체는 클로로필 색소와 유사한 색 특성을 나타내며, 주로 가열 가공하는 녹색 채소인 녹색콩, 완두콩, 시금치 등의 제조에 많이 이용해왔다(Tonucci LH & Elbe JH 1992; Ngo T & Zhao Y 2005). Zn 이온이 pheophytin a 또는 pheophytin b와 Zn-pheophytin 복합체를 형성하여 색소를 안정화시킨다는 연구 결과와 Zn-pheophytin 복합체는 본래의 클로로필 구조보다 산과 열에 더 안정하다는 연구 결과가 보고되었다(Jones ID 등 1977; Takeuchi Y & Amao Y 2005; Lee IS 등 2008; Senklang P & Anprung P 2010a; Nurhayati N & Suendo V 2011). 완두콩에 Cu와 Zn 이온을 처리하여 pheophytin a, b와 복합체를 형성하여 완두콩 퓨레를 저장하는 동안 재녹색화되었다는 연구 결과가 보고되었고(Laborde LF & Elbe JH 1990; Laborde LF & Elbe JH 1994), 생 것과 냉동 녹색콩을 이용하여 Zn-pheophytin과 Zn-pyropheophytin 구조를 형성시킨 연구에서도 일반 가공 녹색콩에 비하여 녹색이 향상되었다는 보고가 있었다(Canjura FL 등 1999). 또한 시금치를 이용한 Zn-, Cu-pheophytin 복합체 형성 연구(Jones ID 등 1977; Laborde LF & Elbe JH 1990; Ozkan G & Bilek SF 2015), 판단(pandan) 잎을 이용한 Zn-chlorophyll 유도체 복합체 형성 연구(Senklang P & Anprung P 2010b), 녹색 배를 이용한 복합체 형성 연구(Ngo T & Zhao Y 2005; Ngo T & Zhao Y 2007) 등에서 Zn-클로로필 유도체 복합체 형성이 가공 제품의 녹색을 유지하고, 저장 중에 녹색을 유지하는데 긍정적인 효과를 나타냈다고 보고하였다. 하지만 이들 Zn-pheophytin 복합체 형성에서 무기산염인 zinc chloride를 사용하여 색소 안정성을 확인한 논문이 대부분이고, zinc citrate나 zinc lactate와 같은 유기산염을 이용한 클로로필 복합체 형성에 따른 색소 안정성 연구는 상대적으로 미미한 실정이다.
녹색 클로로필을 함유하며, 기능성을 가지고 있는 것으로 알려진 새싹보리는 품종이나 토양 등에 따라 다르나, 비타민 C, 비타민 E 및 β-carotene 등의 각종 비타민을 다량 함유하고 있고, 미네랄의 좋은 공급원으로, 특히 천연항산화제인 2-C-glycosylisovitexin과 saponarin, 폴리페놀 화합물 등을 함유하고 있어서 항산화능을 가진 좋은 소재로 알려져 있다(Yu YM 등 2002a; Yu YM 등 2002b; Jang JH 등 2007). 따라서 새싹보리의 클로로필에 Zn 이온을 첨가하여 Zn-pheophytin 복합체를 형성해 색소를 안정화시켜 색소 소재로 활용한다면 열과 산 처리에 강한 다양한 제품 가공에 응용할 수 있을 것으로 기대된다. 특히 Zn-pheophytin 복합체를 형성할 때 유기태의 형태로 Zn 이온을 첨가하면 인체 내에서 Zn을 흡수 이용률도 향상시킬 수 있을 것으로 기대된다.
따라서 본 연구에서는 새싹보리에 무기산염인 zinc chloride과 유기산염인 zinc citrate, zinc lactate를 가압멸균기로 열처리를 하여 새싹보리의 클로로필 zinc 복합체 형성 정도를 확인하고, 처리 조건에 따라 분말의 산화안정성과 pH 안정성, 열 안정성을 비교 평가하였으며, 80% ethanol로 추출한 새싹보리 분말의 클로로필 함량과 항산화능력을 확인하였다.
재료 및 방법
1. 재료
실험에 사용한 새싹보리는 2016년 4월 수확된 것을 ㈜새뜸원(Jeollanam-do, Korea)에서 구입하여 시료로 사용하였다. Ethanol(99.9%), Ferric chloride, Na2CO3, N,N-dimethylformamide은 Daejung Chemicals & Metals Co. Ltd.(Gyeounggi-do, Korea)에서, Folin-Ciocalteu reagent, 2,2’-azino-bis(3-etylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTs), potassium persulfate, trichloroacetic acid(TCA), quercetin, butylated hydroxytolune(Kocher, BHT)은 Sigma-Aldrich Chemical Co. (St. Louis, MO, USA)에서 구입하여 사용하였다. Gallic acid, sodium phosphate buffer는 Yakuri Pure Chemicals Co. Ltd. (Kyoto, Japan), L(+)-ascorbic acid, AlCl3는 Junsei Chemical Co. Ltd.(Tokyo, Japan)에서 구입하여 사용하였다. NaNO2는 Kanto Chemical Co, Inc.(Tokyo, Japan), potassium ferricyanide는 Duksan Pure Chemical Co. Ltd.(Gyeonggi-do, Korea), PBS(phosphate buffered saline)는 Life Technologies(California, USA)에서 구입하여 사용하였다. 2배 사과식초는 청정원(Gyeonggi-do, Korea), 식소다는 ㈜신광식품(Gyeongsangnamdo, Korea)에서 구입하여 실험에 사용하였다.
2. 새싹보리 처리
수확한 새싹보리는 수세 후 250 g 씩 분할하여 가위로 1 cm 크기 이내로 잘게 자른 후, 5,000 mL 비커에 넣었다. 시료에 첨가할 수용액을 제조하기 위하여 증류수에 citric acid로 적정하여 pH 5로 맞추었다. 시료는 각 군마다 250 g의 새싹보리를 사용하여 pH 5로 보정된 수용액을 첨가하여 가압멸균기로 처리하여 제조되었다. 열처리한 군과 비교를 위해 새싹보리 생 상태 그대로 건조기에 건조시킨 생잎(BL)을 제조하였다. 열처리 대조군(BLA)는 1 L의 pH 5로 보정된 증류수 용액만을 첨가하였다. 아연처리군은 1 L의 pH 5로 보정된 수용액에 0.01% ZnCl2(BLAZ), 0.01% zinc citrate(BLAC), 0.01 % zinc lactate(BLAL)를 각각 첨가하여 용액 전량을 새싹보리와 혼합하여 열처리하였다. 각각의 수용액을 첨가한 시료는 가압 열처리를 위하여 autoclave(HB-506-8, Hanbaek Scientific Co., Gyeonggi-do, Korea)에서 110℃로 30분 1회 처리 후에, 1시간 동안 4℃에서 냉각하고, 다시 같은 조건으로 autoclaving한 후 1시간 냉각과정을 반복하여 수행하였다. 처리된 시료는 흐르는 물에 씻어 식품건조기(SW-300, Sehwa Products INC, Gyeonggi-do, Korea)에 넣고, 온도 37±1℃의 조건으로 24시간 건조하였으며, 건조된 시료는 100 mesh 체에 내려 분말로 실험에 사용하였다.
3. 새싹보리 분말의 아연 함량 분석 및 색소 안정성 분석
새싹보리 분말의 처리 방법에 따른 Zn 함량을 분석하기 위해 0.5 g의 새싹보리 분말을 마이크로가수분해장치 테프론 용기에 넣고, 65% 질산 7 mL와 30% 과산화수소수 각 1 mL를 넣었다. 테프론 용기를 밀봉한 후에 마이크로가수분해장치(ETHOS TC, Milestone, 24010 Sorisole Bergamo, Italy)로 산 분해를 실시하여 산 분해된 시료를 냉각시킨 후 풀어, 0.1 % 질산용액을 이용하여 50 mL로 정용한 후 시료로 사용하였다. 처리된 시료는 미량중금속 아연의 분석을 위하여 ICP/MS(NEXION 300X, PerkinElmer, MA, USA)를 사용하였다. ICP/MS의 기기의 조건은 RF power 1,600 watts, Lense voltage 6.75 V, nebulizer gas flow는 0.96 L/min, auxillary gas flow는 1.4 L/min, sampling interfaces는 Ni로 새싹보리의 Zn 함량을 분석하였다. 아연 표준물질은 10 mg/L의 표준용액을 0.1% 질산은으로 5, 10, 50, 100 μg/L로 희석하여 사용하였고, 아연의 질량 값은 원소의 질량별 분포비율에 따라 분포도가 가장 높은 질량 값을 설정하여 분석하였다.
새싹보리 분말 색소의 산화안정성을 확인하기 위하여 0.5 g의 새싹보리 분말을 petri dish(35×10 mm)에 담아 햇빛이 잘 드는 곳에 배치하여 저장 7일 후와 14일 후 색의 변화를 확인하였다.
pH에 의한 안정성을 확인하기 위해 새싹보리 분말 0.5 g에 증류수 20 mL을 첨가한 후, 식초와 1% 식소다를 이용하여 수용액상의 pH를 pH 3, 5, 7로 조정한 후, 1시간 동안 끓는 물에서 가열하였다. 이를 Whatman No.2 여과지를 이용하여 감압여과기(DOA-P704-AC, GAST Manufacturing, INC., MI, USA)를 통해 여과시켜 여과지에 남은 잔사를 식품건조기(SW-300, Sehwa Products INC, Gyeonggi-do, Korea)에 넣어 3시간 동안 건조한 다음 잔사를 이용하여 색의 변화를 확인하였다.
새싹보리 분말의 열 안정성을 확인하기 위해서 0.5 g의 새싹보리를 도가니에 담아 데크오븐(FDO-7104(B), Daeyung Bakery Machinery Co., Ltd, Seoul, Korea)에 100℃/100℃로 1시간 동안 가열한 후, 실온에서 식힌 후 색의 변화를 확인하였다.
새싹보리 분말의 색의 변화는 디지털 카메라(Kento, Canon, Tokyo, Japan)로 촬영하여 관찰하였으며, 색도계(Spectra magicTM NX, Konica Minolta, Tokyo, Japan)를 이용하여 Hunter의 L(lightness)값, ±a(redness/greenness)값 및 ±b(yellowness/ blueness)값을 3회 반복 측정해서 그 평균값으로 나타내었다. 기기는 L=96.83, a=-0.06, b=-0.15인 표준 백색판(standard white plate)으로 보정하여 사용하였고, 색차(△E)는 백색판을 기준으로 식에 의하여 계산하였다.
4. 색소 추출물의 제조 및 분석
새싹보리 분말의 색소 추출물은 새싹보리 분말 2 g(건량 기준)에 50 mL의 80% ethanol을 첨가한 후, 암소에서 마그네틱바를 이용하여 4시간 동안 stirring하여 제조하였다. 추출물은 Whatman No.2 여과지를 이용하여 감압여과기(DOA-P704-AC, GAST Manufacturing, INC., MI., USA)를 통해 여과시킨 후 50 mL로 정용하였다.
클로로필 함량은 Zarco-Tejada PJ 등(2004)의 방법을 수정하여 분석하였다. 새싹보리 분말 추출물 2 mL를 3 mL의 N, N-dimethylformamide와 혼합한 후, UV-Vis spectrophotometer(Optizen pop, Mecasys Co., Ltd, Deajeon, Korea)를 이용하여 400∼700 nm 범위의 흡광도를 0.5 nm 단위로 측정하여 확인하였다. 새싹보리 분말 추출물의 클로로필 a와 b, a/b 비율은 663.8 nm와 646.8 nm에서 흡광도를 측정한 후, 다음 계산식을 이용하여 클로로필 a와 b 함량을 계산하여 나타내었다.
Chlorophylls a = 12×A663.8-3.11×A646.8
Chlorophylls b = 20.78×A646.8-4.88×A663.8
총 플라보노이드 함량(total flavonoid contents)은 No JH 등(2012)의 방법으로 측정하였다. 새싹보리 분말 추출물 1 mL와 증류수 4 mL를 혼합한 후, 5% NaNO2 0.3 mL를 섞어 5분간 반응시킨 다음, 10% AlCl3 0.3 mL와 1 M NaOH 2 mL, 증류수 2.4 mL를 넣고 잘 섞어준 후 UV-Vis spectrophotometer를 이용하여 510 nm에서 흡광도를 측정하였다. 시료는 quercetin과 비교하여 시료의 총 플라보노이드 함량을 g 당 quercetin 함량으로 환산하여 표시하였다.
총 페놀성 화합물 함량(total phenolic compounds)은 Folin-Ciocalteu's reagent 시약을 이용하여 No JH 등(2012)의 방법으로 분석하였다. 새싹보리 분말 추출물 0.1 mL에 0.9 mL의 증류수와 0.1 mL의 Folin-Ciocalteau reagent를 혼합하여 실온에서 5분간 방치한 후, 1 mL의 7% Na2CO3를 혼합하였다. 1시간 동안 실온에서 방치한 후 UV-Vis spectrophotometer를 이용하여 716 nm에서 흡광도를 측정하여, gallic acid를 이용하여 작성한 표준곡선식(Y=52.063x-0.0033(R2=0.9998))을 이용하여 페놀성 화합물 함량을 계산하였다.
ABTs(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt) 라디칼 소거능은 Re R 등(1999)의 방법에 준하여 실시하였다. 7 mM ABTs radical과 2.45 mM potassium persulfate를 혼합하여 실온 암소에서 24시간 동안 방치하여 라디칼을 형성시켰다. 만들어진 ABTs 라디칼을 PBS(Phosphate buffered saline)에 희석하여 ABTs 용액(v:v=48.5:1.5)을 제조하였다. 제조한 ABTs 용액 1,980 μL에 새싹보리 추출물 20 μL를 첨가하여 실온에서 10분간 방치한 후, UV-Vis spectrophotometer를 이용하여 734 nm에서 흡광도를 측정하여, BHT(butylated hydroxytoluene, Kocher)와 비교하여 ABTs 라디칼 소거능을 확인하였다.
새싹보리 추출물의 환원력(reducing power)은 No JH 등(2012)의 방법으로 분석하였다. 시료 1 mL에 200 mM의 sodium phosphate buffer(pH 6.6) 1.25 mL와 1% potassium ferricyanide 1.25 mL를 혼합한 후, 50℃의 water bath에서 20분간 반응시켰다. 10% trichloroacetic acid 1.25 mL를 첨가한 후에 4℃에서 10분간 반응시킨 후, 반응시킨 용액 중 2.5 mL를 증류수 5 mL와 0.1% ferric chloride 1.25 mL를 섞어서 반응시켰다. UV-Vis spectrophotometer를 이용하여 700 nm에서 흡광도를 측정하여 BHT와 비교하여 환원력을 확인하였다.
5. 통계처리
모든 실험은 3회 반복하여 측정해서 실험하였으며, 평균과 표준편차로 표기하였다. 모든 실험의 결과는 SPSS 12.0K(SPSS INC., Chicago IL, USA)를 이용하여 ANOVA test를 통하여 통계 처리하였고, Duncan’s multiple-range test로 검증하였다.
결과 및 고찰
1. 클로로필 및 아연 함량
일반적으로 클로로필 분자는 포피린 구조 내부의 Mg 이온이 Zn이나 Cu와 같은 2가 양이온과 치환되면서 더 안정한 분자 구조를 가지며, Zn이나 Cu로 치환된 구조는 산과 열에 훨씬 안정하다고 알려져 있다(Canjura FL 등 1999; Senklang P & Anprung P 2010a). Zn과 클로로필 복합체 형성 시에 pH 4∼6에서 복합체 형성이 가장 증가하고, 그 이상에서는 복합체 형성이 감소하였으며, 110℃에서 15분간 가열하였을 때 가장 적절한 Zn-클로로필 유도체 결합을 형성하였다고 보고된 바 있다(Ngo T & Zhao Y 2005; Senklang P & Anprung P 2010b). 따라서 본 연구에서는 새싹보리의 클로로필 색소와 Zn의 복합체 형성을 위하여 110℃, pH 5에서 반응시켜 새싹보리 분말을 제조하였다.
새싹보리 분말의 Zn 함량과 클로로필 함량을 측정한 결과는 Table 1과 Fig. 1에 나타내었다. 클로로필 색소를 가열하면 isocyclic 링의 C10 탄소의 carbomethoxyl이 제거되어 양이온인 Zn 이온이 클로로필과 반응할 수 있게 된다(Laborde LF & Elbe JH 1994; Seklang P & Anprung P 2009). 110℃에서 반응시켜 Zn을 결합시킨 BLAZ, BLAC, BLAL의 Zn 함량은 각각 1,244.47 ppm, 911.34 ppm, 634.12 ppm으로 Zn 처리하지 않은 BL 86.08 ppm에 비해 현저히 높게 나타났고, BLAZ에서 Zn 함량이 가장 높은 경향을 보였다(p<0.05). 이를 통해 zinc chloride나 zinc citrate, zinc lactate가 각각 클로로필 색소의 포피린 링 구조에 Zn을 치환하는 정도가 다르며, 무기태인 zinc chloride의 치환도가 가장 좋음을 알 수 있었다.
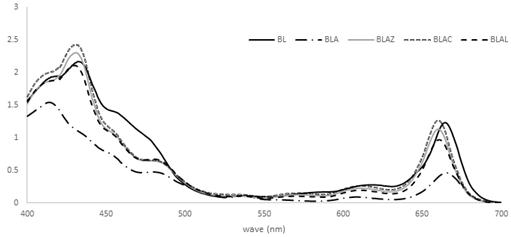
Absorbance spectrums of chlorophyll in 80% EtOH extracts form different treating young barley leaves.YBL samples are BL (fresh barley leaf), BLA, BLAZ, BLAC and BLAL were treated by autoclaving at 110℃ in pH 5 distilled water, 0.01% zinc chloride solution, 0.01% zinc citrate solution, and 0.01% zinc lactate solution, respectively.
클로로필 a와 b의 함량은 BL에서 13.22 μg/mL, 4.06 μg/mL으로 나타났고, BLA에서 5.10 μg/mL, 0.73 μg/mL로 열처리에 의해 클로로필 a, b가 감소하는 경향을 보였다(p<0.05). 반면에 BLAZ와 BLAC, BLAL에서는 클로로필 a 함량이 각각 10.59 μg/mL, 11.78 μg/mL, 9.52 μg/mL로 나타났다. 이는 흡광도를 이용하여 함량을 계산하였기 때문에 Zn 처리 시 생성되는 Zn-pehophytin a과 클로로필 a의 흡광도 값이 유사한 경향을 보이기 때문에 값이 유사하게 나온 것으로 생각된다.
Zn로 처리한 새싹보리의 클로로필 색소의 특성을 알아보기 위하여 400∼700 nm로 흡광도를 0.5 nm 단위로 스캔한 결과, BL은 432 nm와 664.5 nm, BLA는 414 nm와 665 nm, BLAZ는 431 nm와 660 nm, BLAC는 430 nm와 660 nm, BLAL은 429.5 nm와 660.5 nm에서 피크를 나타냈다. Takeychi Y & Amao Y(2005)의 스피룰리나 클로로필 색소 연구에서 Zn-클로로필은 421 nm과 662 nm에서, Mg-클로로필은 433 nm와 668 nm에서 특정 흡수 밴드를 보인다고 보고하였고, Ngo T & Zhao Y(2007)의 녹색 배를 이용한 Zn-클로로필 유도체 형성 연구에 따르면 Zn 처리를 하지 않은 배는 409 nm, 666 nm에서 피크를 나타내었고, Zn 처리를 하였을 때는 428.5 nm와 660.5 nm에서 피크를 나타내었다고 하였다. Nurhayati N & Suendo V(2011) 및 Takeuchi Y & Amao Y(2005)의 연구에서 클로로필 색소 추출물의 흡광도를 측정하였을 때, Zn-pheophytin a의 소레대(soret band)는 클로로필 a 색소에 비해 433 nm에서 424 nm로, Q대(Q band)는 667 nm에서 658 nm로 피크 밴드가 이동한다고 하였는데, 본 연구에서도 이와 유사한 결과를 얻을 수 있었다. Zn 처리한 추출물에서 나타내는 주된 녹색은 Zn-pheophytin으로 생각된다(Ngo T & Zhao Y 2007). 이는 Zn-pheophytin a의 소레대의 최고준위 점유 분자궤도가 클로로필 a에 비해 작기 때문이며, Q band에서는 최고준위 점유 분자궤도가 클로로필 a에 비해 크기 때문에 파장의 피크가 바뀌는 것으로 생각된다(Nurhayati N & Suendo V 2011). 이를 통해서 BLAZ와 BLAC, BLAL은 클로로필 구조 내의 Mg이 Zn으로 치환되어 유도체 형성이 잘 이루어졌을 것으로 생각되며, 이들 새싹보리는 열이나 pH 등에 색의 안정성을 유지할 수 있을 것으로 기대된다.
새싹보리 분말의 산화 안정성을 확인하기 위하여 Zn 처리한 새싹보리와 처리하지 않은 새싹보리 분말을 각각 실온에서 7일, 14일 동안 공기와 햇빛이 통하는 곳에 보관하여 새싹보리 분말의 색의 변화를 확인하여 Fig. 2와 Table 2에 제시하였다. 처리하지 않은 상태인 BL이 가장 선명한 녹색을 나타내며, BLA는 열처리로 인하여 녹색이 소실됨을 확인할 수 있었다. Zn 처리한 BLAZ, BLAC, BLAL은 BL에 비해 다소 진한 녹색을 나타냄을 알 수 있었다(Fig. 2). 실온에서 7일간 저장하였을 때, BL에서 녹색이 탈색되는 현상이 급격하게 나타났고, BLA는 전체가 갈색화 됨을 확인할 수 있었으나, Zn 처리한 BLAZ, BLAC, BLAL은 녹색이 유지되는 것을 확인할 수 있었다. 14일간 저장하였을 때, BL은 대부분이 갈색화 되었으며, BLA는 색이 빠져 하얗게 변하는 현상을 확인할 수 있었다. 저장 기간 동안의 색도 값을 측정한 결과, 명도 L 값은 모든 샘플에서 증가하는 경향을 보였다(p<0.05). Ngo T & Zhao Y(2005)의 연구에 따르면 10℃와 21℃에서 Zn와 함께 열 가공 처리한 녹색 배를 저장하였을 때, 명도 L 값이 저장 시간이 증가할수록 증가하는 경향을 보였고, 녹색의 강도가 감소하는 경향을 보였다고 했다. 이는 금속-클로로로필 유도체가 빛에서 복사 에너지를 흡수하여 흥분상태인 삼중분자로 변화시켜 퀴논이나 페놀 화합물 등과 직접적으로 반응하는 자유라디칼 이온으로 변화될 수 있어 이러한 변화를 통해 포피린의 구조가 붕괴되어 색을 잃을 수 있기 때문으로 생각되었다(Min DB & Boff JM 2002). 따라서 저장 중에 Zn 처리한 BLAZ, BLAC, BLAL도 일부 녹색이 갈색으로 변하지만, 처리하지 않은 생 분말에 비해 녹색의 유지력이 뛰어남으로, Zn 처리한 새싹보리가 산소와 햇빛에 대해서 클로로필 색소를 보다 안정하게 유지함을 알 수 있었다. Zn은 인체에서 필수적인 영양성분으로 zinc lactate 등은 스포츠 음료, 주스, 시리얼, 아기 음식 등에 첨가되어 강화 제품으로 생산되고 있기 때문에(Ngo T & Zhao Y 2005), Zn 처리는 새싹보리의 색에 대한 안정성을 높일 뿐 아니라, 건강 기능성에도 기여할 것으로 생각된다.

The colour of young barley leaves treated with various zinc ion solutions at various storage periods, pHs, and heating at 100℃.YBL samples are BL (fresh barley leaf), BLA, BLAZ, BLAC and BLAL were treated by autoclaving at 110℃ in pH 5 distilled water, 0.01% zinc chloride solution, 0.01% zinc citrate solution, and 0.01% zinc lactate solution, respectively.
녹색 채소는 가공 중에 산에 의해서 클로로필 구조 내에 있는 마그네슘이 수소로 치환되면서 pheophytin이나 pheophobide로 전환되기 때문에, 가열이나 산 조건에서 밝지 않은 올리브 녹색으로 변화되는 특성을 보인다(Kim JM 등 2015). 특히 클로로필 색소와 Zn 이온과의 복합체 형성에는 Zn 이온 농도와 pH 값 등이 크게 영향을 준다고 보고하였다(Laborde LF & Elbe JH 1990; Ozkan G & Bilek SE 2015). 따라서 본 실험에서는 처리된 새싹보리 분말을 pH 3, 5, 7로 조정하여 1시간 동안 가열 처리하여 조리 중의 새싹보리의 pH 변화에 따른 안정성을 확인하여 Fig. 2와 Table 3에 나타내었다.
pH 3과 5로 처리하여 1시간 동안 가열하여 분말을 관찰하였을 때, BL은 다소 누렇게 변화하는 경향을 보였고, BLA 역시 색이 갈색으로 변화하는 경향을 확인할 수 있었다. 반면, Zn 처리한 BLAZ, BLAC, BLAL은 초기 녹색과 유사한 색으로 색이 유지됨을 확인할 수 있었다(Fig. 2). pH 7에서는 BL에서도 녹색이 일부 유지되는 경향은 보였으나, 가열 과정에서의 색 변화로 인해 녹색이 일부 감소함을 확인할 수 있었다(Fig. 2). 색차계를 이용하여 새싹보리의 L, a, b 값을 확인한 결과, 적색도/녹색도 값인 a 값에서 BL과 BLA가 -0.24∼1.38로 Zn 처리한 BLAZ, BLAC, BLAL -5.52∼-3.35에 비하여 녹색도 값이 감소하는 경향을 보임을 확인할 수 있었다(p<0.05). 또한 황색도/청색도를 나타내는 b 값도 BLAZ, BLAC, BLAL에서는 거의 유사한 값을 보인 반면, BL에서는 pH 범위에 따라 값이 변화하여 색에 변화가 있음을 알 수 있었다. 이는 pH 7∼8 사이에서는 조리 시 녹색의 변화가 뚜렷하지 않지만, 그 이하나 이상에서는 a 값의 변화가 크게 나타난다고 보고된 것과 유사한 결과였다(Koca N 등 2006). 일반적으로 채소와 과일을 가열하는 과정에서 채소가 가지고 있는 유기산이 채소와 과일의 세포에서 빠져나오게 되면서 조리 중에 pH의 변화가 일어나게 되고, 색의 변화가 나타날 수 있다고 한다(Ngo T & Zhao Y 2005). 따라서 Zn 처리는 조리 가공 시의 pH 변화와 관계없이 새싹보리의 클로로필 색의 변화를 최소화하여 안정성 개선시킴을 알 수 있었다.
새싹보리 분말의 열 안정성을 측정하기 위하여 100/100℃로 1시간 동안 가열한 후 색의 변화를 관찰한 결과는 Fig. 2와 Table 3에 나타내었다. BL은 100/100℃에서 1시간 가열 시 색의 대부분이 갈색으로 변화하였고, BLA에서도 마찬가지의 형태를 나타냄을 확인할 수 있었다(Fig. 2). 반면, Zn 처리한 BLAZ, BLAC, BLAL에서는 기존의 녹색과 유사한 색을 나타냄을 확인할 수 있었으나, BLAL은 상대적으로 일부 녹색이 갈색화되는 현상을 보임을 확인할 수 있었다(Fig. 2). 적색도/녹색도를 나타내는 a값은 BL과 BLA에서 0.70, 0.50으로 적색으로 색이 변한 것과 달리, Zn 처리한 BLAZ, BLAC, BLAL에서 -5.21∼-3.50 범위로 값이 나타나, 녹색이 보존됨을 확인할 수 있었다. Canjura FL 등(1999)의 연구에서는 완두콩에 Zn 처리를 하여 120∼145℃까지 가열하여 완두콩의 색의 변화를 확인하였는데, Zn 처리하지 않은 완두콩에서는 a값의 변화가 현저하게 나타난 반면, Zn 처리하여 복합체를 형성한 샘플에서는 온도에 따른 변화가 나타나지 않았다고 보고하였다. 따라서 Zn-클로로필 유도체 복합체를 형성한 BLAZ, BLAC, BLAL은 열처리에 안정한 경향이 있기 때문에, 떡이나 빵, 쿠키 등의 고온에서 가열하는 가공 제품 제조 시에 색에 있어 안정성을 유지할 수 있을 것으로 사료된다.
플라보노이드는 폴리페놀 화합물로부터 생기는 자연 물질 중 하나로 주로 채소와 과일에 많이 존재하며, 식이 섭취 시에 비타민 C나 E와 같이 항산화활성이 높은 것과 비교하여도 좋은 항산화물로 알려져 있다(Benedet JA 등 2007). 새싹보리 분말 추출물의 총 플라보노이드 함량 측정 결과는 Fig. 3(A)와 같았다. Zinc chloride를 처리한 BLAZ 실험군에서 8.68 mg quercetin/g young barely leaves(YBL)로 가장 높은 함량을 보였으며, 새싹보리에 zinc 처리를 하지 않고 가압 열처리를 한 BLA에서 7.94 mg quercetin/g YBL로 가장 낮은 함량을 보였다(p<0.05). Nithiyanantham S 등(2012)의 연구에 따르면 높은 가열하여 추출할 경우, 산화 방지 특성을 가지는 아글리콘플라보노이드의 글루코사이드 결합이 깨지기 때문에 상온에 비해 상대적으로 낮은 플라보노이드 값을 보일 수 있다고 하였다. 본 실험에서 zinc 처리를 한 실험군 BLAZ, BLAC, BLAL에서는 가열 처리하여 추출하였으나, 그 함량의 저하가 나타나지 않았다. 이를 통해서 zinc 처리가 총 플라보노이드 함량에 큰 영향을 주지 않음을 알 수 있었다.
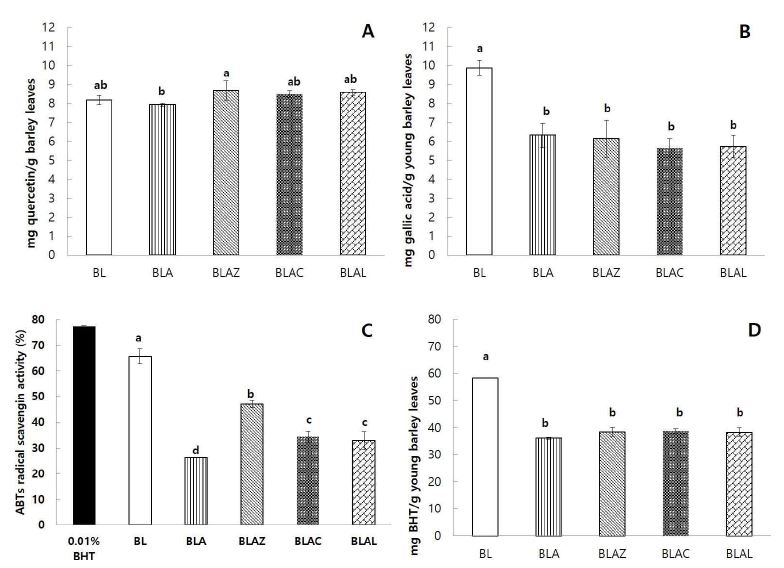
Antioxidant activities of powder pigments extracted from young barley leaves treated with zinc ion solutions: total flavonoids contents (A), total phenolic compounds (B), ABTs radical scavenging activities (C) and reducing power (D).YBL samples are BL (fresh barley leaf), BLA, BLAZ, BLAC and BLAL were treated by autoclaving at 110℃ in pH 5 distilled water, 0.01% zinc chloride solution, 0.01% zinc citrate solution, and 0.01% zinc lactate solution, respectively.1) a∼c Different letters on the bar mean significantly different at p<0.05 by Duncan's multiple range test.
총 페놀성 화합물 함량은 산화방지능력과 매우 높은 상관성을 가지고 있는 것으로 보고되고 있기 때문에, 중요한 항산화 지표 중 하나로 사용되고 있다(No JH 등 2012). 새싹보리 추출물의 처리 조건에 따른 총 페놀성 화합물 함량 측정 결과는 Fig. 3(B)와 같았다. 새싹보리는 saponarin, lutonrin, 2’-O-glucosylvitexin과 같은 폴리페놀 화합물을 가지고 있어 활성 라디칼을 잘 소거하는 것으로 알려져 있다(Yu YM 등 2002b; Dudjak J 등 2004). 새싹보리 분말 추출물 BL에서 9.87 mg gallic acid/g YBL로 가장 높은 함량을 보였으며, 110℃에서 가압 열처리를 통해 제조된 BLA, BLAZ, BLAC, BLAL에서는 5.67∼6.31 mg gallic acid/g YBL로 총 페놀성 화합물 함량이 감소함을 확인할 수 있었다(p<0.05). 가열 처리하지 않은 새싹보리 분말과 함량의 비교를 통해서 열처리 과정에서 총 페놀성 화합물의 함량이 감소함을 확인할 수 있었다.
ABTs radical 소거능은 ABTs radical cation 폼을 이용하여 식품 성분의 항산화 활성을 흡광도 기계를 이용하여 측정하는 방법으로, 라디칼이 항산화 물질과 빠르게 반응하여 비교적 안정하고 일반적인 항산화 측정 방법이다(Re R 등 1999). 생 분말을 이용하여 추출물을 제조한 BL은 65.66%로 가장 높은 라디칼 소거능을 보였고, BLAZ에서 47.11%로 다음으로 높은 소거능을 보였으며, BLA에서 26.30%로 가장 낮은 라디칼 소거능을 보였다(p<0.05). 이는 Ferruzzi MG 등(2002)의 클로로필 유도체의 항산화 활성 연구에서 ABTs 라디칼 소거능이 클로로필 a(0.67 TEAC) > Zn-pheophytin a(0.43 TEAC) > pheophytin a(0.02 TEAC)인 결과와 유사한 결과였다. Candan N & Tarhan L(2003)의 연구에 따르면 식물체에 존재하는 Zn은 활성산소를 제거하는 기능을 하며, 식물 세포벽에서의 과산화 반응에서 직접적으로 항산화 작용을 하는 중요한 성분이라고 하였다. 이는 BL이 가장 많은 총 페놀성 화합물 함량을 보이고, 다른 추출물의 함량이 적은 결과와 비슷한 경향을 보임을 알 수 있어, 추출물의 총 페놀성 화합물 함량이 ABTs 라디칼 소거능에 영향을 주었을 것으로 생각해볼 수 있었다. Candan N & Tarhan L(2003)과 Saeidnejad AH & Kafi M(2013)의 연구에 따르면 식물체에 존재하는 Zn은 활성산소를 제거하는 기능을 하며, 식물 세포벽에서의 과산화 반응에서 직접적으로 항산화 작용을 하는 중요한 성분이라고 하였다. 또한 Zn-클로로필 복합체를 형성한 것이 항산화능력이 높게 나타난다는 연구결과가 보고되었다(Ozkan G & Bilek SE 2015). 따라서 Zn-클로로필 복합체의 형성은 색의 안정성을 증진시킬 뿐 아니라, 항산화 활성에도 긍정적인 기능을 할 것으로 기대되었다.
추출물의 환원력은 노란색의 실험 용액이 녹색이나 파란색으로 변화하는 것을 원리로 활성 정도를 확인한다(No JH 등 2012). 환원제가 존재하면 Fe3+/ferricyanide 복합체가 ferrous 형태로 환원이 되어 700 nm에서 파란색으로 Fe2+ 중합체가 관찰되어진다(Ferreira ICFR 등 2007). 새싹보리 분말 추출물의 처리 조건별 환원력을 측정한 결과는 Fig. 3(D)와 같았다. 새싹보리 추출물인 BL에서 58.38 mg BHT/g YBL로 가장 높은 함량을 보였으며, 감압 열처리한 BLA, BALZ, BLAC, BLAL에서는 36.07∼38.79 mg BHT/g YBL로 낮은 경향을 보였다(p<0.05). 이를 통해서 환원력은 Zn의 처리가 크게 영향을 주지 못함을 알 수 있었다.
요약 및 결론
식품의 가공 중에 새싹보리의 클로로필 색소의 변색을 최소화하기 위하여 새싹보리에 zinc chloride, zinc citrate, zinc lactate를 110℃에서 감압 열처리를 하여 새싹보리의 클로로필과 Zn 복합체 형성 정도를 확인하고, 처리 조건에 따라 분말의 산화안정성과 pH 안정성, 열 안정성과 항산화 능력을 확인하였다. Zn 처리한 BLAZ, BLAC, BLAL에서 각각 1,244.47 ppm, 911.34 ppm, 634.12 ppm을 보였으며, 색소 흡광도를 400∼700 nm로 측정한 결과, 피크 흡광도의 파장이 이동하는 것을 확인하여 Zn-클로로필 복합체의 형성이 효과적으로 일어났음을 확인할 수 있었다. 산화 안정성, pH 안정성, 열 안정성을 각각 측정한 결과, zinc chloride와 zinc citrate를 처리한 BLAZ와 BLAC에서 녹색도인 a 값이 일정하게 유지되어 가장 안정적인 것을 확인할 수 있었다. 이를 통해서 zinc chloride와 zinc citrate가 새싹보리의 클로로필 색소를 유지하는데 있어 효과적임을 알 수 있었고, 색소의 항산화 능력을 일정부분 유지할 수 있고, 특히 zinc citrate 같은 유기태의 경우 인체의 흡수율도 높기 때문에 기능적인 면에서도 좋을 것으로 생각되었다.
Acknowledgments
This research was supported by technology commercialization support program(814002-3), Ministry of Agriculture, Food and Rural Affairs.
REFERENCES
-
Benedet, JA., Umeda, H., Shibamoto, T., (2007), Antioxidant activity of flavonoids isolated from young green barley leaves toward biological lipid samples, J Agr Food Chem, 5(14), p5499-5504.
[https://doi.org/10.1021/jf070543t]

- Candan, N., Tarhan, L., (2003), Changes in chlorophyll-carotenoid contents, antioxidant enzyme activities and lipid peroxidation levels in Zn-stressed Mentha pulegium, Turk J Chem, 27(1), p21-30.
-
Canjura, FL., Watkins, RH., Schwartz, SJ., (1999), Color improvement and metallo-chlorophyll complexes in continuous flow aseptically processed peas, J Food Sci, 64(6), p987-990.
[https://doi.org/10.1111/j.1365-2621.1999.tb12265.x]

- Dudjak, J., Lachman, J., Miholova, D., Kolihova, D., Pivec, V., (2004), Effect of cadmium on polyphenol content in young barley plants (Hordeum vulgare L.), Plant Soil Environ, 50(11), p471-477.
-
Ferreira, ICFR., Baptista, P., VilasBoas, M., Barros, L., (2007), Free-radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal: Individual cap and stripe activity, Food Che, 100, p1511-1516.
[https://doi.org/10.1016/j.foodchem.2005.11.043]

-
Ferruzzi, MG., Bohm, V., Courtney, PD., Schwartz, SJ., (2002), Antioxidant and antimutagenic activity of dietary chlorophyll derivatives determined by radical scavenging and bacterial reverse mutagenesis assays, J Food Sci, 67(7), p2589-2595.
[https://doi.org/10.1111/j.1365-2621.2002.tb08782.x]

- Jang, JH., Choi, HS., Cheong, HS., Kang, OJ., (2007), A comparison of the antioxidant activity of barley leaf tea and green tea according to leaching conditions in distilled water, Korean J Food Cook Sci, 23(2), p165-172.
-
Jones, ID., White, RC., Gibbs, E., Butler, LS., Nelson, LA., (1977), Experimental formation of zinc and copper complexes of chlorophyll derivatives in vegetable tissue by thermal processing, J Agr Food Chem, 25(1), p149-153.
[https://doi.org/10.1021/jf60209a030]

-
Kim, JM., No, JH., Shin, MS., (2015), Development of fine bamboo leaf powder and its color stability, Korean J Food Cook Sci, 31(4), p405-412.
[https://doi.org/10.9724/kfcs.2015.31.4.405]

-
Koca, N., Karadeniz, F., Burdurlu, HS., (2006), Effect of pH on chlorophyll degradation and colour loss in blanched green peas, Food Chem, 100(2), p609-615.
[https://doi.org/10.1016/j.foodchem.2005.09.079]

- Lee, IS., Lee, HY., Kim, HL., Ko, KH., Chang, HC., Kim, IC., (2008), Effect of metal ions on stabilization of codium fragile’s pigments, Korean J Food Preserv, 15(3), p352-360.
-
Lee, NY., Kim, YK., Choi ID, Cho SK., Hyun, JN., Choi, JS., Park, KH., Kim, KJ., Lee, MJ., (2010), Biological activity of barley (Hordeum vulgare L.) and barley by-product extracts, Food Sci Biotechnol, 19(3), p795-791.
[https://doi.org/10.1007/s10068-010-0110-2]

-
Laborde, LF., Elbe, JH., (1990), Zinc complex formation in heated vegetable purees, J Agr Food Chem, 38(2), p484-487.
[https://doi.org/10.1021/jf00092a033]

-
Laborde, LF., Elbe, JH., (1994), Chlorophyll degradation and zinc complex formation with chlorophyll derivatives in heated green vegetables, J Agr Food Chem, 42(5), p1100-1103.
[https://doi.org/10.1021/jf00041a010]

-
Min, DB., Boff, JM., (2002), Chemistry and reaction of singlet oxygen in foods, Comp Rev Food Sci Food Safety, 1(3), p58-72.
[https://doi.org/10.1111/j.1541-4337.2002.tb00007.x]

-
No, JH., Kim, HS., Lee, KA., Shin, MS., (2012), The antioxidant activities of the Korean variety mung bean hull extracts as dependent on the different extraction methods, Korean J Food Cook Sci, 28(5), p605-612.
[https://doi.org/10.9724/kfcs.2012.28.5.605]

-
Ngo, T., Zhao, Y., (2005), Retaining green pigments on thermally processed peels-on green pears, J Food Sci, 70(9), pC568-C574.
[https://doi.org/10.1111/j.1365-2621.2005.tb08306.x]

-
Ngo, T., Zhao, Y., (2007), Formation of zinc-chlorophyll-deriva-tive complexes in thermally processed green pears (Pyrus communis L.), J Food Sci, 72(7), pC397-C404.
[https://doi.org/10.1111/j.1750-3841.2007.00465.x]

-
Nithiyanantham, S., Selvakumar, S., Siddhuraju, P., (2012), Total phenolic content and antioxidant activity of two different solvent extracts from raw and processed legumes, Cicer arietinum L. and Pisum sativum L., J Food Composit Analy, 27(1), p52-60.
[https://doi.org/10.1016/j.jfca.2012.04.003]

- Nurhayati, N., Suendo, V., (2011), Isolation of chlorophyll a from spinach leaves and modification of center ion with Zn2+: Study on its optical stability, JMS, 16(2), p65-70.
- Oh, HI., Lee, HJ., Moon, TH., Noh, BS., Kim, SJ., (2008), Food Chemistry, Soohaksa, Korea, p334-335.
-
Ozkan, G., Bilek, SE., (2015), Enzyme-assisted extraction of stabilized chlorophyll from spinach, Food Chem, 176, p152-157.
[https://doi.org/10.1016/j.foodchem.2014.12.059]

-
Re, R., Pelllegrini, N., Proteggente, A., Pannala, A., Yang, M., Rice-evans, C., (1999), Antioxidant activity applying an improved ABTs radical cation decolorization assay, Free Radical Biol Med, 26(9/10), p1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

- Saeidnejad, AH., Kafi, M., (2013), Alleviative effects of zinc on physiological properties and antioxidants activity of maize plants under salinity stress, Intl J Agr Crop Sci, 5(5), p529-537.
- Senklang, P., Anprung, P., (2010a), Microencapsulation of Zn-chlorophyll pigment from pandan leaf by spray drying and its characteristic, Int Food Res J, 17(4), p1031-1042.
-
Senklang, P., Anprung, P., (2010b), Optimizing enzymatic extraction of Zn-chlorophyll derivatives from pandan leaf using response surface methodology, J Food Process Preserv, 34(5), p759-776.
[https://doi.org/10.1111/j.1745-4549.2009.00393.x]

-
Takeuchi, Y., Amao, Y., (2005), Light-harvesting properties of zinc complex of chlorophyll-α from spirulina in surfactant micellar media, Biometals, 18(1), p15-21.
[https://doi.org/10.1007/s10534-004-5770-z]

-
Tonucci, LH., Elbe, JH., (1992), Kinetics of the formation of zinc complexes of chlorophyll derivatives, J Agr Food Chem, 40(12), p2341-2344.
[https://doi.org/10.1021/jf00024a004]

- Yu, YM., Chang, WC., Chang, CT., Hseieh, CL., TSAI, CE., (2002a), Effects of young barley leaf extract and antioxidative vitamins on LDL oxidation and free radical scavenging activities in type 2 diabetes, Diabetes Metab, 28(2), p107-114.
-
Yu, YM., WU, CH., Tseng, YH., Tsai, CE., Chag, WC., (2002b), Antioxidative and hypolipidemic effects of barley leaf essence in a rabbit model of atherosclerosis, Jpn J Pharmacol, 89(2), p142-148.
[https://doi.org/10.1254/jjp.89.142]

-
Zarco-Tejada, PJ., Miller, JR., Harron, J., Hu, B., Noland, TL., Goel, N., Mohammed, GH., Sampson, P., (2004), Needle chlorophyll content estimation through model inversion using hyperspectral data from boreal conifer forest canopies, Remote Sensing Environ, 89(2), p189-199.
[https://doi.org/10.1016/j.rse.2002.06.002]


