
자색고구마로부터 분리한 안토시아닌 분획물의 고지방식이로 유도된 인슐린 저항성과 간 지질 축적 개선 효과
Abstract
Anthocyanins, a class of flavonoids, are natural water-soluble pigments, mainly found in vegetables and fruits. Anthocyanins have attractive pharmacological activities, such as anti-oxidant, anti-inflammatory, anti-cancer, and anti-diabetic effects. The purpose of this study was to investigate the inhibitory effects of the anthocyanin-rich fraction (ANF) from purple sweet potato on high fat diet-induced insulin resistance and hepatic steatosis. C57BL/6J mice were assigned to the following groups (n=8 per group): normal fat diet (NF); high fat diet (HF); high fat diet with ANF 50mg/kg (ANF50). Normal fat or high fat diets were fed for a total of 17 weeks, and ANF was orally administrated for 8 weeks (from 10 to 17 weeks, five times/week). In our results, there were no significant differences in body weight, food intake, and tissue weight upon ANF supplementation. The levels of serum triacylglycerol, total-cholesterol, and glucose were also not affected by ANF supplementation. However, ANF supplementation significantly decreased serum insulin and HOMA-IR levels as well as prevented hepatic fat accumulation in high fat-fed mice. These results show that ANF may be beneficial for improving high fat-induced insulin resistance and protecting against development of hepatic steatosis.
Keywords:
anthocyanins, purple sweet potato, insulin resistance, hepatic steatosis서 론
통계청 발표에 따르면, 우리나라 2014년 사망원인별 사망률은 간암의 경우 22.8%, 간질환의 경우 13.1%로 간조직 질환이 전체 사망원인에 기여하는 비율은 1/3 이상을 차지한다(Korea National Statistical Office 2014). 이 중 비알코올성 지방간(non-alcoholic fatty liver disease, NAFLD)은 알코올 섭취의 병력과는 무관하게 고지방식이 등으로 간에 지방이 축적되는 상태로, 지방간염과 간섬유화, 간경화를 거쳐 간암으로 진행되는 가장 흔한 형태의 만성 간질환이다(Sunny NE 등 2011). NAFLD의 위험인자로는 비만, 인슐린 저항성, 고지혈증, 당뇨 등이 알려져 있어(Park SH 등 2006), 식생활 등의 생활습관을 개선시키는 것이 중요한 치료법이다.
인슐린 저항성은 인슐린 작용에 대한 조직의 민감성(sensitivity) 감소로서, 인슐린의 주요 작용인 근육과 지방으로의 혈중 포도당 이동과 간의 당 신생 억제를 저해한다(Defronzo RA & Ferrannini E 1991). 인슐린 저항성은 그 자체가 질병은 아니지만, 내당능 장애, 이상지질혈증 등과 같은 대사 이상이 나타날 가능성을 증가시키고, 그 결과 제 2형 당뇨나 NAFLD등의 위험성이 증가한다(Reaven GM 2005). 특히, 인슐린 저항성과 NAFLD의 관련성은 여러 연구에서 검토된 바 있다(Bugianesi E 등 2010; Birkenfeld AL& Shulman GI 2014; Kumashiro N 등 2011). 따라서 인슐린 저항성 개선을 통한 NAFLD를 예방 또는 치료할 수 있는 식품 소재의 발굴이 요구되어진다.
자색고구마는 일반고구마와 달리 육질 전체가 붉은색을 띄는 것으로 식이섬유와 무기질, 비타민을 함유하여 영양학적으로 우수할 뿐만 아니라, 안토시아닌을 다량 함유하고 있어, 최근에 건강기능식품으로 새롭게 관심을 받고 있다(Lee YM 등 2012; Kim HW 등 2012). 안토시아닌은 붉은색, 보라색, 푸른색 등의 색을 띠는 플라보노이드 화합물로 채소 및 과일류에 주로 존재하는 수용성 천연색소이다(Silva S 등 2015). 안토시아닌의 phenolic 구조는 활성산소종(reactive oxygen species)을 소거하는 능력을 갖고 있어 항산화뿐만 아니라, 항염증, 항비만 및 항당뇨 활성을 나타내는 것으로 보고되었다(Wang YJ 등 2010; Tsuda T 2016; Choi MH 등 2016).
자색고구마의 기능성에 관한 연구로는 자색고구마 물 추출물의 산화스트레스에 대한 신경세포 보호 효과(Kwak JH 등 2010), 자색고구마 분말의 사염화탄소에 의한 간 손상 보호 효과(Cho YJ 등 2003), 자색고구마 물 추출물의 간 내 인슐린 저항증 개선 효과(Zhang ZF 등 2013) 등이 보고되어 있다. 또한, 자색고구마의 분말이나 추출물이 아닌 자색고구마에서 분리한 안토시아닌의 항당뇨 효과(Zhao JG 등 2013), adenosine monophosphate-activated protein kinase(AMPK) 활성화에 의한 간의 지질 축적 저해 효과 등도 연구되었다(Hwang YP 등 2011a).
자색고구마 유래 안토시아닌이 인슐린 저항성을 개선시킴으로 지방간의 발달을 억제시킬 것으로 예상되어지나, 관련 연구는 미비한 편이다. 따라서 본 연구는 자색고구마에서 분리한 안토시아닌 분획물이 고지방식이로 유도된 인슐린 저항성과 지방간에 미치는 영향을 평가하고자 수행되었다.
재료 및 방법
1. 자색고구마 안토시아닌 분획물
본 연구에 사용한 자색고구마(신자미)는 농촌진흥청 바이오에너지작물센터에서 2011년에 재배하여 수확한 것이다. 자색고구마를 동결건조(PVTFD 10R, Ilsin Lab, Yangju, Korea)하고, 40 mesh 분쇄기(FM909T, Hanil, Wonju, Korea)로 분쇄한 후 분말상태로 밀봉하여 냉동(-20℃) 보관하였다. 자색고구마 분말 50 g을 0.5% trifluoroacetic acid가 포함된 증류수 1.5 L에서 3시간 동안 상온에서 3회 반복하여 교반추출하였다. 이를 감압 여과한 후 hexane, ethylacetate, butanol로 각각 3회 반복하여 순차적으로 용매 분획을 실시하였다. 감압여과 후 용매를 제거하여 최종적으로 안토시아닌 분획물(anthocyanin rich fraction, ANF) 3 g을 얻었다. 시료는 냉동(-20℃) 보관하여 실험에 사용하였다. 본 연구진의 선행연구에서 자색고구마 신자미의 안토시아닌 함량은 1,342 mg/100 g dry weight이며, 구성은 peonidine 계열의 안토시아닌이 77.4%를 차지하며, cyanidine 계열의 안토시아닌이 22.6% 정도 포함되어 있다(Kim HW 등 2012).
2. 실험동물 및 식이
4주령의 수컷 C57BL/6J 마우스(Central Lab. Inc., Seoul, Korea)를 정상지방식이군(NF)과 고지방식이군(HF)으로 나누어 9주간 정상지방식이 또는 고지방식이를 공급하였다. 9주 후에 HF군을 두 군으로 나누어, 한 군을 HF군으로 나머지 군을 고지방식이 + ANF 50 mg/kg 투여군(ANF50)으로 하였고(Hwang YP 등 2011b), 8주간 더 사육하였다.
식이조성은 Table 1에 제시하였다. 정상지방식이(D12450J, Research Diets Inc., New Brunswick, NJ)는 지방 함량이 열량의10%를차지하였고, 고지방식이(D12492, Research Diets Inc., New Brunswick, NJ)는 지방 함량이 열량의 60%를 차지하였다. ANF는 주 5회씩 8주간 경구투여 하였으며, NF군과 HF군은 증류수를 동일하게 경구투여하였다(각 군당 n=8).
실험동물은 케이지당 2마리씩 임의 배치하여 사육하였다. 체중은 일주일에 1번씩 일정한 시간에 실험동물 저울을 이용하여 측정하였으며, 식이섭취량은 매일 일정한 시간에 공급하고 남은 양을 체크해 측정하였다. 모든 실험동물의 절차는 국립농업과학원 동물실험윤리위워회로부터 승인을 받아 수행하였다(승인번호 NAAS 1309).
3. 혈액 및 조직 채취
17주 동안 사육한 실험동물은 15시간 절식시킨 후 탄산가스를 이용해 마취시키고, 심장으로부터 혈액을 채취하였다. 혈액은 30분간 실온에 방치 후 3,000 rpm에서 20분간 원심분리 하여 혈청을 분리하였다. 간은 채취하여 무게를 측정한 후에 액체질소로 급속 냉동하였으며, 조직학적 분석을 위해 간의 일부를 포르말린에 고정하였다. 지방조직은 개복했을 때, 복강 앞쪽으로 생식기관 주변에 저장되어 있는 지방(gonadal fat)과 뒤편으로 신장 주변에 저장되어 있는 지방(retroperitoneal fat)을 채취하였다. 간과 마찬가지로 지방 조직의 무게를 측정한 후에 액체 질소로 급속 냉동하였고, 조직학적 분석을 위해 gonadal fat의 일부를 포르말린에 고정하였다. 혈액과 조직은 분석 시까지 -80℃에 보관하였다.
4. 내당능(Oral Glucose Tolerance Test, OGTT)
공복 시 혈당 수준을 측정하여 초기 혈당으로 한 후 75% glucose 용액을 2 g/kg의 수준으로 경구투여하고, 30, 60, 120분에 꼬리로부터 채혈하여 혈당의 변화를 혈당측정기(Accu-Check Active, Roche, Germany)로 측정하였다. 각 시간별로 2번의 측정치에 대한 평균을 구하였다.
5. 혈액 분석
혈중 당 총콜레스테롤 농도는 효소법(Asan Pharm Co., Seoul, Korea)으로, 인슐린은 ELISA kit(Crystal Chem Inc., Downers Grove, IL)을 이용하여 측정하였다. 인슐린 저항성 지수(homeostasis model assessment-estimated insulin resistance, HOMA-IR)는 아래의 식에 의해 계산하였다(Jang HH 등 2012).
6. 간 조직 내 지질 축적
간 조직을 이용해 haematoxylin and eosin(H&E) 염색 슬라이드를 제작하고, 지방간의 정도를 판독하였다. 지방증은 간조직 전체에서 지방이 축적된 면적의 비율을 기준으로 점수화 하였으며, 판독기준은 Table 2에 제시하였다(Jang HH 등 2012).
7. 지방조직 내 지방세포 크기
지방 조직을 이용해 H&E 염색 슬라이드를 제작하고 지방세포 크기를 측정하였다. 현미경 ×400 배율 세 시야에서 제일 큰 지방세포 세 개의 장축의 길이를 구하여 평균을 구하였고, 군 평균을 도출하여 군 간 비교를 하였다.
8. 통계처리
실험결과는 평균±표준편차로 나타냈다. 처리간의 차이는 SPSS 프로그램 21.0(IBM Corp., Armonk, NY)에서 ANOVA를 실시한 후 군 간에 유의한 차이가 있을 때 사후검정으로 Duncan's multiple range tests에 의하여 p<0.05 수준에서 검증하였다.
결과 및 고찰
1. 체중 및 식이섭취량
실험동물의 초기 체중, 고지방식이를 9주간 공급한 후의 체중, 최종 체중, 체중 증가량, 식이섭취량 및 식이효율은 Table 3에 제시하였다. 실험 초기 체중은 군 간에 유의적인 차이가 없었으며, 고지방식이를 9주간 공급한 후에 HF군과 ANF50군의 체중과 체중 증가량은 NF군에 비해 유의적으로 증가하였다. 식이섭취량은 HF군에서 NF군에 비해 유의하게 감소한 것으로 나타났으며, 섭취량에 대한 체중증가량을 나타내는 식이효율은 ANF의 투여에 상관없이 HF군에서 유의하게 증가하였다. 간의 무게 또한 HF군에서 증가하였으나, ANF의 보충이 유의한 영향을 미치지 않았다.
본 연구에서 사용한 고지방식이는 soybean oil을 2.5%, lard를 24.5% 함유하여 지방으로부터 열량 공급이 총 열량의 60%를 차지하였다. 여러 연구에서 열량의 45% 이상을 지방으로 공급하는 고지방식이 급여 시 체중과 간 무게의 유의한 증가를보고한것은 본연구결과와 유사하다(Jang HH 등2012; Seo E 등 2010). 식이섭취량의 경우, 고지방식이에 의하여 의미있게 감소하였으나, 본 연구에서 사용된 고지방식이(5.24 kcal/g)는 정상지방식이(3.85 kcal/g)에 비해 열량이 높아 식이섭취량이 감소함에도 불구하고, 열량의 섭취를 증가시켰다. 식이섭취량에 따른 하루 총 열량 섭취량으로 보면, 정상지방식이 섭취군이 9.74 kcal/day, 고지방식이 섭취군이 12.45 kcal/day이다.
2. 혈중 총 콜레스테롤 및 중성지질
실험동물의 혈중 총 콜레스테롤 및 중성지질 함량을 Table 4에 나타내었다. 총 콜레스테롤의 경우, NF군에 비해 HF군에서 유의적으로 증가하였고, ANF의 투여는 총 콜레스테롤 함량에 유의적인 영향을 나타내지 않았다. 중성지질의 경우, 고지방식이나 ANF의 보충에 의하여 군간에 유의한 차이를 보이지 않았다.
혈중 중성지질 함량의 증가는 일반적으로 고탄수화물 식이 섭취에 의해 관찰되어진다(Hellerstein MK 002). 또한, 본 연구 결과는 Eisinger K 등(2014)이 열량의 45%를 지방이 공급하는 고지방식이를 14주간 마우스에게 제공하였을 때 혈중 중성지질 수준이 정상지방식이 대조군과 차이가 없었다고 보고한 것과 일치한다. 즉, 50 mg/kg의 수준으로 공급된 자색고구마 유래 ANF는 고지방식이로 인한 체중이나 혈중 지질의 증가를 개선하는데 효과적이지 못한 것으로 나타났다.
3. 혈당, 인슐린 및 인슐린 저항성 지수(HOMA-IR)
실험동물의 혈당, 인슐린 및 인슐린 저항성 지수를 Table 4에 나타내었다. 혈당은 NF군에 비해 HF군에서 유의하게 증가하였으며, ANF의 투여가 고지방식이로 인한 혈당의 증가를 저해하지는 못하였다. 그러나 HF군에서 ANF의 첨가는 고지방식이로 인한 인슐린의 증가를 유의하게 저해하였다. 인슐린저항성 지수의 경우도, ANF50군에서 NF군의 수준으로 회복되었다.
Hwang YP 등(2011a)의 연구에 따르면, 지방으로부터의 열량이 총 열량의 45%를 차지하는 고지방식이를 공급한 마우스에게 자색고구마 신자미에서 유래한 안토시아닌 분획을 200 mg/kg의 수준으로 4주간 공급하였을 때, 혈당이 유의하게 감소하였다. 안토시아닌을 주요 성분으로 하는 자색고구마 색소체(purple sweet potato color)를 700 mg/kg 수준으로 고지방식이(60% 지방)와 함께 20주간 공급하였을 때도, 공복 혈당을 유의하게 감소시켰다(Zhang ZF 등 2013). 그러나 본 연구에서 ANF의 투여에 따라 혈당이 유의하게 감소하지 못한 것은 고지방식이의 지방 유래 에너지 함량, 공급 기간, 안토시아닌의 투여 농도 등의 차이 때문인 것으로 생각된다. 본 연구에서 사용된 고지방식이는 지방의 에너지 함량이 60%이고, 공급 기간도 17주로 더 길었으며, 이에 따라 고지방식이 대조군의 혈당이 Hwang YP 등(2011a)의 연구에서보다 더 높은 수준으로 나타났다. 또한 본 연구에서는 ANF가 50 mg/kg의 수준으로 공급되어 위의 두 개의 선행연구에 비해 각각 1/4, 1/12 정도로 낮은 수준이었다.
본 연구에서 ANF는 고지방식이로 인한 인슐린의 증가를 유의하게 저해시켰으며, 인슐린 저항성 지수도 개선시킬 수 있었다. Jang HH 등(2012)의 연구에서 안토시아닌이 2.5%를 차지하는 흑미 추출물을 식이 중 1%의 수준으로 7주간 공급하였을 때 고지방식이로 유의하게 증가한 HOMA-IR을 감소시키지 못하였다. 이것을 실험동물 개체 당 경구투여한 안토시아닌 함량으로 환산하면 29 mg/kg이며, 본 연구의 ANF 투여 농도 50 mg/kg의 약 절반 수준이다. 따라서 지방의 에너지 함량이 60%인 고지방식이를 공급한 마우스에서 50 mg/kg수준으로 ANF를 보충한 것은 혈당은 감소시키지 못하였으나, 고지방식이로 인한 고인슐린혈증을 저해시켰으며, 인슐린 저항성을 개선시키는데 효과적이라고 할 수 있다.
4. 지방조직 무게와 지방세포의 크기
고지방식이와 ANF 공급에 따른 지방조직의 무게와 지방세포의 크기를 Table 5에 나타내었다. NF군에 비해 HF군의 gonadal fat, retroperitoneal fat의 무게가 유의적으로 증가하였고, ANF 투여에 의한 지방조직 무게의 유의적인 변화는 나타나지 않았다. 지방세포의 크기 또한 고지방식이에 의해 증가하였으나, ANF는 이러한 증가를 저해하지 못하였다.
Wu T 등(2013)은 mullberry에서 분리된 안토시아닌을 고지방식이를 섭취한 C57BL/6J 마우스에 40, 250 mg/kg의 수준으로 공급하였을 때 체지방이 농도의존적으로 유의하게 감소함을 보고하였다. 이 연구에서 사용된 mullberry의 주요 안토시아닌은 cyanidin-3-glucoside and cyanidin-3-rutinoside로 본 연구의 자색고구마의 주요 안토시아닌이 peonidin 3-caffeoyl-p-hydroxybenzoyl-sophoroside-5-glucoside과 cyanidin 3-caffeoyl-p-hydroxybenzoyl-sophoroside-5-glucoside인 것과 구별된다(Kim HW 등 2012). 식품에 함유된 개별 안토시아닌의 다양한 조성과 이에 따른 체지방 무게에 대한 영향, 관련된 분자 메커니즘 구명을 위한 추가 연구가 필요하다.
5. 내당능(OGTT)
공복 시 혈당부터 시작하여 당을 경구 투여한 후 30, 60, 120분의 혈당을 Fig. 1에 나타내었다. 공복 혈당은 군 간에 유의한 차이를 보이지 않았으나, 당 투여 후 30분에 NF군에 비해 HF군의 혈당이 유의하게 증가하였고, ANF의 투여는 혈당을 NF군의 수준으로 회복시키지는 못하였으나, HF군에 비해 감소시키는 경향을 나타내었다. 당 투여 60, 120분에서는 군 간에 유의적인 차이가 없었다.
Zhang ZF 등(2013)의 연구에서도 안토시아닌을 주요 성분으로 하는 자색고구마 색소체(purple sweet potato color)를 700 mg/kg 수준으로 고지방식이(60% 지방)와 함께 20주간 공급하였을 때, 내당능을 모든 시간별로 유의적으로 개선시켰다. ANF는 혈중 인슐린 농도와 HOMA-IR를 유의하게 감소시켰고, 결과적으로 포도당의 경구 투여 후 내당능을 개선시킨 것으로 사료된다.
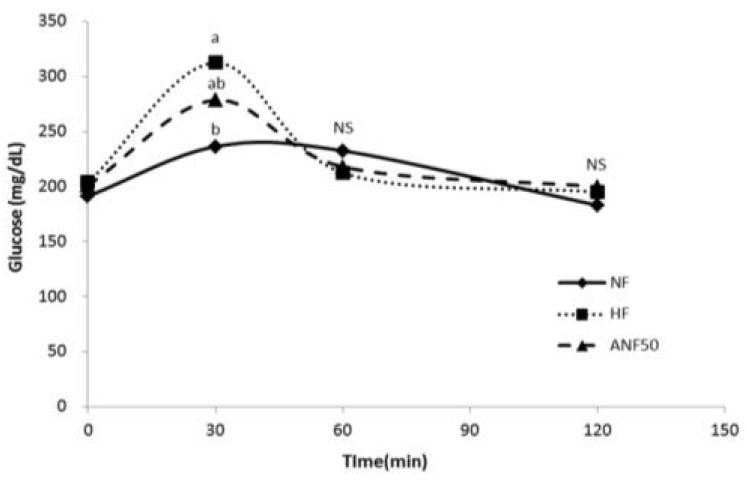
Effects of ANF on glucose tolerance in mice fed high fat diet.Data are expressed as Mean±S.E. (n=8). Statistical significance was determined using ANOVA followed by a Ducan's multiple range tests (p<0.05). Abbreviations: NF, normal fat diet group (fat 10% of calories); HF, high fat diet group (fat 60% of calories); ANF50, high fat diet with anthocyanin fraction (50 mg/kg).
6. 간지질 축적 정도
간 조직 내 지질의 축적 정도를 점수화 하여 Fig. 2에 제시하였다. NF군에서는 간 지질 축적 정도를 점수화 하였을 때, 0점(<5%)이 62.5%, 1점(5∼33%)이 37.5%인 것에 반해, HF군에서는 2점(34∼66%)이 크게 증가하였다. 그러나 ANF50군에서는 간의 지질 축적이 크게 억제되어 2점이 37.5%로 감소하였고, 0점과 1점이 3/5 이상을 차지하였다.
Song H 등(2016)은 sweet cherry 안토시아닌을 200 mg/kg수준으로 15주 동안 공급하였을 때, 고지방식이로 유도된 간조직 내 지질의 축적을 억제시켰다고 보고하였다. 또한, sweet cherry 안토시아닌은 간 조직의 DNA microarray 분석에서 PPARγ 경로 등 간의 지질 대사를 개선시키는 것으로 나타났다. Ling W 등(2016)은 안토시아닌(bilberries와 blackcurrants 유래)을 식이 kg 당 100 mg의 수준으로 16주 동안 공급하였을 때 고지방식이로 인한 미토콘드리아의 함량 감소, 미토콘드리아 biogenesis, 산화적 인산화 및 β-산화의 손상을 정상 수준으로 회복시켰다. 이것은 phosphorylated AMP-activated protein kinase(p-AMPK)와 peroxisome proliferator-activated receptor-gamma coactivator-1α(PGC-1α)의 활성화에 의한 것으로 설명되었다. Hwang YP 등(2011a)의 연구에서도 안토시아닌의 간의 지질 축적을 저해 효과를 adenosine monophosphateactivated protein kinase(AMPK) 활성화를 통한 지방산 산화촉진에 의한 것으로 보고하였다. 따라서 본 연구에서 사용된 자색고구마 ANF는 간 조직 내 지방산의 산화를 촉진시킴으로 고지방식이로 인한 지방간의 유발을 억제시킨 것으로 사료된다.
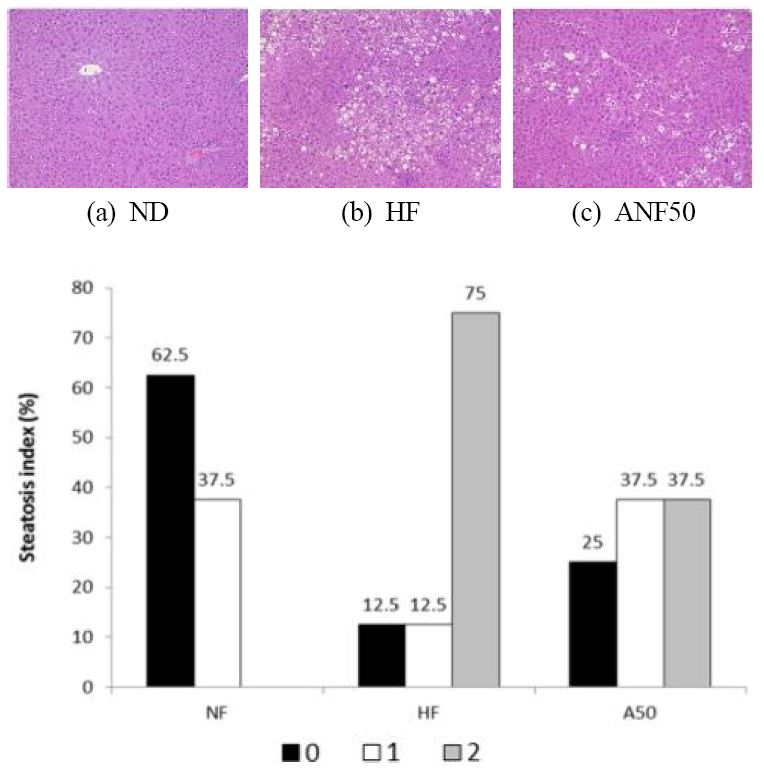
Effect of ANF on hepatic steatosis in mice fed high fat diet.Photomicrographs of H&E stained liver from representative animals in the ND (a), HF (b), and ANF50 (c) groups(×400). Percentage of hepatic steatosis grade (0∼3 scale) within each groups (d). Data are expressed as percentage within group. Hepatic steatosis was graded as 0 (fatty hepatocytes occupying <5%), 1 (fatty hepatocytes occupying 5∼33%), 2 (fatty hepatocytes occupying 34∼ 66%), or 3 (fatty hepatocytes occupying >66%) Abbreviations: NF, normal fat diet group (fat 10% of calories); HF, high fat diet group (fat 60% of calories); ANF50, high fat diet with anthocyanin fraction (50 mg/kg).
결 론
본 연구는 고지방식이를 급여한 실험동물에서 자색고구마(신자미) 안토시아닌 분획물(ANF)이 인슐린 저항성과 지방간에 미치는 영향을 평가하기 위하여 수행되었다. 9주간 정상지방식이(지방함량이 열량의 10%) 또는 고지방식이(지방함량이 열량의 60%)를 공급하였고, 고지방식이군을 두 군으로 나눈 후, 한 군에 ANF 50 mg/kg 투여하여 8주간 더 사육하였다. 그 결과, ANF의 투여는 고지방식이에 의한 체중 증가와 식이섭취량, 간과 지방 조직의 무게의 변화에 유의한 영향을 미치지 못하였다. 또한, ANF는 고지방식이로 인한 혈당, 혈중 중성지질과 총 콜레스테롤의 함량을 감소시키지 못하였다. 그러나 고지방식이 섭취군에서 정상식이군에 비해 유의적으로 증가한 간 조직 내 지질 축적 정도는 ANF의 보충에 의해 개선되었으며, 이것은 혈중 인슐린 함량과 HOMAIR은 유의한 감소를 수반하였다. 따라서 자색고구마 유래 안토시아닌은 고지방식이로 유도되는 인슐린 저항성과 간의 지질 축적을 개선시키는데 효과가 있을 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술연구개발사업(과제번호 PJ01178701)과 2014학년도 서울여자대학교 교내학술연구비 지원에 의해 이루어진 것이며, 그 지원에 감사드립니다.
References
-
Bugianesi, E, Moscatiello, S, Ciaravella, MF, Marchesini, G, (2010), Insulin resistance in nonalcoholic fatty liver disease, Curr Pharm Des, 16, p1941-1951.
[https://doi.org/10.2174/138161210791208875]

-
Birkenfeld, AL, Shulman, GI, (2014), Non alcoholic fatty liver disease, hepatic insulin resistance and type 2 diabetes, Hepatology, 59, p713-723.
[https://doi.org/10.1002/hep.26672]

- Cho, YJ, Kim, HA, Bang, MA, Oh, YB, Jeong, BC, Moon, YH, Jeong, WJ, (2003), Pretective effect of purple sweet potato (Ipomoea batatas) hepatotoxicity rats induced by carbon tetrachlolide, Korean J Food Culture, 18, p202-210.
-
Choi, MH, Shim, SM, Kim, GH, (2016), Protective effect of black raspberry seed containing anthocyanins against oxidative damage to DNA, protein, and lipid, J Food Sci Technol, 53, p1214-1221.
[https://doi.org/10.1007/s13197-015-2094-7]

-
Defronzo, RA, Ferrannini, E, (1991), Insulin resistance: A multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic cardiovascular disease, Diabetes Care, 14, p173-194.
[https://doi.org/10.2337/diacare.14.3.173]

-
Eisinger, K, Liebisch, G, Schmitz, G, Aslanidis, C, Krautbauer, S, Buechler, C, (2014), Lipidomic snalysis of serum from high fat diet induced obese mice, Int J Mol Sci, 15, p2991-3002.
[https://doi.org/10.3390/ijms15022991]

-
Hellerstein, MK, (2002), Carboydrate-induced hypertriglyceridemia: Modifuing factors and implications for cardiovascular risk, Curr Opin Lipidol, 13, p33-40.
[https://doi.org/10.1097/00041433-200202000-00006]

-
Hwang, YP, Choi, JH, Han, EH, Kim, HG, Wee, JH, Jung, KO, Jung, KH, Kwon, KI, Jeong, TC, Chung, YC, Jeong, HG, (2011a), Purple sweet potato anthocyanins attenuate hepatic lipid accumulation through activating adenosine monophosphate- activated protein kinase in human HepG2 cells and obese mice, Nutr Res, 31, p896-906.
[https://doi.org/10.1016/j.nutres.2011.09.026]

-
Hwang, YP, Choi, JH, Choi, JM, Chung, YC, Jeong, HG, (2011b), Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxide-induced hepatotoxicity, Food Chem Toxicol, 49, p2081-2089.
[https://doi.org/10.1016/j.fct.2011.05.021]

- Jang, HH, Park, MY, Kim, HW, Lee, YM, Hwang, KA, Park, JH, Park, DS, Kwon, O, (2012), Black rice (Oryza sativa L.) extract attenuates hepatic steatosis in C57BL/6 J mice fed a high-fat diet via fatty acid oxidation, http://www.ncbi.nlm. nih.gov/pmc/articles/PMC3366884/ accessed on Jun. 3. 2016.
-
Kim, HW, Kim, JB, Cho, SM, Chung, MN, Lee, YM, Chu, SM, Che, JH, Kim, SN, Kin, SY, Cho, YS, Kim, JH, Park, HJ, (2012), Anthocyanin changes in the Korean purple-fleshed sweet potato, Shinzami, as affected by steaming and baking, Food Chem, 130, p966-972.
[https://doi.org/10.1016/j.foodchem.2011.08.031]

- Korean National Statistical Office, (2014), Annual report on the cause of death statistics.
-
Kumashiro, N, Erion, DM, Zhang, D, Kahn, M, Beddow, SA, Chu, X, D. Still, CD, Gerhard, GS, Han, X, Dziura, J, Petersen, KF, Samuel, VT, I. Shulmana, GI, (2011), Cellular mechanism of insulin resistance in nonalcoholic fatty liver disease, Proc Natl Acad Sci, 108, p16381-16385.
[https://doi.org/10.1073/pnas.1113359108]

- Kwak, JH, Chol, GN, Park, JH, Kim, JH, Jeong, HR, Heong, CH, Heo, HJ, (2010), Antioxidant and neuronal cell protective effect of purple sweet potato extract, J Agric & Life Sci, 44, p57-66.
-
Lee, YM, Bae, JH, Kim, JB, Kim, SY, Chung, MN, Park, MY, Ko, JS, Song, J, Kim, JH, (2012), Changes of physiological activities in four sweet potato genotypes by cooking conditions, Korean J Nutr, 45, p12-19.
[https://doi.org/10.4163/kjn.2012.45.1.12]

- Ling, W, Shen, T, Tang, W, Jiang, W, (2016), Anthocyanins improved mitochondrial dysfunction in mice of non-alcoholic fatty liver disease induced by high fat diet, Abstract No D357 II 915.29 presented an the Experimental Biology 2016 Meeting, San Diego, CA, USA.
-
Park, SH, Jeon, WK, Kim, SH, Kim, HJ, Park, DI, Cho, YK, Sung, IK, Sohn, CI, Keum, DK, Kim, BI, (2006), Prevalence and risk factors of non-alcoholic fatty liver disease among Korean adults, J Gastroenterol Hepatol, 21, p138-143.
[https://doi.org/10.1111/j.1440-1746.2005.04086.x]

-
Reaven, GM, (2005), The insulin resistance syndrome; Definition and dietary approaches to treatment, Annu Rev Nutr, 25, p391-406.
[https://doi.org/10.1146/annurev.nutr.24.012003.132155]

-
Seo, E, Han, Y, Park, SY, Koh, H, Lee, HJ, (2010), Alteration of lipid metabolism related proteins in liver of high-fat fed obese mice, J Life Sci, 20, p1019-1026.
[https://doi.org/10.5352/JLS.2010.20.7.1019]

-
Silva, S, Costa, E, Calhau, C, Morais, R, Pintado, M, (2015), Anthocyanins extraction from plant tissues: A review, accessed on Oct. 4. 2015.
[https://doi.org/10.1080/10408398.2015.1087963]

- Song, H, Wu, T, Xu, D, Chu, Q, Lin, D, Zheng, X, (2016), Dietary sweet cherry anthocyanins attenuates diet-induced hepatic steatosis by improving hepatic lipid metabolism in mice, http://www.sciencedirect.com/science/article/pii/S08999007 1600037X, accessed on Oct. 4. 2015.
-
Sunny, NE, Parks, EJ, Browning, JD, Burgess, SC, (2011), Excessive hepatic mitochondrial TCA cycle and gluconeogenesis in humans with nonalcoholic fatty liver disease, Cell Metab, 14, p804-810.
[https://doi.org/10.1016/j.cmet.2011.11.004]

- Tsuda, T, (2016), Recent progress in anti-obesity and anti-diabetes effect of berries, http://www.mdpi.com/2076-3921/5/2/13 accessed on Jun. 3. 2016.
-
Wang, YJ, Zheng, YL, Lu, J, Chen, GQ, Wang, XH, Feng, J, Ruan, J, Sun, X, Li, CX, Sun, QJ, (2010), Purple sweet potato color suppresses lipopolysaccharide-induced acute inflammatory response in mouse brain, Neurochem Int, 56, p424-430.
[https://doi.org/10.1016/j.neuint.2009.11.016]

-
Wu, T, Qi, XM, Liu, Y, Guo, J, Zhu, RY, Chen, W, Zheng, XD, Yu, T, (2013), Dietary supplementation with purified mulberry( Morus australis Poir) anthocyanins suppresses body weightgain in high-fat diet fed C57BL/6 mice, Food Chem, 141, p482-487.
[https://doi.org/10.1016/j.foodchem.2013.03.046]

-
Zhang, ZF, Lu, J, Zheng, YL, Wu, DM, Hu, B, Shan, Q, Cheng, W, Li, MQ, Sun, YY, (2013), Purple sweet potato color attenuates hepatic insulin resistance via blocking oxidative stress and endoplasmic reticulum stress in high fat diet treated mice, J Nutr Biochem, 24, p1008-1018.
[https://doi.org/10.1016/j.jnutbio.2012.07.009]

-
Zhao, JG, Yan, QQ, Lu, LZ, Zhang, YQ, (2013), In vivo antioxidant, hypoglycemia, and anti-tumor activities of anthocyanin extracts from purple sweet potato, Nutr Res Pract, 7(5), p359-365.
[https://doi.org/10.4162/nrp.2013.7.5.359]


