감초를 이용한 눈꽃동충하초 균사체 배양 추출물의 항균 활성 및 항염증 활성 분석
Abstract
This study was carried out to investigate the antimicrobial and anti-inflammatory activities of ethanol extract from Glycyrrhizae radix (GR) and ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium (GRPM). Antimicrobial activity was measured by paper disc diffusion assay and minimum inhibitory concentration (MIC). Anti-inflammatory activity was evaluated by measurement of NO production in LPS-stimulated RAW264.7 cells. For the results of the paper disc diffusion assay, GRPM showed high antimicrobial activities against Bacillus cereus, Listeria monocytogenes, and Staphylococcus aureus. In addition, the MIC of GRPM (100 ppm) was lower than that of GR (200 ppm) against L. monocytogenes. When the morphology of L. monocytogenes treated with GRPM was observed using a FE-SEM, the surface of cells treated with GRPM were damaged, and some parts of the cell wall were destroyed. The inhibitory effect on NO production in LPS-stimulated RAW264.7 cells was significantly increased by GRPM treatment. In conclusion, GRPM is superior to GR in terms of antimicrobial and anti-inflammatory activities.
Keywords:
Glycyrrhizae radix, Paecilomyces japonica mycelium, antimicrobial activity, anti-inflammatory activity서 론
버섯은 진균류이며 자실체를 가지는 고등균류로서, 당류, 단백질, 비타민, 무기질 등 영양소가 풍부하고 다양한 생리활성 물질을 생산하여 예로부터 식용 및 약용으로 널리 이용되어 왔다. 버섯은 또한 특유의 맛, 향 및 물성을 가지는 동시에 저칼로리 식품으로 알려져 꾸준히 소비되고 있다(Nho WN 2009). 일반적으로 버섯이 가지는 약리적 효과에는 항균, 항염증, 항바이러스, 항종양, 혈압 및 혈당 강하, 콜레스테롤 저하 작용 등이 있으며(Wasser SP & Weis AL 1999), 약리작용이 강한 대표적인 버섯으로는 상황(Phellinus linteus), 표고(Lentinula edodes), 영지(Ganoderma lucidum), 동충하초(Codyceps militaris) 등이 있다(Das SK 등 2010; Smith JE 등 2002; Wasser SP 2002). 버섯류의 유용한 생리활성 물질은 자실체뿐만 아니라, 균사체, 포자, 배양액에도 존재하는 것으로 알려져(Shin YK 등 2008) 균사체의 기능성에 대한 연구가 주목을 받고 있다. 균사체는 배양되는 동안 천연물에 함유된 성분을 다양한 기능성을 갖는 물질로 전환하여 본래 천연물이 가진 생리활성을 더욱 높일 수 있다(Ryu JS 2012).
동충하초는 자낭균류 맥각균목 동충하초과에 속하는 일종의 약용버섯으로, 대표적인 동충하초속에는 Cordyceps속, Paecilomyces속, Torrubiella속 등이 있으며, 이들의 항산화 및 항종양 효과(Reis FS 등 2013), 혈당 강하효과(Lee YA 등 2001), 항균효과(Lee KM 등 2008), 신장 및 간 보호 기능(Jo WJ 등 2008; Wang Y 등 2010) 등이 보고되었다. 그러나 그동안 동충하초와 관련된 연구는 대부분 번데기 동충하초(Cordyceps militaris)에 대한 연구들이 많으며, 눈꽃동충하초(Paecilomyces japonica)에 관련된 연구는 미미하고, 더욱이 눈꽃동충하초 균사체의 고체배양에 관한 연구는 매우 부족한 실정이다.
한편, 감초(Licorice, Glycyrrhizae radix)는 콩과에 속하는 다년생 초본 식물로, 항산화, 항염증, 항바이러스 등 다양한 약리적 활성을 가지고 있어(Matsui S 등 2004; Sohn EJ 등 2003; Wolkerstorfer A 등 2009) 약용으로 많이 사용되어 왔다. 특히 감초의 liquiritigenin 성분은 항균 활성이 높고, 냉장온도에서 증식 가능한 저온성균인 Listeria monocytogenes에 대하여 항균 활성을 나타내는 것으로 보고되었으며(Ahn EY 등 1998), 항염증 효과도 가지고 있는 것으로 알려져 있다(Matsui S 등 2004). 그러나 아직까지 감초와 눈꽃동충하초 균사체가 함께 배양될 때 배양물의 생리활성에 대한 연구가 수행되어 있지 않아, 본 연구에서는 한약재로 널리 이용되고 있는 감초에 눈꽃동충하초 균사체를 고체배양하고, 이들 배양 추출물의 항균 활성과 항염증 활성에 대하여 살펴보았다.
재료 및 방법
1. 실험 재료
본 실험에 사용한 감초는 대구광역시 약령 시장에서 구입하였으며, 눈꽃동충하초 균사체는 산림청 국립산림과학원에서 분양받았다. 미생물 균주는 한국미생물보존센터(Korean Culture Center of Microorganisms; KCCM)와 한국생명공학연구원 미생물자원센터(Korean Collection for Type Culture; KCTC)에서 분양받았으며, RAW264.7 대식세포는 한국세포주은행(KCLB)으로부터 분양받아 사용하였다.
2. 시약
실험에서 사용된 dimethylsulfoxide(DMSO), glutaraldehyde solution, osmium tetroxide, isoamyl acetate solution, thiazoly blue tetrazolium bromide(MTT), lipopolysaccharide(LPS)는 Sigma Chemical Co.(USA)에서 구입하였으며, nutrient agar, nutrient broth, tryptic soy agar, tryptic soy broth, potato dextrose agar(PDA), potato dextrose broth (PDB)는 Acumedia Co.(USA)에서 구입하여 사용하였다. 또한, fetal bovine serum(FBS), Roswell Park Memorial Institute medium(RPMI-1640 with L-glutamin), Dulbecco's modified Eagle's minimal essential medium(DMEM/high glucose)는 Hyclone Co.(USA)에서 구입하여 사용하였다.
3. 균사체 배양 및 고체배양물 제조
멸균된 PDA 배지에 눈꽃동충하초 균사체를 5 × 5 mm 크기의 균총으로 접종하여 25℃에서 7일간 배양하였으며, 4주 간격으로 계대배양하였다. 액체종균 제조를 위해 활성화된 균총을 멸균된 PDB에 접종하여 25℃에서 5일간 진탕배양하였으며, 배양 후 이를 homogenizer(400 Mark Ⅱ, SEWARD, USA)로 균질화하여 고체배양에 사용하였다. 감초는 증류수에 1시간 동안 침지시킨 다음 121℃에서 15분간 고압 멸균하여 냉각한 뒤, 균질화시킨 눈꽃동충하초 액체종균을 무균적으로 접종하였다. 접종 후 25℃의 배양기에서 10일간 배양하면서 육안으로 균사체 성장 정도를 관찰하였다.
4. 추출물 조제
감초 및 감초에 눈꽃동충하초 균사체를 고체배양한 배양물은 20배(w/v)의 80% 에탄올을 가하여 실온에서 24시간 동안 교반 추출하였다. 추출액은 여과지(Toyo No. 2, Advantec, Japan)로 여과한 다음 감압농축하여 동결건조하고, -20℃에서 냉동보관하며 실험에 사용하였다.
5. 항균 활성 측정
분양받은 균주는 적합한 배지를 이용하여 37℃에서 계대 배양하여 실험에 사용하였다(Table 1).
시료의 항균 활성은 paper disc법(Bauer AW 등 1966; Kwak DJ 등 2002)을 이용하여 측정하였다. 각 균에 적합한 액체배지를 이용하여 37℃에서 12시간 동안 배양한 미생물 배양액을 1 × 108 CFU/mL로 희석한 후, 100 μL를 취해 각각의 평판배지에 도말하고, 실온에서 2시간 동안 고착시켰다. 고착된 균 위에 멸균된 paper disc(ø: 6 mm, Advantec, Japan)를 놓고, syringe filter(pore size 0.25 μm, Advantec, Japan)로 제균한 농도별 시료를 20 μL씩 각 paper disc에 분주한 후 37℃의 incubator에서 24시간 동안 배양하였다. 배양 후 paper disc 주위에 생성된 생육저해환(clear zone)의 크기를 측정하여 시료의 항균 활성을 비교하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
최소생육저해농도는 National Committee for Clinical Laboratory Standard(NCCLS 1993)에 따라 agar dilution method로 측정하였다. 배지 19 mL와 DMSO에 용해하여 제균한 시료 1 mL를 혼합하여 고체배지를 제조하였다. 균주에 적합한 액체배지에서 배양한 미생물 배양액 0.1 mL(최종 접종 농도 1∼2 × 104 CFU/mL)를 고체배지 위에 분주하고, glass spreader를 사용하여 배지 상에 골고루 분포되도록 도말하였다. 이를 37℃에서 24시간 배양한 후 colony가 형성되지 않는 농도를 MIC로 나타내었다.
액체배지에 균을 선배양한 배양액 4 mL와 MIC보다 높은 농도의 추출물을 혼합하여 최종 부피를 5 mL로 조절한 후 12시간 동안 배양하였다. 배양된 균액을 원심분리하여 상층액을 제거한 후 0.1 M PBS(pH 7.2)로 수세하고 2% glutaraldehyde를 이용하여 얼음에서 90분간 균을 고정하였다. 그 후 1% osmium tetroxide에 1시간 처리하고, 농도별 ethanol(50, 70, 80, 90, 100%)을 각각 20분씩 처리하여 탈수하였다. 탈수 후, isoamyl acetate에 12시간 동안 처리하여 건조시켰으며, 건조된 균은 gold coating하여 주사전자현미경(FE-SEM, JSM-6701F, JEOL, USA)으로 관찰하였다. 대조군은 시료 대신 용매를 혼합하여 배양한 후 동일한 방법으로 처리하여 관찰하였다.
6. 항염증 활성 측정
RAW264.7 대식세포는 10% FBS, 1% penicillin이 첨가된 RPMI-1640 배지에서 배양하였으며, 37℃, 5% CO2 조건 하에서 계대배양하여 사용하였다.
RAW264.7 대식세포의 생존율은 MTT assay를 실시하여 측정하였다(Carmichael J 등 1987). 배양한 대식세포를 96 well plate에 1 × 105 cells/mL의 농도가 되도록 180 μL씩 분주하여 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 배양 후 배지 80 μL를 제거하고, 농도별 시료를 100 μL씩 각 well에 첨가하여 48시간 동안 위와 동일한 조건에서 배양하였다. 배양된 96 well plate의 각 well에 5 μg/mL의 MTT 용액 20 μL씩을 첨가하여 4시간 배양한 후 배양액을 제거하고, DMSO : ethanol(1 : 1, v/v)용액 150 μL씩을 첨가하여 30분간 진탕배양한 뒤 ELISA reader(Versamx, USA)를 이용하여 550 nm의 파장에서 흡광도를 측정하였다. 배양 후 아래의 식을 이용하여 각 시료에 대한 RAW264.7의 세포 생존율을 구하였다.
RAW264.7을 1 × 105 cells/mL의 농도로 96 well plate에 분주하여 24시간 배양한 후, 시료 추출물을 농도별(25, 50, 100, 200, 400 μg/mL)로 처리한 다음, LPS(1 μg/mL)를 처리하여 24시간 배양하였다. 세포 배양액 100 μL와 Griess 시약(5% phosphoric acid에 용해한 1% sulfanilamide : 1% naphthylethylenediamine dihydrochloride = 1 : 1, v/v) 100 μL를 혼합하여 상온에서 10분 동안 반응시킨 후, ELISA reader를 이용하여 540 nm에서 흡광도를 측정하였고, sodium nitrite로 표준곡선을 작성하여 NO 함량을 산출하였다(Lee SJ 등 2012).
7. 통계처리
본 실험을 통해 얻은 결과들은 SPSS(version 20) program으로 t-test 및 분산분석(ANOVA, analysis of variance)을 이용하여 분석하였으며, 각 시료들 간의 유의성 검증은 Duncan's multiple range test를 이용하여 실시하였다.
결과 및 고찰
1. 균사체 고체배양
감초에 눈꽃동충하초 균사체를 고체배양한 배양물을 제조하기 위하여 감초에 눈꽃동충하초 균사체 액체종균을 균질화하여 접종한 후 배양한 결과, 3∼4일이 경과 시부터 균사의 생장을 육안으로 확인할 수 있었으며, 백색을 띄는 눈꽃 동충하초 균사체가 감초를 덮으며 정상적으로 고체배양되는 것을 확인할 수 있었다(Fig. 1).
2. 항균 활성
식중독 관련 균주에 대한 감초 에탄올 추출물(GR)과 감초와 눈꽃동충하초 균사체 배양물의 에탄올 추출물(GRPM)의 항균 활성을 paper disc법으로 측정하여 생육저해환의 크기를 비교한 결과는 Table 2와 같다. GR 및 GRPM은 그람 음성균인 E. coli, P. aeruginosa, S. typhimurium에 대한 항균 활성을 보이지 않았으며, 그람 양성균인 B. cereus, L. monocytogenes, S. aureus에 대해 항균 활성을 나타내었고 이들의 항균활성은 추출물의 농도가 증가할수록 증가하는 것으로 나타났다. Kim SJ 등(2006)은 감초 에탄올 추출물이 S. aureus, L. monocytogenes 등 여러 그람 양성균에 대해 항균성이 높다고 보고하였는데, 이는 본 연구에서 GR 및 GRPM이 그람 양성균에 대해 항균 활성을 보인 결과와 일치하는 것이었다. 특히 실험한 농도에서 S. aureus에 대한 GR과 GRPM의 항균 활성은 다른 미생물에 비해 전반적으로 높게 나타났다. 한편, GR과 GRPM 항균 활성사이의 유의성을 검증한 결과, B. cereus와 L. monocytogenes의 경우 추출물의 농도가 2,000, 4,000 μg/disc일 때, GRPM이 GR에 비해 유의적으로 높은 항균 활성을 가지는 것으로 나타났다. 특히 L. monocytogenes 에 대하여 4,000 μg/disc의 농도에서 GRPM은 17.33 mm의 매우 큰 생육저해환을 보여 가장 큰 유의적 차이를 나타내었다(p<0.01). 9종의 버섯균사체를 이용하여 항균활성을 연구한 Kim MC 등 (2006)의 연구에서 일반 배지로 배양한 버섯균사체 추출물에 비해 감귤농축액을 첨가한 배지로 배양한 추출물의 항균 활성이 더 높았다고 보고하였고, Kim T(2009)의 연구에서도 감귤농축액으로 배양한 구름버섯균사체 배양 추출물이 P. aeruginosa CCARM2171과 S. aureus CCARM3230 균주에 현저한 항균활성을 나타내었다고 하였다. 또한 Lee EJ 등(2013)의 연구에서도 꽃송이 버섯 균사체를 순물을 이용하여 배양할 때 항균 활성이 높아졌으며, 이는 균사 증식 시 2차 대사산물인 항균 물질이 활발하게 생산되었기 때문으로 추측하였다. 본 연구에서도 감초와 눈꽃동충하초 균사체를 함께 배양하였을 때 항균 활성이 증가하는 것으로 나타났는데, 관련 선행 연구들을 볼 때 균사체 배양과정에서 항균 활성을 가진 물질들이 생성되거나 증가되는 것으로 보여, 향후 균사체 배양 시 항균 활성 성분 변화에 대한 후속 연구가 필요할 것으로 생각된다.
Paper disc법을 통해 GR과 GRPM의 항균 활성을 확인한 후, 이들 균주에 대한 최소생육저해농도(MIC)를 측정한 결과는 Table 3과 같다. GR과 GRPM은 모두 앞서 실험한 paper disc법의 결과와 일치하게 그람 음성균인 E. coli, P. aeruginosa, S. typhimurium에서는 MIC가 1,000 ppm 이상으로 나타났으며, 그람 양성균인 B. cereus, L. monocytogenes, S. aureus에 대해서는 200 ppm 이하로 나타났다. Kim HJ 등(2013)의 연구에서도 중국산 감초 에탄올 추출물의 MIC는 그람 양성균인 B. subtilis와 P. acnes에 대해 각각 625 μg/mL, 10,000 μg/mL으로 나타났으나, 그람 음성균인 E. coli와 P. aeruginosa에 대해서는 항균 활성을 나타나지 않았다고 하여 본 연구 결과와 유사한 결과를 보여주었다. GR의 B. cereus에 대한 MIC는 100 ppm이었으며, L. monocytogenes와 S. aureus에 대한 MIC는 200 ppm으로 나타났다. 또한 GRPM의 B. cereus와 L. monocytogenes에 대한 MIC는 100 ppm이었으며, S. aureus에 대한 MIC는 200 ppm으로 나타나 균사체 배양을 거친 GRPM의 L. monocytogenes에 대한 항균 활성이 GR보다 높아진 것을 확인할 수 있었다. 감초 에탄올 추출물에는 항균성을 나타내는 flavanone 화합물의 일종인 liquirtigenin이 함유되어 있다고 보고되었는데(Ahn EY 등 1998), 본 연구에서도 균사체 배양 시 항균 활성이 증가되는 것으로 나타나, 이러한 항균 성분들이 배양 과정을 통해 증가되었을 것으로 생각되었다.
L. monocytogenes에 GR과 GRPM을 처리한 군과 처리하지 않은 군의 세포형태를 주사전자현미경을 이용하여 관찰하였다. Fig. 2에서 보는 바와 같이, 추출물을 처리하지 않은 대조군은 세포가 온전한 단간균의 형태를 보였으며 표면이 매끄럽고 깨끗하였다. 반면, GR과 GRPM을 처리한 균은 대조군에 비해 세포가 수축되고 세포 표면이 손상을 받아 일부 균의 세포벽이 파괴되었으며, 이로 인해 세포 내 물질이 균체외부로 유출된 것이 관찰되었다. 또한 GR을 처리한 균에 비해 GRPM을 처리한 균에서 더 많은 세포 표면의 손상이 일어나 세포가 파괴된 것을 볼 수 있었다. 이러한 세포 형태의 파괴 정도의 차이는 paper disc와 MIC 실험에서 나타난 항균활성 결과와 일치하는 것으로 감초에 눈꽃동충하초 균사체를 배양함으로써 세포 손상이 증가된 것을 확인할 수 있었다. Park SB와 Cho GS(2011)의 연구에서는 은행잎 및 은행 외종피 추출물의 항균 활성 확인 시 L. monocytogenes에 추출물을 처리한 경우 일부 세포벽의 파괴가 관찰되었으며, Jeon YH 등(2012)의 연구에서도 산수유 에탄올 추출물 처리 시 균주의 세포막 파괴와 세포의 성분 유출 등으로 균의 생육이 억제되었다고 보고하였는데, 본 연구에서도 GR과 GRPM 처리 시 동일한 양상이 관찰되어 이들 추출물이 균주의 세포막 손상을 일으켜 세포가 파괴되고 세포 내 성분이 세포 외부로 유출됨으로써 균의 증식 및 생육이 억제된 것으로 사료된다.

Scanning electron micrographic images of L. monocytogenes treated with ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium (×20,000).GR: Ethanol extract from Glycyrrhizae radix, GRPM: Ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium.
3. 항염증 활성
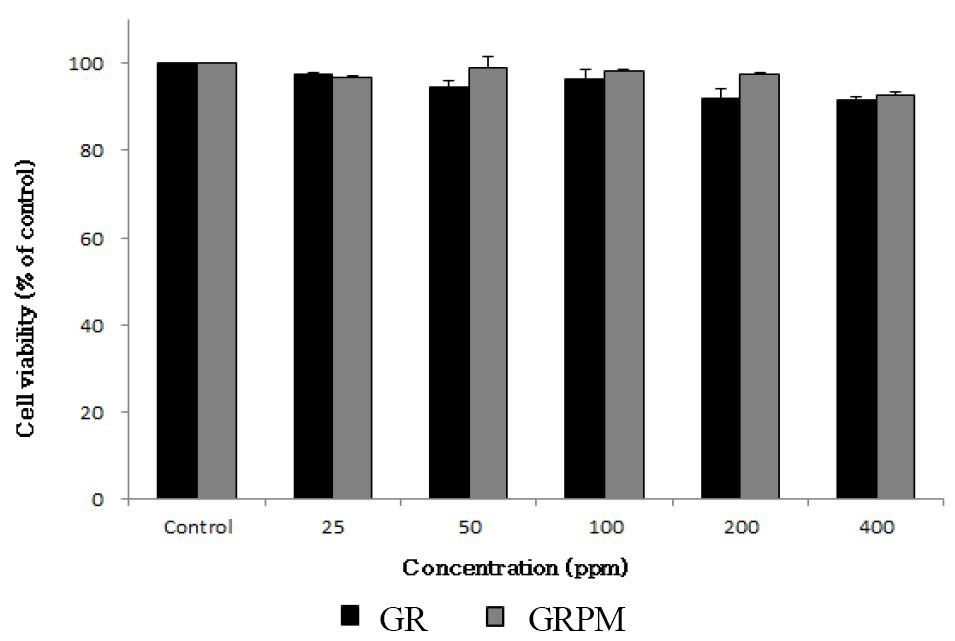
MTT assay를 이용하여 GR과 GRPM에 대한 RAW264.7의 세포 생존율을 확인한 결과는 Fig. 3과 같다. RAW264.7에 시료를 농도별(25, 50, 100, 200, 400 ppm)로 처리한 결과, 모든 농도에서 90% 이상의 생존율을 보여 이들 시료가 모든 실험 농도에서 RAW264.7에 대해 세포 독성을 나타내지 않는 것을 확인하였다. 따라서 RAW264.7에 대해 시료가 세포 독성을 나타내지 않는 농도인 25∼400 ppm의 농도를 처리하여 NO 생성 억제 활성을 측정하였다.
대식세포는 면역체계에서 염증반응과 면역기능을 조절하는 중요한 세포로서, 외부 자극에 의해 활성화되면 활성산소를 생성시켜 사이토카인(cytokine)과 프로스타글란딘 E2(prostaglandin E2), NO(nitric oxide) 등 염증반응인자를 생성하여 염증 반응을 유발한다. 이 중 NO는 반응성이 큰 물질로 과량 생성되면 염증매개체의 생합성을 촉진하여 염증을 심화시킬 수 있다. 그러므로 NO의 양을 측정함으로써 염증성 분자들의 생성을 간접적으로 측정할 수 있다(Kim YS 등 2012). 본 연구에서 1 μg/mL 농도의 LPS를 처리한 RAW264.7에 GR과 GRPM을 처리하여 NO 생성 억제 활성을 측정한 결과는 Fig. 4와 같다. LPS 처리를 통한 NO 생성 유도 결과, NO 함량이 21.92 μM로 LPS를 처리하지 않은 군보다 약 3배 정도 증가함을 확인하였다. 그 후 대식세포에 시료를 농도별(25, 50, 100, 200, 400 ppm)로 처리하였을 때, NO 함량이 GR 처리 시 19.59∼12.14 μM, GRPM 처리 시 15.22∼9.59 μM로 나타났으며, 시료 농도가 증가함에 따라 NO 생성량이 감량이 감소되는 경향을 보였다. 또한 모든 농도에서 GR에 비해 GRPM의 NO 생성 억제 활성이 유의적으로 더 높게 나타났다. Jung IS 등(2007)은 상황버섯 균사체 배양액에 침지한 발아현미 추출물의 NO 생성 저해 활성이 현미 및 발아현미 추출물에 비해 더 높다고 하여, 본 연구 결과와 유사하게 항염증 활성이 균사체가 배양되는 과정에서 증가되었다고 보고 하였다. Bak JP 등(2011)은 RAW264.7에 감초 에탄올 추출물 5 μg/mL 처리 시 NO 생성이 감소된다고 보고하였으며, 감초의 licochalcone E 성분은 항염증 효과를 가진다는 보고 가 있어(Park GM 등 2011), 본 연구에서도 이러한 성분이 항염증 활성에 영향을 주었을 것으로 생각되었으며, 균사체배양 시 감초의 항염증 성분이 더욱 증가되었을 것으로 추정되었다.
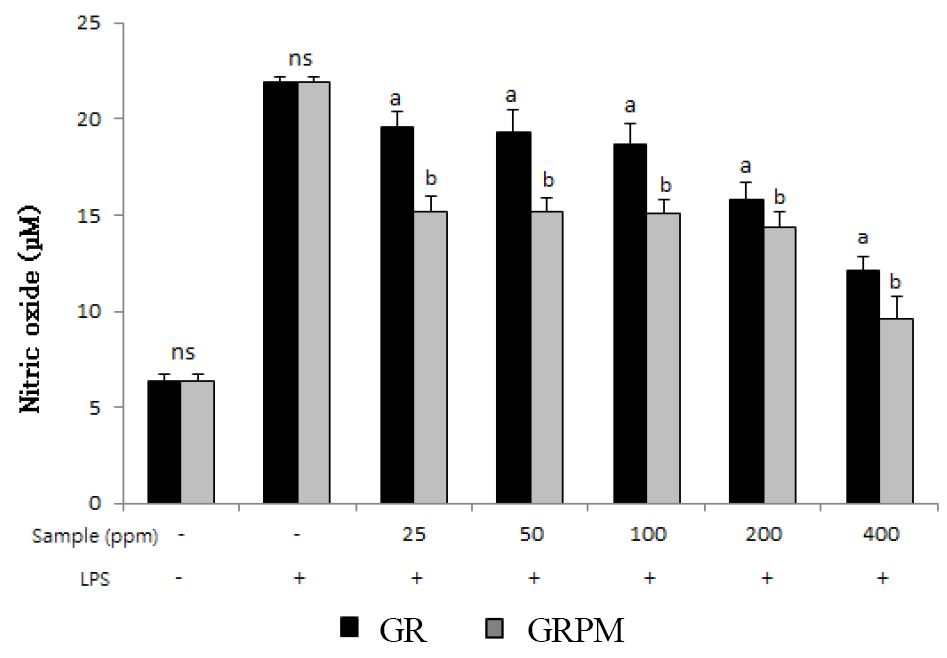
Nitric oxide production in LPS-stimulated RAW 264.7 cells by the treatment of ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium.GR: Ethanol extract from Glycyrrhizae radix, GRPM: Ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium.
요약 및 결론
본 연구에서는 감초 추출물 및 감초에 눈꽃동충하초 균사체를 고체배양한 배양 추출물의 식중독 관련 세균에 대한 항균 활성과 항염증 활성을 살펴보았다. GR 및 GRPM을 식중독과 관련된 6가지 균주에 처리한 결과, 이들은 그람 양성균인 B. cereus와 L. monocytogenes, S. aureus에 항균 활성을 나타내었으며, paper disc법에 의한 생육저해환 측정에서는 B. cereus와 L. monocytogenes에 대해서는 2,000∼4,000 μg/disc의 농도에서, S. aureus에 대해서는 2,000 μg/disc의 농도에서 GRPM의 생육저해환 크기가 GR에 비해 유의적으로 증가하였다. 또한 MIC 측정에서는 GRPM의 L. monocytogenes에 대한 항균 활성이 GR에 비해 증가한 것을 확인할 수 있었다. L. monocytogenes에 GR과 GRPM을 처리한 균과 처리하지 않은 균의 세포 형태를 주사전자현미경으로 관찰한 결과, GR과 GRPM을 처리한 군은 대조군에 비해 세포가 수축되었고 세포 표면이 손상을 받아 일부 세포벽이 파괴되었으며, 이로 인해 균체 외부에 세포 내 성분이 유출된 것이 관찰되었으며, GRPM을 처리한 균에서 더 심한 세포 손상을 볼 수 있었다. 또한 항염증 활성 분석에서는 LPS를 처리한 RAW 264.7 대식세포에 GR과 GRPM을 처리하여 NO 생성 억제 활성을 측정한 결과, 모든 농도에서 GR에 비해 GRPM의 NO생성 억제 활성이 유의적으로 더 높게 나타났다. 이상의 결과를 통해 감초에 눈꽃동충하초 균사체를 고체배양함으로써 본래 감초가 가지는 항균 활성 및 항염증 활성이 증가되는 것이 확인되어, 향후 천연물의 생리활성을 증가시키기 위하여 천연물에 균사체를 배양하는 방법을 활용할 수 있을 것으로 보인다.
References
- Ahn, EY, Shin, DH, Baek, NI, Oh, JA, (1998), Isolation and identification of antimicrobial active substance from Glycyrrhiza uralensis Fisch, Korean J Food Sci Technol, 30, p680-687.
- Bak, JP, Son, JH, Kim, YM, Lee, EY, Leem, KH, Kim, EH, (2011), Suppression of inflammatory macrophage response by Glycyrrhiza urelensis Herbal acupuncture extract, Korean J Acupuncture, 28, p49-58.
- Bauer, AW, Kirby, WMM, Sherris, JC, Turck, M, (1966), Antibiotic susceptibility testing by a standardized single disk method, Am J Clin Pathol, 45, p493-496.
- Carmichael, J, DeGraff, WG, Gazdar, AF, Minna, JD, Mitchell, JB, (1987), Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing, Cancer Res, 47, p936-942.
-
Das, SK, Masuda, M, Sakurai, A, Sakakibara, M, (2010), Medicinal uses of the mushroom Cordyceps militaris: Current state and prospects, Fitoterapia, 81, p961-968.
[https://doi.org/10.1016/j.fitote.2010.07.010]

- Jeon, YH, Park, MH, Kim, MR, (2012), Antibacterial activity of the ethanol extract from Cornus officinalis against some bacteria related to foodborne illness and food spoilage, J East Asian Soc Diet Life, 22, p692-700.
- Jo, WJ, Nam, BH, Oh, SJ, Choi, YJ, Kang, EY, Hong, SH, Lee, SH, Jeong, MH, (2008), Hepatic protective effect and singledose toxicity study of water extract of Cordyceps militaris grown upon protaetia dreujtarsis, Korean J Food Sci Technol, 40, p106-110.
-
Jung, IS, Kim, YJ, Choi, IS, Choi, EY, Shin, SH, Gal, SW, Choi, YJ, (2007), Studies on antioxidant activity and inhibition of nitric oxide synthesis of germinated brown rice soaked in mycelial culture broth of Phellinus linteus, J Life Science, 17, p1141-1146.
[https://doi.org/10.5352/JLS.2007.17.8.1141]

-
Kim, HJ, Bae, JY, Jang, HN, Park, SN, (2013), Comparative study on the antimicrobial activity of Glycyrrhiza uralensis and Glycyrrhiza glabra extracts with various countries of origin as natural antiseptics, Korean J Microbiol Biotechnol, 41, p358-366.
[https://doi.org/10.4014/kjmb.1307.07003]

- Kim, MC, Kim, MJ, Kim, T, Park, GT, Son, HJ, Kim, GY, Choi, WB, Oh, DC, Heo, MS, (2006), Comparison of antibacterial and antioxidant activities of mushroom mycelium culture extracts cultivated in the citrus extracts, Korean J Biotechnol Bioeng, 21, p72-78.
- Kim, SJ, Shin, JY, Park, YM, Chung, KM, Lee, JH, Kweon, DH, (2006), Investigation of antimicrobial activity and stability of ethanol extracts of Licorice root (Glycyrrhiza glabra), Korean J Food Sci Technol, 38, p241-248.
-
Kim, YS, Lee, SJ, Hwang, JW, Kim, EH, Park, PJ, Jeong, JH, (2012), Anti-inflammatory effects of extracts from Ligustrum ovalifolium H. leaves on RAW 264.7 macrophages, J Korean Soc Food Sci Nutr, 41, p1205-1210.
[https://doi.org/10.3746/jkfn.2012.41.9.1205]

- Kim, T, (2009), Bioactivity of Coriolus versicolor mycelium culture extract and culture characteristics of medicinal mushroom mycelia, Ph D Dissertation, Cheju National University, Cheju, p44-49.
- Kwak, DJ, Nam, SY, Lee, DS, (2002), Antibacterial activity of phellodendri cortex on dental caries bacteria Staphylococcus sanguis, J Kor Aca Den Technol, 24, p43-49.
-
Lee, EJ, Kim, JE, Park, MJ, Park, DC, Lee, SP, (2013), Antimicrobial effect of the submerged culture of Sparassis crispa in soybean curd whey, Korean J Food Preserv, 20, p111-120.
[https://doi.org/10.11002/kjfp.2013.20.1.111]

-
Lee, KM, Hong, IP, Nam, SH, Sung, GB, Bae, YH, (2008), The cultural characteristics and antibacterial activities of Cordyceps militaris and Paecilomyces tenuipes, Korean J Appl Entomol, 47, p479-486.
[https://doi.org/10.5656/KSAE.2008.47.4.479]

-
Lee, SJ, Kim, EK, Kim, YS, Hwang, JW, Lee, KH, Choi, DK, Kang, H, Moon, SH, Jeon, BT, Park, PJ, (2012), Purification and characterization of a nitric oxide inhibitory peptide from Ruditapes philippinarum, Food Chem Toxicol, 50, p1660-1666.
[https://doi.org/10.1016/j.fct.2012.02.021]

- Lee, YA, Cho, SM, Kim, JH, Lee, JH, (2001), Hypoglycemic effect of Cordyceps militaris, Kor J Pharmacogn, 32, p327-329.
-
Matsui, S, Matsumoto, H, Sonoda, Y, Ando, K, Aizu-Yokota, E, Sato, T, Kasahara, T, (2004), Glycyrrhizin and related compounds down-regulate production of inflammatory chemokines IL-8 and eotaxin 1 in a human lung fibroblast cell line, Int Immunopharmacol, 4, p1633-1644.
[https://doi.org/10.1016/j.intimp.2004.07.023]

- NCCLS, (1993), Methods for dilution antimicrobial susceptibility test for bacterial that grow aerobically, 3th ed, Approved standard, NCCLS document M7-A3 National Committee for Clinical Laboratory Standards, Vilanova, PA, USA.
- Nho, WN, (2009), Industrial aspect of bioactivity of mushroom and the antimicrobial activity of Plourotus ostereatus, MS Thesis, Konkuk University, Seoul, p1-22.
-
Park, GM, Jun, JG, Kim, JK, (2011), Anti-inflammatory effect of licochalcone E, a constituent of licorice, on lipopolysaccharide- induced inflammatory responses in murine macrophages, J Life Science, 21, p656-663.
[https://doi.org/10.5352/JLS.2011.21.5.656]

-
Park, SB, Cho, GS, (2011), Antimicrobial activity of extracts and fractions of Ginkgo biloba leaves, seed and outer seedcoat, J Korean Soc Food Sci Nutr, 40, p7-13.
[https://doi.org/10.3746/jkfn.2011.40.1.007]

-
Reis, FS, Barros, L, Calhelha, RC, C’iric’, A, Griensven, LJ, Sokovic’, M, Ferreira, IC, (2013), The methanolic extract of Cordyceps militaris (L.) Link fruiting body shows antioxidant, antibacterial, antifungal and antihuman tumor cell lines properties, Food Chem Toxicol, 62, p91-98.
[https://doi.org/10.1016/j.fct.2013.08.033]

- Ryu, JS, (2012), Chemical composition and biological functions of red ginseng (Panax ginseng C. A. Meyer) fermented by Phelinus linteus mycelia, Ph D Dissertation, Dankook University, Yongin, p15-80.
- Shin, YK, Jang, HS, Kim, JS, Ryu, HY, Kim, JK, Kwun, IS, Sohn, HY, (2008), Solid fermentation of medicinal herb using Phellinus baumii mycelium and anti-thrombin and antioxidation activity of its methanol extract, Kor J Microbiol Biotechnol, 36, p201-08.
-
Smith, JE, Rowan, NJ, Sullivan, R, (2002), Medicinal mushrooms: A rapidly developing area of biotechnology for cancer therapy and other bioactivities, Biotechnology Letters, 24, p1839-1845.
[https://doi.org/10.1023/A:1020994628109]

- Sohn, EJ, Kang, DG, Lee, AS, Lee, YM, Yin, MH, Yeum, KB, Noh, SY, Lee, HS, (2003), Antioxidant activities of Glycyrrhizin and its effect on renal expression of Na, K-ATPase in gentamicin-induced acute renal failure rats, Korean J Oriental Physiology & Pathology, 17, p542-548.
-
Wang, Y, Yin, H, Lv, X, Wang, Y, Gao, H, Wanga, M, (2010), Protection of chronic renal failure by a polysaccharide from Cordyceps sinensis, Fitoterapia, 81, p397-402.
[https://doi.org/10.1016/j.fitote.2009.11.008]

-
Wasser, SP, Weis, AL, (1999), Medicinal properties of substances occurring in higher basidiomycere mushrooms: current perspectives (Review), Int J Med Mushrooms, 1, p31-62.
[https://doi.org/10.1615/IntJMedMushrooms.v1.i1.30]

-
Wasser, SP, (2002), Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides, Appl Microbiol Biotechnol, 60, p258-274.
[https://doi.org/10.1007/s00253-002-1076-7]

-
Wolkerstorfer, A, Kurz, H, Bachhofner, N, Szolar, OHJ, (2009), Glycyrrhizin inhibits influenza A virus uptake into the cell, Antiviral Res, 83, p171-178.
[https://doi.org/10.1016/j.antiviral.2009.04.012]