생강(Zingiber officinale Roscoe) 추출물의 항산화 및 A2058 흑색종세포 사멸 효과
Abstract
This study investigated the effects of ginger (Zingiber officinale Roscoe) on antioxidant and antiproliferative activities in A2058 human melanoma cells. The antioxidant and antiproliferative activities of 70% ethanol extracts of Zingiber officinale Roscoe were identified based on DPPH and ABTS free radical scavenging capacities. Treatment of cells with Zingiber officinale Roscoe at concentrations of 0, 0.2, and 0.4 mg/mL for 24 hours significantly reduced cell viability as determined by Hoechst 33258 nuclear staining, apoptosis analysis, and Western blotting analysis, respectively. In our study, 70% ethanol extracts of Zingiber officinale Roscoe exhibited antioxidant activity and inhibited A2058 cell growth in a dose-dependent manner. Concomitant activation of the mitochondria-dependent apoptotic pathway of A2058 human melanoma cells by Zingiber officinale Roscoe extracts was mediated via modulation of Bax and Bcl-2 expression, which activated cleavage of caspases-3, caspases-9, and poly ADP-ribose polymerase. The findings of study indicate that Zingiber officinale Roscoe extracts induce apoptosis in A2058 human melanoma cells, and this phenomenon occurs via the death receptor-mediated and intrinsic pathways.
Keywords:
Zingiber officinale Roscoe, ginger, antioxidant, apoptosis, A2058, melanoma cells서 론
생강(Zingiber officinale Roscoe)은 생강과(Zingiberaceae)에 속하는 다년생 초본(草本)으로 열대 아시아가 원산지이며, 아시아, 아프리카, 아메리카 등 대부분의 지역에서 재배되고 있다(Kim JS 등 1991; Kim WJ & Choi HS 2006). 땅 속에서 성장하는 덩이줄기는 어두운 노란색부터 황색 또는 붉은색의 다육질이며, 향신료로 세계적으로 널리 사용되고 있으며(Chung YK 등 2012), 특유의 자극적인 향은 주성분인 gingerol, shogaol, zingerone 등에 기인되며, 이 외에도 flavonoids, terpenoids 등 다양한 생리활성 화합물이 존재하는 것으로 보고되고 있다(Yoshikawa M 등 1993; Nakazawa T & Ohsawa K 2002; Ryu MJ & Chung HS 2015). 생강의 주요 약리작용으로는 항균, 항산화, 항암, 항염, 구토, 변비, 고혈압, 설사, 발열, 치매 등에 효과가 있다고 알려져 있다(Chang WS 등 1994; Sheo HJ 1999; Thomson M 등 2002; Shukla Y & Singh M 2007; Stoilova I 등 2007; Ali BH 등 2008; Butt MS & Sultan MT 2011; Bae JS & Kim TH 2011; Lee EJ 등 2011; Karna P 등 2012).
악성 흑색종(human melanona cells)은 최근 들어 급격히 발생률이 증가하고 있으며, 피부암 중에 가장 악성도가 높은 암 종으로, 색소를 만드는 세포가 악성변화를 일으키는 질환으로, 인체 부위 중 주로 등 윗부분이나 팔, 다리에서 발견되는데, 연령과 피부 특성이 악성 흑색종 발생에 크게 영향을 미치는 것으로 알려져 있다(Hoang MT & Eichenfield LF 2000). 악성 흑색종은 초기에 진단되면 수술에 의해 치료가 가능하지만, 증세가 진행되거나 재발한 경우 특별한 치료법이 없을 뿐 아니라, 다른 기관으로 전이가 높은 난치성 질환이다(Markovic SN 2007; Siegel R 등 2012). 이들 종양세포는 화학요법 시 강한 독성과 약물에 대한 내성이 강하므로(Chen J 등 2008), 약물 치료 시 부작용으로 인한 폐단을 감소시킬 뿐 아니라, 암세포 사멸 효능을 증진시킬 수 있는 천연 소재발굴에 관한 연구가 꾸준히 이루어지고 있다(Kang HS 등 2012; Guon TE & Chung HS 2014a; Guon TE & Chung HS 2014b; Guon TE & Chung HS 2016).
이에 따라 본 연구는 인체 암세포 증식을 저해시키는 기능성 천연 소재 발굴을 목적으로, 생강 추출물의 항산화 효과와 A2058 인체 악성 흑생종세포 증식억제 및 사멸효과를 확인하였다. 또한 Flow cytometry, Western blotting 실험을 통해 A2058 세포사멸과 관련된 기전을 규명하였으며, 인체 흑색종세포 성장억제 소재로서의 생강의 활용 가능성을 관찰하였다.
재료 및 방법
1. 시약 및 배지
실험에 사용된 배지 DMEM과 fetal bovin serum(FBS), penicillin-streptomycin(PS), Trypsin-EDTA는 GIBCO BRL(Gibco, Grand Island, NY, USA) 제품을 사용하였다. DMSO, 2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,2-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT), phosphate buffered saline(PBS), Folin-Ciocalteu’ phenol reagent, gallic acid 시약은 Sigma사(Sigma Chemical Co., St. Louis, MO, USA) 제품을 사용하였고, 1차 antibody인 Bcl-2, Bax, caspase-9, caspase-3, poly ADP-ribose polymerase(PARP) 항체와 2차 antibody인 goat anti-rabbit IgG-HRP, goat anti-mouse IgG-HRP, rabbit anti-goat는 Santa Cruz사(Santa Cruz Biotechnol. Inc., Santa Cruz, CA, USA)에서 구입하였다.
2. 시료 준비
생강은 2012년 5월 서울 양재동 소재 농협 하나로 마트에서 구매하여 사용하였다. 깨끗이 씻은 생강을 껍질을 벗기지 않은 상태로 상온에서 2일 동안 건조시킨 후, 잘게 썰은 건조물 10 g을 70% ethanol로 80℃ water bath에서 1시간 추출하고, 이 과정을 3회 반복하였다. 추출액은 여과지(Whatman No. 1, Whatman International Ltd, Maidstone, UK)로 여과한 뒤, 여과된 추출액을 60℃ 열수에서 감압농축기(N-1000S-W, Eyela, Tokyo, Japan)로 농축 후 동결 건조하였다. 동결 건조된 분말시료의 무게를 측정한 후(수득량: 1.5635 g), 실험할 때까지 -20℃ 냉동고에 저장하였으며, 100% 3차 증류수에 전부 용해시킨 후 실험 시 적합한 농도로 제조하여 사용하였다.
3. 총 폴리페놀 화합물 함량 측정
총 폴리페놀 화합물 함량은 phosphomolybdic acid와 반응하여청색을나타내는 원리를이용한 Folin-Denis 방법(Florence CRF 등 1992)으로 측정하였다. 10 mg/mL 농도로 methanol에 용해시킨 시료 50 μL에 Folin-Ciocalteu’ phenol reagent 50 μL를 첨가하여 혼합한 후 3분간 실온에서 반응시킨 뒤, 10% sodium carbonate 용액 150 μL를 가하여 암실에서 1시간 방치 후 ELISA reader(SpectraMax Molecular Devices, LLC, CA, USA)로 760 nm에서 흡광도를 측정하였다. 표준품인 gallic acid를 이용하여 검량선을 작성하였고, 총 폴리페놀 함량은 건조 시료 중량 당 mg gallic acid equivalent(GAE/g dry weight, DW)로 나타내었다.
4. 항산화력 측정
항산화 활성은 1,1-diphenyl-2-picrylhydrazyl(DPPH)를 사용하여 시료의 라디칼 소거효과를 측정하는 DPPH법(Blois MS 1958)을 활용하였다. 시료 추출물 100 μL를 가하고 실온에서 30분간 반응시킨 후 ELISA reader로 515 nm에서 흡광도를 측정하였다. 측정된 흡광도를 아래의 식에 대입하여 라디칼 소거활성을 계산하고, 추출물을 첨가하지 않은 실험 대조군 값보다 50%의 활성을 보이는 추출물의 농도(half maximal effective concentration, EC50, mg/mL)로 표시하였다.
(A: sample + 시약, B: sample, C: blank + 시약, D: blank)
ABTS 라디칼 소거활성은 Fellegrini N 등(1999)의 방법으로 측정하였다. 즉, 7 mM ABTS와 2.45 mM K2S2O8을 섞어 어두운 곳에서 16시간 방치시킨 후, 이를 absolute ethanol로 희석하여 ELISA reader로 734 nm에서 흡광도를 측정하였다. 이때 대조군의 흡광도 값이 0.7±0.002가 되도록 조절한 ABTS solution을 사용하였다. 측정된 흡광도를 아래의 식에 대입하여 라디칼 소거활성을 계산하고, 추출물을 첨가하지 않은 대조군 값보다 50%의 활성을 보이는 추출물의 농도(EC50, mg/mL)로 표시하였다.
(A: sample + 시약, B: sample, C: blank + 시약, D: blank)
5. A2058 세포배양 및 세포증식 실험(MTT Assay)
인체 melanoma 세포주인 A2058 세포는 American Type Culture Collection(ATCC, USA)으로부터 제공받았으며, 분주 받은 세포주를 10% heat-inactivated FBS와 1% penicillin streptomycin을 첨가한 DMEM 배지를 사용하여 5% CO2를 함유한 37℃ 배양기(MCO-15AC, Sanyo Electric Co. Ltd, Osaka, Japan)에서 키우고, 2주 이상 계대 배양하여 배양환경에 충분히 적응시킨 후 세포밀도가 70∼80% 정도로 포화되면 0.05% Trypsin-EDTA 용액으로 계대 배양하면서 실험에 사용하였다. 세포증식은 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide(MTT) assay로 측정하였으며, A2058 세포를 96 well plates에 1.5×104로 분주하여 24시간 배양한 후에 MTT 시약을 2.0 mg/mL 농도로 50 μL를 각 well에 처리하여 37℃에서 4시간 반응시킨 후 배지를 제거하고, DMSO를 첨가하여 형성된 formazan 크리스탈을 용해시켜 ELISA reader로 540 nm에서 흡광도를 측정하였다. 세포의 증식률은 시료의 흡광도를 대조군의 흡광도에 대한 백분율로 나타내었다(Guon TE & Chung HS 2014a).
6. Hoechst 33258 염색
A2058 세포를 6 well plates에 3×105 cells/mL로 분주하여 24시간 배양 후 시료를 처리하였다. 배지를 제거하고 PBS로 2회 세포 단층을 씻어낸 후 methanol로 실온에서 30분 동안 세포를 고정하고, PBS로 2회 세척하였다. Hoechst 33258 최종 농도가 2 μg/mL가 되도록 PBS에 희석하여 세포에 첨가하고, 15분 동안 어두운 곳에서 염색한 후 형광 현미경(Model BX51, Olympus Optical Co., Tokyo, Japan)으로 관찰하였다(Guon TE & Chung HS 2014b).
7. Flourescence Activated Cell Sorting(FACS) 실험
A2058 세포의 apoptosis 비율을 측정하기 위해 flow cytometry 실험을 수행하였다. A2058 세포를 6 well plates에 1×106 cells/mL로 분주하여 24시간 배양한 후 시료 추출물을 첨가하였다. 세포 단층을 PBS로 2회 씻어낸 후 trysin-EDTA로 처리하여 2,000 rpm에서 10분간 원심분리하고, 세포들을 수집한 후 Annexin V와 Propidium Iodide로 염색한 후, Flow cytometry(BD Biosciences, NJ, USA)를 사용하여 apoptotic cell 수를 측정하였다.
8. 단백질 발현 실험(Western Blotting Analysis)
A2058 세포사멸과 세포증식에 반응하는 단백질 발현을 Western blotting analysis로 확인하였다. A2058 세포를 1×106 cells/mL로 6 well plates에 분주하고, 생강을 농도별로 첨가하여 24시간 배양한 후 세포를 모았다. 세포를 모을 때에는 차가운 PBS로 세척한 후 cell을 모아 2,000 rpm에서 10분간 원심분리 후, protein lysis buffer를 넣어 세포를 파괴하고, 4℃, 13,000 rpm에서 5분간 원심분리 후 상층액을 모아 시료로 사용하였다. 이어서 단백질 정량 후 12% SDS-PAGE에서 동량의 단백질을 loading하여 2시간 동안 단백질을 분리한 후, nitrocellulose membrane에 옮겼다. 단백질이 옮겨진 membrane에 1% BSA로 blocking한 후, 1차 antibody인 Bcl-2, Bax, cleaved caspase-3, cleaved caspase-9, cleaved PARP를 4℃에서 overnight으로 반응시켰다. 이어서 Tris-buffered saline containing 0.1% Tween-20(TBST)로 세척 후, 다시 2차 goat antirabbit IgG-HRP, goat anti-mouse IgG-HRP, rabbit anti-goat로 1시간 동안 반응시켜 TBST로 씻어낸 후, Western Bright ECL solution으로 확인하였다.
9. 통계처리
실험 결과는 SPSS Statistics Ver. 22.0(Statistical Package for Social Sciences, SPSS Inc., IL, USA) 통계 프로그램을 이용하여 각 실험군의 평균과 표준편차로 계산하고, p<0.05 수준에서 일원분산분석(one-way ANOVA)를 수행한 후 대조군과 처리군 간의 유의성을 검증하였다.
결과 및 고찰
1. 시료의 총 폴리페놀 함량
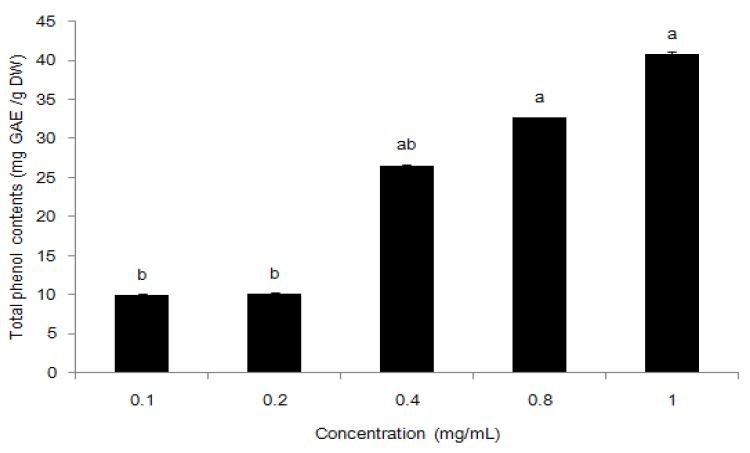
천연에 널리 분포되어 있는 폴리페놀 화합물은 두 개 이상의 phenolic hydroxyl기를 가지고 있는 방향족 화합물로 항산화, 항암, 항염 등의 효과가 우수한 것으로 보고되고 있다(Yu 등 2006). 생강 추출물의 총 폴리페놀 함량은 시료 농도 0.1 mg/mL에서 2.8 mg, 0.4 mg/mL에서 11.6 mg, 0.8 mg/ mL에서 13.1 mg, 1.0 mg/mL에서 18.9 mg으로 나타나, 생강 추출물 농도가 증가할수록 총 폴리페놀 함량이 증가하는 것으로 확인되었다(Fig. 1).
2. 시료에 의한 DPPH, ABTS 라디칼 소거활성
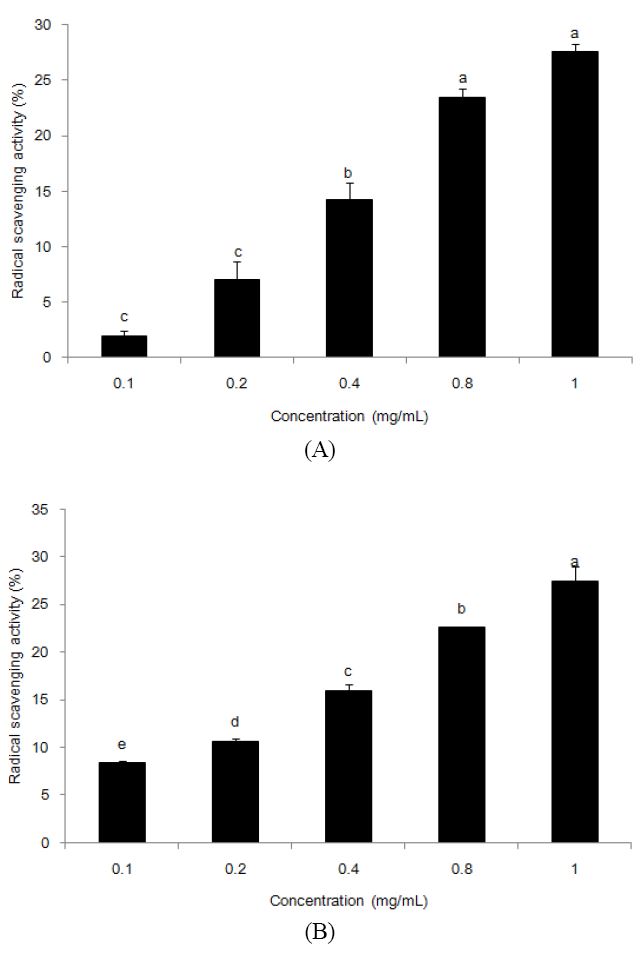
DPPH는 짙은 보라색을 띠는 비교적 안정한 free radical로 항산화 활성을 갖는 물질로부터 전자 혹은 수소를 제공받으면 환원되면서 노란색으로 탈색되어 항산화능 측정에 많이 이용되고 있다(Kim 등 2006). DPPH 라디칼 소거활성은 생강 추출물 0.1 mg/mL 농도에서 1.9%, 0.2 mg/mL에서 7.0%, 0.8 mg/mL에서 23.5%, 그리고 최대 농도인 1.0 mg/mL에서 27.5%로 시료 농도에 의존적으로 증가하였다(Fig. 2A). ABTS는 시료에 의해 특유의 청록색이 탈색되는 정도를 라디칼 소거능으로 나타내 항산화성을 측정하는 원리를 이용한 방법으로(Wang MF 등 1998), 시료 농도가 0.1 mg/mL에서 8.4%, 0.2 mg/mL와 0.4 mg/mL에서 각각 10.6%와 22.6%, 그리고 최종 농도인 1.0 mg/mL에서 27.5%로 라디칼 소거능이 증가하였다(Fig. 2B).
3. 시료에 의한 A2058 세포 증식억제
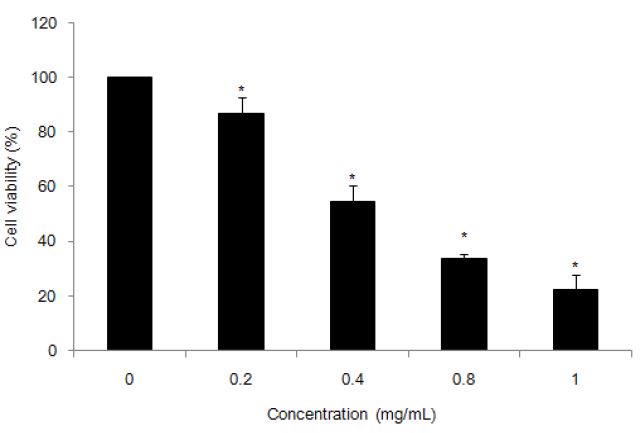
본 연구에서 A2058 세포에 생강 추출물을 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg/mL 농도로 처리하고, 24시간 뒤 MTT 시약을 첨가하여 흡광도를 측정하였다. 실험 결과, A2058 세포 생존율이 각각 86.9%, 54.6%, 44.6%, 33.5% 및 22.0%로 시료 농도가 증가할수록 유의적으로 감소하였다(Fig. 3). 특히, 시료농도가 낮은 경우에도 A2058 세포증식이 유의적으로 억제하는 것을 확인할 수 있었다. 따라서 A2058 세포의 증식 억제에 있어서 생강 추출물이 농도 의존적으로 작용함을 관찰하였다. 이상의 결과를 근거로 하여 추후 진행되는 Hoechst 33258, Facs, Western blot 실험의 시료농도는 0, 0.2, 0.4 mg/mL로 설정하였다.
4. 시료에 의한 A2058 세포핵의 형태 변화
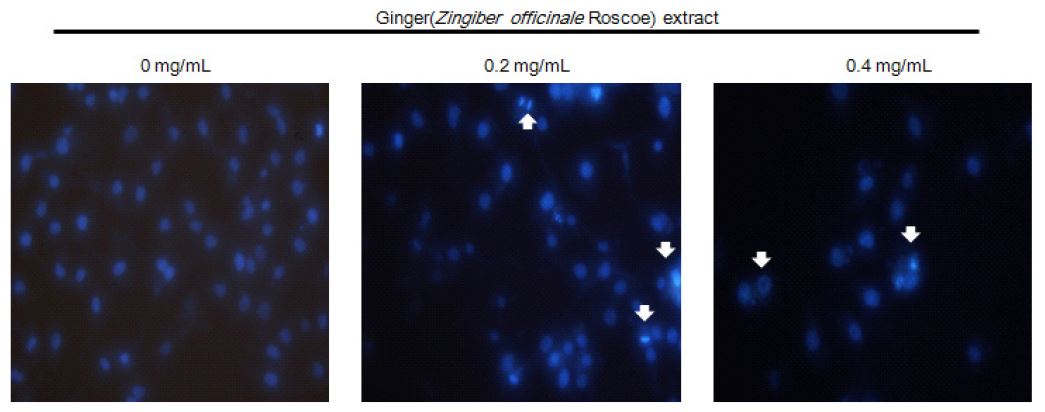
A2058 세포에 생강 추출물을 처리하였을 때 세포 생존율이 억제되는 것을 확인한 후, A2058 세포의 형태학적 변화를 관찰하였다. 시료를 처리하지 않은 대조군의 경우, A2058 세포가 안정적으로 부착되어 정상적으로 증식이 이루어진 모습이 관찰되었다. 하지만 생강 추출물을 처리한 경우, 농도가 증가할수록 세포증식이 감소하였고, 배양액에 부유한 모습이 관찰되었다. 또한 시료 농도가 0.2 mg/mL로 부터 세포 형태가 변하기 시작하였으며, 0.4 mg/mL 농도에서는 세포의 응축현상을 확인할 수 있었다(Fig. 4). Coiocaru SI 등(2015)은 생강추출물을 농도별로 처리하였을 때, 무색소성 흑색종 세포의 형태가 수축되고, 세포막이 변화되었으며, 시료 농도와 비례적으로 세포수가 감소하였다고 보고한 바 있으며, 본 실험에서도 세포의 형태변화 등 동일한 실험결과가 관찰되었다.
5. 시료에 의한 A2058 세포사멸 유도
생강 추출물에 의해 A2058 세포의 증식이 억제되는 현상이 apoptosis에 기인하는 것인지 또는 necrosis에 기인하는 것인지를 확인하기 위해 phosphatidyl serine(PS)에 특이적으로 결합하는 Annexin V와 popidium iodidie(PI)로 이중 염색하고, Flow cytometery로 정량분석을 수행하였다. 실험 결과, 생강추출물을 처리하지 않은 대조군 세포에서는 total apoptosis가 10.2% 발현되었으며, 시료를 0.2 mg/mL 첨가한 경우의 total apoptosis는 33.8%, 0.4 mg/mL 시료농도에서는 59.7 %로 나타나, 생강 추출물 농도에 비례적으로 A2058 세포사멸이 일어나는 것이 확인되었다(Fig. 5). Akimoto M 등(2015)은 췌장암 세포의 total apoptosis가 생강 추출물 0.1 mg/mL과 0.2 mg/mL 처리 시 각각 24.3%와 31.0% 발생한다고 보고한 바 있으며, 이번 연구에서도 시료 농도가 증가함에 따라 A2058 세포의 total apoptosis가 증가하였으며, 세포사멸 효과가 있음을 확인하였다.
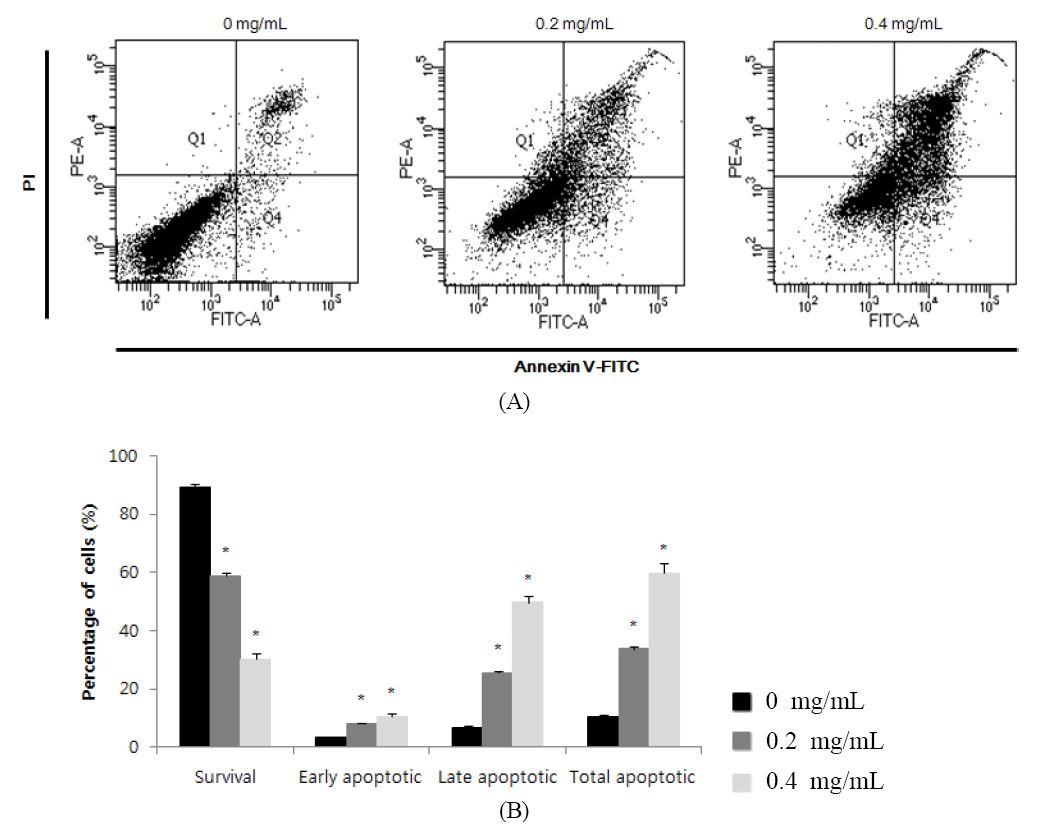
Induction of apoptosis by ginger (Zingiber officinale Roscoe) extracts in A2058 human melanoma cells.(A) Flow cytometric analysis of A2058 human melanoma cells incubated for 24 h. The right bottom quadrant represents Annexin Vstained cells (early-phase apoptotic cells). The top right quadrant represents PI- and Annexin V-stained cells(late-phase apoptotic cells).(B) Statistical analysis of apoptosis. * p<0.05, significantly different from control cells.
6. 시료가 A2058 세포사멸에 미치는 영향
A2058 세포의 증식억제가 apoptosis에 의한 현상임을 확인한 후, 세포사멸에 관여하는 주요 인자인 Bcl-2, Bax, caspases의 발현정도를 단백질 수준에서 관찰하기 위해 Western blotting을 수행하였다. 실험 결과, 세포의 사멸을 지연시키거나 억제하는 것으로 알려진 Bcl-2는 생강 추출물의 농도가 증가할수록 발현이 비례적으로 감소하였고, 이와 반대로, cytochrome c의 방출과 세포사멸을 유도하는 Bax의 발현량은 현저하게 증가하는 것이 확인되었다.
또한 A2058 세포사멸에 관여하는 중요 단백질 중 caspases와 PARP의 발현에 작용하는 시료의 영향을 관찰한 결과, 시료 농도가 증가할수록 caspases의 활성형태인 cleaved caspase-3, caspase-9 및 PARP의 발현이 증가하였으며(Fig. 6), 이러한 현상은 A2058 세포사멸이 intrinsic pathway에 의해 시작된다는 것을 제시하고 있다. 이는 미토콘드리아의 막 투과성을 조절하는 Bcl-2 family에 의해 cytochrome c 방출이 증가하면서 apoptosis 현상이 조절(Koesmeyer SJ 등 1993)되기 때문인 것으로 설명될 수 있다. 세포사멸은 death receptor를 매개로 하는 extrinsic pathway와 mitochondria에 의해 유도되는 intrinsic pathway로 구분되는데, 이 중 intrinsic path- way는 apoptosis initiator로 작용하는 caspase-9의 활성과 관련이 있으며(Green DR & Reed JC 1998; Jin Z 등 2005), 이때 caspase-3가 활성화됨으로써 apoptosis의 형태학적 특징에 관여하는 PARP 발현에 영향을 주며(Oliver FJ 등 1998), 생강 추출물이 이러한 반응에 관여하는 것으로 확인되었다.
결론적으로, 이번 실험을 통해 70% ethyl alcohol로 추출한 생강 시료 1.0 mg/mL 농도에서 DPPH, ABTS 유리기 소거능이 가장 우수하였고, A2058 세포 생존율이 0.4 mg/mL농도에서 50% 이상 감소되었다(P<0.05). 따라서 항산화 효과 및 A2058 세포사멸 효과가 우수한 70% ethanol 추출물에 함유된 활성물질 규명을 목적으로, 생강의 주요 성분인 폴리페놀과 volatile oils 등 순수 화합물의 규명이 필요하다.
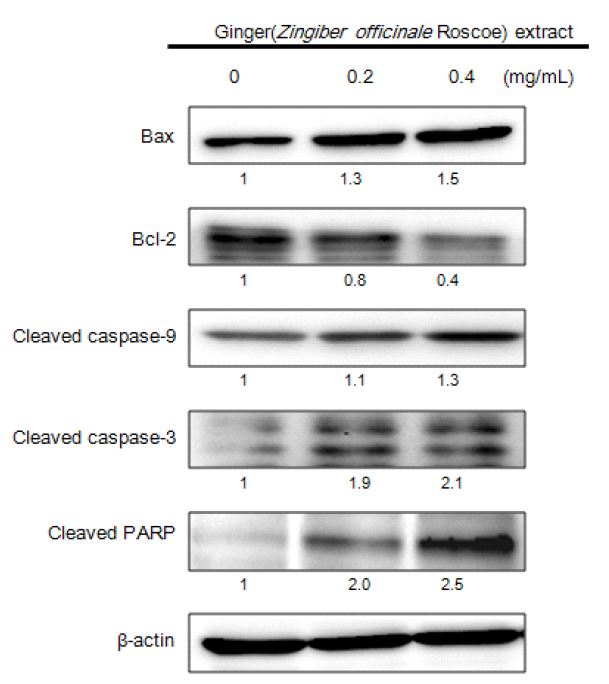
Effects of ginger (Zingiber officinale Roscoe) extracts on expression of apoptosis-related proteins in A2058 human melanoma cells.Cell lysates were electrophoresed and Bax, Bcl-2, cleaved caspase- 9, cleaved caspase-3, and cleaved PARP were detected by Western blot analysis with the corresponding antibodies.
결론 및 요약
본 연구는 천연소재로부터 생리활성이 우수한 신규 기능성 소재 발굴을 목적으로, 국내산 생강 70% ethyl alcohol 추출물의 총 폴리페놀 함량, 항산화 활성 및 A2058 악성 흑색종 세포 증식 억제효과를 확인하였다.
생강 추출물의 총 폴리페놀은 18.89 mg GAE/g 함유되었으며, DPPH 라디칼 소거능과 ABTS 라디칼 소거 활성은 1.0 mg/mL 농도에서 27.45%로 높은 항산화 수치를 나타내었다. 또한 악성 흑색종 세포인 A2058 세포에 생강 추출물을 0.2, 0.4, 0.8, 1.0 mg/mL 농도로 처리하여 세포 증식을 확인한 결과, A2058 세포 생존율이 각각 86.9%, 54.6%, 33.5% 및 22.0%로 시료 농도가 증가할수록 A2058 세포사멸이 증가하는 것이 확인되었다. 뿐만 아니라, 시료 농도가 증가할수록 A2058 세포의 apoptotic body 등 형태학적 변화가 관찰되었으며, apoptosis에 의해 사멸되는 A2058 세포의 비율이 증가하는 것으로 확인되었다.
이어서 A2058 흑색종세포에 반응하는 apoptosis 조절인자들의 영향을 확인하기 위해 관련된 단백질의 발현을 관찰하였다. Anti-apoptotic 단백질인 Bcl-2는 시료 농도가 증가할수록 감소하였고, pro-apoptotic 단백질인 Bax는 시료 농도에 의존적으로 증가하였다. 이는 미토콘드리아 막 투과성을 조절하는 Bcl-2 family에 의해 cytochrome c의 방출이 증가하면서 apoptosis가 조절되는 것으로 추정할 수 있다. 또한 cleaved caspase-3, cleaved caspase-9와 cleaved PARP 발현도 증가하여 mitochondria에 의해 유도되는 intrinsic pathway를 통해 A2058 세포사멸이 유발되는 것으로 확인되었다.
본 연구결과는 기능성 천연소재 발굴을 위한 기초자료로 사용될 수 있으며, 활성물질 규명과 동물실험 등의 추가적인 연구가 필요할 것으로 사료된다.
References
-
Akimoto, M, Iizuka, M, Kanematsu, R, Yoshida, M, Takenaga, K, (2015), Anticancer effect of ginger extract against pancreatic cancer cells mainly through reactive oxygen speciesmediated autotic cell death, PLoS ONE, 10, pe0126605.
[https://doi.org/10.1371/journal.pone.0126605]

-
Ali, BH, Blunden, G, Tanira, MO, Nemmar, A, (2008), Some phytochemical, pharmacological and toxicological properties of ginger(Zingiber officinale Roscoe): A review of recent research, Food Chem Toxicol, 46, p409-420.
[https://doi.org/10.1016/j.fct.2007.09.085]

-
Bae, JS, Kim, TH, (2011), Pancreatic lipase inhibitory and antioxidant activities of Zingiber officinale extracts, Kor J Food Preserv, 18, p390-396.
[https://doi.org/10.11002/kjfp.2011.18.3.390]

-
Blois, MS, (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Butt, MS, Sultan, MT, (2011), Ginger and its health claims: molecular aspects, Crit Rev Food Sci Nutr, 51, p383-393.
[https://doi.org/10.1080/10408391003624848]

- Chang, WS, Chang, YH, Lu, FJ, Chiang, HC, (1994), Inhibitory effects of phenolics on xanthine, Anticancer Res, 14, p501-506.
-
Chen, J, He, X, Peng, H, Yang, XO, (2008), Research on the antitumor effect of ginsenoside Rg3 in B16 melanoma cells, Melanoma Res, 18, p322-329.
[https://doi.org/10.1097/CMR.0b013e32830b3536]

-
Chung, YK, Lee, JJ, Lee, HJ, (2012), Rheological properties of pound cake with ginger powder, Kor J Food Preserv, 19, p361-336.
[https://doi.org/10.11002/kjfp.2012.19.3.361]

- Coiocaru, SI, Stan, M, Stoian, G, Dinischiotu, A, (2015), Effects of Zingiber officinale Roscoe fresh extract on amelanotic melnoma and normal skin fibroblasts, Rev Med Chir Soc Med Nat Iasi, 119, p592-596.
-
Fellegrini, N, Ke, R, Yang, M, Rice-Evans, C, (1999), Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2'-azinobis(3-ethylbenzothiazoline- 6-sulfonic acid) radical cation decolorization assay, Method Enzymol, 299, p379-389.
[https://doi.org/10.1016/S0076-6879(99)99037-7]

-
Florence, CRF, Pascale, MG, Jacques, JN, (1992), Cystenine as an inhibitor of enzymatic browing and kinetic studies, J Agric Food Chem, 40, p2108-2113.
[https://doi.org/10.1021/jf00023a014]

-
Green, DR, Reed, JC, (1998), Mitochondria and apoptosis, Sci, 281, p1309-1312.
[https://doi.org/10.1126/science.281.5381.1309]

-
Guon, TE, Chung, HS, (2014a), Effects of Nelumbo nucifera root extract on proliferation and apoptosis in HT-29 human colon cancer cells, J East Asian Soc Diet Life, 24, p20-27.
[https://doi.org/10.17495/easdl.2014.02.24.1.20]

- Guon, TE, Chung, HS, (2014b), Effect of Epimedium koreanum Nakai on apoptosis in HCT116 human colon cancer cells, Food Eng Prog, 18, p2154-2159.
- Guon, TE, Chung, HS, (2016), Hyperoside and rutin of Nelumbo nucifera induce mitochondrial apoptosis through a caspasedependent mechanism in HT-29 human colon cancer cells, Oncol Lett, 11, p2463-2470.
- Hoang, MT, Eichenfield, LF, (2000), The rising incidence of melanoma in children and adolescents, Dermatol Nurs, 121, p192-193.
-
Jin, Z, El-Deiry, WS, (2005), Overview of cell death signaling pathways, Cancer Biol Ther, 4, p139-163.
[https://doi.org/10.4161/cbt.4.2.1508]

-
Kang, HS, Kim, JS, Kim, SJ, Park, HM, (2012), Reactive oxygen species mediated ginsenoside Rg3 and Rh2-induced apoptosis in hepatoma cells through mitochondrial signaling pathways, Food Chem Toxicol, 50, p2736-2741.
[https://doi.org/10.1016/j.fct.2012.05.027]

-
Karna, P, Chagani, S, Gundala, SR, Rida, PCG, Asif, G, Sharma, V, Gupta, MV, Aneja, R, (2012), Benefits of whole ginger extract in prostate cancer, Br J Nutr, 107, p473-484.
[https://doi.org/10.1017/S0007114511003308]

- Kim, JS, Koh, MS, Kim, YH, Kim, MK, Hong, JS, (1991), Volatile flavor components of Korean ginger(Zingiber officinale Roscoe), Kor J Food Sci Technol, 25, p141-149.
- Kim, KB, Yoo, KH, Park, HY, Jeong, JM, (2006), Anti-oxidative activities of commercial edible plant extracts distributed in Korea, J Kor Soc Appl Biol Chem, 49, p328-333.
- Kim, WJ, Choi, HS, (1998), Natural Spices, Hyoilbooks Co., Seoul, Korea, p53-70.
- Koesmeyer, SJ, Shutter, JR, Veis, DJ, Merry, DE, Oltvai, ZN, (1993), Bcl-2/Bax: A rheostat that regulates an anti-oxidant pathway and cell death, Seminars in Cancer Biol, 4, p327-332.
-
Lee, EJ, Yang, SA, Choi, HD, Im, HG, Whang, K, Lee, IS, (2011), Comparison of gingerols in various fractions and the antioxidant effects of supercritical fluid extracts from ginger, Kor J Food Sci Technol, 43, p469-474.
[https://doi.org/10.9721/KJFST.2011.43.4.469]

- Markovic, SN1, Erickson, LA, Rao, RD, Weenig, RH, Pockaj, BA, Bardia, A, Vachon, CM, Schild, SE, McWilliams, RR, Hand, JL, Laman, SD, Kottschade, LA, Maples, WJ, Pittelkow, MR, Pulido, JS, Cameron, JD, Creagan, ET, (2007), Melanoma study group of the Mayo Clinic Cancer Center. Malignant melanoma in the 21st century, part 2: staging, prognosis, and treatment, Mayo Clin Proc, 82, p490-513.
-
Nakazawa, T, Ohsawa, K, (2002), Metabolism of [6]-gingerol in rats, Life Sci, 70, p2165-2175.
[https://doi.org/10.1016/S0024-3205(01)01551-X]

-
Oliver, FJ, Rubia, G, Rolli, V, Ruiz-Ruiz, MC, de Murica, G, Murica, JM, (1998), Importance of poly(ADP-ribose) polymerase and its cleavage in apoptosis. Lesson from an uncleavable mutant, J Biol Chem, 273, p33533-33539.
[https://doi.org/10.1074/jbc.273.50.33533]

-
Ryu, MJ, Chung, HS, (2015), [10]-Gingerol induces mitochondrial apoptosis through activation of MAPK pathway in HCT116 human colon cancer cells, In Vitro Cell Dev Biol- Animal, 51, p92-101.
[https://doi.org/10.1007/s11626-014-9806-6]

- Sheo, HJ, (1999), The antibacterial action of garlic, onion, ginger and red pepper juice, J Kor Soc Food Sci Nutr, 28, p94-99.
-
Shukla, Y, Singh, M, (2007), Cancer preventive properties of ginger: a brief review, Food Chem Toxicol, 45, p683-690.
[https://doi.org/10.1016/j.fct.2006.11.002]

-
Siegel, R, Naishadham, D, Jemal, A, (2012), Cancer statistics for Hispanics/Latinos, CA: Cancer J Clin, 62, p283-298.
[https://doi.org/10.3322/caac.21153]

-
Stoilova, I, Krastanov, A, Stoyanova, A, Denev, P, Gargova, S, (2007), Antioxidant activity of a ginger extract(Zingiber officinale), Food Chem, 102, p764-770.
[https://doi.org/10.1016/j.foodchem.2006.06.023]

-
Thomson, M, Al-Qattan, KK, Al-Sawan, SM, Alnageeb, MA, KhanI, Ali, M, (2002), The use of ginger(Zingiber officinale Rosc.) as a potential anti-inflammatory and antithrombotic agent, Prostaglandins, Leukot Essential Fatty Acids, 67, p475-478.
[https://doi.org/10.1054/plef.2002.0441]

-
Wang, MF, Yi, J, Rangarajan, M, Yu, S, LaVoie, EJ, Huang, TC, Ho, CT, (1998), Antioxidative phenolic compounds from sage (Salivia officinalis), J Agric Food Chem, 46, p4869-4873.
[https://doi.org/10.1021/jf980614b]

- Yoshikawa, M, Hatakeyama, S, Chatani, N, Nishino, Y, Yamahara, J, (1993), Qualitative and quantitative analysis of bioactive principles in Zingiberis Rhizoma by means of high performance liquid chromatography and gas liquid chromatography. On the evaluation of Zingiberis Rhizoma and chemical change of constituents during Zingiberis Rhizoma processing, Yakugaku Zasshi, 113, p307-315.
- Yu, MH, Im, HG, Lee, HJ, Ji, YJ, Lee, IS, (2006), Components and their antioxidative activities of methanol extracts from sarcocarp and seed of Zyzypus jujuba var. inermis Rehder, Kor J Food Sci Technol, 38, p128-134.