
머루 과피와 종자 에탄올 추출물의 항산화 활성 및 항돌연변이 활성 분석
Abstract
The antioxidative activity and antimutagenic activity of the ethanol extracts from pericarp and seeds of wild grape (Vitis coignetiea) were analyzed in this study. The antioxidative activity of the extracts from wild grape was determined using 2,2-diphenyl-1-picrylhydrazyl (DPPH) assay and 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) assay. The antimutagenic activity of the extracts was evaluated on Salmonella typhimurium TA98 and TA100 by Ames test using 4-nitroquinoline 1-oxide (4-NQO) and sodium azide as mutagens. In the antioxidative activity determination, IC50 values of the DPPH radical scavenging activity of the extracts from pericarp and seeds were 27.16 ppm and 7.61 ppm, respectively. Additionally, ABTS radical scavenging activities of pericarp and seed extract were 99.75% and 98.87% at 200 ppm, respectively. In the antimutagenic activity determination, pericarp extract at 5 mg/plate inhibited 72.6% and 74.3% of mutagenicity of S. typhimurium TA98 induced by 4-NQO and sodium azaid, respectively. Also, the mutagenicity inhibition rates of seed extract at 5 mg/plate were 77.8% and 74.5% in S. typhimurium TA100 induced by 4-NQO and sodium azaid, respectively. These results demonstrate that the ethanol extract from wild grape has remarkable antioxidant activity and antimutagenicity.
Keywords:
Wild grape, seed, pericarp, antioxidative activity, antimutagenic activity서 론
생체 내 과산화수소(H2O2), 수산화기(OH) 및 superoxide anion(O2-)과 같은 활성 산소종(reactive oxygen species)은 동ㆍ식물이 체내에서 세균, 곰팡이, 바이러스 등이 침입하였을 때 이를 사멸시켜 생체를 방어하는 역할을 하지만, 체내에 이런 활성 산소종이 지나치게 증가할 경우 자기 몸의 조직을 공격할 수 있다(Cheon KB 1999). 활성 산소종은 생체 내 주요 구성 성분인 지질, 단백질, 핵산 등의 성분들을 손상시켜 생체기능을 저하시키고(Ludvisson J 1993; Park CS 2005), 유전자를 공격해 돌연변이나 암을 유발할 수 있으며(Cheon KB 1999), 정상적인 대사를 방해하고 산화적 손상을 입혀 각종 질병과 노화를 촉진시킨다(Beckman KB & Ames BN 1998; Ku KM et al 2009). 항산화 활성을 가진 물질들은 체내에서 free radical의 생성을 억제하거나 소거하여 각종 질병을 예방하고 노화를 억제할 수 있어, 활성 산소종에 의한 산화적 스트레스를 억제하며 생체를 보호할 수 있는 항산화제가 최근 크게 주목받고 있다.
식물에는 플라보노이드와 안토시아닌과 같은 항산화 활성을 가진 성분들이 다양하게 존재하는데, 머루(Vitis coignetiea)는 산포도라고도 불리며, 포도과에 속하는 식물로 사과산, 주석산 등의 유기산과 안토시아닌 등의 색소를 다량 함유하고 있다(Lee DH et al 2004; Choi SY et al 2006a). 또한, 머루에는 칼슘, 인, 철분 등의 무기질 및 비타민 B1, B2, C 등 수용성 비타민도 풍부하게 들어 있다(Bing DJ 2015; Choi SY et al 2006b). 머루 열매는 약용으로 종창, 동상, 이뇨, 두통, 식욕촉진 등을 위해 사용되었으며(Kim NY et al 2006), 뿌리는 염증치료와 항비만 효과(Choi SY et al 2006b)가 있다고 알려져 있다.
그동안 머루에 관해 수행된 연구를 살펴보면 머루주의 품질 특성과 발효조건의 최적화(Kim SH 2008; Kim YS et al 2008; Lee DH et al 2004; Seo JS 2008), 머루를 첨가한 약주의 특성(Choi SH & Kwak EJ 2012), 머루즙과 머루주의 이화학적 분석 및 항산화 효과(Choi SY et al 2006a), 머루를 이용한 스파클링 와인 제조(Bing DJ 2015) 등 머루주에 대한 연구가 주로 수행되었으며, 머루즙을 첨가한 빵의 특성(Lee BY et al 2010), 머루 분말을 첨가한 샐러드드레싱의 품질 특성(Bing DJ et al 2015), 머루 분말로 대체한 쌀 시폰 케이크의 품질(Bing DJ & Chun SS 2015), 머루를 이용한 Sourdough 식빵 개발(Bing DJ et al 2014) 등 머루를 첨가한 식품의 특성에 대한 연구들은 많으나, 아직까지 머루의 과피와 종자의 항산화 활성이나 항돌연변이 활성에 대한 연구는 동종인 포도에 비해 미흡하다. 따라서 본 연구에서는 우리가 주로 섭취하는 과육 외에 머루 과피와 종자의 생리활성을 살펴보고, 기능성 식품의 개발을 위한 기초 자료로 이용하고자, 머루의 과피와 종자 추출물의 DPPH, ABTS radical 소거능 측정을 통한 머루의 항산화 활성을 분석하였으며, Ames test를 이용하여 항돌연변이 활성을 측정하였다.
재료 및 방법
1. 재료 및 시약
본 실험에 사용한 머루는 경북 봉화에서 재배하여 수확한 것을 사용하였다. 2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt, 4-nitroquinoline-1-oxide(4-NQO), dimethylsulfoxide(DMSO), sodium azide는 Sigma Chemical Co.(St. Louis, MO, USA)로부터 구입하였으며, butylated hydroxytoluene(BHT)은 Junsei Chemical Co., Ltd.(Japan)에서 구입하였다.
2. 실험 방법
머루의 과피와 종자를 분리하고, 종자는 45℃에서 하루 동안 건조시킨 후 분쇄하였다. 머루 과피 및 종자 100 g에 0.1 % HCl-60% ethanol(1:1, V/V) 2 L를 각각 가하여 12시간 동안 추출한 후 여과지(Toyo No. 2, Advantec, Japan)로 여과하는 하는 과정을 4회 반복하였다. 여과액을 회전감압농축기(EYELA, Rikakiki Co., Japan)로 농축하고 동결건조한 후, 추출물은 -20℃에서 냉동 보관하여 실험에 사용하였다.
(1) DPPH Radical 소거능 측정
머루 과피 및 종자 추출물의 radical 소거능은 Blois MS (1958)의 방법을 이용하여 측정하였다. 0.1 M sodium acetate buffer(pH 5.5)에 용해한 시료 용액 1 mL와 7.5×10-5 M DPPH 용액 2 mL를 혼합하여 vortex로 교반한 후 37℃에서 30분간 반응시키고, UV/Visible spectrophotometer(Du 800, Beckman, USA)를 사용하여 515 nm에서 흡광도를 측정하였다. 대조군으로는 BHT를 사용하였으며, 3번 반복 실험하였다. 시료의 DPPH radical 소거능은 아래의 식을 이용하여 산출하였으며, IC50 값을 구하였다.
(2) ABTS Radical 소거능 측정
머루 에탄올 추출물의 ABTS radical 소거능은 Re R 등(1999)의 방법을 수정하여 측정하였다. 즉, 증류수에 녹인 7 mM ABTS 용액과 2.45 mM potassium persulfate 용액을 1:1로 혼합하여 12∼16시간 동안 30℃ 암소에서 방치한 후 5 mM potassium phosphate buffer(pH 7.4)로 734 nm에서 흡광도가 0.7∼0.8이 되도록 희석하였다. ABTS 희석용액 4 mL와 0.1 M sodium acetate buffer(pH 5.5)에 용해시킨 시료 40 µL를 혼합한 다음 1분간 반응시킨 후 734 nm에서 흡광도를 측정하였다. 대조군으로는 BHT를 사용하였으며, 3번 반복 실험하였다. 시료의 ABTS radical 소거능을 구하였고, IC50 값도 산출하였다.
한국생명공학연구원 생물자원센터에서 분양받은 Salmonella typhimurium TA98(KTCT 2053), Salmonella typhimurium TA-100(KTCT 2054)를 이용하여 Ames test(Maron MI & Ames BN 1983)를 실시하였으며, 사용 균주들은 주기적으로 deep rough(rfa) 돌연변이, histidine 요구성, R-factor, uvrB 돌연변이의 유전형질을 확인하였다. 돌연변이 유발물질로는 직접돌연변이원인 4-NQO와 sodium azide를 사용하였다. 돌연변이 물질은 dose response 예비실험을 통해 최적 농도를 확인한 후 사용하였다. 또한 추출 시료도 본 실험 전에 mutagenicity test를 실시하여 실험균주에 돌연변이를 일으키지 않는 농도를 확인하여 실험에 적용하였다. 돌연변이 물질인 4-NQO와 sodium azide는 각각 DMSO와 멸균수에 녹여 syringe filter(φ=0.2 μm, Advantec, Japan)를 통과시켜 제균한 후 사용하였다. 항돌연변이 실험을 위해 nutrient broth(NB)에서 12시간 동안 활성화시킨 균 배양액을 NB를 이용하여 600 nm에서 흡광도가 0.3∼0.4가 되도록 희석하였다. 멸균한 cap tube에 돌연변이원 50 µL, 시료 50 µL, 희석된 균배양액 100 µL를 첨가한 다음 0.2 M phosphate buffer(pH 7.0)을 첨가하여 최종부피를 700 µL가 되도록 하였다. 이를 37℃ 항온수조에서 30분 동안 배양한 후 0.5 mM histidine/biotin이 첨가된 top agar를 2 mL 넣고 vortex에서 혼합한 후 minimal glucose agar plate에 도말하였다. Plate는 암실에서 1시간 동안 두어 굳혔으며, 굳힌 plate는 37℃에서 48시간 동안 배양한 후 복귀돌연변이의 colony 수를 측정하였다. 항돌연변이 활성은 아래의 식에 의해 산출하였다.
P : 시료무첨가 복귀돌연변이
S : 시료첨가 복귀돌연변이
N : 자연 복귀돌연변이
3. 통계 분석
모든 실험결과는 SPSS(v. 18.0) 프로그램을 이용하여 통계처리하였다. 실험군 간의 유의성은 분산분석을 실시하고, Duncan's multiple range test(p<0.05)로 검정하였다.
결과 및 고찰
1. 추출물의 항산화 활성
머루 과피 및 종자 추출물의 농도별 radical 소거능을 측정한 결과는 Fig. 1과 같다. 과피와 종자 추출물 모두 추출물의 농도가 증가함에 따라 radical 소거능도 함께 증가하는 것을 볼 수 있었으며, 특히 종자 추출물의 경우 전반적으로 대조군으로 사용된 BHT보다 radical 소거능이 더 높게 나타남을 볼 수 있었다. 10 ppm 이하의 농도에서는 종자 추출물이 과피 추출물보다 높은 radical 소거능을 보였으나, 50 ppm 이상에서는 종자 추출물과 과피 추출물 사이에 유의적인 차이가 나타나지 않았다. 150 ppm 농도에서는 과피 추출물이 88.7 %, 종자 추출물이 85.6%의 높은 radical 소거능을 보여 BHT (68.0%)보다 유의적으로 높은 radical 소거활성을 나타내었다. Choi SY 등(2006b)의 연구에서는 머루 과피의 분획물 중 가장 높은 DPPH radical 소거능을 가진 ethyl acetate 분획물이 100 ppm에서 79.2%의 소거능을 보였다고 하였는데, 본 연구에서는 머루 과피와 종자 추출물이 100 ppm에서 각각 88.3%와 85.5%의 radical 소거능을 보여 항산화 활성이 좀 더 높은 것으로 나타났다. 또한 Park CS(2005)의 연구에서 목통, 골담초, 당귀 추출물의 DPPH radical 소거능을 측정한 결과, 1,000 ppm에서 각각 87%, 87%, 43%의 radical 소거능을 보여, 본 연구의 머루 과피 추출물이 이들 추출물보다 높은 항산화 활성을 가진 것으로 나타났다.
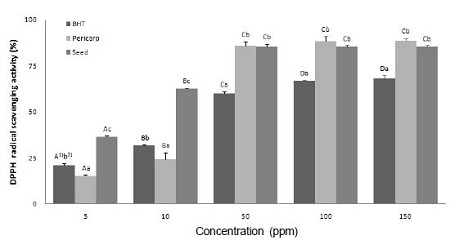
DPPH radical scavenging activity of the ethanol extracts from wild grape.Values are means of triplicate.1) Values with different capital letters (A∼D) are significantly different among the different concentrations in the same sample (p< 0.05). 2) Values with different small letters (a∼c) are significantly different among the different samples at the same concentrations (p< 0.05).
한편, IC50은 검체 농도에 따른 DPPH radical 소거능 변화 곡선으로부터 산화를 50% 억제시키는 농도를 산출한 값으로, 본 실험에서 BHT의 IC50 값은 35.68 ppm이고, 과피와 종자 추출물의 IC50 값은 각각 27.16 ppm, 7.61 ppm으로 산출되어, 머루 추출물이 BHT보다 낮은 IC50 값을 가져 항산화 활성이 우수한 것으로 나타났다. Bang IS(2008)의 연구에서 청일뽕 오디 60% 에탄올 추출물의 항산화력 측정을 위해 DPPH radical 소거능을 측정한 결과, RC50 값(reduce concentration 50%)이 38.5 ppm으로 나타났으며, Park SJ 등(2003)의 연구에서는 78℃, 50℃, 30℃에서 추출한 캠벨얼리종 포도 과피의 RC50 값이 각각 2,437.5 ppm, 2,569.2 ppm, 3,186.1 ppm으로 나타나, 본 연구의 머루 추출물보다 높은 RC50 값을 보였다. 또한 Jin SY(2007)의 연구에서도 DPPH radical을 이용한 석류 부위별 추출물의 RC50 값이 이란산 석류 종자는 94.26 ppm, 이란산 석류 과즙은 838.67 ppm, 국내산 석류 종자는 95.99 ppm, 국내산 석류 과즙은 288.55 ppm이라고 보고하여, 본 연구의 머루 종자 추출물의 항산화 활성이 좀 더 높게 나타났다. 또한 식용과 약용식물의 종자 추출물의 항산화 활성을 분석한 Jeong JA 등(2007)의 연구에서 머루종자 추출물 및 머루×캠벨얼리 교잡종의 종자 추출물의 RC50 값이 각각 71 ppm, 30 ppm이라고 하여, 본 연구에서 측정된 머루 과피와 종자 추출물의 IC50 값이 더 낮아, 이들이 높은 radical 소거능을 가지고 있음을 확인할 수 있었다.
ABTS radical 소거활성 측정은 DPPH radical 소거능 측정법과 함께 항산화 활성을 측정하는 대표적인 방법 중의 하나로, potassium persulfate와의 반응으로 생성된 ABTS free radical이 검체에 있는 항산화 물질에 의해 제거되어 radical 특유의 색인 청록색이 탈색되는 원리를 이용하여 측정하는 방법이다. ABTS radical 소거능 측정은 DPPH radical 측정법에 비해 수용성, 지용성 물질의 항산화력을 동시에 측정할 수 있고, 반응시간이 짧아 빠르게 측정할 수 있는 장점을 가지고 있다(Bang CS 2007).
머루 과피 및 종자 추출물의 ABTS radical 소거능을 측정한 결과는 Fig. 2와 같다. 머루 과피 및 종자 추출물의 ABTS radical 소거능은 앞의 DPPH radical 소거능 결과와 마찬가지로 추출물의 농도가 증가함에 따라 항산화 활성이 증가하는 양상을 나타내었다. 머루 추출물의 항산화력은 ABTS radical 소거능 측정에서도 우수하게 나타나, 머루 과피 및 종자 추출물은 100 ppm에서 각각 82.47%, 99.2%, 200 ppm에서 99.75 %, 99.87%의 매우 높은 radical 소거능을 나타내었다. 또한 종자 추출물이 과피 추출물보다 ABTS radical 소거능이 우수한 것으로 나타나, 100 ppm 농도 이하에서는 종자 추출물의 ABTS radical 소거능이 과피 추출물보다 유의적으로 높게 나타났다. 본 연구결과를 머루와 유사한 베리류의 항산화 활성에 관한 선행연구와 비교해 보면, blueberry, raspberry, mulberrry, strawberry의 에탄올 추출물이 5,000 ppm에서 각각 97.97 %, 93.93%, 95.95%, 96.93%의 ABTS radical 소거능을 보였다고 보고되어(Kang HH 2009), 본 연구의 머루 추출물이 낮은 농도에서도 높은 항산화 활성을 가진 것으로 나타났다. 유자의 항산화 활성에 대한 연구(Lee YJ 2008)에서도 5,000 ppm의 농도에서 유자 whole(과피와 과육 모두)은 67%, 과육은 45%의 radical 소거능을 보여, 본 연구의 머루 추출물의 항산화 활성이 더 높은 것으로 나타났다.
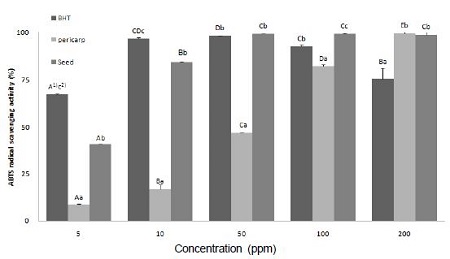
ABTS radical scavenging activity of the ethanol extracts from wild grape.Values are means of triplicate.1) Values with different capital letters (A∼E) are significantly different among the different concentrations in the same sample (p< 0.05). 2) Values with different small letters (a∼c) are significantly different among the different samples at the same concentrations (p< 0.05).
ABTS radical 소거능 측정을 통해 머루 과피 및 종자 추출물의 IC50 값은 각각 54.31 ppm, 6.04 ppm으로 산출되어, 머루 종자 추출물의 IC50 값이 머루 과피 추출물보다 더 낮게 나타났다. ABTS radical 소거능 측정을 통해 항산화 활성을 분석한 선행연구에 의하면 유자 과육 에탄올 추출물의 IC50 값은 6.20 mg/mL(Lee YJ 2008)라고 보고되었고, 울금과 강황의 IC50 값은 66.25 ppm과 141.63 ppm이라고 하여(Oh HI et al 2010), 본 연구의 머루 과피 및 종자 추출물이 이들보다 높은 ABTS radical 소거 활성을 가지고 있음을 확인할 수 있었다.
이와 같이 DPPH와 ABTS radical 소거능 측정을 통해 머루 과피 및 종자 추출물의 항산화 활성이 매우 높은 것으로 나타나, 머루 추출물에는 free radical과 반응하기 적합한 hydroxyl기를 가지고 있는 화합물이 존재하는 것으로 사료되었다(Yoshida T et al 1989; Chen JH & Ho CT 1997; Lee SE et al 2002). 또한 머루 종자 추출물은 전반적으로 ABTS radical 소거능이 DPPH radical 소거능에 비해 더 높게 나타났는데, 이는 소거능에 이용되는 radical의 차이 때문으로 보인다. DPPH는 free radical이고, ABTS는 양이온 radical으로 머루 종자 추출물에는 ABTS 양이온 radical 소거에 우수한 활성을 가진 폴리페놀 성분의 함유량이 높은 것으로 생각되었는데, 실제 Won JH & Kim MR(2012)의 선행연구에서 머루 종자 추출물과 과피 추출물에 다량의 총폴리페놀 화합물이 함유되어 있으며, 과피 추출물(5.98 mg/g)보다 종자 추출물(9.94 mg/g)에 더 많이 폴리페놀이 함유되어 있다고 보고되어, 본 연구의 결과를 뒷받침해 주었다.
2. 항돌연변이 활성
항돌연변이 활성 측정을 위해 실험에 사용한 Salmonella typhimurium TA98과 TA100은 각각 frameshift mutation과 base-pair substitution 변이주로서 모두 histidine/biotin plate에서만 성장하고, biotin plate에서는 성장하지 않아 histidine 요구성을 확인할 수 있는 균종이다(Maron MI & Ames BN 1983). 본 연구에서는 균의 돌연변이 유발을 위해 세포 내의 DNA 정보 발현에 직접적인 이상을 일으키는 돌연변이원으로 4-NQO와 sodium azide를 사용하였다. 또한, 머루 과피 및 종자 추출물의 항돌연변이 활성을 측정하기 위한 본 실험 전에 시료 자체의 돌연변이 유발성을 확인한 결과, 직접돌연변이원인 4-NQO와 sodium azide는 음성대조군에 비해 복귀돌연변이 colony 수를 유의적으로 증가시켰으나, 시료첨가군에서는 실험에 사용된 농도의 추출물이 복귀돌연변이 colony 수를 유의적으로 증가시키지 않아 항돌연변이 실험에 적합함을 확인하였다(data not shown).
먼저 4-NQO를 돌연변이원으로 사용하여 TA100와 TA98에 대한 머루 과피 및 종자 추출물의 항돌연변이 활성을 측정한 결과를 보면, TA100과 TA98 모두 추출물의 농도가 높아질수록 돌연변이 저해율도 높아지는 양상을 보였으며, 5 mg/plate 농도에서 과피와 종자 추출물 모두 65% 이상의 높은 돌연변이 저해활성을 나타내었다(Table 1, Table 2). TA100의 경우, 0.5 mg/plate와 1 mg/plate 농도에서는 머루 과피 추출물과 머루 종자 추출물의 돌연변이 저해 활성에 유의적인 차이가 없었으나, 5 mg/plate에서는 머루 종자 추출물(77.8%)이 머루 과피 추출물(65.8%)보다 유의적으로 높은 돌연변이 저해 활성을 나타내었다(Table 1). TA 98의 경우는 1 mg/plate에서 머루 종자 추출물(31.8.0%)이 머루 과피 추출물(23.8%)보다 돌연변이 저해 활성이 유의적으로 높게 나타났으며, 5 mg/plate에서는 과피와 종자 추출물의 돌연변이 저해활성이 각각 72.6%와 68.0%로 나타나 높은 돌연변이 저해활성을 보였다. 오미자를 재료로 한 선행연구에서 4-NQO를 직접돌연변이원으로 이용한 경우 오미자 에탄올 추출물(5 mg/plate)의 TA100에 대한 항돌연변이 활성이 67.1%라고 하여(Jeon YH et al, 2008a) 머루 추출물의 항돌연변이 저해활성과 유사하였다.

The antimutagenic activity of the ethanol extracts from wild grape on the mutagenicity induced by 4-NQO in Salmonella typhimurium TA100

The antimutagenic activity of the ethanol extracts from wild grape on the mutagenicity induced by 4-NQO in Salmonella typhimurium TA98
Sodium azide를 돌연변이원으로 이용하여 균주에 대한 머루 과피 및 종자 추출물의 항돌연변이 활성을 측정한 결과는 Table 3과 Table 4에 나타나 있다. 4-NQO를 사용하였을 때와 마찬가지로 TA100과 TA98 모두 추출물의 농도가 높아지면 항돌연변이 활성도 높아지는 경향을 나타냈으며, 5 mg/plate의 농도에서 과피 추출물과 종자 추출물은 66.8%와 74.5%의 높은 항돌연변이 활성을 보였다. TA100의 경우, 실험한 농도 전체에서 머루 종자 추출물이 머루 과피 추출물에 비해 모두 유의적으로 높은 항돌연변이 활성을 나타내었다. TA98의 경우에는 5 mg/plate의 농도에서 과피 추출물과 종자 추출물이 74.3%와 73.6%의 높은 항돌연변이 활성을 보였다. 항돌연변이 활성과 관련된 선행연구를 보면, sodium azide를 돌연변이원으로 사용한 경우, Salmonella typhimurium TA100에 대하여 산수유 에탄올 추출물이 5 mg/plate 농도에서 25.5%의 항돌연변이 활성을 나타내었고(Jeon YH et al 2008b), 오미자 에탄올 추출물은 5 mg/plate 농도에서 45.3%의 항돌연변이 활성을 보였다고 보고되어(Jeon YH et al 2008a), 본 연구에서의 머루 추출물이 같은 농도에서 항돌연변이 활성이 좀 더 우수한 것으로 나타났다.

The antimutagenic activity of the ethanol extracts from wild grape on the mutagenicity induced by sodium azide in Salmonella typhimurium TA100
요약 및 결론
본 연구에서는 머루의 생리활성을 탐색하고, 건강식품의 소재로 이용하기 위한 기초자료를 얻기 위하여 머루 과피와 종자 추출물의 항산화 활성 및 항돌연변이 활성을 분석하였다. 연구 결과, 머루 과피 및 종자 추출물의 DPPH radical에 대한 IC50 값은 각각 27.16 ppm, 7.61 ppm으로 대조군으로 이용한 BHT의 IC50(35.68 ppm)보다 낮아 우수한 항산화 활성을 가지고 있는 것으로 나타났다. 또한, ABTS radical 소거능 측정에서도 200 ppm의 농도에서 머루 과피 및 종자 추출물은 각각 99.75%, 99.87%의 매우 높은 소거능을 나타내었다. 한편, 머루 과피 및 종자 추출물의 Salmonella typhimurium TA98과 TA100에 대한 돌연변이 억제 활성을 측정한 결과, 두 추출물 모두 농도가 높아질수록 돌연변이 억제 활성이 증가하는 것으로 나타났다. 4-NQO를 돌연변이원으로 사용한 경우, 5 mg/plate 농도에서 TA100에 대해 머루 종자 추출물과 과피 추출물은 각각 77.8%, 65.8%의 항돌연변이 활성을 보였으며, TA98에 대해서는 68.0%와 72.6%의 항돌연변이 활성을 보였다. Sodium azide를 돌연변이원으로 사용한 경우에는 같은 농도에서 과피 추출물과 종자 추출물은 TA100에 대해 각각 66.8%와 74.5%의 항돌연변이 활성을 보였고, TA98에 대해서는 74.3%와 73.6%의 항돌연변이 활성을 보여 높은 항돌연변이 활성을 가지고 있는 것으로 나타났다. 이들 결과를 볼 때, 머루 과피와 종자 추출물은 높은 항산화 활성 및 항돌연변이 활성을 가지고 있는 것이 확인되어, 향후 이를 기능성 식품의 소재로 활용할 수 있을 것으로 보인다.
References
- Bang, CS., (2007), Antioxidant and antiproliferative activities of the ethanol extracts from leafy vegetables, MA Thesis Chungbuk National University, Cheongju, p33.
- Bang, IS., (2008), Physicochemical characteristics and physiological activities of the Chongilppong mulberry, Ph D Thesis Kongju University, Kongju, p110-111.
- Beckman, KB., Ames, BN., (1998), The free radical theory of aging matures, Physiol Rev, 78(2), p547-581.
- Bing, DJ., (2015), Development of sparkling wine and designed foods containing wild grape (Vitis coignetea ), Ph D Thesis Sunchon University, Sunchon, 1, 34-104.
-
Bing, DJ., Chun, SS., (2015), Quality characteristics and antioxidant properties of rice chiffon cakes with wild grape powder, J Korean Soc Food Sci Nutr, 44(1), p118-127.
[https://doi.org/10.3746/jkfn.2015.44.1.118]

-
Bing, DJ., Kim, WT., Chun, SS., (2014), Development of white bread using fermented wild grape sourdough, J Korean Soc Food Sci Nutr, 43(12), p1896-1905.
[https://doi.org/10.3746/jkfn.2014.43.12.1896]

-
Bing, DJ., Lee, JH., Chun, SS., (2015), Quality characteristics and antioxidant activity of salad dressings prepared with wild grape powder during storage, J Korean Soc Food Sci Nutr, 44(2), p250-259.
[https://doi.org/10.3746/jkfn.2015.44.2.250]

-
Blois, MS., (1958), Antioxidant determination by use of a stable free radical, Nature, 81(4617), p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Chen, JH., Ho, CT., (1997), Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds, J Agric Food Chem, 45(7), p2374-2378.
[https://doi.org/10.1021/jf970055t]

- Cheon, KB., (1999), Screening of antioxidant from Vitis coignetea , Vitis vinifera L. and comparition of its antioxidant activity, MA Thesis Konkuk University, Seoul, p7-8.
- Choi, SY., Cho, HS., Kim, HJ., Ryu, CH., Lee, JO., Sung, NJ., (2006a), Physicochemical analysis and antioxidative effects of wild grape (Vitis coignetiea ) juice and its wine, Korean J Food & Nutr, 19(3), p311-317.
- Choi, SY., Cho, HS., Sung, NJ., (2006b), The antioxidative and nitrite scavenging ability of solvent extracts from wild grape (Vitis coignetiea ) skin, Korean J Soc Food Sci Nutr, 35(8), p961-966.
- Choi, SH., Kwak, EJ., (2012), Volatile flavor compounds and sensory properties of Yakju fermented with different contents of Meoru (Vitis coignetiae ), J East Asian Soc Diet Life, 22(5), p642-648.
- Jeon, YH., Kil, JH., Kim, SM., Kim, MH., Kim, MR., (2008a), Analysis of antioxidative activity and antimutagenic effect of ethanol extract from Schizandra chinensis Baillon, J East Asian Soc Diet Life, 18(5), p746-752.
-
Jeon, YH., Kim, MH., Kim, MR., (2008b), Antioxidative, antimutagenic, and cytotoxic activities of ethanol extracts from Cornus officianalis, J Korean Soc Food Sci Nut, 37(1), p1-7.
[https://doi.org/10.3746/jkfn.2008.37.1.1]

- Jeong, JA., Kwon, SH., Kim, YJ., Shin, CS., Lee, CH., (2007), Investigation of antioxidative and tyrosinase inhibitory activities of the seed extracts, Korean J Plant Res, 20(2), p177-184.
- Jin, SY., (2007), Antioxidant activity in pomegranate and development of the Maejakgwa added pomegranate extract, Ph D Thesis Sookmyung Women's University, Seoul, p44-46.
- Kang, HH., (2009), Determination of biological activities of Korean berries and their anthocyanin identification, Ph D Thesis Gyeongsang National University, Jinju, p53-54.
- Kim, NY., Chio, JH., Kim, YG., Jang, MY., Moon, JH., Park, GH., Oh, DH., (2006), Isolation and identification of an antioxidant substance from ethanol extract of wild grape (Vitis coignetiea ) seed, Korean J Food Sci Technol, 38(1), p109-113.
- Kim, SH., (2008), Optimal condition for deacidification fermentation of wild grape wine by mixed culture, Korean J Soc Appl Biol Chem, 51(1), p17-23.
- Kim, YS., Jeong, DY., Shin, DH., (2008), Optimum fermentation conditions and fermentation characteristics of mulberry (Morus alba ) wine, Korean J Food Sci Technol, 40(1), p63-69.
- Ku, KM., Kim, SK., Kan, YH., (2009), Antioxidant activity, corn silk, functional substances, Korean J Plant Res, 22(4), p323-329.
- Lee, BY., Lee, ME., O, J., Kim, EC., Surh, J., (2010), Preparation and characterization of physicochemical and sensory properties of bread enriched with two types of wild grape extract, Korean J Food Cookery Sci, 26(5), p636-648.
- Lee, DH., Yu, HE., Lee, JS., (2004), Quality characteristics and physiological functionality of wild grape wine, Korean J Natural Sciences, 15(1), p69-78.
- Lee, SE., Seong, NS., Park, CG., (2002), Screening for antioxidative activity of oriental medicinal plant materials, Korean J Medicinal Crop Sci, 10(3), p171-176.
- Lee, YJ., (2008), Antioxidant activity in Yuza (Citrus junos ) and quality characteristics of Yuza yogurt, MA Thesis Sookmyung Women's University, Seoul, p52-54.
- Ludvisson, J., (1993), Intervention at diagnosis of type Ⅰ diabetes using either antioxidants or photopheresis, Diabetes Metab Rev, 9(4), p329-336.
-
Maron, MI., Ames, BN., (1983), Revised methods for the Salmonella mutagenicity test, Mutation Research, 113, p173-215.
[https://doi.org/10.1016/0165-1161(83)90010-9]

- Oh, HI., Park, HB., Ju, MS., Jung, SY., Oh, MS., (2010), Comparative study of anti-oxidant and anti-inflammatory activities between Curcumae longae Radix and Curcumae longae Rhizoma, Korean J Herbology, 25(1), p83-91.
- Park, CS., (2005), Antioxidative and nitrite scavenging abilities of medicinal plant extracts, Korean J Food Preserv, 12(6), p631-636.
- Park, SJ., Lee, HY., Oh, DH., (2003), Free radical scavenging effect of seed and skin extracts from campbell early grape (Vitis labruscana B.), J Korean Soc Food Sci Nutr, 32(1), p115-118.
- Re, R., Pellegrini, N., Proteggente, A., Pannaia, A., Yang, M., RiceEvans, C., (1999), Screening of dietary carotenoids and carotenoid-rich fruit extracts for anti oxidant activities applying, 2'-Azinobis(3-ethylenebenzo thiazoline-6-sulfonic acid) radical cation decolorization assay, Method in Enzymology, 299, p379-389.
-
Seo, JS., Lee, JS., Byun, GI., Kwak, EJ., (2008), Quality characteristics of Yakju fermented with wild grape and 4 kinds of cereals, J Korean Soc Food Sci Nutr, 37(11), p1472-1478.
[https://doi.org/10.3746/jkfn.2008.37.11.1472]

-
Won, JH., Kim, MR., (2012), Analysis of antibacterial activity against food spoilage and food-borne pathogens and cytotoxicity on human cancer cell lines of extracts from pericarp and seed of Vitis coignetiea, Korean J Food Cookery Sci, 28(2), p175-182.
[https://doi.org/10.9724/kfcs.2012.28.2.175]

-
Yoshida, T., Mori, K., Hanano, T., Okumura, T., Uehara, I., Komageo, K., Fujita, Y., Okuda, T., (1989), Studies on inhibition mechanism of autoxidation by tannin and flavonoids, V. Radical-scavenging effects of tannins and polyphenols on 1,1-diphenyl-2-picrylhydrazyl radical. Chem Pham Bull, 37, p1919-1921.
[https://doi.org/10.1248/cpb.37.1919]
