오미자(Schizandra chinensis B.) 추출물의 항산화 효과 및 항균활성 분석
Abstract
The purposes of this study were to analyze the antioxidative effects and antimicrobial activity of Omija. Total phenol contents of Omija extracted with ethanol and water were 53.4±2.2 tannic acid equivalent/mg, and 47.9±2.1 tannic acid equivalent/mg, respectively. Total flavonoid contents of Omija extracted with ethanol and water were 16.3±1.1 naringin equivalent/mg, and 13.1±1.4 naringin equivalent/mg, respectively. Electron donating ability of ethanol extract (1,000 μg/mL) of Omija was 5.1±0.4%. This result was lower than the antioxidant vitamin (ascorbic acid: 96.4±0.6%) and artificial antioxidant BHT (70.0±0.5%). Nitrite-scavenging abilities of Omija were lower than ascorbic acid and BHT. SOD-like activities of Omija extracts, natural antioxidant, and artificial antioxidant at 5 mg/mL were in the other of ascorbic acid (99.0±0.5%) > BHT (72.6±0.5%) > ethanol extract (16.3±0.4%) > water extract (14.4±0.3%). The order of OH radical scavenging activities of Omija extracts and natural antioxidant at 5 mg/mL was ascorbic acid (98.9±0.6%) > tocopherol (85.4±0.6%) > water extract (59.1±0.5%) > ethanol extract (33.1±0.3%). The results show that the antimicrobial effects of Omija could not be detected at both concentrations and extraction methods.
Keywords:
Omija, antioxidative, antimicrobial activity서 론
소득수준의 향상과 식생활의 다양화 및 고급화에 따라 건강에 대한 관심과 더불어 건강식품에 대한 욕구가 크게 증대되고 있다. 이러한 영향으로 일상적으로 섭취하는 식품 중에서 활성산소에 의한 세포의 산화적 손상에 대처할 수 있는 성분의 존재 여부와 그 작용기작에 대한 연구가 활발해지면서 생리활성을 갖는 식품을 개발하려는 경향도 높은 실정이다.
또한 천연물질 개발에 대한 관심이 높아지면서 동ㆍ식물의 기능성 소재 및 원료를 비롯하여 생리활성에 긍정적인 영향을 줄 수 있는 신물질 개발에 이르기까지 매우 다양한 연구가 진행되고 있다(Almeida IF et al 2008). 이러한 천연물질 개발은 대부분 약리적 효능을 도와주는 보조제로써의 기능에 초점을 두고 있으며, 인체에 무해함과 동시에 원료취득의 용이성 및 생산의 간편성을 가져야 함이 기본적 특징이다.
오미자(Schizandra chinensis Baillon)는 목련과에 속하는 목본식물로서 주로 우리나라 중북부지방에 분포하고, 특이한 방향과 신맛이 강하며, 탄닌을 함유하고 있다. 오미자의 약리작용으로 항염증(Guo LY et al 2008), 간 보호(Nomura M et al 1995) 등이 밝혀졌으며, 색소물질로 알려진 anthocyanin의 경우 항산화능이 있는 것으로 알려지고 있다(Kim EY et al 2004). 또한 오미자의 생리활성 효능으로는 활성산소 제거효과(Kim JS & Choi SY 2008; Cho YJ et al 2007)가 있다는 것이 알려져 있으며, 종자유에는 Staphylococcus 등에 대한 항균작용을 나타내는 성분이 있다고 하였다(Kim MS et al 2000, Lee SH et al 2003).
그리고 오미자의 생리활성 및 항산화 효과를 보기 위한 추출액 제조 시 추출방법과 조건 등에 다소 차이를 보였는데, 이 중 추출용액으로는 물(Lee SH et al 2003), 메탄올(Lee JY et al 2001), 에탄올(Jeon YH et al 2008), 물과 메탄올, 에탄올, 에틸아세테이트, 클로로포름의 유기용매(Jung GT et al 2000) 등으로 각기 다르게 사용되었다. 또한 추출물에서 아질산염 소거능 등 일부 항산화 효과를 실험하거나, 항균효과만을 실험한 연구가 대부분으로 이를 같이 수행한 것은 일부였다. 그러므로 본 연구에서는 오미자 추출용액으로 물과 독성이 없는 에탄올을 사용하여 물과 유기용매의 차이에 따른 6종류의 항산화 특성 및 항균활성을 분석함으로써 오미자를 이용한 가공식품 개발과 고부가가치 기능성 식품소재로의 활용가치를 높이는데 기여하고자 하였다.
재료 및 방법
1. 재료 및 전처리
본 실험에 사용된 오미자(충청북도 충주)는 동결건조(FD- 8515, Ilsin, Korea)한 후 분쇄기(M20, IKA, Germany)를 사용하여 20∼30 mesh 크기로 조분쇄하고, -40℃에 냉동보관하면서 시료로 사용하였다.
2. 실험 방법
분말 형태의 오미자 100 g을 정확히 칭량하여 10배의 물 및 95% 에탄올을 각각 첨가한 후, 환류냉각관을 부착한 플라스크에 넣고, 85℃ water bath에서 5시간 동안 추출하였다. 추출물은 여과지(Whatman No. 2)로 여과한 후 감압회전증발기로 40±1℃에서 농축한 후 다시 동결건조하여 측정시료로 사용하였다. 추출수율은 시료의 건물에 대한 추출물의 총 고형분 함량의 백분비로 하였다. 제조된 오미자 추출물들은 냉동실(-40℃)에 보관하면서 실험에 사용하였다.
오미자의 총 페놀 함량은 Folin-Denis 법(Folin O & Denis W 1912)으로 측정하였다. Folin-Denis 시약은 sodium tungstate 10 g, phosphomolybdic acid 2 g, phosphoric acid 5 mL를 100 mL 용량 플라스크에 넣고 증류수로 정용한 후, 삼각플라스크에 옮겨 2시간 동안 환류 조작하여 사용하였다. 실험방법으로는 캡튜브에 증류수 7 mL, 시료 1 mL씩 넣은 후 Folin-Dennis 시약 0.5 mL를 첨가하여, 정확히 3분 후에 sodium carbonate anhydrous 포화용액 1 mL, 증류수 0.5 mL를 넣고 725 nm에서 흡광도를 측정하였으며, 표준용액으로는 탄닌산(tannic acid, Sigma Co., St. Louis, USA)을 사용하였다.
플라보노이드 함량은 Kang YH et al(1996)의 방법에 준하여 물 및 에탄올 추출물 각 1 mL와 diethylene glycol 10 mL에 1 N-NaOH용액 1 mL를 가하여 잘 혼합하고, 37℃에서 1시간 반응시킨 후 420 nm에서 흡광도를 측정하였다. 이때 표준검량곡선은 나린진(naringin, Sigma Co., St. Louis, USA)을 사용하여 작성하였다.
오미자의 전자공여능(electron donating ability, EDA)은 Blois 방법(Blois MS 1958)을 응용하여 각 시료의 DPPH (1,1- diphenyl-2-picrylhydrazyl) radical 소거능을 측정하였다. 시험관에 0.0035% DPPH 용액 3 mL와 시료 0.15 mL를 넣고 잘 혼합한 후 실온에서 30분간 방치한 다음 516 nm에서 흡광도를 측정하였으며, blank 시험을 하여 대조구의 흡광도를 같은 조건에서 측정하였다. 이들 측정값을 다음 식에 대입하여 DPPH radical 소거활성을 계산하였다.
SA: Sample absorbance
CA: Control absorbance
오미자의 아질산염 소거작용은 Gray와 Dugan의 방법(Gray JI & Dugan LR 1975)에 의하여 측정하였다. 즉, 1 mM NaNO2 용액 1 mL에 일정농도의 시료 1 mL를 가하고, 0.1 N HCl로 반응용액의 pH를 1.2로 조정한 다음 총량을 10 mL로 하였다. 이 용액을 37℃에서 1시간 반응시킨 후 각 반응액을 1 mL씩 취하여 2% 초산용액 5 mL와 Griess 시약(30% acetic acid로 조제한 1% sulfanilic acid와 1% naphthylamine을 1:1 비율로 혼합한 것, 사용직전에 조제) 0.4 mL를 가하여 잘 혼합하였다. 이 혼합액을 실온에서 15분간 방치한 후 UV/Vis spectrophotometer(TU-1800, USA)를 이용하여 520 nm에서 흡광도를 측정, 잔존하는 아질산량을 구하였다. Blank 시험은 Griess 시약 대신 증류수 0.4 mL를 가하여 상기와 동일하게 행하였다. 아질산염 소거작용은 시료를 첨가한 경우와 첨가하지 않은 경우의 아질산염 백분율로 나타내었다.
N : Nitrite scavenging ability
A : Absorbance of 1 mM NaNO2 added sample after standing for 1 hour
B : Absorbance of 1 mM NaNO2
C : Absorbance of control
SOD 유사활성은 Kim SM et al(2001)에 의하여 측정하였다. 즉, 각 일정농도의 시료 0.2 mL에 pH 8.5로 보정한 tris-HCl buffer(50 mM tris + 10 mM EDTA) 3 mL와 7.2 mM pyrogallol 0.2 mL를 가하고 실온에서 10분간 방치한 후, 1 N HCl 1 mL를 첨가하여 반응을 정지시킨 다음 420 nm에서 흡광도를 측정하였다. SOD 유사활성은
으로 나타냈으며, 대조구로서는 ascorbic acid와 BHT 1 mg/mL를 이용하여 비교하였다.
Hydroxyl radical 소거활성은 Chung SK et al(1997)의 방법에 따라 EDTA가 포함된 Fenton 반응계(Fe2++ H2O2 → HOㆍ+ HO-)에서 분석하였다. 10 mM FeSO4ㆍ7H2O 용액, 10 mM EDTAㆍ2Na 용액, 10 mM 2-deoxyribose 용액을 각각 0.2 mL 혼합한 Fenton 반응 혼합물에 1, 2 및 5 mg/mL의 시료용액 0.2 mL, 0.1 M phosphate buffer 용액(pH 7.4) 1.2 mL를 넣어 총 용액 1.8 mL로 조제하였다. 여기에 10 mM H2O2용액 200 μL를 가하여 혼합한 후 37℃에서 4시간 반응시켰다. 다시 2.8 % TCA(trichloroacetic acid) 시약 1.0 mL와 1% TBA(thiobarbituric acid) 1.0 mL를 가하여 끓는 물에서 10분간 반응시킨 다음 실온에서 급냉한 후 532 nm에서 UV-Vis spectrometer (TU-1800, USA)를 이용하여 흡광도를 측정하였다. 이때 hydroxyl radical 소거능은 아래의 식으로부터 구하였다.
As : 시료 첨가구의 흡광도
Ac : 시료 무 첨가구의 흡광도
Ao : 37℃에서의 반응이 생략된 시약 혼합물의 흡광도
항균효과는 paper disc 법(Kim MS et al 2000)을 이용하여 측정하였다. 사용된 균주는 Gram 양성균과 Gram 음성균 각 2종류씩 사용하였고, 사용된 배지의 조건은 Table 1과 같았다. Gram 양성균으로는 Bacillus cereus, Staphylococcus aureus를, Gram 음성균으로는 Escherichia coli, Salmonella enteritidis를 사용하였다. 각 시험균주를 해당 액체배지에 24시간 전배양하였고, 평판배지의 조제는 각각의 생육배지로 멸균된 1.5% agar를 petri dish에 20 mL씩 분주하여 응고시킨 후 각 시험 균액을 0.1 mL씩 첨가하여 멸균된 유리봉으로 배지위에 고르게 펴지도록 도포하여 사용하였다. 오미자 추출물들을 각각 일정농도로 주입한 paper disc(8 mm, Toyo Roshi Kaicha, Ltd., Tokyo, Japan)를 평판배지 위에 흡착시켜 멸균수 30 μL를 주입한 후 37℃에서 24시간 배양하고, paper disc 주변의 inhibition clear zone(8 mm: no inhibition, 8∼9 mm: very slight inhibition, 9∼10 mm: slight inhibition, 10∼14 mm: moderate inhibition)의 직경(mm)을 측정하여 추출물의 항균효과를 비교, 분석하였다.
실험결과는 SAS package(release 8.01)를 이용하여 평균±표준편차로 표시하였고, 평균값의 통계적 유의성은 p<0.05 수준에서 Duncan's multiple range test에 의해 검정하였다.
결과 및 고찰
1. 오미자의 물 및 에탄올 추출수율
오미자의 물 추출수율은 43.2±0.2%이었고, 에탄올 추출수율은 47.7±0.5%로써 물보다 유기용매인 에탄올로 추출한 실험구에서 더 높은 함량을 나타내었다(Table 2).
Kwon HJ & Park CS(2008)은 오미자 물 추출 수율은 32.9%, 에탄올 추출 수율은 33.9%이라 하였고, Nam SE et al(2014)의 연구에서도 오미자를 70% 및 99% 에탄올과 물로 추출했을 때 유기용매 추출물에서 수율이 높다고 하여 본 연구와 같은 결과를 나타내었다.
2. 총 폴리페놀과 플라보노이드 함량
오미자의 총 페놀 및 플라보노이드 함량을 측정한 결과, Table 3과 같이 총 페놀은 물 추출물 47.9±2.1 tannic acid equivalent/mg, 에탄올 추출물 53.4±2.2 tannic acid equivalent/mg였으며, 플라보노이드 함량은 물 추출물 13.1±1.4 naringin equivalent/mg, 에탄올 추출물 16.3±1.1 naringin equivalent/mg으로 물 추출물에 비해 에탄올 추출물에서 총 페놀과 플라보노이드 함량이 더 높게 나타났다. Cho YJ et al(2007)의 오미자 생리활성 연구에서는 총 페놀함량이 물 추출 시 4.35%, 에탄올 추출 시 6.35%였고, Nam SE et al(2014)의 연구에서도 오미자 물 추출물의 총 페놀 함량이 9.2%로 에탄올과 메탄올 추출물에서는 더 증가한 것으로 나타났다. 그리고 Jeon YH et al(2008)는 오미자 에탄올 추출물의 총 페놀 함량은 9.53 mg/g으로 3.97 mg/g인 플라보노이드 함량보다 더 많다고 하여 본 연구와 유사하였다. 식품에 함유되어 있는 페놀화합물은 곡물, 채소, 과일 등 식물계에 널리 분포되어 있어 다양한 구조와 분자량을 가지며, 플라보노이드와 안토시아닌의 주성분이다. 이러한 페놀화합물은 항산화성과 연관되어 페놀화합물을 함유한 추출물의 농도가 높을수록 항산화 활성이 높아지는 것으로 보고되고 있다(Choi SR et al 2008).
3. DPPH Radical 소거능
DPPH(1,1-diphenyl-2-picryl-hydrazyl)는 비교적 안정한 자유라디칼을 지닌 물질로 반응계에 전자를 공여하여 식품 중의 지질산화는 물론, 인체에서 활성 라디칼을 제어할 수 있기 때문에 산화를 억제하는 척도가 된다. 이러한 라디칼 소거작용은 인체의 질병과 노화를 방지하는데 있어서 중추적 역할을 하기 때문에 기능성 식품의 대상으로 관심이 집중되고 있다. 또, DPPH의 환원력을 이용한 항산화 활성 측정법은 비교적 간단하고 실제 항산화 활성과 관련성이 높으므로, 다양한 천연소재로부터 항산화 물질의 검색에 주로 이용되고 있다(Kang KO 2013).
DPPH radical에 대한 오미자의 소거능 효과는 Table 4와 같이 물 추출물의 경우 100, 500 및 1,000 μg/mL 농도에서 각각 2.3±0.3, 4.1±0.3 및 5.4±0.4%이었고, 에탄올 추출물의 경우 100, 500 및 1,000 μg/mL 농도에서 각각 4.1±0.2, 5.9±0.3 및 7.4±0.2%로 에탄올 추출물에서 더 큰 효능을 나타내었다. 그리고 비교군으로 항산화성 비타민 ascorbic acid와 합성 항산화제 BHT(butylated hydroxytoluene)를 이용하여 전자공여능을 비교하였는데, ascorbic acid의 경우 100, 500 및 1,000 μg/ mL 농도에서 54.1±0.5, 96.1±0.5 및 96.4±0.6%이었고, BHT의 경우 16.3±0.4, 55.3±0.5, 70.0±0.5%로 ascorbic acid > BHT > ethanol 추출물 > 물 추출물 순으로 차이를 나타내었다.
이러한 결과는 Kim EY et al(2004)의 오미자 열수 추출물과 Lee SE et al(2003)의 오미자 메탄올 추출물에서의 항산화 활성보다는 높은 것이다. 그리고 Jeon YH et al(2008)은 5∼500 μg/mL 농도에서 오미자의 소거능은 0.5∼57.2%로 농도가 증가할수록 소거활성도 유의적으로 증가하는 경향을 보이나, 합성항산화제인 BHT보다는 낮다고 한 바 있다.
4. 아질산염 소거능
아질산염은 육색소인 myoglobin 및 hemoglobin과 작용함으로써 nitrosomyoglobin과 nitrosohemoglobin을 생성하여 발색을 좋게 하고, Clostridium botulinum의 성장을 억제하여 식중독을 예방한다. 또한 산패를 방지함으로써 저장 중 산패취를 감소시키나, 발암성의 nitrous anhydride(N2O3)와 같은 활성 니트로소화 물질을 생성한다(Wolf IA & Waserman AE 1972).
오미자의 추출물의 pH 농도별 아질산 분해능을 분석한 결과(Table 5), 물 추출물 pH 1.2, 3.0 및 6.0에서의 아질산염 소거능은 13.3±0.3, 5.3±0.1, 2.6±0.02%이었고, 에탄올 추출물은 13.7±0.2, 6.5±0.1, 2.7±0.03%로 나타나 에탄올 추출물 pH 1.2에서 아질산염 소거능이 가장 높았다. Jung GT et al(2000)도 pH 1.2와 pH 3.0의 오미자 추출물에서는 아질산염 소거능이 높으나, pH 6.0에서는 거의 없거나 매우 낮다고 하였고, Kang KO(2013)의 야콘 추출물 실험에서도 pH가 낮을수록 아질산염 분해능이 우수하다고 한 것과 같은 결과로써, 이는 Rice-Evans CA et al(1996)의 연구에서와 같이 낮은 pH에서 안정한 오미자의 anthocyanin 색소에 의한 영향인 것으로 사료된다. 또한 천연항산화제인 ascorbic acid와 합성항산화제인 BHT의 아질산염 소거능은 물 추출물에서 78.1±0.5, 49.1±0.4, 17.2 ±0.3%이었고, 에탄올 추출물에서는 74.9±0.5, 44.3±0.4 및 13.5 ±0.3%로 나타났었다. 이 결과에서 아질산 소거능이 가장 큰 물질은 ascorbic acid이며, pH가 낮은 조건에서 아질산염 소거능이 높다는 것을 알 수 있었다.
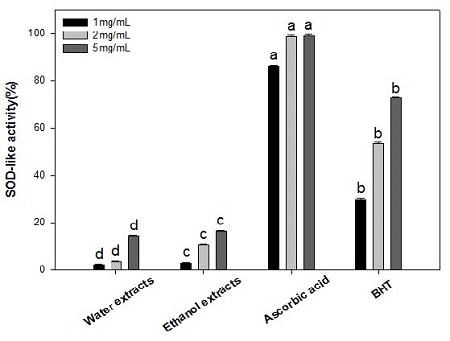
5. SOD(Superoxide Dismutase) 유사활성능
인체는 superoxide dismutase(SOD), glutathione peroxidase (GPX) 등의 항산화 효소가 있어 활성산소의 유리기를 제거함으로써 산화-항산화 균형을 유지하고, 산화적 스트레스로부터 인체를 보호하고 있는데, 초과산화 이온이 가지고 있는 자유라디칼 음이온은 세포에 해로운 영향을 미치기 때문에, SOD는 초과산화이온을 산소와 과산화수소로 바꿔줌으로써 독성으로부터 세포를 방어하는 역할을 한다. 산소에 노출되는 거의 모든 세포에서 이러한 SOD에 의한 항산화방어 기작이 중요하므로 인체의 항산화효소 방어력을 증가시키기 위해서는 외부로부터 항산화물질을 함유한 식품을 섭취해야 한다(Seo CJ et al 2007).
오미자 추출물의 SOD 유사활성능은 Fig. 1과 같이 물 추출물은 1, 2 및 5 mg/mL 농도에서 각각 2.3±0.2, 3.7±0.2 및 14.4±0.3%이었고, 에탄올 추출물은 3.1±0.3, 10.6±0.4 및 16.3 ±0.4%로 물 추출물보다 에탄올 추출물에서 활성이 높았다. Ascorbic acid와 BHT를 측정한 결과, 1, 2 및 5 mg/mL에서 SOD 유사활성은 각각 86.1±0.5, 98.6±0.5 및 99.0±0.5%이었으며, BHT는 29.8±0.5, 53.5±0.5 및 72.6±0.5%로서 천연 항산화제가 합성 항산화제인 BHT보다 활성이 더 높은 것을 알 수 있었다. Kim JS & Choi SY(2008)는 오미자 물 추출물 1 mg/mL의 SOD 유사활성은 52.4%였으며, 동일한 농도의 BHT는 55.7%의 활성을 나타낸 것으로 보고하여 천연 항산화제로서의 가치를 시사하였다.
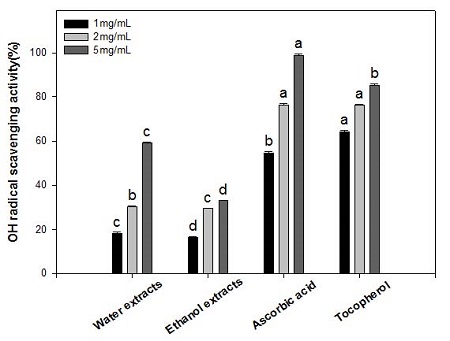
6. Hydroxyl Radical 소거능
환원력은 항산화능과 밀접한 관련이 있으며 이러한 환원력은 페놀성 화합물에 기인하는 바가 큰데, 페놀 화합물은 전자나 수소원자를 제공하여 자유라디칼이나 활성산소종을 보다 안정된 화합물로 전환시킴으로써 라디칼에 의한 연쇄반응을 종결짓게 된다.
오미자의 hydroxyl radical(ㆍOH)의 소거능을 측정한 결과(Fig. 2), 물 추출물 1, 2 및 5 mg/mL에서 각각 18.5±0.5, 30.6± 0.3 및 59.1±0.5%이었고, 에탄올 추출물은 16.5±0.5, 29.6±0.3 및 33.1±0.3%로써, 물 추출물이 에탄올 추출물보다 더 높은 소거능을 나타내었다. 비교군인 ascorbic acid와 tocopherol의 환원력은 1, 2 및 5 mg/mL 농도에서 ascorbic acid는 54.6±0.7, 76.3±0.5 및 98.9±0.6%이었고, tocopherol은 64.1±0.7, 76.2±0.5 및 85.4±0.6%로써 ascorbic acid가 가장 높은 OH radical 소거능을 보였다. Kim JS & Choi SY(2008)은 오미자 물 추출물의 hydroxyl radical 소거능은 1 mg/mL에서 33.6%로 ascorbic acid보다 낮다고 하였으며, Kim SG & Kang KO(2012)도 오디의 물 추출물보다 메탄올 추출물에서 hydroxyl radical 소거활성이 더 크지만 ascorbic acid보다는 작다고 하였다. 인진쑥 메탄올 추출물의 환원력은 50∼500 μg/mL 농도에서 0.058∼0.627 범위의 흡광도 값을 보여 시료의 첨가 농도에 의존적으로 증가하였으나, 동일농도의 tocopherol(0.129∼1.096)보다는 낮은 활성이었다고 보고된 바 있다(Jung MJ et al 2008).
7. Paper Disc법에 의한 항균활성 측정
천연물 중에는 많은 종류의 항균활성을 가진 생리활성 물질이 존재하는데, 이는 매우 적은 양으로도 고부가가치를 얻을 수 있는 물질로서 이에 대한 연구가 이루어져 산업적으로 유용하게 활용되고 있다. Conalbumin, avidin, lactoferrin과 같은 단백질류, lysozyme, lactoperoxidase와 같은 효소류, citric acid, malic acid와 같은 유기산류, 중쇄지방산, polyhydric alcohol, 식물의 정유성분, 식물의 색소성분 등은 미생물의 특정 아미노산의 이용을 저지하는 항균활성 기질을 나타내는 것으로 알려져 있다(Lee SH et al 2003).
오미자 추출물의 항균활성을 paper disc 법으로 측정한 결과는 Table 6과 같이 물 및 에탄올 추출물의 항균력은 농도가 증가할수록 우수한 활성을 보였다. 에탄올 추출물의 항균력은 Bacillus cereus, Staphylococcus aureus, Salmonella enteritidis는 5,000 μg/disc에서는 생육 저해환이 측정되지 않았지만 10,000 μg/disc에서는 slight inhibition(9∼10 mm)이었고, 20,000 μg/disc에서는 moderate inhibition(10∼14 mm)로 항균력이 증가되었다. Escherichia coli는 20,000 μg/disc에서만 very slight inhibition(8∼9 mm)로 낮은 생육 저해환을 보였다. 물 추출물에서는 Bacillus cereus, Staphylococcus aureus, Salmonella enteritidis는 10,000 μg/disc에서 very slight inhibition (8∼9 mm)이었고, 20,000 μg/disc에서는 slight inhibition (9∼10 mm)의 항균력을 나타내었다.
오미자 추출물의 항균성 실험에서 Jung GT et al(2000)은 B. subtilis가 가장 저해를 잘 받는다고 보고하였고, Cho YJ et al(2007)은 Helicobacte pylori에 대하여 항균활성을 나타내었다고 보고하였으며, Chung KH et al(2001)은 6종류의 세균에 대하여 항균활성을 나타내었으나, 2종류의 효모와 4종류의 곰팡이에 대해서는 항균활성이 없었다고 보고하여 오미자 추출물이 다양한 세균에 대하여 항균활성을 나타내는 것을 알 수 있었다. 이는 Lee SH et al(2003)의 연구에서와 같이 추출과정에서 다량의 유기산 및 정유 성분들이 용출되었기 때문이며, 이러한 결과에서 천연 항균제품으로서의 응용 가능성이 있는 것으로 사료된다.
요약 및 결론
오미자의 기능성 식품개발을 위한 기초자료를 얻고자 항산화 효과 및 항균활성을 실험하였다. 오미자의 생리활성 성분 분석을 위해 물 및 에탄올로 추출하였는데 물 추출수율은 43.2±0.2%이었고, 에탄올 추출수율은 47.7±0.5%로 에탄올 추출 시 수율이 더 높았다. 오미자의 총 페놀 함량은 물 추출물 47.9±2.1 tannic acid equivalent/mg, 에탄올 추출물 53.4±2.2 tannic acid equivalent/mg였으며, 플라보노이드 함량은 물 추출물 13.1±1.4 naringin equivalent/mg, 에탄올 추출물 16.3±1.1 naringin equivalent/mg였다. DPPH 법에 의한 radical 소거활성은 ascorbic acid > BHT > 에탄올 추출물 > 물 추출물 순으로 차이를 나타내었고, 아질산 분해능은 pH 1.2의 에탄올 추출물에서 가장 높았다. 오미자의 SOD 유사활성능은 물 추출물보다 에탄올 추출물에서 더 높았으며, 반면 hydroxy radical(ㆍOH) 소거능은 물 추출물이 에탄올 추출물보다 더 높게 나타났다. Bacillus cereus, Staphylococcus aureus, Escherichia coli 및 Salmonella enteritidis에 대한 오미자 추출물의 항균활성은 농도가 증가할수록 우수한 활성을 보였으며, 에탄올 추출물의 20,000 μg/disc에서 moderate inhibition(10〜14 mm)로 가장 우수한 항균력을 보였다.
이상의 결과에서 우리나라 전통식품으로 오랫동안 사용되어 온 오미자가 항산화성과 항균력을 가진 것을 확인할 수 있었으며, 오미자의 생리활성물질을 추출하기 위해서는 물보다 에탄올과 같은 유기용매를 사용하는 것이 더욱 효과적이라는 것을 알 수 있었다. 그러므로 건강기능성 식품개발이나 가공식품 제조 시 고부가가치 창출을 위해 이를 응용한 식품개발 연구가 더욱 활발하게 진행되길 바라는 바이다.
References
-
Almeida, IF., Valentao, P., Andrade, PB., Seabra, RM., Pereira, TM., Amaral, M H., Costa, PC., Bahia, MF., (2008), Oak leaf extract as topical antioxidant: Free radical scavenging and iron chelating activities and in vivo skin irritation potential, Biofactors, 33, p267-279.
[https://doi.org/10.1002/biof.5520330403]

-
Blois, MS., (1958), Antioxidant determination by the use of a stable free radical, Nature, 26, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Cho, YJ., Ju, IS., Kim, BC., Lee, WS., Kim, MJ., Lee, BG., An, BJ., Kim, JH., Kwon, OJ., (2007), Biological activity of Omija (Schizandra chinensis Baillon) extracts, J Korean Soc Appl Biol Chem, 50, p198-203.
- Choi, SR., You, DH., Kim, JY., Park, CB., Ryu, J., Kim, DH., Eun, JS., (2008), Antioxidant and antimicrobial activities of Artemisia capillaris Thunberg, Korean J Medicinal Crop Sci, 16, p112-117.
- Chung, KH., Lee, SH., Lee, YC., Kim, JT., (2001), Antimicrobial activity of Omija (Schizandra chinensis Baillon) extracts, J Korean Soc Food Sci Nutr, 30, p127-132.
-
Chung, SK., Osawa, T., Kawakishi, S., (1997), Hydroxyl radicalscavenging effect of spice and scavenger from brown mustard, Biotech Biochem, 61, p118-123.
[https://doi.org/10.1271/bbb.61.118]

- Folin, O., Denis, W., (1921), On phosphotungstic-phosphomolybdic compounds as color reagents, J Biol Chem, 12, p239-243.
-
Gray, JI., Dugan, LR., (1975), Inhibition of N-nitrosamine formation in model food system, J Food Sci, 40, p981-985.
[https://doi.org/10.1111/j.1365-2621.1975.tb02248.x]

- Guo, LY., Hung, TM., Bae, KH., Shin, EM., Zhou, HY., Hong, YN., Kang, SS., Kim, HP., Kim, YS., (2008), Anti-inflammatory effects of schisandrin isolated from the fruit of Schisandra chinensis Baillon, Eur J Pharmacol, 4, p299-593.
- Jeon, YH., Kil, JH., Lim, SM., Kim, MH., Kim, MR., (2008), Analysis of antioxidative activity and antimutagenic effect of ethanol extract from Schizandra chinensis Baillon, J East Asian Soc Diet Life, 18, p746-752.
- Jung, GT., Ju, IO., Choi, , JS., Hong, JS., (2000), The antioxidative, antimicrobial and nitrite scavenging effects of Schizandra chinensis seeds, Korean Soc Food Sci Tech, 32, p928-935.
- Jung, MJ., Yin, Y., Heo, SI., Wang, MH., (2008), Antioxidant and anticancer activities of extract from Artemisia capollaries, Korean J Pharmacogn, 39, p195-198.
- Kang, KO., (2013), Analysis of antioxidant effects and antimicrobial activity of extracts from yacon powder, J East Asian Soc Diet Life, 23, p374-381.
- Kang, YH., Park, YK., Lee, GD., (1996), The nitrite scavenging and electron donating ability of phenolic compounds, Korean J Food Sci Technol, 28, p232-239.
- Kim, EY., Baik, IH., Kim, JH., Kim, SR., Rhyu, MR., (2004), Screening of the antioxidant activity of some medicinal plants, Korean J Food Sci Technol, 36, p333-338.
-
Kim, JS., Choi, SY., (2008), Physicochemical properties and antioxidative activities of Omija (Schizandra chinensis Bailon), Korean J Food Nutr, 21, p35-42.
[https://doi.org/10.3746/jkfn.2008.37.1.35]

- Kim, MS., Lee, DC., Hong, JE., Chang, KS., Cho, HY., Kwon, YK., Kim, HY., (2000), Antimicrobial effects of ethanol extracts from Korean and Indonesian plants, Korean J Food Sci Technol, 32, p949-958.
- Kim, SG., Kang, KO., (2012), Effects of extraction method on physiological activity and antibiosis of mulberry powder, J East Asian Soc Diet Life, 22, p392-400.
- Kim, SM., Cho, YS., Sung, SK., (2001), The antioxidant ability and nitrite scarvenging ability of plant extracts, Korean J Food Sci Technol, 33, p626-632.
- Kwon, HJ., Park, CS., (2008), Biological activities of extract from Omija (Schizandra chirensis Baillon), Korean Preservation, 15, p587-592.
- Lee, JY., Min, YK., Kim, HY., (2001), Isolation of antimicrobial substance from Schizandra chinensis Baillon and antimicrobial effect, Korean J Food Sci Technol, 33, p389-394.
- Lee, SE., Seong, NS., Bang, JK., Park, CG., (2003), Antioxidative activities of Korean medicinal plants, Korean J Medicinal Crop Sci, 11, p127-134.
- Lee, SH., Lee, YC., Yoon, SK., (2003), Isolation of the antimicrobial compounds from Omija extract, Korean J Food Sci Technol, 35, p483-487.
-
Nam, SE., Lee, JY., Go, JS., Kin, JB., Jang, HH., Kim, HR., Lee, YM., (2014), Change of antioxidant and antimicrobial activities of Schizandra chinensis Baillon under different extraction conditions, J Korean Soc International Agri, 26, p513-518.
[https://doi.org/10.12719/KSIA.2014.26.4.513]

- Nomura, M., Nakachiyama, M., Hida, T., Ohtaki, Y., Sudo, K., Aizawa, T., Aburada, M., Miyamoto, Y., Gomisin, A., (1994), A lignan component of Schizandra frucyus inhibitis development of preneoplatic lesions in rat liver by 3'-methyl-4-dimethylamino azobenzene, Cancer Lett, 75, p11-18.
-
Rice-Evans, CA., Miller, NJ., Paganga, G., (1996), Structure-antioxidant activity relationship of flavonoids and phenolic acids, Free Radic Biol Med, 20, p933-956.
[https://doi.org/10.1016/0891-5849(95)02227-9]

- Seo, CJ., Yi, SM., Ko, YW., (2007), The effect of antioxidant supplement on the activity of SOD, CAT and MDA in high intensity aerobic exercise, J Korean Sport Res, 218, p21-31.
-
Wolf, IA., Wasserman, AE., (1972), Nitrates, nitrite and nitrosamine, Science, 177, p15-19.
[https://doi.org/10.1126/science.177.4043.15]