발효 김치로부터 분리한 Lactobacillus sp. Strain KYH를 이용한 진생베리 추출물 최적 발효 공정 확립 및 생성물의 특성 분석
Abstract
The pharmacological effects of ginseng berry have been known to improve psychological function, immune activities, cardiovascular conditions, and certain cancers. It is also known that fermentation improves the bioavailability of human beneficial natural materials. Accordingly, we investigated the optimal fermentation conditions of ginseng berry extract with strain isolated from conventional foods. We also analyzed the fermentation product and its antioxidant activity. The bacterium isolated from fermented kimchi was identified as Lactobacillus sp. strain KYH. To optimize the process, fermentation was performed in a 5 L fermenter containing 3 L of ginseng berry extract at 200 rpm for 72 hr. Under optimized conditions, batch and fed-batch fermentations were performed. After fermentation, organic acids, amino acids, sugars, ginsenosides, and antioxidant activity were evaluated. The optimum fermentation conditions were determined as pH 7.0 and a temperature of 30˚C, respectively. After fermentation, the amounts and compositions of organic acids, amino acids, sugars, ginsenosides, and antioxidant activity were altered. In comparing the distribution of ginsenosides with that before fermentation, the ginsenoside Re was a major product. However, amounts of ginsenosides Rb1, Rc, and Rd were reduced, whereas amounts of ginsenosides Rh1 and Rh2 increased. Total phenol content increased to 43.8%, whereas flavonoid content decreased to 19.8%. The DPPH radical scavenging activity and total antioxidant activity increased to 27.2 and 19.4%, respectively.
Keywords:
Antioxidant, fermentation, ginseng berry, Lactobacillus, optimization서 론
인삼(Panax ginseng C.A. Meyer)은 두릅나무과(Araliaceae)에 속하며, 느리게 자라는 다년생초로서 한국, 중국, 일본 등지에서 수 천년동안 사용되어온 약초이다(Wang CZ & Yuan CS 2008). 인삼의 대표적 약효성분은 진세노사이드(ginsenoside, ginseng+glycoside)로서 다른 식물에서 발견되는 사포닌과 다른 독특한 구조 및 활성을 가지는 것으로 알려져 있다(Choi KT 2008). 진세노사이드들은 인삼의 모든 부위에 존재하며, 항산화, 항암, 항염증, 항바이러스, 기억력 개선, 신경조절, 간 보호, 혈당 저하, 지방 흡수 조절작용, 성기능 개선 등 약 30 여종 이상의 다양한 생리활성을 갖는 것으로 보고되어 왔다(Qi LW et al 2011; Attele AS et al 1999; Lee SY et al 2010; Wang CZ et al 2006; Attele AS et al 2002).
진생베리(ginseng berry)는 인삼열매로 진세노사이드의 함량이 인삼뿌리와 다르게 나타나며, 특히 진생베리는 진세노사이드 Re와 Rd 함량이 상대적으로 높은 것으로 알려졌다(Dey L et al 2003). 최근 진생베리 추출물의 다양한 약리효능들이 발표되고 있는데, 항 허혈(Lim KH et al 2013; Kim HB et al 2011; Huang YC et al 2005), 항염증(Lee KW et al 2012), 항당뇨(Park EY et al 2012; Attele AS et al 2002), 항비만(Xie JT et al 2007), 암세포에 대한 항증식 기능(Wang CZ et al 2006; Xie JT et al 2011; Lee YJ et al 2003)을 가지는 것으로 보고되었다.
진생베리 및 인삼의 진세노사이드들은 체내에 흡수될 때 사람의 장내에 서식을 하고 있는 미생물에 의하여 당 부분이 분해가 되어 흡수되기 쉬운 구조로 전환된다고 알려졌다(Quan LH et al 2012). 하지만 진세노사이드를 분해하는 장내 세균 군들은 사람마다 다르며, 분해능이 매우 저조한 경우 흡수율이 현저하게 떨어진다(Amidon GL et al 1995; Ando T et al 1980). 최근 발효를 통하여 추출물 함유 활성 성분 및 생리활성의 증가를 목적으로 하는 다양한 연구가 보고되었다(Rajan KN & Rajrendav AD 2009; Park YS & Jang HG 2003). 특히 미생물을 이용한 천연물 발효는 미생물의 에너지원을 제외한 영양성분들은 대부분 그대로 보존되고, 미생물이 분비하는 각종 가수분해효소들에 의해 세포내 조직에 결합되어 있던 생리활성 물질들이 유리되기 때문에 생체이용률(bioavailability)이 훨씬 높아지는 것으로 알려졌다(Hubert J et al 2008; Katina K et al 2007). Microbacterium, Aspergillus, Acremonium 속 등 다양한 균주나 프로바이오틱 균주를 이용하여 인삼의 생물 전환에 대한 논문들이 발표되고 있으나(Cheng LQ et al 2008; Chi h & Ji GE 2005; Lu ZQ et al 2008), 진생베리를 이용한 연구들은 미비한 실정이다(Lee BH et al 2006). 따라서 본 연구에서는 김치로부터 적합한 생체친화성 균주를 선발하고, 최적의 진생베리 발효조건을 구축하고자 하였으며, 선발된 균주 Lactobacillus sp. strain KYH를 이용하여 최적의 조건 하에 발효 전후의 진생베리 추출물의 진세노사이드 등의 성분 분석과 항산화 활성을 비교하였다.
재료 및 방법
1. 시약 및 재료
진생베리 원료는 백년 에프엔지사(Geunsan, Chungnam, Korea)로부터 페이스트 상태로 공급되었고, 실험을 수행하기 전까지 냉동하여 보관하였다. 실험에 사용된 발효 균주는 금산군 추부면에 소재하고 있는 식품점에서 구입한 발효 김치에서 분리되었다. 김치는 아이스박스를 이용하여 실험실로 옮기고, 실험을 수행하기 전까지 냉장고에 보관하였다.
분석을 위한 시약인 gallic acid, hesperidin, Na2CO3, aluminum chloride, NaOH, BuOH, ethyl acetate, H2SO4, acetone, 2.2-azinobis(3-ethylbenzothiazoline-6-sulfonic acid(ABTS), 1,1-diphenyl-2-picrylhydrazyl(DPPH), trolox은 Sigma Aldrich Co. (St. Louis, MO, USA)에서 구입하였다.
2. 진생베리 발효 배지 제조
진생베리 발효 균주의 증식 및 배양을 위한 염배지(mineral medium; MM)는 3 g K2HPO4, 0.2 g MgSO4, 0.05 g CaCl2, 0.1 g NaCl를 증류수 1 L에 용해하고 pH를 7.0으로 보정하여 제조하였다. 염배지에 효모 추출물(yeast extract; Y)을 포함하였을 때는 MMY로 표기하였고, 탄소원인 2% sucrose를 첨가한 경우에는 MMY2S로 표기하였다. 한천(agar; A) 2%를 첨가하여 고체 배지를 제조한 경우에는 위에서 언급을 한 것처럼 MMY2A2S로 표기하였고, 20 °Brix 진생베리 추출액(ginseng berry; GB) 5%를 첨가하여 액체 배지를 제조한 경우에는 MMY2S5GB로 표기하였다.
3. 균주 분리 및 동정
진생베리 추출물 발효 가능균주들을 분리하기 위한 기본 배지로 MRS(Difco, Sparks, USA)를 사용하였다. MRS 고체 배지는 한천 2%(w/v)를 첨가하여 제조하고 MRS2A(MRS plus 2% agar)로 표기하였다. MRS에 포함된 포도당과는 별도로 탄소원인 sucrose를 2%(w/v) 첨가하였을 경우에는 MRS2A2S로 표기하였다. 균주분리를 위하여 김치 국물의 일부를 MRSA2S 평판 배지에 도말을 하여 30℃ 항온기에서 24∼48 hr 배양하였다. 증식된 단일 콜로니를 MMY2S5GB 배지 10 mL를 담고 있는 배양 시험관(20 mm × 150 mm)에 무균적으로 옮기고, 30℃ 항온기에서 24∼48 hr 배양하였다. 증식 후에 반복적으로 같은 배지에 3∼4차례 계대배양하였다. 진생베리 발효 균주는 MMY2S5GB 배지에서 최적의 증식 및 발효 특성을 나타내는 균주를 최종적으로 선택하였다. 동정 전의 균주는 KYH로 명기하였다.
최종적으로 선택된 분리 균주의 동정은 Shin JH & Yoo SK(2012)의 방법을 조정하여 수행되었다. 분리 정제한 16S rRNA 염기서열은 ABI PRISM 310 Genetic Analyser (Applied Biosystems, Carsbad, CA)를 사용하여 분석하였고, 상동성은 DDBJ/NCBI/GenBank database의 BLAST program을 이용하여 비교하였다. 각 염기서열의 상동성은 alignment Clustal X program를 이용하여 병렬로 정렬하였으며, 계통도의 작성은 근린 결합법에 의거하여 결정하였다(Thomson JD et al 1994).
4. 진생베리 추출 및 농축
진생베리 열수 추출을 위하여 공급된 진생베리 슬러지는 65℃의 열풍건조기에서 건조하여 건조된 진생베리 분말 200 g을 부직포에 담아 5,000 mL 추출용 둥근 플라스크에 넣고, 2,000 mL 정제수를 넣어 내용물이 완전히 잠기게 한 후에 환류 추출하였다. 진생베리 추출액은 불순물을 제거한 후에 진공농축기를 이용하여 농축기의 압력은 약 600 mmHg, 온도는 보정 압력에서 용매의 끓는점을 감안하여 80℃를 유지하였고, 최종 농축액이 약 50 ˚Brix가 될 때까지 농축하였다. 연구에 사용된 추출물은 농축액을 20 ˚Brix까지 희석하여 사용한 것이다.
5. 진생베리 추출물 최적 발효
Lactobacillus sp. strain KYH 최적 발효 조건을 구하기 위해서 MMY2S5GB에 pH meter(model 720P, Istek Co., Korea)를 이용하여 20% HCl과 20% NaOH로 pH를 7로 조정한 다음, MMY2S5GB 50 mL를 250 mL 배양 플라스크에 옮겨 고압솥(JS-AC-60, Johnsam Co., Korea)에서 121℃로 15 min 멸균시켰다. 먼저 발효 최적 온도 조건을 찾기 위해서는 무균작업대에서 멸균된 배지에 전날 계대 배양하여 균주가 활성화 된 배양액 2%를 옮겨 진탕 배양기를 이용하여 20℃, 25 ℃, 30℃, 35℃, 40℃ 조건에서 100 rpm으로 12 hr 배양하였다. 배양을 하는 동안 1 hr 단위로 sampling을 하여 균체의 증식을 측정하였다. 발효 최적 pH 조건을 찾기 위해서는 pH를 3, 4, 5, 6, 7로 조절하고, 전날에 계대 배양하여 균주가 활성화된 배양액 2%를 접종하였으며 30℃, 100 rpm으로 12 hr 배양하였다. 배양을 하는 동안 1 hr 단위로 sampling을 하여 균체의 증식을 측정하였다. 균의 증식은 총 균수 측정법을 이용하여 평가하였다. 회분식(batch) 발효공정은 3 L MMY2S5GB 배지를 working volume 5 L 발효기에 넣고, 멸균한 후에 전날 미리 계대배양 한 200 mL의 Lactobacillus sp. strain KYH 배양액을 접종하였다. 그 다음 30℃, pH 7, 100 rpm 조건으로 배양하였고, 12 hr마다 sampling하였다. 유가식(fed-batch) 발효는 3 L MMY2S 배지를 working volume 5 L 발효기애서 30℃, pH 7, 100 rpm으로 12 hr 배양한 후에 20(˚Brix) 진생베리 농축액을 1 mL/min 속도로 1 L를 공급하였고, 배양액은 4 hr마다 sampling하였다. 균의 증식은 총 균수 측정법을 이용하여 평가하였다. 균수는 발효기간 동안에 살아 있는 것으로 가정을 하고 colony forming unit(CFU)/mL로 표기하였다.
6. 진생베리 추출물 성분 분석
구성당의 분석을 위하여 시료 0.5 g에 80% ethanol 50 mL를 가하여 환류냉각기에서 80℃, 5 hr동안 추출한 후에 농축하고, ethanol 20 mL로 정용한 다음 HPLC(Shimadzu Co., Japan)로 분석하였다. Column은 shim-pack ISA-07/S2504(250 ×4.0 mm)을 사용하였고, 이동상의 구성은 A: potassium borate (pH 8)와 B: potassium borate(pH 9)이었다. 분석 온도는 65 ℃, 유속은 0.5 mL/min, injection volume 20 μL이었다. 검출기는 fluorescence detector(Ex=320 nm, Em=430 nm)를 사용하여 분석하였다.
유기산 분석을 위하여 시료 0.2 g에 증류수 20 mL를 가하여 항온수조에서 80℃, 4 hr동안 교반 및 추출한 후에 ethanol 20 mL로 정용한 다음 HPLC(Shimadzu Co., Japan)로 분석하였다. Column은 two shim-pack SCR-102H(300×8.0 mm)를 사용하였고, 이동상은 4 mM p-toluenesulfonic acid를 사용하였고, 분석 온도는 40℃, 유속은 0.7 mL/min, injection volume은 20 μL이었다. 검출기는 electrocontractility를 사용하였다.
구성 아미노산 분석을 위하여 아미노산 자동분석기(S-433H, Sykam GmbH, Germany)를 사용하였으며, column은 cation separation column LCA K06/Na(4.6×150 mm)을 사용하였다. 기기 작동 온도는 57∼74℃, buffer 유속은 0.45 mL/min, reagent 유속은 0.25 mL/min, buffer pH 범위는 3.45∼10.85로 하였고, fluorescence spectrophotometer를 사용하여 440 nm, 570 nm에서 흡광도로 측정하였다.
진세노사이드를 분리 및 정량하기 위해서 TLC-densitometry 법을 이용하였다(Corthout J et al 1999). 표준 진세노사이드 Re, Rd 및 Rg1들은 Chromadex Co.(USA)의 제품을 구입하여 사용하였으며, 진세노사이드 분리를 위한 TLC plate는 Merck Co.(USA)의 제품으로 silica gel 60F 254 aluminium sheets를 사용하였으며, 전개용매는 butanol : ethyl acetate : water(5 : 5 : 4, v/v, upper layer)으로 사용하였다. 발색 시약은 진한 황산 H2SO4 5 mL를 증류수 95 mL로 혼합하여 제조하였다. 발색 시약을 분사하고 건조시킨 후 105℃ dry oven에서 10분간 가온 발색하여 TLC Plate 상에 각각 분리된 사포닌의 spot을 확인하였다. 진세노사이드의 정량은 digital densitometry인 scion image program(Scion Image, Scion Corp., Maryland, USA)을 이용하여 분석하였다.
7. 항산화능 분석
페놀류 화합물의 정량은 gallic acid(Sigma Aldrich Co., USA)를 표준물질로 하여 Folin-Ciocalteu reagent(FCR)발색방법으로 분석하였다(Dewanto V et al 2002). 표준물질 제조을 gallic acid(20, 40, 60, 80, 100 mg/L) 용액 1 mL를 9 mL DIW(deionized water)에 혼합하여 제조하였다. 100 μL 샘플용액을 1.5 mL Na2CO3 (20 g/100 mL), 500 μL FCR, 6 mL DIW와 혼합한 후 상온에서 2 hr 반응을 시키고 765 nm에서 흡광도를 측정하였다. 총 페놀화합물 함량은 건조시료 g 당 gallic acid(GAE)의 양으로 평가하였다.
전체 플라보노이드의 함량은 aluminium chloride 비색법을 이용하여 측정하였고(Saleh ES & Hameed A 2008), 표준물질은 hesperidin(Sigma Aldrich Co., USA)으로 20, 40, 60, 80, 100 mg/L 용액 1 mL를 9 mL DIW에 혼합하여 제조하였다. 0.5 mL 샘플용액, 1.5 mL 95% methanol, 0.1 mL 10% aluminium chloride(Sigma Aldrich Co., USA), 0.1 mL 1 M NaOH, 2.8 mL DIW를 혼합한 후 상온에서 30 min 반응을 시키고 415 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 건조시료 g 당 hesperidin 양으로 평가하였다.
DPPH 라디칼에 대한 소거활성은 Blois의 방법을 변형하여 측정하였다(Blois MS 2004). 측정에 사용된 2,2-diphenyl-1-picrylhydrazyl(DPPH)용액의 농도는 75 μM로 제조하였다. 라디칼 반응은 DPPH 용액 3.9 mL와 발효 후 진생베리 추출물을 100 μL를 혼합하고, 차광 상태에서 37℃, 20 min 반응시킨 후 UV-1601 spectrophotometer(Shimadzu Co., Australia)를 이용하여 517 nm에서 흡광도를 측정하였다. 대조구는 methanol : water(1 : 1)로 하여 추출물을 대신하였다. 반응 후 DPPH 라디칼 소거활성은 대조구에 대한 시료의 흡광도를 비교하여 아래와 같은 식으로 계산하였다.
총 항산화능은 TEAC(Trolox equivalent antioxidant capacity) 방법에 의하여 측정하였다(Liyana PCM & Shahidi F 2006). 표준곡선은 trolox(Sigma Aldrich Co., USA)로 (20, 40, 60, 80, 100 mg/L) 용액을 만들어 1 mL를 9 mL DIW에 혼합하여 제조한 후 660 nm에서의 흡광도를 측정하여 만들었다. 총 항산화능은 시료의 ABTS+를 소거하는 항산화 능력을 표준물질인 trolox의 표준곡선과 비교하여 계산하였다.
결과 및 고찰
1. 진생베리 추출물 발효 균주 분리 및 동정
발효 김치로부터 분리한 균주들은 MRS2A2S 배지에서 협막의 유무로서 글루칸을 생성하는 균주들과 생산하지 않는 균으로 구분할 수 있었다. 협막을 생산하는 균주들은 대부분 구균의 형태를 보여주었고, 뚜렷한 단일 콜로니를 보여주는 균주들은 간균의 형태를 보여주었다. 균주의 동정 및 계통학적 위치결정을 위하여 sequencing을 수행한 결과, 분리한 균의 16S rRNA gene 영역은 1274 bp의 염기로 구성되어 있었다. Lactobacillus type에 속하는 균주로 확인되었으며, 최종적으로 Lactobacillus sp. KYH로 명명하기로 하였다.
2. Lactobacillus sp. Strain KYH에 의한 진생베리 발효의 최적 조건
발효의 배양온도는 대사물질 생산 속도에 크게 영향을 미친다. 발효 온도가 증가함에 따라서 균체량 생산 수율이 떨어지는데, 이는 대사 유지를 위한 에너지가 소비되기 때문이다(Wang DIC et al 1979). Lactobacillus sp. strain KYH 균주의 성장에 있어서 배양 온도에 따른 영향을 알아보기 위하여 MMY2S5GB 배지를 pH 7로 맞춘 뒤에 20℃, 25℃, 30℃, 35 ℃, 40℃의 온도조건에서 1 hr마다 660 nm에서 흡광도 값을 측정하여 균체성장을 비교해 본 결과, 30℃에서 가장 성장이 활발한 것을 확인할 수 있었다. 3 hr 이후로 서서히 증가하기 시작하여 25 hr까지 증식이 활발한 것으로 나타났다(Fig. 1A). 이와 같은 결과는 유산균으로부터 진생베리를 발효시킨 기존의 보고와 일치하는 결과이다(Jeon JM et al 2011). 본 연구와 유사하게 진생베리 증포 추출물의 최적발효조건에 대한 보고에서도 30℃에서 발효하는 것이 가장 효과적인 것으로 보고되어 있다(Kim ST et al 2013).
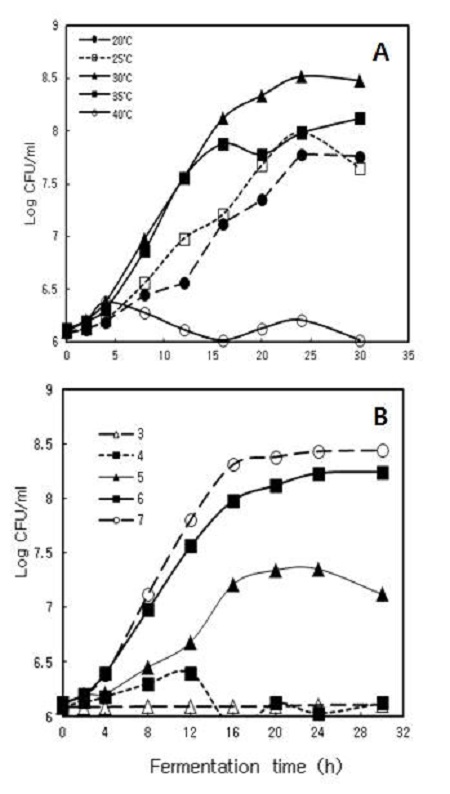
1. Growth kinetics during the fermentation of Lactobacillus sp. strain KYH on medium of MMY2S5GB at various temperature in pH 7 (A) and various pH in 30℃ (B).Fermentation medium was mineral medium (3 g K2HPO4, 0.2 g MgSO4, 0.05 g CaCl2, 0.1 g NaCl per 1 L water), yeast extract 0.5%, sucrose 2% and ginseng berry extract 5%.
배양액의 pH는 영양분, 성장인자 등의 세포막 이동속도에 영향을 미치며, 외부의 pH가 변하면 영양물질 분자의 이온화 경향이 달라져 물질 흡수 능력에 차이를 보이기 때문에 미생물의 증식과 생산에 중요한 역할을 한다(Wang DIC et al 1979). 최적 pH를 결정하기 위해서 MMY2S5GB 배지의 pH를 20% HCl 및 NaOH를 이용하여 3, 4, 5, 6, 7로 조절하여 30℃에서 배양한 결과, 5, 6, 7의 pH 배지에서 활발한 성장을 보였으며, 그 중에서 pH 7에서 가장 잘 증식하는 것으로 확인되었다. 그러나 pH 3에서는 성장이 거의 일어나지 않았다(Fig. 1B).
따라서 Lactobacillus sp. strain KYH에 의한 진생베리 발효의 최적 조건으로는 30℃, pH 7인 것으로 확인할 수 있었다.
3. 발효기에서의 Lactobacillus sp. Strain KYH에 의한 진생베리 발효
회분식 발효는 발효조를 사용하여 배양의 경과에 따라 배지성분이 감소되어 기질이 완전히 소비될 때까지 배양을 계속하여 미생물의 증식과 생성물을 축적하는 폐쇄(closed system) 발효 공정이다. Kim ST 등(2013)은 Lactobacillus plantarum, Bacillus subtilis에 의한 인삼열매 증포추출물의 발효 연구에서는 발효 최적 시점이 48 hr 이내라고 보고하였다. 본 연구에서는 발효가 진행하는 동안 진세노사이드 Re 및 TGS(total ginsenosides)의 양은 크게 변화하지 않았다. 따라서 균체의 증식이 정상기에 접어드는 60시간 이내를 발효의 최적시간으로 평가하였다. Fig. 2에서 보여주는 것처럼 균주의 증식 kinetics를 보면 상당히 긴 유도기(약 48 hr)가 진행되어 아마 진생베리 추출액이 균주의 증식을 억제하는 물질이 포함된 것으로 생각된다(Lee JS et al 2008). 발효액의 pH 변화에서도 같은 경향을 보였다. 진세노사이드 Re의 양은 발효액을 기준으로 약 1.45 mg/mL이었고, TGS(total ginsenosides)는 약 3.4 mg/mL이었다(Fig. 2).
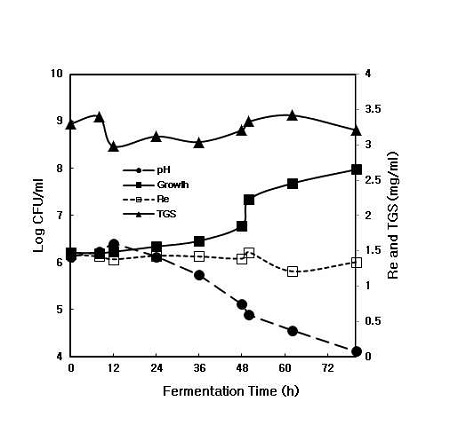
Kinetics of growth and change of ginsenoside Re and total ginsenosides (TGS) during the batch fermentation of Lactobacillus sp. strain KYH.Fermentation medium was mineral medium (3 g K2HPO4, 0.2 g MgSO4, 0.05 g CaCl2, 0.1 g NaCl per 1 L water), yeast extract 0.5%, sucrose 2% and ginseng berry extract 5%. Fermentation was performed on shaking incubator at 30℃, 100 rpm, and pH 7.
회분식 발효에서 진생베리의 균주 증식 억제 현상을 발견하였기 때문에 본 연구에서는 fed-batch(two-stage) 발효를 수행하였다. 먼저 균주를 대수기까지 증식을 한 후에 진생베리 농축액(20 ˚Brix)을 1 mL/min 속도로 공급을 하였다. 균주 증식의 대수기는 발효 개시 후 12 hr 지나 형성이 되었고, 이후로 농축액을 공급하기 시작하였으며, 진생베리 발효는 17 hr 동안 수행되었다. 발효 후 진세노사이드 Re의 양은 발효액을 기준으로 약 2.3 mg/mL이었고, TGS(total ginsenosides)의 양은 5.76 mg/mL이었다(Fig. 3). Kang BH 등(2013)은 유산균을 이용한 인삼 및 홍삼 추출물의 발효에서 진세노사이드 함량을 분석한 결과, 발효 전과 비교하였을 때 진세노사이드 Re의 함량이 감소하였다고 보고하였다.
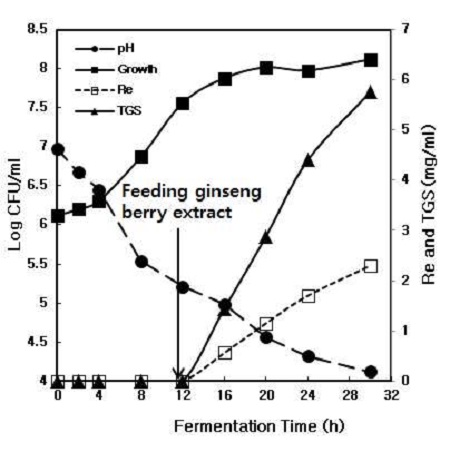
Kinetics of growth and change of ginsenoside Re and total ginsenosides (TGS) during the fed-batch fermentation of Lactobacillus sp. strain KYH.Fermentation medium was mineral medium (3 g K2HPO4, 0.2 g MgSO4, 0.05 g CaCl2, 0.1 g NaCl per 1 L water), yeast extract 0.5% and sucrose 2%. Fermentation was performed on shaking incubator at 30℃, 100 rpm, and pH 7.0 Flow rate of ginseng berry was 1 mL/min.
4. 진생베리 발효 추출물 성분 분석
진생베리 구성 유기산 분석을 위하여 ion chromatography를 이용하였고, 그 결과는 Table 1과 같다. 분석 대상 유기산들은 oxalic acid, citric acid, malic acid, tartaric acid, lactic acid, formic acid, succinic acid들이다. 발효 전 진생베리 추출물과 발효 후 진생베리 추출물의 유기산 분포는 차이가 있었다. 발효 전 진생베리 추출물의 경우에는 lactic acid와 acetic acid 등이 주종을 이루고 있는 반면에, 발효 후 진생베리 추출물에는 citric acid 및 oxalic acid 등이 주종을 이루었다.
진생베리 추출물의 주요 구성당의 결과는 Table 2와 같다. 구성당은 glucose 및 fructose들이 주종을 이루고 있는데, 발효 전 진생베리 추출물과 발효 후 진생베리 추출물의 양은 크게 차이가 났다. Rhamnose, ribose, mannose, galactose, xylose는 발효 후에 감소하였다. 이는 당들이 발효로 인하여 소비된 것으로 보여진다. 반면에 maltose는 발효 후에 양이 증가되었다. 아마도 진생베리의 다당류가 가수분해된 것으로 보여진다.
아미노산은 핵산관련 물질, 지방산, 펩티드, 유산, 유리당, 카보닐 화합물, 휘발성 화합물 등과 함께 풍미를 형성하는 물질로 알려져 있으며(Calkins CR & Hodgen JM 2007), 맛에도 영향을 미친다. 단맛은 glycine, alanine, threonine, proline, serine 등 쓴맛은 leucine, isoleucine, methionine, phenylalanine, lysine, valine, histidine, arginine 등, 신맛은 aspartic acid, 감칠맛은 glutamic acid가 있다(Brand JG & Bryant BP 1994).
발효 전 진생베리 추출물과 발효 후 진생베리 추출물의 총 아미노산의 함량은 Table 3과 같다. 진생베리 발효 전과 발효 후 추출물의 아미노산 함량은 aspartic acid과 glycine이 가장 많이 함유되었으며, 그 다음으로 glutamic acid, alanine, leucine 순이었다. 아미노산의 총 함량은 발효 전 진생베리 추출물은 723.7 mg/g이고, 발효 후 진생베리 추출물은 930.3 mg/g이었다. 따라서 본 연구 결과는 발효 후에 총 아미노산의 함량이 약 22% 정도 증가하였다.
발효 전 진생베리 추출물과 발효 후 진생베리 추출물의 TLC chromatograms을 이용한 진세노사이드의 분포는 Fig. 4와 같다. Jeon JM 등(2011)에서는 진생베리 발효 시 진세노사이드 Re, Rc, Rb1의 함량이 증가되었고, Kim ST 등(2013)에서는 진세노사이드 Rh1, Rg2, Rd, Rg3, Rh2의 함량이 증가되었다. 본 연구에서 발효 전 진생베리 추출물과 발효 후 진생베리 추출물을 비교하였을 때 진세노사이드의 분석결과는 Table 4와 같다. 진세노사이드 Re는 발효에 상관없이 가장 많은 함량을 보였으나, 발효 전 진생베리 추출물에는 발효 후 진생베리 추출물보다 진세노사이드 Rb1, Rc, Rd의 함량이 많았다. 반면에 진생베리 발효 후 추출물에는 진생베리 발효 전 추출물에서 확인되지 않았던 진세노사이드 Rh1와 Rh2가 확인되었다. 이는 진세노사이드 Re는 Rg2로 진세노사이드 Rg1은 Rh1으로 생물전환이 된 것으로 보여진다(Kim SJ et al 2013; Quan LH et al 2012; Stritularak B et al 2009). 발효 처리한 인삼 및 홍삼 추출물에서도 발효 전과 비교하였을 때 진세노사이드 Rg1, Rc는 감소되었고, 반면에 진세노사이드 Rd, Rh1, Rh2, Rg2 및 Rg3의 양은 증가되었다(Lee AR & Park JH 2015; Kang BK et al 2013; Lee KS et al 2010).
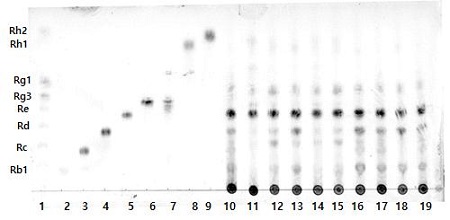
TLC chromatograms of ginsenosides of ginseng berry fermentation.Numbers from 1 to 9 represent ginsenoside standards (Rb1, Rc, Rd, Re, Rg3, Rg1 and Rh2), Rb1, Rc, Rd, Re, Rg3, Rg5+Rk1, Rh1 and Rh2, respectively. Numbers 10 to 11 represents the distribution of ginsenosides before fermentation, ginsenosides after fermentation.
5. 항산화능 분석
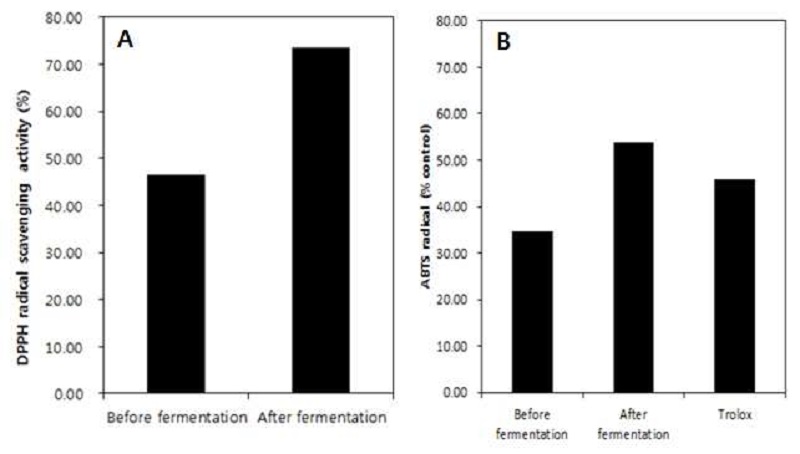
발효 전 진생베리 추출물과 발효 후 진생베리 추출물에 대한 총 페놀 화합물 및 플라보노이드 함량을 비교하였다. 총 페놀성 화합물의 함량은 gallic acid를 대표 지표 물질로 하여 측정을 하였는데, 발효 전 진생베리 추출물에는 99.99 GAE mg/g의 총 페놀 함량이 있는 것으로 측정이 되었고, 발효 후 진생베리 추출물에는 143.88 GAE mg/g으로 약 43.8% 증가된 것으로 나타났다(Fig. 5A).
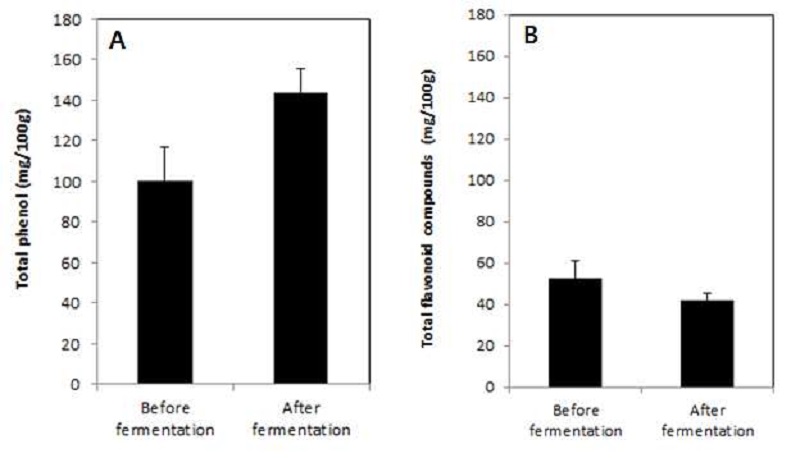
Amounts of total phenol compounds (A) and total flavonoid compounds (B) of ginseng berry extracts by fermentation.
총 플라보노이드 화합물은 hesperidin을 대표 지표 물질로 하여 측정을 하였는데, 발효 전 진생베리 추출물에는 52.47 mg/g의 총 플라보노이드 함량이 있는 것으로 측정이 되었고, 발효 후 진생베리 추출물에는 42.07 mg/g으로 약 19.8% 감소된 것으로 나타났다(Fig. 5B). 따라서 본 연구 결과는 총 페놀 화합물의 함량은 약 44% 정도 증가하였고, 총 플라보노이드의 함량은 약 20% 정도 감소하였다. Kang BH 등(2013)와 Lee KS 등(2010)의 연구결과는 인삼 및 홍삼 추출물의 총 페놀 함량은 발효 후에 약간 감소되었고, 총 플라보노이드 함량은 발효 후에 증가된다고 보고하였다.
DPPH의 측정 방법은 산소인 자유 라디칼이 생체 고분자들인 지질 단백질 등과 결합을 하여 피부의 노화 및 질병을 유발하는 물질로 밝혀진 이래로 항산화 물질의 라디칼 소거능력에 이용되고 있다(Pitchumoni SS & Doraiswamy PM 1998).
발효 전 진생베리 추출물과 발효 후 진생베리 추출물의 DPPH 소거능력 및 총 항산화 활성 능력에 대한 측정 결과는 Fig. 6과 같다. DPPH 소거능력은 발효 전 진생베리 추출물은 46.5%이고, 발효 후 진생베리 추출물은 73.67%이었다. 이와 유사한 연구로 Jeon JM 등(2011)에서 DPPH 소거능은 진생베리 추출물에는 54.30%이고, 발효 후에는 86.39%로 증가되었다. ABTS는 sodium persulfate 첨가에 의하여 ABTS 라디칼로 전환이 되어 파랑색으로 된다. ABTS 라디칼은 항산화 기능을 나타내는 비타민 C, 글루타티온, 페놀 화합물과 반응을 하여 무색의 중성 형태로 전환이 된다. 반응을 하지 않는 경우에는 ABTS는 안정화 되어 있지만 페놀성 화합물과는 강렬하게 반응을 하여 점차 무색으로 된다(Miller NJ 1993). 총 항산화 능력은 trolox를 대표 지표 물질로 하여 측정하였는데 발효 전 진생베리 추출물은 34.6%이고, 발효 후 진생베리 추출물은 53.97%이었다. 따라서 진생베리 추출물의 항산화 능력은 발효를 통하여 약 19.37% 증가하였다. 진생베리 발효 추출물의 항산화 능력은 표준물질인 trolox보다 약 5.97% 이상 증가함을 보여주었다(Fig. 6). 이와 유사한 연구로 발효 처리한 인삼의 DPPH 및 ABTS는 발효 전보다 증가되었다(Lee AR & Park JH 2015). 발효는 항산화 활성 능력을 증가시켜주는 것으로 예상할 수 있다.
요 약
인삼의 열매인 진생베리는 항암, 항염증, 혈당저하 등의 효능이 있는 것으로 보고되어 오고 있다. 진생베리와 같은 약리활성의 물질들은 생체이용률이 높을 때 높은 효능을 보이는 것으로 알려졌다. 발효는 세포내 조직에 결합되어 있던 생리활성 물질들을 유리시키기 때문에 생체이용율(bioavailability)이 높이는 것으로 알려졌다. 따라서 본 연구에서는 김치로부터 적합한 생체친화성 균주를 선발하여 최적의 발효공정을 확립하고, 발효생성물의 영양성분 및 진세노사이드의 변화와 항산화 활성을 연구하였다. 김치로부터 분리된 발효 균주는 16S rDNA 염기서열을 비교하여 Lactobacillus sp. strain KYH로 동정되었다. 최적 발효 공정을 수행한 결과, 최적 발효조건은 온도 30℃와 pH 7로 결정되었다. 발효는 회분식 및 유가식 공정으로 수행을 하였다. 회분식 발효에서는 고농도의 진생베리 추출물의 증식속도가 낮아 유가식 배양을 수행하였다. 발효 후 영양성분 및 진세노사이드의 변화와 항산화 특성을 분석한 결과, 유기산은 발효 전 진생베리 추출물의 경우에는 lactic acid 와 acetic acid 등이 주종을 이루고 있는 반면에, 발효 후 진생베리 추출물에는 citric acid 및 oxalic acid 등이 주종을 이루었다. 발효 후에 당의 함량이 감소되었고, 구성 당은 glucose와 fructose가 주종을 이루었다. 진생베리 발효 추출물에는 glutamic acid, glycine, leucine, histidine, arginine과 같은 아미노산들의 함량이 높아졌다. 진세노사이드 Re는 발효에 상관없이 가장 많은 함량을 보였으나, 발효 전 진생베리 추출물에는 발효 후 진생베리 추출물에서 보다 진세노사이드 Rb1, Rc, Rd의 함량이 많았다. 반면에 진생베리 발효 후 추출물에는 진생베리 발효 전 추출물에서 확인되지 않았던 진세노사이드 Rh1와 Rh2가 확인되었다. 총 페놀, 플라보노이드 함량의 변화는 발효 전 후에 변화가 있었는데, 총 페놀량은 43.8% 증가하였고, 플라보노이드 함량은 19.8% 감소하였다. DPPH 소거능 및 총 항산화 능력은 발효 후에 각 각 27.2%와 19.4% 증가하였다. 따라서 Lactobacillus sp. strain KYH를 이용하여 최적의 조건 하에 발효된 진생베리 추출물의 진세노사이드 등 생리활성 성분 변화와 증대된 항산화 활성을 확인할 수 있었다.
Acknowledgments
본 연구는 2014년도 미래창조과학부 한국연구재단(과제번호: 2014R1A2A2A04005236)의 지원을 받아 수행된 연구결과로 이에 감사드립니다.
References
-
Amidon, GL., Lennernas, H., Shah, VP., Crison, JR., (1995), A theoretical basis for a biopharmaceutics drug classification: The correlation of in vitro drug product dissolution and in vivo bioavailability, Pharm Res, 12, p413-420.
[https://doi.org/10.1023/A:1016212804288]

-
Ando, T., Tanaka, O., Shibata, S., (1980), Preparation of anti-lipolytic substance from Panax ginseng, Planta Med, 38, p18-23.
[https://doi.org/10.1055/s-2008-1074832]

-
Attele, AS., Wu, CS., Yuan, JA., (1999), Multiple pharmacological effects of ginseng, Biochem Pharmacol, 58, p1685-1693.
[https://doi.org/10.1016/S0006-2952(99)00212-9]

-
Attele, AS., Zhou, YP., Xie, JT., Wu, IA., Zhang, L., Dey, L., Pugh, W., Rue, PA., Polonsky, KS., Yuan, CS., (2002), Antidiabetic effects of Panax ginseng berry extract and the identification of an effective component, Diabetes, 51, p1851-1858.
[https://doi.org/10.2337/diabetes.51.6.1851]

- Blois, MS., (2004), Antioxidant determinations by the use of a stable free radical, Nature, 18, p1000.
-
Brand, JG., Bryant, BP., (1994), Receptor mechanisms for flavour stimuli, Food Qual Prefer, 5, p31-40.
[https://doi.org/10.1016/0950-3293(94)90006-X]

-
Calkins, CR., Hodgen, JM., (2007), A flesh look at meat flavor, Meat Sci, 77, p63-80.
[https://doi.org/10.1016/j.meatsci.2007.04.016]

-
Chen, GT., Tang, M., Song, Y., Lu, ZQ., Zhang, JQ., Huang, HL., Wu, LJ., Guo, DA., (2008), Microbial transformation of ginsenoside Rb1 by Acremonium strictum, Applied Microbial Biotechnol, 77, p1345-1350.
[https://doi.org/10.1007/s00253-007-1258-4]

-
Cheng, LG., Na, JR., Bang, MH., Kim, MK., Yang, DC., (2008), Conversion of major ginsenoside Rb1 to 20(S)-ginsenoside Rg3 by Microbacterium sp. GS514, Phytochemistry, 69, p218-224.
[https://doi.org/10.1016/j.phytochem.2007.06.035]

-
Chi, H., Ji, GE., (2005), Transformation of ginsenosides Rb1 and Re from Panax ginseng by food microorganisms, Biotechnology Letters, 27, p765-771.
[https://doi.org/10.1007/s10529-005-5632-y]

-
Choi, KT., (2008), Botanical characteristics, pharmacological effects and medicinal components of Korean Panax ginseng CA Meyer, Acta Pharmacol Sinica, 29, p1109-1118.
[https://doi.org/10.1111/j.1745-7254.2008.00869.x]

-
Corthout, J., Naessens, T., Apers, S., Vlietinck, AJ., (1999), Quantitative determination of ginsenosides from Panax ginseng roots and ginseng preparations by thin layer chromatography densitometry, J Pharm Biomed Anal, 21, p187-192.
[https://doi.org/10.1016/S0731-7085(99)00109-0]

-
Dewanto, V., Wu, X., Adom, KK., Liu, RH., (2002), Thermal processing enhances the nutritional values of tomatoes by increasing total antioxidant activity, J Agri Food Chem, 50, p3010-3014.
[https://doi.org/10.1021/jf0115589]

-
Dey, L., Xie, JT., Wang, A., Wu, J., Maleckar, SA., Yuan, C., (2003), Antihyperglycemic effects of ginseng: Comparison between root and berry, Phytomedicince, 10, p600-605.
[https://doi.org/10.1078/094471103322331908]

-
Huang, YC., Chen, CT., Chen, SC., Laing, PH., Chang, Y., Yu, LC., Sung, HW., (2005), A natural compound (ginsenoside Re) isolated from Panax ginseng as a novel angiogenic agent for tissue regeneration, Pharmaceutical Research, 22, p636-645.
[https://doi.org/10.1007/s11095-005-2500-3]

-
Hubert, J., Berger, M., Nepveu, F., Paul, F., Dayde, J., (2008), Effects of fermentation on the phytochemical composition and antioxidant properties of soy germ, Food Chem, 109, p709-721.
[https://doi.org/10.1016/j.foodchem.2007.12.081]

- Jeon, JM., Choi, SK., Kim, YJ., Jang, SJ., Cheon, JW., Lee, HS., (2011), Antioxidant and antiaging effect of ginseng berry extract fermented by lactic acid bacteria, J Soc Cosmet, 37, p75-81.
-
Kang, BH., Lee, KJ., Hur, SS., Lee, DS., Lee, SH., Shin, KS., Lee, JM., (2013), Ginsenoside derivatives and quality characteristics of fermented ginseng using lactic acid bacteria, Korean J Food Preserv, 20, p578-582.
[https://doi.org/10.11002/kjfp.2013.20.4.573]

-
Katina, K., Liukkonen, KH., Kaukovirta-Norja, A., Adlercreutz, H., Heinonen, SM., Lampi, AM., (2007), Fermentation induced changes in the nutritional value of native or germinated rye, J Cereal Sci, 46, p348-355.
[https://doi.org/10.1016/j.jcs.2007.07.006]

- Kim, EY., Baik, IH., Kim, JH., Kim, SR., Rhyu, MR., (2004), Screening of the antioxidant activity of some medicinal plants, Kor J Sci Technol, 36, p333-338.
-
Kim, HB., Lim, KH., Kang, CW., Kim, BS., Roh, YS., Kwon, J., Kim, S., Ejaz, S., Kim, JH., (2011), Influence of ginsenoside-Re against myocardial infarction in isolated heart, Mol Cell Toxicol, 7, p15-24.
[https://doi.org/10.1007/s13273-011-0003-3]

-
Kim, SJ., Kim, JD., Ko, SK., (2013), Changes in ginsenoside composition of ginseng berry extracts after a microwave and vinegar process, J Ginseng Res, 37, p269-272.
[https://doi.org/10.5142/jgr.2013.37.269]

-
Kim, ST., Kim, HJ., Jang, SK., Lee, DI., Joo, SS., (2013), Establishment of optimal fermentation conditions for steam dried ginseng berry via friendly bacteria and its antioxidant activities, J Food Sci, 45, p77-83.
[https://doi.org/10.9721/kjfst.2013.45.1.77]

-
Lee, AR., Park, JH., (2015), Antioxidant and hepatoprotective effects of hydroponic cultured ginseng folium by fermentation, Kor J Herbol, 30, p101-108.
[https://doi.org/10.6116/kjh.2015.30.4.101.]

- Lee, BH., You, HJ., Park, MS., Kwon, B., Ji, GE., (2006), Transformation of the glycosides from food materials by probiotics and food microorganisms, J Microbiol Biotechnol, 16, p497-504.
-
Lee, JS., Kim, GN., Jang, HD., (2008), Effect of red ginseng extract on storage and antioxidant activity of tofu, J Korean Soc Food Sci Nutr, 37, p1497-1506.
[https://doi.org/10.3746/jkfn.2008.37.11.1497]

-
Lee, KS., Seong, BJ., Kim, KH., Kim, SI., Han, SH., Kim, HH., Baik, ND., (2010), Ginsenoside, phenolic acid composition and physiological significances of fermented ginseng leaf, J Kor Soc Food Sci Nutr, 39, p1194-1200.
[https://doi.org/10.3746/jkfn.2010.39.8.1194]

-
Lee, KW., Jung, SY., Choi, SM., Yang, EJ., (2012), Effects of ginsenoside Re on LPS-induced inflammatory mediators in BV2 microglial cells, BMC Complementary and Alternative Medicine, 12, p196-203.
[https://doi.org/10.1186/1472-6882-12-196]

- Lee, SY., Kim, YK., Park, NI., Kim, CS., Lee, CY., Park, SU., (2010), Chemical constituents and biological activities of the berry of Panax ginseng, J Med Plant Res, 4, p349-353.
-
Lee, YJ., Jin, YR., Urn, WC., Ji, SM., Cho, JY., Ban, JJ., Lee, SK., (2003), Ginsenoside Rc and Re stimulate c-Fos expression in MCF-7 human breast carcinoma cells, Arch Pharm Res, 26, p53-57.
[https://doi.org/10.1007/BF03179932]

-
Lim, KH., Lim, DJ., Kim, JH., (2013), Ginsenoside Re ameliorates ischemia and reperfusion injury in the heart: A hemodynamics approach, J Ginseng Res, 37, p283-292.
[https://doi.org/10.5142/jgr.2013.37.283]

-
Liyana, PCM., Shahidi, F., (2006), Importance of insoluble bound phenolics to antioxidant properties of wheat, J Agri food Chem, 54, p1256-1264.
[https://doi.org/10.1021/jf052556h]

-
Miller, NJ., Davis, MJ., Copinaththan, V., Milner, A., (1993), A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates, Clinical Science, 26, p265-277.
[https://doi.org/10.1042/cs0840407]

-
Park, EY., Kim, HJ., Kim, YK., Park, SU., Choi, JE., Cha, JY., Jun, HS., (2012), Increase in insulin secretion induced by Panax ginseng berry extracts contributes to the amelioration of hyperglycemia in streptozotocin induced diabetic mice, J Ginseng Res, 36, p153-160.
[https://doi.org/10.5142/jgr.2012.36.2.153]

- Park, YS., Jang, HG., (2003), Evaluation of physiological activity and lactic acid fermentation of Rubus Coreanus Miq, J Kor Soc Agric Chem Biotechnol, 46, p367.
-
Pitchumoni, SS., Doraiswamy, PM., (1998), Current status of antioxidant therapy for Alzheimer’s disease, J Am Geriatr Soc, 46, p1566-1572.
[https://doi.org/10.1111/j.1532-5415.1998.tb01544.x]

-
Qi, LW., Wang, CZ., Yuan, CS., (2011), Ginsenosides from American ginseng: Chemical and pharmacological diversity, Phytochemistry, 72, p689-99.
[https://doi.org/10.1016/j.phytochem.2011.02.012]

-
Quan, LH., Min, JW., Sathiyamoorthy, S., Yang, DU., Kim, YJ., Yang, DC., (2012), Biotransformation of ginsenosides Re and Rg1 into ginsenosides Rg2 and Rh1 by recombinant glucosidase, Biotechnol Lett, 34, p913-917.
[https://doi.org/10.1007/s10529-012-0849-z]

- Rajan, KN., Rajendan, AD., (2009), Effect of fermentation parameters on extra cellular tannase production by Lactobacillus plantarum MTCC 1407, E J Chemistry, 6, p979.
- Saleh, ES., Hameed, A., (2008), Total phenolic contents and free radical scavenging of certain Egyptian ficus species leaf samples, Food Chem, 114, p1271-1277.
- Shin, JH., Yoo, SK., (2012), Antioxidant properties in microbial fermentation products of Lonicera japonica Thunb extract, J East Asian Soc Dietary Life, 22, p98-102.
-
Sritularak, B., Morinaga, O., Yuan, CS., Shoyama, Y., Tanaka, H., (2009), Quantitative analysis of ginsenosides Rb1, Rg1, and Re in American ginseng berry and flower samples by ELISA using monoclonal antibodies, J Nat Med, 63, p360-363.
[https://doi.org/10.1007/s11418-009-0332-x]

-
Thomson, JD., Higgins, DG., Gibson, TJ., (1994), Crustal improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions specific gap penalties and weight matrix choice, Nucleic Acids Res, 22, p4673-4680.
[https://doi.org/10.1093/nar/22.22.4673]

-
Wang, CZ., Wu, JA., McEntee, A., Yuan, CA., (2006), Saponins composition in American ginseng leaf and berry assayed by high performance liquid chromatography, J Agric Food Chem, 54, p2261-2266.
[https://doi.org/10.1021/jf052993w]

-
Wang, CZ., Yuan, CS., (2008), Potential role of ginseng in the treatment of colorectal cancer, Am J Chin Med, 36, p1019-1028.
[https://doi.org/10.1142/S0192415X08006545]

-
Wang, CZ., Zhang, B., Song, WX., Ni, M., Luo, X., Aung, HH., Xie, JT., Robin, T., Tong, CH., Yuan, CH., (2006), Steamed American ginseng berry: Ginsenoside analyses and anticancer activities, J Agric Food Chem, 54, p9936-9942.
[https://doi.org/10.1021/jf062467k]

- Wang, DIC., Cooney, CL., Demain, AL., Dunnill, P., Humphrey, AE., Lilly, MD., (1979), Fermentation and Enzyme Technology, John Wiley & Sons, USA, 6, p87-90.
-
Xie, JT., Du, GJ., McEntee, E., Aung, HH., He, H., Mehendale, SR., Wang, CZ., Yuan, CS., (2011), Effects of triterpenoid glycosides from fresh ginseng berry on SW480 human colorectal cancer cell line, Cancer Res Treat, 43, p49-55.
[https://doi.org/10.4143/crt.2011.43.1.49]

-
Xie, JT., Wang, CZ., Ni, M., Wu, JA., Mehendale, SR., Aung, HH., Foo, A., Yuan, CS., (2007), American ginseng berry juice intake reduces blood glucose and body weight in ob/ob mice, J Food Sci, 72, p590-594.
[https://doi.org/10.1111/j.1750-3841.2007.00481.x]