
미숙과 건여주(Momordica charantia L.) 열수 및 에탄올 추출물의 탄수화물 분해효소 저해 활성 및 항염증 활성에 대한 연구
Abstract
Bitter melon (Momordica charantia L.) has been used as a medicinal plant due to its biological activity. This study investigated the inhibitory effects on carbohydrase and anti-inflammatory effects of hot-water extract (WEM) and ethanol extract (EEM) from dried bitter melon cultivated in Korea. The inhibitory activities of EEM against α-amylase and α-glucosidase were over 70% at 4,000 ppm. The inhibitory activities of EEM were significantly higher than those of WEM at all concentrations. The anti-inflammatory effects were evaluated by measuring nitric oxide (NO) production in LPS-stimulated RAW264.7 cells. EEM did not show cytotoxicity on RAW264.7 cells at the test concentrations. Moreover, the inhibitory effect on NO production in LPS-stimulated RAW264.7 cells was significantly increased by the addition of EEM. These findings suggest that EEM has good inhibitory effect on carbohydrase and anti-inflammatory activity and it has potential as a source of natural functional material.
Keywords:
Bitter melon, carbohydrase, anti-inflammatory activity서 론
경제 성장으로 생활양식이 편리해지고, 식생활의 서구화 및 음식의 과잉섭취 등으로 비만, 당뇨, 암 등 각종 성인병의 발병율이 증가하고 있어 성인병을 예방하고 개선하기 위해 천연물의 생리활성에 관한 연구들이 활발히 수행되고 있다(Lim SJ & Kim SH 2001). 여주(Momordica charantia L.)는 박과에 속하는 1년생 덩굴성 식물로 쓴맛이 나며, 외관은 긴 타원형 또는 난형 형태로 오이와 비슷하나, 겉에 돌기가 있으며, 돌기가 많을수록 유용성분이 많고, 쓴맛이 강한 것으로 알려져 있다(Day C et al 1990; Pugazhenthi S & Murthy PS 1995). 여주는 특유의 쓴맛 때문에 bitter melon, bitter cucumber, bitter gourd라고 불리며, 생김새로 인해 balsam pear, balsam apple이라고도 한다(Lee JW 2010). 여주는 덜 익은 미숙과일 때는 녹색이며, 완숙되면 주황색이 되고, 내부에 있는 종자는 홍색 종피로 싸여 있다(Sin SM 2012). 여주 미숙과에는 비타민 C, 비타민 A와 같은 비타민과 칼륨, 철분 등의 미네랄이 풍부하다(Grover JK & Yadav SP 2004). 여주의 미숙과, 종자, 뿌리, 줄기, 잎은 약용으로 많이 이용하며, 미숙과 및 성숙과, 홍색 종피는 식용으로 사용되고 있다(Raman A & Lau C 1996; Shin JS 2012). 여주는 항바이러스, 항당뇨, 항궤양 및 혈압강하 기능 등을 가지고 있다고 보고되었으며(Ng TB et al 1992; Raman A & Lau C 1996; Basch E et al 2003), 그밖에 야맹증, 피부병, 구충, 류머티스, 통풍, 폐렴, 황달, 소화궤양, 생리통 등에도 효과가 있는 것으로 알려져 있다(Grover JK & Yadav SP 2004).
여주와 관련된 선행 연구로는 대만산 야생 여주의 항산화 및 free radical 소거능 활성(Wu SJ & Ng LT 2008), 여주 종자를 정유한 오일의 화학성분 및 항균활성(Alessandra B et al 2008), 쥐를 이용한 여주 메탄올 추출물의 항궤양 활성(Alam S et al 2009), 여주 추출물의 항산화 활성(Park Y et al 2007) 등이 보고되었으나, 아직까지 여주 미숙과의 생리활성에 대한 연구는 미흡한 실정으로, 본 연구에서는 국내산 미성숙 건여주 열수 및 에탄올 추출물의 탄수화물 분해효소저해활성 및 항염증 활성에 대해 분석하고, 기능성 식품소재로서의 이용 가능성을 살펴보았다.
재료 및 방법
1. 실험재료
본 실험에 사용된 여주는 경남 함양군에서 미숙과 상태로 채취하여 건조시킨 것을 구입하여 사용하였다.
2. 시약
실험에 사용된 dimethylsulfoxide(DMSO), thiazoly blue te- trazolium bromide(MTT), glutaraldehyde solution, N-(1-naphtyl) ethylenediamine dihydrochloride, ρ-nitrophenyl-α-D-gluco-py- ranoside, α-glucosidase(from Bacillus stearothermophilus), α-amylase(from porcine pancreas), 3,5-dinitrosalicylic acid는 Sigma Chemical Co.(USA)에서 구입하였으며, fetal bovine serum(FBS), Dulbecco's modified Eagle's minimal essential medium(DMEM/High glucose), roswell park memorial insti- tute medium(RPMI-1640, with L-glutamin)는 Hyclone Co.(USA)에서 구입하여 사용하였다.
3. 건여주 추출물 제조
건여주 추출물은 열수와 에탄올로 추출하여 제조하였다. 열수 추출물은 건여주 100 g에 증류수 2 L를 가하여 65℃의 수조에서 4시간 동안 추출한 후 원심분리하여 상등액을 얻었다. 이를 여과지(Toyo No. 2, Advantec. Japan)를 이용하여 여과한 후 감압농축기(LABOROTA 4000-efficient, Heidolph Instruments GmbH & Co. Germany)를 이용하여 농축한 뒤 동결건조하였다. 에탄올 추출물은 건여주 100 g에 80% 에탄올 2 L를 가하여 25℃, 108 rpm으로 24시간 동안 진탕 추출하였다. 추출 후 여과지로 여과하여 농축한 뒤 동결 건조하여 시료로 사용하였다. 건조된 추출물은 –20℃에서 냉동 보관하였다.
4. 탄수화물 분해효소 저해 활성 측정
건여주 열수 및 에탄올 추출물의 α-glucosidase 저해 활성은 Watanabe J 등(1997)의 방법을 이용하여 측정하였다. 0.2% bovine serum albumin과 0.02% NaN3을 함유한 100 mM potassium phosphate buffer(pH 7.0)를 용매로 하여 농도별 시료와 α-glucosidase 용액(70 unit/mL) 및 5 mM pNPG(ρ-nitro- phenyl-α-D-glucopyra- noside)를 제조하였다. 96 well plate에 시료 10 μL와 α-gluco- sidase 용액 50 μL를 주입하고, 바로 ELISA reader(Tecan- Sunrise, Komabiotech, Australia)를 이용하여 405 nm에서 흡광도를 측정한 후 25℃에서 5분간 반응시켰다. 여기에 5 mM pNPG 50 μL를 첨가한 후 다시 25℃에서 5분간 반응시키고, 동일 파장에서 흡광도를 측정하였다. 반응 후 측정한 흡광도에서 초기 흡광도를 뺀 값으로 α-glucosidase의 저해율을 계산하였고, 대조군으로는 acarbose (Gluciobay tab., Bayer Inc. Korea)를 사용하였다.
건여주 추출물의 α-amylase 저해 활성은 Ali H 등(2006)의 방법을 이용하여 측정하였다. 농도별 시료 40 μL와 증류수 160 μL를 넣고 증류수로 제조한 0.5% 전분용액을 넣어 혼합한 후, 200 μL의 α-amylase 용액(4 unit/mL)을 첨가하고 25℃에서 3분간 반응시켰다. 그 후 반응액의 200 μL를 제거하고, DNS(96 mM 3,5-dinitrosalicylic acid : 2M NaOH에 용해한 5.31 M sodium potassium tartrate = 2.5 : 1) 용액 100 μL를 첨가하여 85℃의 수조에서 15분간 반응시킨 후, 증류수 900 μL를 첨가하고 540 nm에서 흡광도를 측정하였다. 시료 무첨가군은 시료 대신 증류수를 첨가하였고, blank test는 효소용액 대신 증류수를 첨가하였으며, 대조군은 acarbose를 사용하였다.
α-Amylase agar diffusion을 이용한 건여주 추출물의 α-amylase 저해 활성은 Lim SH 등(2010)의 방법을 이용하여 측정하였다. 1% soluble starch와 1% agar powder를 증류수에 용해한 후 이를 멸균하여 starch agar plate를 제조하였다. 제조된 starch agar plate 위에 멸균된 paper disc(∅: 6 mm)를 얹고, syringe filter(pore size 0.25 μm)로 제균한 4,000 ppm 농도의 시료 11.2 μL와 α-amylase 용액(300 unit/mL) 8.8 μL를 섞어 분주하였다. 37℃에서 3일간 반응시킨 후 3% KI에 용해한 5 mM I2 용액 4 mL를 가해 15분간 발색시켜 나타나는 환의 반지름을 측정하여 환의 면적을 산출하였으며, 시료 무첨가군의 면적에 대한 % 비율로 저해율을 나타내었다. 시료 무첨가군는 시료 대신 증류수를 첨가하였으며, 대조군은 acarbose를 시료와 동일한 농도로 제조하여 사용하였다.
5. 항염증 활성 측정
RAW264.7 대식세포는 한국세포주은행(KCLB)에서 분양받아 사용하였다. RAW264.7 대식세포는 10% FBS, 1% penicillin이 첨가된 RPMI-1640 배지에서 배양하였으며, 37℃, 5% CO2 조건하에서 계대배양하며 사용하였다.
RAW264.7 대식세포의 생존율은 Carmichael J 등(1987)의 방법을 이용하여 MTT assay를 실시하여 측정하였다. 세포가 1×105 cells/well이 되도록 배양액으로 희석한 후 96 well plate에 180 μL씩 분주하여 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 배양액 80 μL를 제거하고, 농도별 시료를 100 μL씩 각 well에 분주한 후 48시간 동안 배양하였다. 배양 후 증류수로 제조한 5 μg/mL 3-(4,5-dimethylthiazol-2-yl)- 2,5-dimethyl tetrazolium(MTT) 용액 20 μL씩을 첨가하여 4시간 동안 배양한 뒤 배양액을 제거하였다. 배양액이 제거된 각 well에 DMSO : ethanol(1:1) 용액 150 μL를 첨가하여 shaking incubator에서 30분간 교반한 후, ELISA reader를 이용하여 550 nm에서 흡광도를 측정하여 세포독성을 산출하였다.
Lee SJ 등(2012)의 방법을 이용하여 건여주 열수 및 에탄올 추출물의 nitric oxide(NO) 생성량을 측정하였다. RAW264.7 대식세포를 1×105 cells/mL의 농도로 96 well plate에 180 μL씩 분주하여 24시간 배양하고, 농도별 시료를 20 μL씩 처리한 다음, 증류수로 제조한 1 μg/mL lipopolysaccharide(LPS)를 20 μL 처리하여 24시간 동안 배양하였다. 세포 배양액 100 μL와 Griess 시약 100 μL를 혼합하여 상온에서 10분 동안 반응시킨 후 ELISA reader를 이용하여 540 nm에서 흡광도를 측정하고, sodium nitrite로 검정곡선을 작성하여 NO 함량을 산출하였다.
6. 통계분석
본 실험을 통해 얻은 결과들은 SPSS(version 20) program을 이용하여 t-test 및 분산분석(ANOVA, analysis of variance)을 실시하여 분석하였고, 각 시료들 간의 유의성 검증은 Duncan's multiple range test를 이용하여 실시하였다.
결과 및 고찰
1. 탄수화물 분해효소 저해 활성
α-Glucosidase는 소장 상피세포의 Brush-Border membrane에 존재하는 효소로서, 다당류 또는 이당류 탄수화물의 소화, 흡수를 위해 이들을 단당류로 가수분해를 하는 역할을 한다. 따라서 α-glucosidase 활성을 저해하면 식후 혈당 상승이 억제될 수 있으며, 이러한 원리를 이용하여 항당뇨 활성을 측정할 수 있다(Gua J et al 2006). 미성숙 건여주 추출물의 α- glucosidase에 대한 저해 활성 결과는 Table 1과 같다. 미성숙 건여주 열수 및 에탄올 추출물은 모두 당뇨병 치료제로 사용되고 있는 대조군인 acarbose보다 α-glucosidase에 대한 저해 활성이 낮았으나, α-glucosidase에 대한 저해 활성을 가지고 있었으며, α-glucosidase 농도가 높아질수록 α-glucosidase에 대한 저해 활성이 증가하였다. 또한, 에탄올 추출물은 열수 추출물보다 유의적으로 높은 α-glucosidase에 대한 저해 활성을 보였으며, 4,000 ppm 농도에서 에탄올 추출물은 70% 이상의 높은 저해 활성을 나타내었고, 열수 추출물은 50% 이상의 저해 활성을 나타내었다. Kwon YR 등(2014)은 쇠비름의 70% 에탄올 추출물을 이용하여 α-glucosidase 저해 활성을 측정한 결과, 5 mg/mL(5,000 ppm)의 농도에서 48.90%의 저해 활성이 나타났고, acarbose보다 낮은 저해 활성을 나타내었다고 보고하였다. 따라서 본 실험에서 나타난 미숙과 건여주 열수 및 에탄올 추출물의 α-glucosidase 저해 활성은 쇠비름 에탄올 추출물의 저해 활성보다 좀 더 높은 것으로 나타나, 양호한 항당뇨 활성을 가지고 있는 것으로 확인되었다.
α-Amylase는 탄수화물의 α-D-(1,4)-glucan 결합을 분해하는 효소로서, 사람, 동물, 미생물 등의 탄수화물 대사에 있어서 필수적인 효소이다. 그러나 과혈당증이나 인슐린 비의존형 당뇨병과 같은 탄수화물 대사 질환의 치료를 위해서는 당의 소화 및 흡수를 제어할 필요가 있어, 이를 위해 α-amylase 효소에 대한 활성 저해에 관한 연구가 수행되고 있다(Lee BB et al 2008). 본 연구에서 미숙과 건여주 추출물의 α-amylase에 대한 활성 저해를 측정한 결과는 Fig. 1과 같다. 미숙과 건여주 에탄올 추출물과 열수 추출물 모두 α-amylase에 대한 저해 활성을 보였으며, 추출물의 농도가 증가함에 따라 α- amylase에 대한 저해 활성도 증가하는 농도 의존적 활성 억제 양상을 보였다. 특히, 에탄올 추출물의 α-amylase 저해 활성(41.34∼73.37%)은 모든 농도에서 대조군인 acarbose의 저해 활성(10.96∼49.04%) 및 열수 추출물의 저해 활성(12.83∼52.17%)보다 유의적으로 높게 나타났다. 열수 추출물은 α- amylase에 대한 저해 활성은 가지고 있었으나, 대조군인 acar- bose의 α-amylase 저해 활성과 유의적인 차이를 나타내지 않았다.
당뇨병 치료와 관련된 약물들에 대한 부작용들이 보고되고 있는데(Braunwald E et al 2001; Holman RR & Tumer RC 1991), 제2형 당뇨병 치료를 위해 대표적으로 사용되는 혈당강하제인 acarbose는 복부팽만, 설사 등의 부작용을 보이고 있어 최근에는 혈당을 낮추는 효과를 가지는 천연물에 대한 연구가 수행되고 있다. 약용식물을 대상으로 항당뇨 활성을 연구한 Jeong HJ 등(2010)의 연구에서 상엽의 열수와 초음파 추출물은 각각 50.15%와 43.34%의 α-amylase 저해 활성을 보여 66.02%인 acarbose보다 낮은 저해 활성을 나타냈으나, 상엽 에탄올 추출물은 89.70%의 저해 활성을 보여 acarbose보다 높은 저해 활성을 보였으며, 상백피와 백복령 에탄올 추출물은 각각 61.47%와 60.10%로 acarbose와 비슷한 저해 활성을 나타냈다고 보고하였다. 또한 Lee BB 등(2008)은 제비꽃을 용매별로 추출하여 α-amylase 저해 활성을 측정한 결과, 아세톤 추출물(92.51%), 메탄올 추출물(92.28%), 에탄올 추출물(65.70%), 물 추출물(55.26%) 순으로 α-amylase 저해 활성이 나타났다고 보고하였고, Hwang EY 등(2009)은 구기자의 에탄올 및 열수 추출물을 이용하여 α-amylase 저해 활성을 측정한 결과 에탄올 추출물이 대조군인 acarbose보다 IC50값이 2배 이상 낮은 값을 나타내어 당뇨병 약제로서 기능성 효과가 있다고 보고하였다. 본 연구에서 미숙과 건여주 에탄올 추출물은 당뇨병 치료제인 acarbose보다 높은 α-amylase 저해 활성을 보였으며, 1,000 ppm에서 acarbose에 비해 α-amylase 저해 활성이 4.1배로 높게 나타나, 우수한 저해 활성을 가지고 있는 효과적인 천연 당뇨조절제로서의 이용 가능성을 보여주었다.
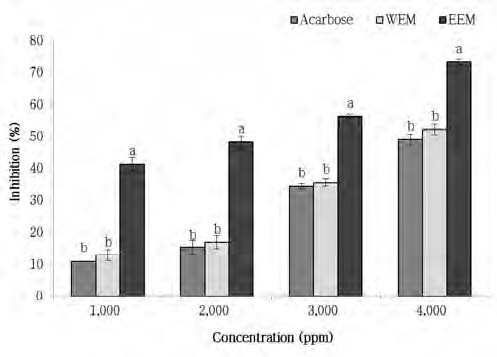
Inhibitory activity of water and ethanol extracts from Momordica charatia L. and acarbose on α-amylase.WEM : Water extract of Momordica charantia L., EEM : Ethanol extract of Momordica charantia L.Means with the different letters are significantly different by Dun- can's multiple range test at the same concentration (p<0.05).
추출물의 α-amylase 저해 활성을 확인하기 위해 전분과 요오드 반응을 이용한 α-amylase agar diffusion 법으로 실험한 결과는 Fig. 2와 같다. α-Amylase agar diffusion 측정에서는 α- amylase 활성에 대한 시료의 억제 활성이 높을수록 전분 분해가 감소하여 요오드와 반응하는 면적은 늘고 clear zone은 줄어들게 되는데, 실험 결과, 열수 추출물과 acarbose의 clear zone은 무첨가군에 비해 감소하였으며, 두 시료 간에는 큰 차이가 나타나지 않았다. 그러나 에탄올 추출물은 무첨가군에 비해 clear zone이 현저히 감소하여 α-amylase에 대한 높은 저해 활성을 가지고 있음을 볼 수 있었다. 환의 반지름을 측정하여 면적을 구해서 시료의 α-amylase 저해율을 산출한 결과(Table 2), 에탄올 추출물은 72.35%, 열수 추출물은 40.76 %, acarbose는 34.75%의 순으로 α-amylase에 대한 저해 활성을 나타내어 앞의 α-amylase 저해 활성 실험과 일치하는 결과를 보여주었다. Lim SH 등(2010)의 연구에서 돌단풍 잎의 에탄올 및 물 추출물을 이용하여 α-amylase 저해 활성에 대한 IC50값을 측정한 결과, 각각 4,623.87과 10,000 μg/mL 이상이었고, 대조군인 acarbose의 IC50값은 5,187.78 μg/mL로 에탄올 추출물의 α-amylase 저해 활성이 물 추출물보다 높았다고 보고하여 본 연구와 유사한 결과를 보였다.
2. 항염증 활성
미숙과 건여주 추출물이 RAW264.7 대식세포에 독성을 나타내는지 확인하기 위해 MTT assay를 이용하여 세포 생존율을 측정하였으며, 그 결과는 Fig. 3과 같다. 미숙과 건여주 추출물을 처리한 결과, 열수 추출물을 처리한 군은 가장 낮은 농도인 25 ppm에서 62.94%의 생존율을 보였으며, 이후 농도가 증가함에 따라 생존율은 낮아지는 것으로 나타났다. 반면, 에탄올 추출물을 처리한 군은 시료 무첨가군과 비교하였을 때 모든 농도에서 90% 이상의 높은 생존율을 나타내었다.

Inhibitory activity of water and ethanol extracts from Momordica charatia L. and acarbose on α-amylase by agar diffusion method
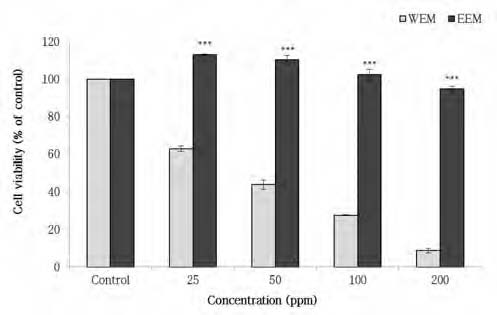
Viability of RAW264.7 cells by treatment of water and ethanol extracts from Momordica charantia L.WEM : Water extract of Momordica charantia L., EEM : Ethanol extract of Momordica charantia L..*** means significant difference between WEM and EEM by student's t-test (p<0.001).
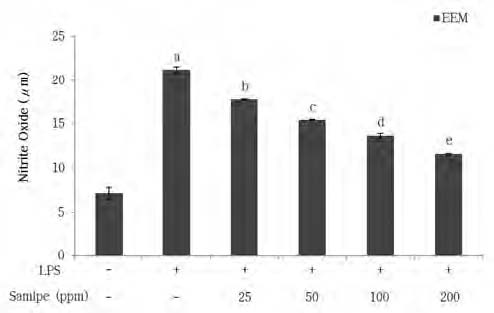
Nitric oxide production in LPS-stimulated RAW264.7 cells by the treatment of ethanol extract from Momordica charantia L.Means with the different letters are significantly different by Dun- can's multiple range test (p<0.05).
항염증 효과가 있는 찔레꽃 나무뿌리의 에탄올 추출물은 100 μg/mL의 농도에서 대식세포에 대해 세포 독성을 나타내었다고 보고되었는데(Park GH et al 2011), 본 연구에서 미숙과 건여주 에탄올 추출물은 200 ppm 농도에서도 94.86%의 높은 세포 생존율을 보여 독성을 거의 나타내지 않는 것으로 나타나, 안전성을 보유한 소재임을 확인할 수 있었다. 이들 결과를 바탕으로 NO 생성량 측정은 대식세포에 대해 독성을 나타낸 열수 추출물을 제외한 에탄올 추출물을 이용하여 수행하였다.
NO 형성은 박테리아를 죽이거나, 종양 제거에 중요한 역할을 하지만, 과도하게 NO가 형성되면 염증이 유발되어, 조직의 손상, 유전자 변이, 신경손상 등을 일으킬 수 있다(Weise F & Nathan CF 1991). LPS로 염증반응을 유도한 RAW264.7 대식세포에 미성숙 건여주 에탄올 추출물을 처리하였을 때의 NO 생성량을 산출한 결과는 Fig. 4와 같다. RAW264.7 대식세포가 기본적으로 생산해 내는 NO 함량을 측정하기 위해 LPS와 시료 모두 처리하지 않고 측정하였을 때 NO 농도는 7.71 μM로 나타났으며, LPS를 처리하였을 때는 21.19 μM로 나타나 LPS 무처리군에 비해 NO 함량이 약 3배 정도 증가하였다. LPS를 처리한 RAW264.7 대식세포에 미 성숙 건여주 에탄올 추출물을 25∼200 ppm의 농도로 처리하여 NO 함량을 측정한 결과, 시료의 농도가 증가함에 따라 NO 함량이 유의적으로 감소하여(17.80∼11.58 μM) 건여주 에탄올 추출물 농도에 의존적인 것을 확인할 수 있었다. 또한 미성숙 건여주 에탄올 추출물을 200 ppm 농도로 처리한 군에서 NO 생성량은 11.58 μM로, LPS 단일 처리군의 NO 생성량(21.19 μM)보다 약 45% 감소되어 건여주 에탄올 추출물의 NO 생성 저해 활성이 우수한 것으로 나타났다. 상처를 아물게 하는 효능이 있는 것으로 알려진 찔레꽃 나무뿌리의 용매 추출물을 이용하여 NO 생성량을 측정한 Park GH 등(2011)의 연구에서 에탄올 추출물은 100 μg/mL의 농도에서 가장 높은 40%의 NO 생성 억제능을 나타내었고 열수, 메탄올, 아세톤 추출물도 30% 이상의 NO 생성 억제효과를 나타내었으며, 추출물의 농도 의존적으로 NO 생성이 억제되었다고 보고하여 본 연구의 미성숙 건여주 에탄올 추출물의 NO 생성 억제 효과와 유사하였다.
결 론
본 연구에서는 국내에서 재배된 미성숙 건여주의 열수 및 에탄올 추출물을 이용하여 탄수화물 분해효소 저해 활성 및 항염증 활성을 분석하였다. α-Glucosidase 저해 활성 측정 결과, 열수 추출물은 4,000 ppm의 농도에서 50% 이상, 에탄올 추출물은 70% 이상의 높은 α-glucosidase 저해 활성을 나타내었다. 또한 α-amylase 저해 활성을 측정 결과, 에탄올 추출물은 모든 농도에서 열수 추출물과 대조군인 acarbose에 비해 유의적으로 높은 α-amylase 저해 활성을 보여주었다. α-Amy- lase agar diffusion을 이용한 α-amylase 저해율 산출에서도 에탄올 추출물은 72.35%, 열수추출물은 40.76%, acarbose는 34.75%의 순으로 α-amylase에 대한 저해를 나타내어 에탄올 추출물이 가장 높은 α-amylase 저해 활성을 나타내었다.
항염증 활성 분석에서는 RAW264.7 대식세포에 대한 세포 생존율을 확인한 결과, 열수 추출물을 처리한 군은 세포 독성을 나타낸 반면, 에탄올 추출물을 처리한 군은 무처리군과 비교하였을 때 모든 농도(25∼200 ppm)에서 90% 이상의 높은 세포 생존율을 나타내었다. LPS를 처리한 대식세포에 에탄올 추출물을 처리하여 NO 생성 억제 활성을 측정한 결과, 추출물의 농도가 증가함에 따라 NO 생성량이 유의적으로 감소하는 결과를 보였다. 따라서 이들 결과를 통해 미숙과 건여주 에탄올 추출물의 탄수화물 분해효소 저해 활성 및 항염증 활성이 우수함을 확인할 수 있었으며, 향후 이들이 혈당 조절 및 항염증 활성을 가진 건강기능식품 및 의약품 등의 천연 기능성 소재로서 이용 가능성이 높을 것으로 기대된다.
References
-
Alam, S, Asad, M, Asdaq, SM, Prasad, VS, (2009), Antiulcer activity of methanolic extract of Momordica charantia L. in rats, J Ethnopharmacol, 123, p464-469.
[https://doi.org/10.1016/j.jep.2009.03.024]

-
Alessandra, B, Tiziana, S, Manuela, D, Maria, PG, (2008), Chemical composition and antimicrobial activity of Momordica charantia seed essential oil, Fitoterpia, 79, p123-125.
[https://doi.org/10.1016/j.fitote.2007.11.002]

-
Ali, H, Houghton, PJ, Soumyanath, A, (2006), Alpha-Amylase inhibitory activity of some Malaysian plants used to treat diabetes; with particular reference to Phyllanthus amarus, J Ethnopharmacol, 107, p449-455.
[https://doi.org/10.1016/j.jep.2006.04.004]

- Basch, E, Gabardi, S, Ulbricht, C, (2003), Bitter melon (Momordica charantia): A review of efficacy and safety, Am J Health Syst Pharm, 60, p356-359.
- Braunwald, E, Fauci, AS, Kasper, DL, Hause, SL, Longo, DL, Jameson, JL, (2001), Harrison’s Principles of Internal Medicine, 15th ed, McGraw-Hill, New York, USA, p2109-2137.
- Carmichael, J, DeGraff, WG, Gazdar, AF, Minna, JD, Mitchell, JB, (1987), Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing, Cancer Res, 47, p936-942.
-
Day, C, Cartwright, T, Provost, J, Bailey, CJ, (1990), Hypoglycaemic effect of Momordica charantia extracts, Planta Med, 56, p426-429.
[https://doi.org/10.1055/s-2006-961003]

-
Grover, JK, Yadav, SP, (2004), Pharmacological actions and potential uses of Momordica charantia: A review, J Ethnopharmacol, 93, p123-132.
[https://doi.org/10.1016/j.jep.2004.03.035]

- Gua, J, Jin, YS, Han, W, Shim, TH, Sa, JH, Wang, MH, (2006), Studies for component analysis, antioxidative activity and α-glucosidase inhibitory activity from Equisetum arvense, J Korean Soc Appl Biol Chem, 49, p77-81.
- Holman, RR, Tumer, RC, (1991), Oral agents and insulin in the treatment of NIDDM. In: Text Book of Diabetes, Pickup, J, Williams, G (eds, Blackwell, Oxford, UK, p467-469.
-
Hwang, EY, Hong, JH, Choi, JH, Lee, EJ, Lee, IS, (2009), Study on anti-obesity and hypoglycemic effects of Lycium chinense Mill extracts, J Korean Soc Food Sci Nutr, 38, p1528-1534.
[https://doi.org/10.3746/jkfn.2009.38.11.1528]

- Jeong, HJ, Lee, SG, Lee, EJ, Park, WD, Kim, JB, Kim, HJ, (2010), Antioxidant activity and anti-hyperglycemic activity of medicinal herbal extracts according to extraction methods, Korean J Food Sci Technol, 42, p571-577.
-
Kwon, YR, Cho, SM, Hwang, SP, Kwon, GM, Kim, JW, Youn, KS, (2014), Antioxidant, physiological activities, and acetylcholinesterase inhibitory activity of Portulaca oleracea extracts with different extraction methods, J Korean Soc Food Sci Nutr, 43, p389-396.
[https://doi.org/10.3746/jkfn.2014.43.3.389]

-
Lee, BB, Park, SR, Han, CS, Han, DY, Park, EJ, Park, HR, Lee, SC, (2008), Antioxidant activity and inhibition activity against α-amylase and α-glucosidase of Viola mandshurica extracts, J Korean Soc Food Sci Nutr, 37, p405-409.
[https://doi.org/10.3746/jkfn.2008.37.4.405]

- Lee, JW, (2010), Chemical and physiological properties of bitter melon (Momordica charantia L., Ph D Dissertation, Chunbuk National University, Jeonju, p1-3, 42.
-
Lee, SJ, Kim, EK, Kim, YS, Hwang, JW, Lee, KH, Choi, DK, Kang, H, Moon, SH, Jeon, BT, Park, PJ, (2012), Purification and characterization of a nitric oxide inhibitory peptide from Ruditapes philippinarum, Food Chem Toxicol, 50, p1660-1666.
[https://doi.org/10.1016/j.fct.2012.02.021]

-
Lim, SH, Kim, HY, Park, MH, Park, YH, Ham, HJ, Lee, KY, Kim, KH, Park, DS, Kim, SM, (2010), Biological activities of solvent extracts from leaves of Aceriphyllum rossii, J Korean Soc Food Sci Nutr, 39, p1739-1744.
[https://doi.org/10.3746/jkfn.2010.39.12.1739]

- Lim, SJ, Kim, SH, (2001), The effect of each fraction of methanol extract of Alisma canaliculatum on blood glucose levels and lipid metabolism in streptozotocin induced diabetic rats, Korean J Nutr, 34, p619-625.
-
Ng, TB, Chan, WY, Yeung, HW, (1992), Proteins with abortifacient, ribosome inactivating, immunomodulatory, antitumor and anti-AIDS activities from Cucurbitaceae plants, Gen Pharmacol, 23, p579-590.
[https://doi.org/10.1016/0306-3623(92)90131-3]

-
Park, GH, Lee, JY, Kim, DH, Cho, YJ, An, BJ, (2011), Anti-oxidant and antiinflammatory effects of Rosa multiflora root, J Life Sci, 21, p1120-1126.
[https://doi.org/10.5352/JLS.2011.21.8.1120]

- Park, Y, Boo, HO, Park, YL, Cho, DH, Lee, HH, (2007), Antioxidant activity of Momordica charantia L. extracts, Kor J Medicinal Crop Sci, 15, p56-61.
-
Pugazhenthi, S, Murthy, PS, (1995), Partial purification of a hypoglycemic fraction from the unripe fruits of Momordica charantia Linn, Indian J Biochem, 10, p19-22.
[https://doi.org/10.1007/BF02873663]

-
Raman, A, Lau, C, (1996), Anti-diabetic properties and phytochemistry of Momordica charantia L. (Cucurbitaceae, Phytomedicine, 2, p349-362.
[https://doi.org/10.1016/S0944-7113(96)80080-8]

- Shin, JS, (2012), Biological activity of ethanolic extract of Momordica charantia L., Ph D Dissertation, Kyungsung University, Pusan, p1-4.
- Sin, SM, (2012), Protective activity of Momordica charantia L. from recognition impairment through anti-inflammation and protection from neuronal cell, MS Thesis, Pusan National University, Pusan, p1-4.
-
Watanabe, J, Kawabata, J, Kurihara, H, Niki, R, (1997), Isolation and identification of α-glucosidase inhibitors from Tochucha (Eucommia ulmoides, Biosci Biotechnol Biochem, 61, p177-178.
[https://doi.org/10.1271/bbb.61.177]

-
Weise, F, Nathan, CF, (1991), Purification and characterization of the cytokine-induced macrophage nitric oxide synthase: an FAD and FMN-containing flavoprotein, Proc Natl Acad Sci, 88, p7773-7777.
[https://doi.org/10.1073/pnas.88.17.7773]

-
Wu, SJ, Ng, LT, (2008), Antioxidant and free radical scavenging activities of wild bitter melon (Momordica charantia Linn. var. abbreviata Ser.) in Taiwan, LWT Food Sci and Tech, 41, p323-330.
[https://doi.org/10.1016/j.lwt.2007.03.003]


