국내산 해조류 4종의 물과 에탄올 추출물이 3T3-L1에서 지방세포 분화에 미치는 영향
Abstract
The aim of this study was to examine the cytotoxicity and potential inhibitory effects from four types of edible domestic brown seaweeds, Undaria pinnatifida (UP), Laminaria japonica (LJ), Sargassum fulvellum (SF), and Hizikia fusiforme (HF), on preadipocyte differentiation in 3T3-L1 cell line. Water and ethanol extracts from the four types of seaweeds were prepared and tested for cell viability in the 3T3-L1 cell line by using MTT assay. In addition, various doses of the water extract of seaweeds (WES) and ethanol extract of seaweeds (EES) were treated at the beginning of 3T3-L1 differentiation and continued until the cells were fully differentiated to adipocytes. Oil Red-O staining was performed to determine the potential cell differentiation inhibitory effects of the WES and EES by measuring the levels of lipid droplet accumulation in 3T3-L1 adipocytes. PPARγ mRNA expression levels were significantly reduced by WESs of UP, LJ, and HF as well as EESs of LJ and HF. As a result, we observed the superior cell differentiation inhibitory effects of WES compared to that of EES in a dose-dependent manner without any significant cytotoxicity in mouse adipocytes.
Keywords:
Seaweed, adipogenesis, 3T3-L1, water extract, ethanol extract서 론
비만의 원인 및 기전은 유전적인 요인부터 환경적 요인까지 복합적으로 영향을 주는 것으로 알려져 있는데(Mokdad AH et al 2003), 에너지 저장고인 지방세포의 비대로 면역세포의 모집(recruitment)과 염증성 사이토카인(cytokines)의 분비로 인한 만성염증 상태가 인슐린 저항성 및 심혈관계 질환을 유발한다는 이론이 점차 확고해지고 있다(Xu H et al 2003). 비만은 일반적으로 지방전구세포(preaipocyte)에서 분화를 통해 지방세포(adipocyte)를 과잉으로 생성하고, 중성지방을 축적하는 일련의 adipogenesis라는 과정을 거쳐서 유발된다. 즉, 과거에는 단순한 에너지 저장고로 여겨졌던 지방세포의 새로운 발견으로, 지방세포의 분화·비대 과정에 미치는 영향을 관찰함이 항비만 물질을 스크리닝(screening)하는데 중요한 in vitro 실험 방법으로 이용되고 있다. 3T3-L1 세포주는 전지방세포주로 분화배지에 의해 비대해짐과 동시에 중성지방을 축적하여 지방세포(adipocytes)로의 분화가 가능하여 대표적인 in vitro 연구에 사용되어 오고 있다. 지방세포 분화과정에서는 세포의 형태학적 변화, 호르몬에 대한 반응 및 지방의 저장과 대사에 관련된 유전자의 발현 등 다양한 변화가 동반된다(Green H & Meuth M 1974; Gregoire FM 2001). 대표적인 지방 분화에 관여하는 전사인자(transcription factor)에는 분화 초기단계의 CCAAT/enhancer-binding protein(C/EBP)와 후기분화에 관여하는 peroxisome proliferator-activated receptorγ(PPARγ)가 있다(Gregoire FM 2001). 이러한 지방분화 전사인자의 발현을 통해서 지방분화에 필요한 최종 산물들의 발현을 통해 지방세포 형성 유도조절자 및 지방세포형성 억제 인자들을 조절하여 전체적인 지방분화를 조절하게 된다.
비만의 치료를 위해서 운동 및 식이요법, 나아가 약물요법이 사용되고 있는데, 항비만제의 부작용(예: 우울증, 약물을 중단했을 때 체중 증가 등)을 최소화하기 위해 최근에는 천연물에서 인체에 부작용을 최소화시킬 수 있는 물질해조류는 한국, 일본, 중국 등 아시아 지역에서 오래전부터 식품 및 가공식품의 원료 등으로 흔하게 이용되어 왔으나, 낮은 소화 흡수율로 영양학적 관심을 끌지 못하였었다. 하지만 해조류가 함유하고 있는 여러 가지 건강증진 생리활성 물질들에 대한 긍정적인 연구결과들이 보고되면서, 다양한 해조류에서 기능성 생리활성 물질 탐색 및 그 활성에 대한 연구가 활발히 진행되고 있다(Miyata M et al 2009; Teas J et al 2013; Shahidi F 2009). 이러한 이유로 서양에서도 과거 해조류를 단순히 농축된 추출물의 형태로 제약분야에서의 원료로 사용하거나, 가공식품의 점도 증가를 위한 농조화제(thickening agent) 및 겔화(gelling agent)를 위한 해조콜로이드(phycocol- loids)로만 취급하였으나, 최근에는 해조류를 직접 식이에 첨가하거나, 기능성 식품으로 고려하는 움직임이 보이고 있다(Shahidi F 2009).
해조류는 크게 갈조류, 홍조류, 녹조류로 나뉘고, 그중 갈조류가 59%, 홍조류 40%, 그리고 나머지를 녹조류가 차지한다. 이러한 해조류의 성분 중 많은 부분이 총 건조무게의 25∼75%를 차지하는 식이섬유이다. 녹조류에는 전분, 셀룰로오스, 자일란(xylan), 매넌(mannans)이, 갈조류에는 라미나란(laminarans), 황산기를 함유하는 다당류의 일종인 알긴산염 (alginates)와 후칸(fucans), 홍조류에는 카라기난(carrageenan)이 함유되어 있으며, 해조류의 물 추출물에는 이러한 식이 다당류가 다량 함유되어 있다. 그밖에도 해조류에는 다양한 비타민, 무기질, 단백질, 다가불포화지방산 등 다양한 영양성분이 함유되어 있다(D’Orazio N et al 2012). 현재까지 보고된 해조류의 생리활성으로는 혈중콜레스테롤 저하효과(Ren D et al 1994; Jung B et al 2001), 종양세포의 성장억제효과(Noda H et al 1990), 항혈액응고효과(Koo J et al 2001), 유해 중금속배출 효과(Davis TA et al 2003), 유해 미생물 증식 억제효과(Lim J et al 2008)와 유익균의 증식 촉진을 통한 장건강개선 효과(O’Sullivan L et al 2010) 등이 있으며, 최근 in vitro와 in vivo 모델을 통한 해조류의 항비만 연구도 활발히 진행되고 있다(Miyata M et al 2009; Jang WS & Choung SY 2013). 하지만 가장 많이 식이로 섭취하는 갈조류의 물과 에탄올 추출물이 3T3-L1에서의 세포독성과 지방생성(adipogenesis)에 미치는 영향을 농도와 추출물 별로 비교 분석한 자료는 부족한 실정이다. 이에 본 연구에서는 우리나라 식탁에 자주 등장하며, 해조류 중 가장 많은 식용비중을 차지하고 있는 미역(Undaria pinnatifida), 다시마(Laminaria japonica), 모자반(Sargassum fulvellum), 톳(Hizikia fusiforme)과 같은 갈조류 4종의 물과 에탄올 추출물이 마우스 지방세포의 분화와 지방구 축적에 미치는 영향에 비교·분석하였다.
재료 및 방법
1. 실험 재료 및 추출물 제조
본 연구에서 사용된 해조류는 제주 오일장에서 2013년 12월에서 2014년 3월까지 국내산 미역, 다시마, 모자반, 톳을 모두 생물로 구매하여 사용하였다. 해조류 4종의 물과 에탄올 추출물 제조방법은 선행연구(Kang S et al 2012)를 바탕으로 Fig. 1과 같이 실시하였다. 해조류의 염분 및 이물질의 제거를 위해 흐르는 물로 3회 이상 수세 후 각 군을 플라스틱 백에 담아 —20℃에서 일차 냉동하여 동결 건조를 실시하였다. 이후 물 추출물은 100 mL의 3차 증류수에 3 g의 시료를 넣고 24 시간동안 침지시킨 뒤 공기 압력기를 이용하여 추출하고, 지퍼백에 담아 동결건조를 시켜 추출물을 얻고, 실험에 처리할 때에는 DPBS에 녹여 필터(0.45 μm)를 한 뒤 실험에 사용하였다. 에탄올 추출물 제조는 3g 해조류 파우더 /70% 에탄올 100 mL 혼탁액을 24시간 동안 침지시킨 뒤, 감압 추출 농축장치로 에탄올 추출물을 얻어 DMSO에 용해시켜 해조류 에탄올추출물 시료 400 μg/mL를 준비하였다. 이후 실험에는 DPBS에 녹여 여과(0.45 μm)한 뒤 실험에 사용하였다(Fig. 1).
2. 3T3-L1 세포주 배양 및 해조류 처치
3T3-L1 세포주(mouse embryonic fibroblast)는 한국세포주은행(Korean Cell Line Bank, Seoul. Korea)에서 분양받아 사용하였다. 3T3-L1 세포는 10% bovine calf serum(BCS, Gibco BRL, USA)와 1% penicillin-streptomycin(P/S, Gibco BRL, USA)이 함유된 Dulbecco’s modified Eagle’s medium(DMEM, Gibco BRL, USA)배지에서 37℃, 5% CO2 조건에서 배양하였다. 3T3-L1 전 지방세포는 2일마다 신선한 배지로 교환해 주었으며, 세포가 70∼80% 밀도가 되었을 때 0.5% 10 X tryp- sin-EDTA를 처리하여 계대 배양하였다. 지방세포로 분화유도를 위해 3T3-L1 세포를 12-well cell culture plate에 1×105 cells/well 농도로 분주하고, 세포가 confluent하기까지 배양한 후, 신선한 배지로 교환하여 48시간을 추가 배양하였다. Confluent 상태에서 배양액을 분화유도배지인 10% FBS, 1% P/S, 250 μM dexamethasone(DEXA, Sigma-Aldrich, USA), 0.5 μM 3-isobutyl-1-methylxanthin(IBMX, Sigma-Aldrich, USA) 및 10 μg/mL 인슐린이 함유된 DMEM 배지로 교환하여 2일간 분화를 유도하였다. 지방세포분화에 미치는 해조류 추출물의 영향을 관찰하기 위해 분화유도와 같이 시료 추출물을 농도별로 함께 처리하였다. 분화유도 후 2∼4일차에 배지를 시료 추출물, 10% FBS, 1% P/S, 10 μg/mL 인슐린을 포함한 DMEM으로 교환하였고, 분화유도 6일차부터는 2일에 한 번씩 10% FBS, 1% P/S를 포함한 DMEM으로 교환하며, 세포를 분화시켰다. 세포의 분화 정도에 따라 모든 실험은 분화 시작 후 8∼10일 사이에 실시하였다.
3. 세포 독성 측정
물과 에탄올 해조류 추출물이 3T3-L1 세포 생존율에 미치는 영향을 MTT(3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tet- razolium bromide)분석을 통해 측정하였다(Mosmann T 1983). 3T3-L1 세포를 24-well plate에 1×105 cells/well로 분주하여, 16∼24시간 안정화시킨 후, 제조한 해조류 물과 에탄올 추출물 4종을 0, 50, 100, 200 μg/mL의 농도별로 처리하고, 다시 24시간동안 배양하였다. 배양액에 200 mg/mL농도의 MTT를 100 μL 첨가하여 4시간 동안 추가 배양한 후 상층액인 배지를 제거하였다. 이후 100 μL의 DMSO로 분주하여 well에 생성된 formazan이 잘 녹을 수 있게 24시간동안 충분히 흔들어 모두 녹인 후, 96-well plate에 각 50 μL씩 분주한 뒤 ELISA reader(Molecular Devices, Sunnyvale CA, USA) 540 nm에서 흡광도를 측정하였다. 세포증식률은 시료를 처리하지 않은 대조군의 흡광도 값과 비교하여, [세포 생존율(%) = (시료처리군의 흡광도/대조군의 평균 흡광도) × 100]으로 산출하였다.
4. Oil Red O Staining을 이용한 해조류 추출물의 지방세포 분화 억제능력 측정
Oil Red O staining(Ramirez-Zacarias J et al 1992)은 분화유도 8∼10일차의 3T3-L1 세포에서 실시하였다. 10% FBS DMEM 배지를 제거한 후, 10% formalin을 1 mL 넣고 10분 실온에서 보관한다. 이후 새로운 10% formalin 1 mL 넣고 4℃에서 1시간 동안 보관해 세포들을 고정시켰다. 고정된 세포는 세포 내 생성된 지방구와 특이적으로 반응하는 Oil Red-O로 1시간 동안 염색한 후, 증류수를 이용해 3번 세척하였다. 염색된 세포들은 건조시켜 100% 아이소프로페놀을 500 μL 첨가하여 Oil Red O를 용출시켜 96-well에 각 100 μL씩 넣어, ELISA reader를 이용하여 500 nm에서 흡광도를 측정하였다. Oil Red O contents(%)를 [Oil Red O contents (%) = (시료처리군의 흡광도/대조군의 평균 흡광도) × 100]으로 계산하였다.
5. Real-time Polymoerase Chain Reaction(real time- PCR)에 의한 mRNA 분석
미역, 다시마, 모자반, 톳의 WES와 EES(100μg/mL)를 처리하면서 분화시킨 3T3-L1 지방전구세포에 TRizol reagent(In- vitrogen Co. Carlsbad, Ca, USA)를 이용한 RNA 추출을 실시하였다. 추출한 RNA의 농도를 측정한 후, High-capacity cDNA reverse transcription kits(Applied Biosystems, USA)를 이용하여 RT를 실시하였다(Lee Y et al 2009). 합성된 cDNA는 타겟 유전자 primer(mouse PPARγ(Cosmo genetech, Korea))와 control 유전자로는 β-actin를 사용하여 real-time PCR(Sybr- Green, Applied Biosystems, USA)를 실시하였다(Table 1).
결과 및 고찰
1. 해조류 물과 에탄올 추출물의 세포독성
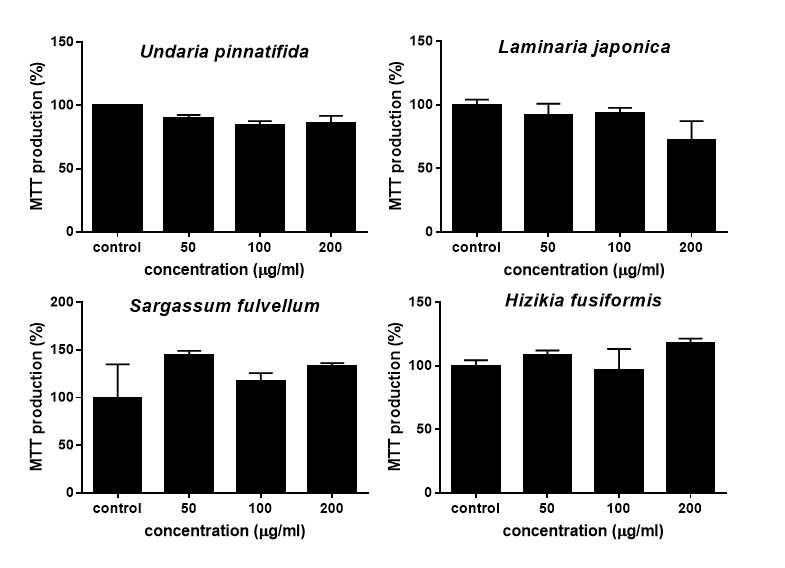
해조류 4종의 물 추출물(WES)과 에탄올 추출물(EES)의 독성은 MTT assay 실험을 통하여 세포 생존율의 차이를 측정하였다. MTT assay 실험의 원리는 노란색의 tetrazolium을 청자색의 formazan으로 환원시키는 미토콘드리아의 능력을 이용하여 세포의 증식과 성장을 흡광도의 변화로 측정하는 것으로써, 살아있는 세포의 수가 많을수록 흡광도가 증가한다. 본 연구에서는 농도별로 대조군, 50, 100, 200 μg/mL를 24시간 처치한 3T3-L1 전지방세포 생존율의 실험 결과, 미역, 다시마, 모자반, 톳 4종의 갈조류의 물 추출물은 200 μg/mL의 가장 높은 농도에서도 3T3-L1 전지방세포에서 독성을 보이지 않았다(Fig. 2). EES의 세포독성도 위의 WES 처치 농도와 같은 조건에서 실험을 실시하였으며, 세포 생존율의 결과 본 연구에 사용된 4종의 갈조류 에탄올 추출물은 최대 200 μg/mL의 농도로 24시간 처치하였을 때 3T3-L1 세포에 유의적인 독성을 나타내지 않았다(Fig. 3).
선행연구에서도 본 연구 결과와 유사한 해조류 에탄올 추출물이 지방세포에서 독성을 일으키지 않았음이 보고된바 있는데, 예를 들어 잔가시 모자반 에탄올 추출물의 세포독성 실험에서도, 100 μg/mL의 농도에서 24시간 처리하였을 때에도 유의적인 독성을 일으키지 않았으며(Lee Y et al 2012), 톳의 추출과정에서 분획물들(물, 부탄올, 에틸아세테이트, 에탄올, 다이클로로메탄)을 수집하여 최대 250 μg/mL의 농도로 3T3- L1 전지방세포에 72시간 동안 처치하였을 때, 유의적인 독성을 나타내지 않았다(Choi EO et al 2012). RAW264.7 세포를 LPS로 처리로 인해 약 50% 정도 감소된 세포는 미역의 메탄올 추출물의 처치로 정상수준으로 회복되기도 하여(Choi J et al 2008), 이러한 해조류의 메탄올과 에탄올 추출물은 세포독성에 크게 영향을 주지 않음을 알 수 있다. 해조류 물 추출물의 경우, 물 추출물을 효소로 소화시킨 후 다양한 다당류를 분획하여 실시한 연구들이 존재하고 있으며, 인간과 쥐의 암 세포주를 이용한 연구들에 암세포의 성장 및 증식을 저해한다고 연구결과들이 존재한다(Athukorala Y et al 2009; Wije- singhe W & Jeon Y 2012; Wijesekara I et al 2011).
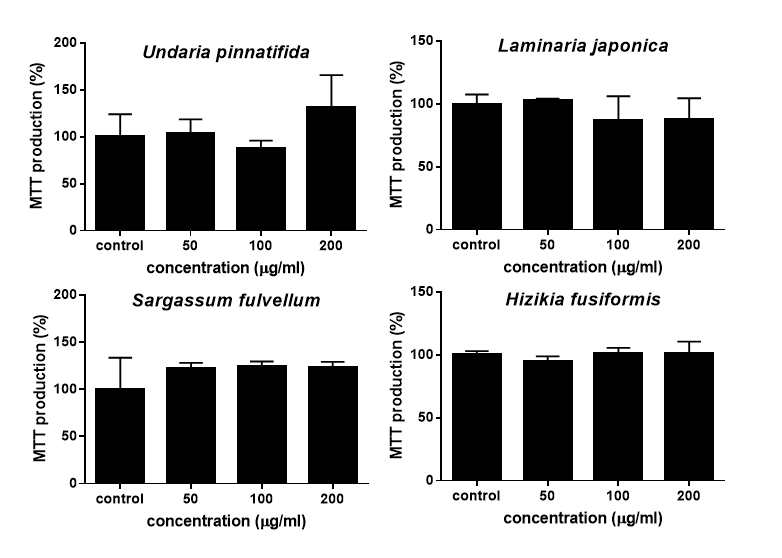
Cytotoxicity of ethanol extract of the four seaweeds(EES) in 3T3-L1 preadipocytes.Data are expressed as mean±SEM. Cytotoxicity of ethanol extracts of the four seaweeds was determined by MTT assay. Preconfluent preadipocytes were treated with various concentration of EES for 24 hours.
2. 3T3-L1 전지방세포의 Lipid Droplet 생성과 PPARγ 유전자 발현에 미치는 해조류 물과 에탄올 추출물의 영향
해조류 4종의 WES과 EES이 전지방세포를 지방세포로 분화하는 과정에 어떤 영향을 미치는지 알아보기 위해서 Oil Red O staining을 실시하였다. 세포질에 축적된 지방구는 전지방세포에서 지방세포로 분화됨을 나타내는 지표이며, 이때 지방구를 염색한 Oil Red O에 비례하여 증가하게 된다(Ramirez-Zacarias J et al 1992). 3T3-L1 전지방세포의 분화시작과 함께 해조류 추출물을 각 정해진 농도별로 처치하여 분화를 진행하여, 분화 완료 시점에서 3T3-L1의 지방구를 Oil Red O로 염색하여 지방구의 형성 정도를 확인하였다(Fig. 4 및 Fig. 5). EES 중에서는 다시마 EES(200 μg/mL)만이 유일하게 지방분화를 억제하는 효과를 가지고 있었다. 반면 WES에서는 미역 WES를 제외한 모든 WES 군에서 유의적인 지방분화 억제효과를 관찰하였다. 다시마 WES는 100 μg/mL부터 대조군과 비교하여 유의적으로 지방구의 형성이 저하됨을 확인하였고, 모자반 WES는 50 μg/mL부터 지방분화 억제효과, 톳 WES는 200 μg/mL에서 지방분화 억제에 유의적인 효과를 나타냈다(Fig. 5(A)). 즉, 본 연구에서는 WES가 EES보다 지방분화 저해 효과가 우수함을 알 수 있었다. 이러한 결과는 톳 추출물이 지방분화에 미치는 영향을 살펴본 연구에서도 비슷하게 톳 에탄올 추출물에 비해 톳 물추출물이 지방분화 억제효과가 우수하였다(Choi EO et al 2012).
Kang S et al(2010)의 연구에서는 식용 갈조류인 미역치(Petalonia binghamiae)의 물 추출물이 3T3-L1 전지방세포에서 PPARγ, CCAAT/enhancer-binding proteins(C/EBP), fatty acid binding protein 등의 지방생성 조절관련 인자들의 발현을 저해하였으며, 나아가 고지방식이를 섭취한 쥐의 몸무게 증가도 억제하는 효과를 보여주었다(Kang S et al 2010). 반면, 같은 그룹의 선행연구에서 미역치의 에탄올 추출물은 오히려 지방생성 조절 관련 인자들을 증가시켰으며, 3T3-L1의 지방분화를 촉진시켰다(Kang S et al 2008). 흥미로운 점은 미역치 에탄올 추출물은 지방세포의 분화촉진과는 독립적으로 당뇨병 증상이 있는 쥐의 고혈당 증세를 완화시켰다는 것이다. 이러한 상이한 결과에 영향을 미칠 수 있는 요인 중 하나는 사용된 용매에 따라 추출된 해조류의 성분들의 차이를 들 수 있다. 예를 들어 미역치 에탄올 추출물에는 폴리페놀이 25.39 mg/g, 다당류가 8.3 mg/g 함유되어 있는 반면, 미역치 물 추출물에는 폴리페놀이 3.96 mg/g, 다당류가 424.3 mg/g이 함유되어 있다(Kang S et al 2010). 본 연구에서 이용한 갈조류 4종의 WES가 EES보다 탁월한 지방분화 억제효과를 나타낸 것 또한 이러한 추출물에 함유되어 있는 폴리페놀과 다당류의 차이일 것이라 사료되나, 추후 체계적인 해조류 추출물 폴리페놀 및 다당류의 비교 분석을 통해서 이에 대한 보다 정확한 결론의 도출이 가능할 것이다.
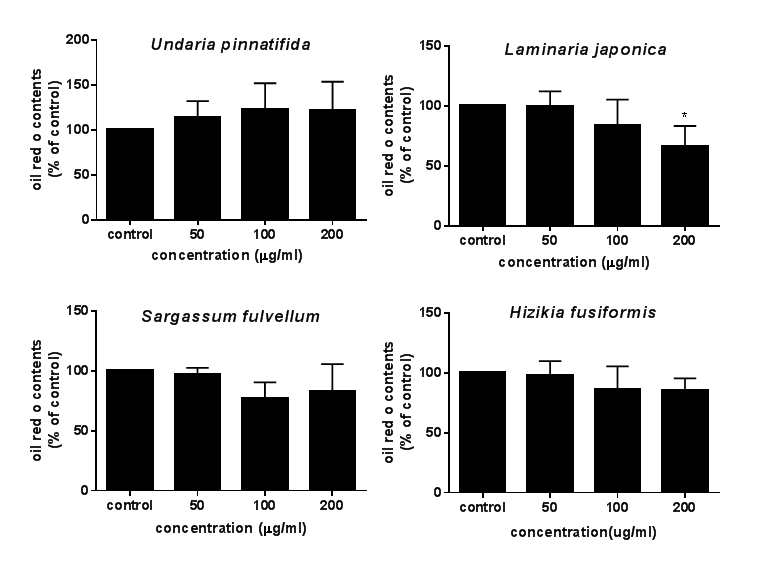
Effect of ethanol extracts of seaweeds(EES) on lipid accumulation in 3T3-L1 adipocytes.3T3-L1 cells were plated in 24-well plates at a density of 50,000 cells/well and differentiated to adipocytes along with various concentrations of the EES. An asterisk represents a significant difference by ANOVA (* p<0.05).
더불어 본 연구에서는 갈조류 4종의 EES와 WES를 처치한 지방세포에서의 지방분화 조절 전사인자 중 하나인 PPARγ의 mRNA 발현에 미치는 영향을 살펴보았다(Fig. 6). EES의 경우, 다시마와 톳 처치군에서는 PPARγ의 유전자 발현이 대조군에 비해 유의적으로 감소하였으나, 미역 처치군에서는 PPARγ의 유전자 발현이 대조군보다 유의적으로 증가함을 관찰하였다. WES의 경우, 모자반 군을 제외하고는 미역, 다시마, 톳 처치군에서 PPARγ의 유전자 발현이 모두 유의적으로 대조군보다 낮아 해조류 추출물이 지방분화 전사인자의 조절에 영향을 줌을 확인하였다. 하지만 Fig. 5의 중성지방 축적 정도의 결과와 mRNA 발현 실험결과는 정확히 일치되지는 않았다. 대표적으로 미역 에탄올 추출물는 PPARγ 유전자 발현을 증가시켰으나, 중성지방 축적을 증가시키지는 않았다. 즉, 해조류 추출물들은 3T3-L1 세포주의 지방분화과정에 전사와 번역단계에서 차별적으로 작용하였다.
해조류 유래 다당류에 대한 지방생성 조절에 관한 연구들을 살펴보면 다음과 같다. Maeda H et al(2006)은 미역, 톳, 모자반에서 추출 가능한 후코잔틴과 이를 돼지 췌장 지방분해 효소로 가수분해한 대사물질인 후코잔티놀(fucoxanthinol)로 3T3-L1 전세포가 지방세포로 분화를 저해함으로 보여주었으며, 특히 후코잔티놀이 후코잔틴보다 탁월한 지방분화억제능력을 보유하고 있음을 확인하였다(Maeda H et al 2006). 후코스(L-fucose), 자일로스, 갈락토오스와 만노오스로 구성되어 있는 후코이단(fucoidan)은 황산다당류로 지방생성 조절관련 인자(C/EBPα, PPARγ) 저하와 이들 신호전달체계의 상위단계에 위치하는 JNK와 ERK의 인산화 저해로 인해 지방세포의 분화를 억제하였다(Kim K et al 2010). 이러한 여러 해조류 추출물이 지방분화에 미치는 영향에 대한 연구들을 종합해 보면 해조류의 종류, 추출 용매 등에 따라 지방분화에 미치는 영향이 다르며, 지방분화 억제 효과는 지방분화와 지방 축적에 관여하는 유전자들의 발현의 효율적인 조절과정을 통해 가능하다고 사려 된다.
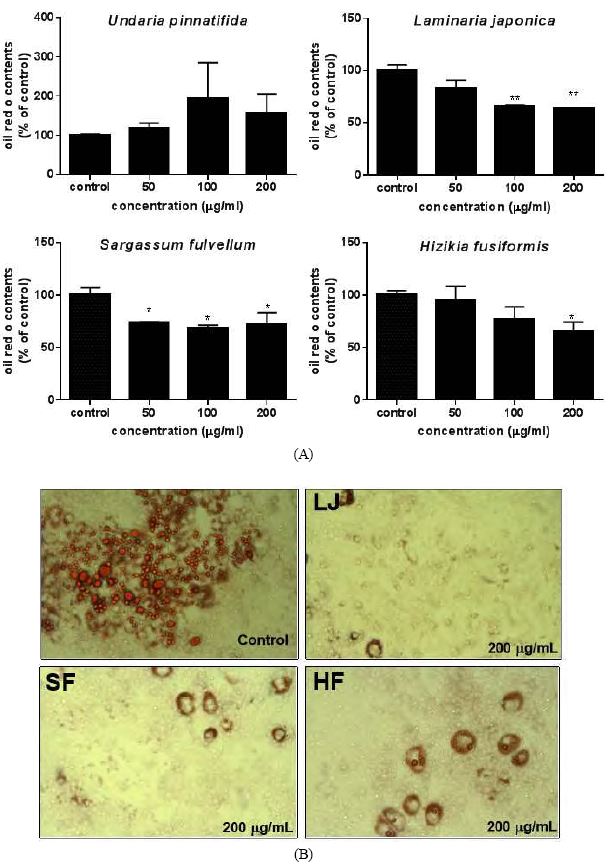
Effect of water extract of seaweeds (WES) on lipid accumulation in 3T3-L1 adipocytes.(A) 3T3-L1 cells were plated in 24-well plates at a density of 50,000 cells/well and differentiated to adipocytes along with various concentrations of the WES. Data are presented as the mean±SEM (n=3). Asterisks represent a significant difference by ANOVA (* p<0.05, ** p<0.001). (B) Accumulations of lipid droplet in 3T3-L1 adipocytes were stained with Oil Red O and visualized by a light microscopy at ×200 magnification.
요약 및 결론
본 연구에서는 식생활에서 흔히 섭취하는 국내산 갈조류 4종, 미역, 다시마, 모자반, 톳의 물과 에탄올 추출물을 이용하여 3T3-L1에서의 세포독성 측정 및 전지방세포에서 지방세포로 분화과정에 해조류 추출물이 미치는 영향을 농도별로 비교·분석하였다. 3T3-L1 전지방세포에서 실시한 EES와 WES의 MTT assay를 이용한 세포독성 실험결과, 모든 추출물의 최대 200 μg/mL의 농도로 24시간 처치는 대조군과 비교해서 유의적인 세포독성을 일으키지 않았다. 전지방세포를 지방세포로 분화시키는 과정에서 두 개의 다른 용매로 추출한 갈조류 4종의 추출물이 미치는 영향을 살펴보기 위해서 3T3-L1 전지방세포의 분화와 동시에 추출물을 농도별로 처치하여 분화를 진행한 결과, 다시마 EES, 다시마 WES, 모자반 WES, 그리고 톳 WES군이 대조군과 비교하여 유의적으로 지방분화를 억제하였다. 이와 같이 해조류를 추출하는 용매에 따라 지방분화에 미치는 효과에 유의적인 차이가 있으며, 특히 해조류 물 추출물의 지방생성 저해 효과는 해조류 에탄올 추출물보다 우수하다는 것을 in vitro 모델을 통해 확인하였다. 미역을 제외한 다시마, 모자반, 톳에서 추출한 물 추출물의 지방분화 억제효과에 대한 세부적인 기전연구를 수행할 것이며, 향후 다양한 해조류 물 추출물 방법에 대한 연구와 함유되어 있는 다당류에 대한 분석과 더불어 in vivo 시험 등을 통한 추가적인 연구가 필요할 것으로 사료된다.
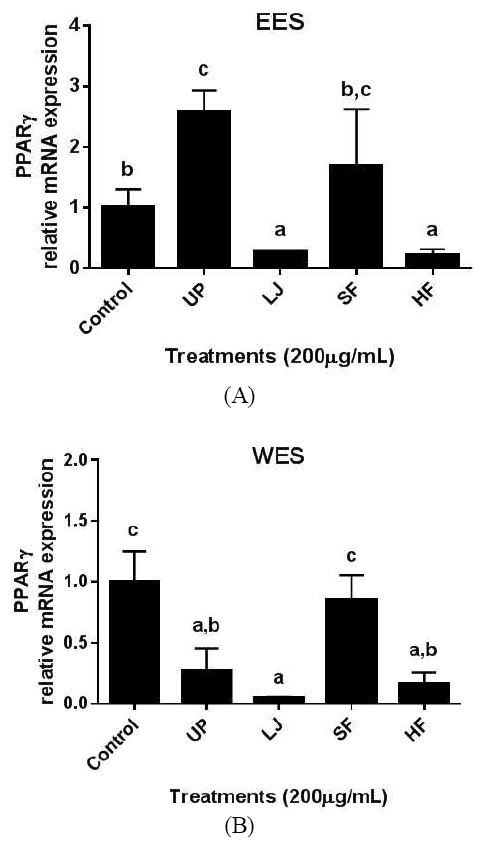
mRNA expression of PPARγ by EES or WES in 3T3-L1 cells.3T3-L1 cells were plated in 6-well plates at a density of 1×106 cells/well and differentiated to adipocytes along with 100 μg/mL of either EES(Panel A) or WES(Panel B). UP: Undaria pinna- tifida, LJ: Laminaria japonica, SF: Sargassum fulvellum, HF: Hizikia fusiforme. Data are presented as the mean±SEM (n=3). Bars that do not share the same superscript are significantly different by ANOVA (P<0.05).
Acknowledgments
본 연구는 한국연구재단 NRF-2013R1A1A1057573의 지원으로 수행되었으며, 이에 감사드립니다.
References
-
Athukorala, Y, Ahn, GN, Jee, Y, Kim, G, Kim, S, Ha, J, Kang, J, Lee, K, Jeon, Y, (2009), Antiproliferative activity of sulfated polysaccharide isolated from an enzymatic digest of Ecklonia cava on the U-937 cell line, J Appl Phycol, 21, p307-314.
[https://doi.org/10.1007/s10811-008-9368-7]

-
Choi, EO, Kim, HS, Han, MH, Choi, YH, Kim, BW, Hwang, J, Hwang, HJ, (2012), Effects of Hizikia fusiforme extracts on adipocyte differentiation and adipogenesis in 3T3-L1 preadipocytes, J of Life Sci, 22, p1399-1406.
[https://doi.org/10.5352/JLS.2012.22.10.1399]

-
Choi, J, Bae, H, Kim, Y, Park, N, Kim, T, Choi, Y, Choi, E, Park, S, Choi, I, (2008), Nutritional composition and biological activities of the methanol extracts of sea mustard (Undaria pinnatifida) in market, J of Life Sci, 18, p387-394.
[https://doi.org/10.5352/JLS.2008.18.3.387]

-
D’Orazio, N, Gemello, E, Gammone, MA, de Girolamo, M, Ficoneri, C, Riccioni, G, (2012), Fucoxantin: A treasure from the sea, Marine Drugs, 10, p604-616.
[https://doi.org/10.3390/md10030604]

-
Davis, TA, Volesky, B, Mucci, A, (2003), A review of the biochemistry of heavy metal biosorption by brown algae, Water Res, 37, p4311-4330.
[https://doi.org/10.1016/S0043-1354(03)00293-8]

-
Green, H, Meuth, M, (1974), An established pre-adipose cell line and its differentiation in culture, Cell, 3, p127-133.
[https://doi.org/10.1016/0092-8674(74)90116-0]

- Gregoire, FM, (2001), Adipocyte differentiation: From fibroblast to endocrine cell, Exp Biol Med (Maywood), 226, p997-1002.
- Jang, WS, Choung, SY, (2013), Antiobesity effects of the ethanol extract of Laminaria japonica Areshoung in high-fat-dietinduced obese rat, Evidence-Based Compl and Alter Med, 2013, p1-17.
- Jung, B, Ahn, C, Kang, S, Park, J, Chung, D, (2001), Effects of Hijikia fusiforme extracts on lipid metabolism and liver antioxidative enzyme activities in triton-induced hyperlipidemic rats, J Kor Soc of Food Sci Nutr, 30, p1184-1189.
-
Kang, S, Jin, Y, Ko, H, Choi, S, Hwang, J, Whang, I, Kim, M, Shin, H, Jeong, H, Kim, S, (2008), Petalonia improves glucose homeostasis in streptozotocin-induced diabetic mice, Biochem Biophys Res Commun, 373, p265-269.
[https://doi.org/10.1016/j.bbrc.2008.06.015]

-
Kang, S, Kim, M, Shin, H, Kim, H, Hong, Y, Park, J, Ko, H, Lee, N, Chung, W, Kim, S, (2010), A water-soluble extract of Petalonia binghamiae inhibits the expression of adipogenic regulators in 3T3-L1 preadipocytes and reduces adiposity and weight gain in rats fed a high-fat diet, J Nutr Biochem, 21, p1251-1257.
[https://doi.org/10.1016/j.jnutbio.2009.11.008]

-
Kang, S, Heo, S, Kim, K, Lee, S, Jeon, Y, (2012), Isolation and identification of new compound, 2,7″-phloroglucinol-6, 6′-bieckol from brown algae, Ecklonia cava and its antioxidant effect, J of Functional Foods, 4, p158-166.
[https://doi.org/10.1016/j.jff.2011.10.001]

-
Kim, K, Lee, O, Lee, B, (2010), Fucoidan, a sulfated polysaccharide, inhibits adipogenesis through the mitogen-activated protein kinase pathway in 3T3-L1 preadipocytes, Life Sci, 86, p791-797.
[https://doi.org/10.1016/j.lfs.2010.03.010]

- Koo, J, Choi, Y, Kwak, J, (2001), Blood-anticoagulant activity of fucoidans from sporophylls of Undaria pinnatifida, Laminaria religiosa, Hizikia fusiforme and Sargassum fulvellum in Korea, Kor J of Fisher and Aquatic Sci, 34, p515-520.
-
Lee, Y, Yoon, B, Choi, H, Lee, B, Lee, O, (2012), Effect of Sargassum micracanthum extract on lipid accumulation and reactive oxygen species (ROS) production during differentiation of 3T3-L1 preadipocytes, Kor J of Food Preser, 19, p455-461.
[https://doi.org/10.11002/kjfp.2012.19.3.455]

- Lee, Y, Thompson, JT, de Lera, AR, Heuvel, JPV, (2009), Isomerspecific effects of conjugated linoleic acid on gene expression in RAW 264.7, J Nutr Biochem, 20, p848-859, e5.
- Lim, J, Jung, K, Lee, J, Jung, E, Kim, D, Kim, Y, Kim, Y, Park, D, (2008), The study on antimicrobial and antifungal activity of the wild seaweeds of Jeju island, J of Soc Cos Sci of Kor, 34, p201-207.
-
Maeda, H, Hosokawa, M, Sashima, T, Takahashi, N, Kawada, T, Miyashita, K, (2006), Fucoxanthin and its metabolite, fucoxanthinol, suppress adipocyte differentiation in 3T3-L1 cells, Int J Mol Med, 18, p147-152.
[https://doi.org/10.3892/ijmm.18.1.147]

-
Miyata, M, Koyama, T, Kamitani, T, Toda, T, Yazawa, K, (2009), Anti-obesity effect on rodents of the traditional Japanese food, tororokombu, shaved laminaria, Biosci Biotechnol Biochem, 73, p2326-2328.
[https://doi.org/10.1271/bbb.90344]

-
Mokdad, AH, Ford, ES, Bowman, BA, Dietz, WH, Vinicor, F, Bales, VS, Marks, JS, (2003), Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001, JAMA, 289, p76-79.
[https://doi.org/10.1001/jama.289.1.76]

-
Mosmann, T, (1983), Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays, J Immunol Methods, 65, p55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Noda, H, Amano, H, Arashima, K, Nisizawa, K, (1990), Antitumor activity of marine algae, Hydrobiologia, 204, p577-584.
[https://doi.org/10.1007/BF00040290]

-
O’Sullivan, L, Murphy, B, McLoughlin, P, Duggan, P, Lawlor, PG, Hughes, H, Gardiner, GE, (2010), Prebiotics from marine macroalgae for human and animal health applications, Marine Drugs, 8, p2038-2064.
[https://doi.org/10.3390/md8072038]

-
Ramirez-Zacarias, J, Castro-Munozledo, F, Kuri-Harcuch, W, (1992), Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with oil red O, Histochemistry, 97, p493-497.
[https://doi.org/10.1007/BF00316069]

- Ren, D, Noda, H, Amano, H, Nishino, T, Nishizawa, K, (1994), Study on antihypertensive and antihyperlipidemic effects of marine algae, Fisheries Science, 60, p83-88.
-
Shahidi, F, (2009), Nutraceuticals and functional foods: Whole versus processed foods, Trends Food Sci Technol, 20, p376-387.
[https://doi.org/10.1016/j.tifs.2008.08.004]

-
Teas, J, Vena, S, Cone, DL, Irhimeh, M, (2013), The consumption of seaweed as a protective factor in the etiology of breast cancer: Proof of principle, J Appl Phycol, 25, p771-779.
[https://doi.org/10.1007/s10811-012-9931-0]

-
Wijesekara, I, Pangestuti, R, Kim, S, (2011), Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae, Carbohydr Polym, 84, p14-21.
[https://doi.org/10.1016/j.carbpol.2010.10.062]

-
Wijesinghe, W, Jeon, Y, (2012), Biological activities and potential industrial applications of fucose rich sulfated polysaccharides and fucoidans isolated from brown seaweeds: A review, Carbohydr Polym, 88, p13-20.
[https://doi.org/10.1016/j.carbpol.2011.12.029]

-
Xu, H, Barnes, GT, Yang, Q, Tan, G, Yang, D, Chou, CJ, Sole, J, Nichols, A, Ross, JS, Tartaglia, LA, Chen, H, (2003), Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance, J Clin Invest, 112, p1821-1830.
[https://doi.org/10.1172/JCI200319451]