잔대 추출물의 항염 및 항천식 효과

Abstract
Asthma is an increasing global health problem, and novel strategies to prevent or ameliorate the condition are needed. The purpose of the present study was to evaluate the anti-inflammatory and anti-asthma effects of Adenophora triphylla var. japonica extracts. We investigated the molecular mechanism underlying the effects of 80% ethanol extracts (AE) of A. triphylla on lipopolysaccharide (LPS)-stimulated RAW 264.7 cells. AE treatment inhibited pro-inflammatory cytokines such as TNF-α and IL-6 as well as nitric oxide (NO) production in LPS-stimulated RAW 264.7 cells. In particular, NO and pro-inflammatory cytokine production was suppressed more effectively by aerial parts (AE-A) than roots (AE-R) of A. triphylla. Quantitative RT-PCR assay showed that AE reduced mRNA levels of iNOS and COX-2. We also evaluated the anti-asthmatic effects of AE-A in an ovalbumin (OVA)-induced BALB/c mouse model. AE-A supplementation significantly reduced the amounts of airway eosinophils, IL-4 and IL-13 levels in BALF, and IgE levels in serum as compared with untreated, OVA-induced mice. These results suggest that AE-A can be considered as a therapeutic agent to potentially relieve asthma.
Keywords:
Adenophora triphylla, anti-inflammatory, anti-allergic, asthma서 론
천식은 전세계적으로 거의 3억 명의 사람에게서 발병하고 있으며, 소아천식을 비롯한 천식의 유병률이 지속적으로 증가하는 현상을 보이고 있다. 이는 대기오염, 집 먼지 등 환경적인 요인과 호흡기 감염 등이 원인이 되어 발생하는 것으로 알려져 있다(Baïz N & Annesi-Maesano I 2012). 천식은 기관지의 과민성 염증반응의 대표적인 질환으로, 기도 내 T helper (Th)2 사이토카인 분비, 호산구 침윤과 점액질 과다 분비 및 기관지 과민반응을 특징적으로 나타낸다(Lee MY et al 2011). 기도의 만성염증은 대부분은 흡입성 스테로이드로 조절되지만, 여러 연구에서 흡입성 스테로이드제가 기도 개형을 억제하지 못하는 한계를 나타내는 결과를 보고하였다(Durrani SR et al 2011). 최근에는 immunoglobulin E(IgE), Th2 사이토카인 분비를 조절함으로써 과민성 염증을 개선하고, 천식 증상을 완화하는 치료제 혹은 천연소재 개발이 시도되고 있다(Brugiolo AS et al 2011; Ci X et al 2012).
잔대(Adenophora triphylla var. japonica)는 쌍떡잎식물 초롱꽃목 초롱꽃과의 다년생 식물로서, 사삼(沙蔘), 딱주, 제니라고도 불린다. 초여름에 연한 잎과 줄기를 삶아 나물로 먹으며, 뿌리는 ‘사삼’이라 하여 식용 및 약용으로 사용되어 왔다(Ham YA et al 2009a; Park DS 2010). 잔대에 관한 연구로는 잔대 에탄올 추출물과 그 분획물의 항돌연변이와 항종양 효과(Ham YA et al 2009b), 잔대 뿌리의 에틸아세테이트 추출물의 항산화 효과(Choi HJ et al 2008) 등이 보고되어 있다. 고지방식이로 유도된 비만 마우스에서 잔대 뿌리의 에탄올 추출물이 항산화 효과와 염증 반응 개선 효과, 인슐린 저항성 개선 효과를 나타낸 연구 결과도 있다(Lee SE 2012). 또한, Chung KJ 등(2002)은 사삼을 포함한 한약재의 처방 검액이 기관지 상피세포에서 염증 유발 사이토카인의 발현을 억제하였다고 보고하였다. 천식 동물모델에서 잔대의 뿌리 추출물은 기도 과민성(airway hyperresponsiveness, AHR)을 개선하고, 폐 기관지 염증세포와 염증 관련 사이토카인 분비를 억제한다는 보고(Roh SS et al 2008)도 있으나, 잔대의 지상부와 지하부를 구분하여 염증 및 천식에 대한 효과를 연구한 것은 없다.
따라서 본 연구는 천식을 완화하고 증상을 개선할 수 있는 식품소재를 발굴하고자, 잔대를 지상부(잎과 줄기)와 지하부(뿌리)로 구분하여 항염증 효과를 평가하였고, 지하부에 비해 효능이 우수한 것으로 나타난 지상부를 가지고, 천식 동물모델에서 알레르기성 염증 반응의 개선 효과를 구명하였다.
재료 및 방법
1. 잔대 추출물 제조
본 실험에서 사용한 잔대(Adenophora triphylla var. japonica)는 천안시에서 재배된 것으로, 지상부와 지하부 부분으로 나누어 수세 후 동결건조(PVTFD 10R, Ilsin Lab, Yangju, Korea)하여 균일하게 분쇄하였다. 시료 100 g에 중량 대비 10배의 80% 발효주정을 가하고, 실온에서 16시간, 3시간 2회 교반 추출하였다. 추출물은 Advantec paper(No.6) (Advantec Co., Tokyo, Japan)를 이용하여 감압 여과하는 과정을 2번 거친 후 감압농축기(EYELA N-1000, Riakikai Co., Ltd., Tokyo, Japan)를 사용하여 농축하였고, 동결건조(PVTFD 10R, Ilsin Lab, Yangju, Korea)하여 -70℃에서 보관하면서 본 실험에 사용하였다. 잔대 지상부와 지하부의 추출 수율은 각각 14.1 %, 18.7%이었다.
2. 세포배양
본 실험에는 마우스 대식세포인 RAW 264.7(Korean Cell Line Bank, Seoul, Korea) 세포를 사용하였다. 실험에 사용한 배지는 10% fetal bovine serum(Invitrogen, Carlsbad, CA, USA)과 penicillin-streptomycin solution(100 units/mL penicillin과 100 μg/mL streptomycin) (Hyclone Laboratories Inc., South Logan, UT, USA)이 포함된 DMEM이었고, 37℃, 5% CO2 조건에서 배양되었다.
3. MTT Assay
RAW 264.7 세포를 2×105 cell/mL 농도로 96 well plate에 200 μL씩 분주하여 24시간 경과 후 잔대 추출물을 농도별로 처리하여 24시간 동안 배양하였다. Plate에서 배지를 제거하고, 최종 처리농도 5 mg/mL가 되도록 thiazolyl blue tetrazolium bromide(Sigma-Aldrich Co., St. Louis, MO, USA)를 각 well에 100 μL씩 넣어 4시간 반응(37℃, 5% CO2 )시켰다. Plate 바닥에 생성된 formazan이 같이 나오지 않도록 조심스럽게 배지를 제거하고, DMSO 200 μL를 넣어 용해시킨 후 540 nm에서 흡광도를 측정하였다. 실험은 3회 반복하여 수행하였으며, 대조군(PBS) 대비 세포 생존율로 나타내었다.
4. NO 함량 측정
RAW 264.7 세포를 2×105 cell/mL 농도로 96 well plate에 200 μL씩 분주하여 24시간 경과 후 LPS(200 ng/mL)와 잔대 추출물을 처리하여 24시간 동안 배양하였다. 상층액 50 μL와 Griess reagent 50 μL를 실온에서 20분간 반응시킨 후 540 nm에서 흡광도를 측정하였다. 실험은 3회 반복하여 수행하였으며, NO의 농도는 sodium nitrite(NaNCO2 )를 사용한 표준곡선으로부터 구하였다.
5. 사이토카인 함량 측정
RAW 264.7 세포를 2×105 cell/mL 농도로 96 well plate에 200 μL씩 분주하여 24시간 경과 후 LPS(200 ng/mL)와 잔대 추출물을 처리하였다. 24시간 배양 후 상등액을 회수하여 TNF-α와 IL-6 ELISA kit(BD Biosciences, San Diego, CA, USA)를 이용하여 제조사의 매뉴얼대로 측정하였다. 실험은 2회 반복으로 하였다.
6. iNOS 및 COX-2 mRNA 발현 수준
RAW 264.7 세포를 2×105 cell/mL 농도로 24 well plate에 1 mL씩 분주하여 24시간 경과 후 LPS(200 ng/mL)와 잔대 추출물을 처리하여 24시간 동안 추가 배양하였다. RNeasy plus mini kit(Qiagen, Valencia, CA, USA)로 RNA를 추출하고, cDNA는 Quantitect Reverse Transcription kit(Qiagen)를 이용하여 매뉴얼에 따라 합성하였다. 생성된 cDNA를 이용하여 CFX96TM Real-Time PCR Detection System(Bio-Rad, Hercules, CA, USA)에서 SYBR green PCR reagents(Bio-Rad, Hercules, CA, USA)를 이용한 real time quantitative PCR 반응을 수행하였다. GAPDH를 endogenous control로 사용하였고, 반응조건은 다음과 같다. Pre-denaturation 95℃ 10 min; 95℃ 15 s, 60℃ 30 s, 72℃ 30 s; 40 cycles. 사용된 프라이머의 염기서열은 Table 1에 제시하였다. PCR 반응의 특이성은 melting curve 분석으로 확인하였다. 실험은 3회 반복으로 하였다.
7. 실험동물
6주령된 암컷 BALB/c 마우스(15∼19 g) 32마리를 (주)중앙실험동물에서 구입하여 실험에 사용하였다. 고형사료(Purina Inc., St Louis, MO, USA)와 물은 2∼3일마다 새로 공급하여 자유롭게 먹도록 하였고, 식이섭취량과 체중변화를 기록하였다. 사육장의 온도는 23±3℃, 습도 50±10%의 환경에서 1주간 적응시킨 후 실험에 사용하였다. 시험군은 무처리군(NC), 천식유도군(OVA), 천식유도+덱사메타존(3 mg/kg BW)처리군(DEX), 그리고 천식유도+잔대 지상부 80% 발효주정추출물(100 mg/kg BW) 처리군(AE-A)으로 4군으로 군당 8마리씩 무작위로 나누어 시험하였다. 본 실험은 국립농업과학원 동물실험윤리위원회의 승인(NAAS1307) 절차에 따라 수행하였다.
8. 천식유발 및 시료채취
전신 감작을 위해 20 μg의 Chicken egg ovalbumin(OVA)과 2 mg의 aluminum potassium sulfate(Sigma-Aldrich Co.)를 인산완충액(PBS) 200 μL로 용해한 후 혼합하였다. 이 혼합물을 2주 간격으로 총 2회 복강 내로 주사하여 전신 감작시켰다. 마지막 감작일로부터 3일 후 시험물질을 7일간 1일 1회 경구 투여하였으며, 마지막 3일간은 nebulizer를 이용하여 3% OVA 용액을 하루 1회 30분씩 비강 및 기도내로 흡입시켰다. 마지막 시험물질 투여 다음날 마취 후 조직을 수집하였다. 마취제는 Tiletaminer와 Zolazepam(ZoletilTM 250 mg/ 5 cc, Virbac, Carros, France) 1:1 혼합액과 Zylazine(Rumpun 2 % Bayer, Leverkuchen, Germany)을 3:1로 섞은 후 0.9% 멸균생리식염수로 10배 희석한 혼합액을 0.1 mL씩 복강투여하였다(Fig. 1).
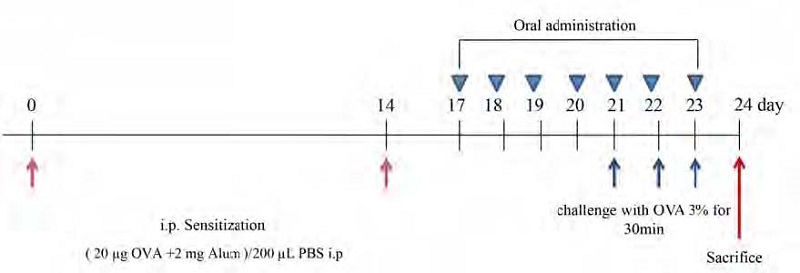
Mouse model of allergic asthma.Mice were sensitized with an intraperitoneal (i.p.) injection of 20ug of ovalbumin (OVA) emulsified in 2 mg aluminum hydroxide in a total volume of 200 μL in PBS per animal on days 0 and 14. The challenge was inhaled by nebulization of 3% OVA on days 21, 22, and 23 for 30 min. The oral treatments with 100 mg/kg of AE or 3 mg/kg of dexamethasone were achieved from day 17 to day 23 of the protocol.
9. 혈청 중 항원 특이 항체량의 측정
혈액은 심장 채혈법(heart puncture)으로 포집하고, 4℃, 3,000 rpm에서 30분간 원심 분리하여 혈청을 얻었으며, -70℃에 보관하였다. 혈청 Immunoglobulin E(IgE)측정을 위해 Mouse OVA specific IgE ELISA Kit(Biolegend, San Diego, CA, USA)를 사용하였다. 실험은 2회 반복으로 하였다.
10. 기관지 폐포 세척액 중 염증세포 측정
기관지 폐포 세척액(Bronchoalveolar lavage fluid, BALF)은 마취 후 기관지에 PBS 250 μL를 주입한 후 회수하는 방법으로 4회 반복하여 얻었다. BALF는 원심분리하여 상층액은 사이토카인 측정에 사용하였으며, 세포는 PBS 1 mL에 다시 혼합하여 BALF 중 총 세포 수를 측정하였다. 남은 검체는 cytospin에 넣어 슬라이드 도말하여 Diff-Quick 염색한 후 백혈구 감별을 실시하였다.
11. BALF 중 사이토카인 측정
BALF의 사이토카인(IL-4, IL-5, IL-13) 측정은 Mouse interleukin 4 Immunoassay kit(R&D systems, Minneapolis, MN, USA), Mouse interleukin 5 Immunoassay kit(R&D systems, Minneapolis, MN, USA), Mouse interleukin 13 Immunoassay kit(R&D systems, Minneapolis, MN, USA)를 사용하였다. 실험은 2회 반복으로 하였다.
12. 조직병리학적 소견 관찰
폐조직 일부를 10% 포르말린 용액에 고정하여, hematoxylin & eosin(H&E) 염색과 periodic acid-Schiff(PAS) 염색을 실시하였으며, 광학현미경(Olympus BX53, Olympus Co., Tokyo, Japan)을 이용하여 병리조직학적 검사를 수행하였다.
13. 통계처리
실험결과는 SAS 9.2 프로그램을 이용하여 실시하였다. 평균±표준편차(표준오차)로 표시하였고, 각 처리 간의 통계적 유의성은 one-way ANOVA를 실시하여 p<0.05 수준에서 Duncan’s multiple range test로 검증하였다.
결 과
1. RAW 264.7 세포에서 LPS로 유도된 염증 반응에 미치는 영향
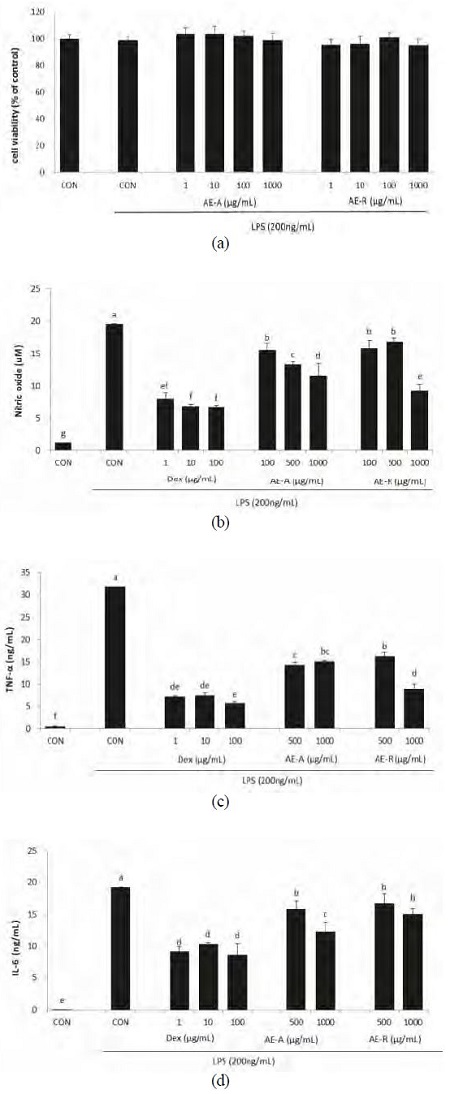
대식세포에서 LPS로 염증반응을 유도했을 때 잔대 지상부 추출물(AE-A)과 지하부 추출물(AE-R)이 미치는 영향을 Fig. 2에 제시하였다. 먼저 RAW 264.7 세포에 대한 세포독성도를 조사한 결과, AE-A와 AE-R은 농도 1,000 μg/mL까지 세포생존율에 유의한 영향을 미치지 않았다. NO와 TNF-α, IL-6의 함량은 LPS 처리로 대조구에 비해 유의적으로 증가하였다. 그러나 양성대조물질로 사용된 덱사메타존(Dex)은 LPS에 의한 염증 반응을 완전 저해시켰고, AE-A와 AE-R 또한 LPS 단독 처리구에 비해 유의적으로 NO와 TNF-α, IL-6의 함량을 감소시킨 것으로 나타났다.
2. RAW 264.7 세포에서 LPS로 유도된 iNOS, COX-2 mRNA 발현에 미치는 영향
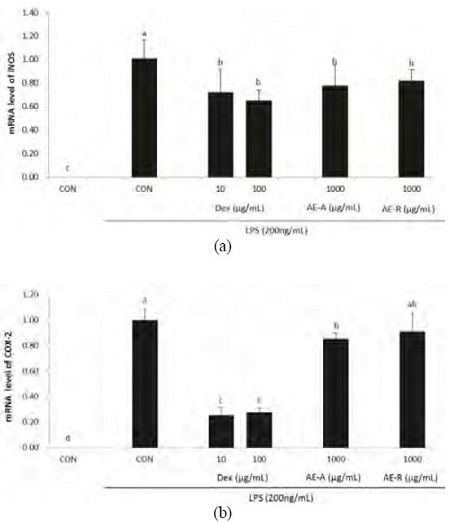
잔대 추출물의 RAW 264.7 세포에서 LPS로 유도된 iNOS, COX-2 mRNA 발현에 대한 영향을 Fig. 3에 제시하였다. 대식세포에 LPS를 처리하였을 때, iNOS와 COX-2의 mRNA 발현은 LPS를 처리하지 않은 대조구에 비해 유의적으로 크게 증가하였다. 그러나 Dex와 AE-A는 LPS에 의한 iNOS와 COX-2의 mRNA 발현의 증가를 유의적으로 저해시켰다. AE-R의 경우, iNOS의 발현을 LPS 단독 처리구에 비해 유의적으로 감소시켰고, COX-2의 발현은 감소시키는 경향을 나타냈다.
3. OVA로 유도된 천식 마우스의 BALF 중 염증세포에 미치는 영향
AE-A가 OVA로 유도된 천식 마우스의 BALF 중 염증세포에 미치는 영향을 Fig. 4에 나타내었다. CON 군에서 BALF 중 염증세포(총 세포, 중성구, 호산구, 림프구, 대식세포)가 OVA 처리에 의해 정상대조군(NC)에 비해 유의하게 증가하였다. 반면, AE-A 군에서는 CON 군에 비하여 BALF 중 호산구가 유의하게 감소하였다(p<0.0001). AE-A 군의 BALF 중 중성구와 림프구는 CON 군에 비해 통계적 유의성 없이 감소하는 경향을 보였다.
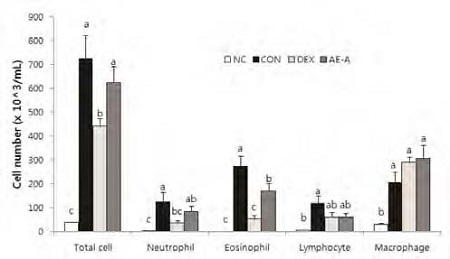
Effects of AE-A on the recruitment inflammatory cell numbers in BALF of mice.Cells were isolated by centrifugation and stained with Diff-Quik stain reagent. Cell numbers were determined using a light microscope to count cells. NC; normal control (PBS only), CON; OVA-sensitized/challenged mice, DEX; dexamethasone (3 mg/kg) + OVA-sensitized/challenged mice, AE-A; Adenophora triphylla (100 mg/ kg) + OVA-sensitized/challenged mice. Values are expressed as means±S.E. Means with the same letters are not significantly different at p<0.05.
4. OVA로 유도된 천식 마우스의 BALF 중 사이토카인과 IgE에 미치는 영향
실험동물의 BALF 중 IL-4, IL-5, IL-13 등의 Th-2 사이토카인 농도를 Fig. 5에 제시하였다. OVA로 유도된 천식 마우스의 BALF 중 사이토카인은 NC군에 비해 현저히 증가하였다. 그에 비해 AE-A 투여는 OVA로 인한 IL-4, IL-5, 그리고 IL-13 증가를 유의적으로 감소시켰다. 혈청 중 OVA specific IgE 함량은 NC 군에 비해 CON 군에서 유의하게 증가한 반면, AE-A 군에서는 OVA specific IgE 함량이 통계적으로 유의하게 감소하였다(Fig. 6).
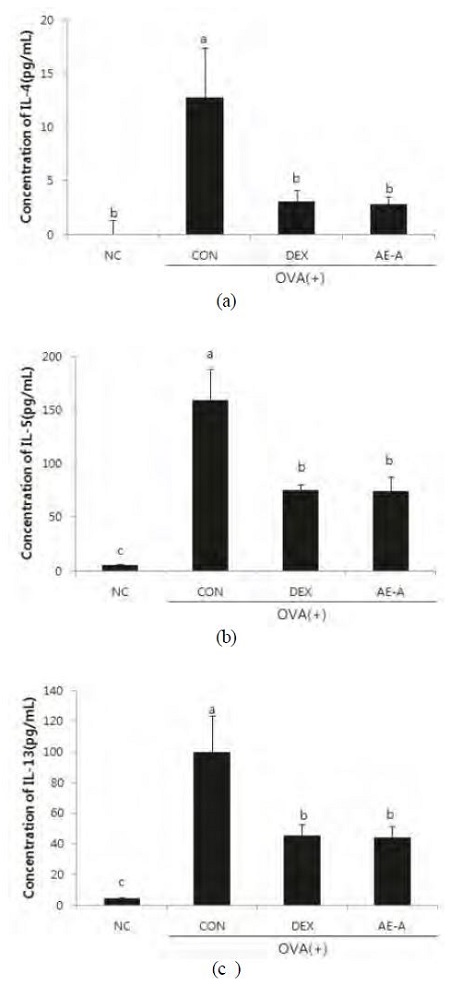
Effects of AE-A on IL-4 (a), IL-5(b), and IL-13 (c) levels in BALF.BALF was collected 24 h after the final OVA challenge in mice. Each sample was analyzed using ELISA kit. NC; normal control (PBS only), CON; OVA-sensitized/challenged mice, DEX; dexamethasone (3 mg/kg) + OVA-sensitized/challenged mice, AE-A; Adenophora triphylla (100 mg/kg) + OVA-sensitized/challenged mice. Values are expressed as means±S.E. Means with the same letters are not significantly different. p<0.05.
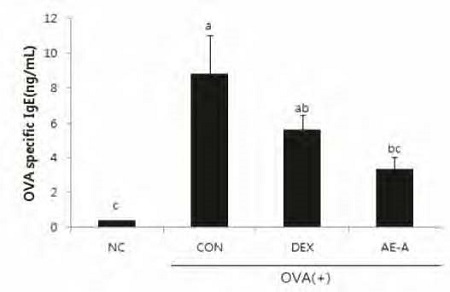
Effect of AE-A on IgE level in serum.Serum samples were collected 24 h after the final OVA challenge in mice. Each sample was analyzed using ELISA kit. NC; normal control (PBS only), CON; OVA-sensitized/challenged mice, DEX; dexamethasone (3 mg/kg) + OVA-sensitized/challenged mice, AE-A; Adenophora triphylla (100 mg/kg) + OVA-sensitized/challenged mice. Values are expressed as means±S.E. Means with the same letters are not significantly different. p<0.05.
5. OVA로 유도된 천식 마우스의 폐 조직병리학적 소견에 미치는 영향
염증세포 침윤 정도를 관찰하기 위해 폐 조직을 H&E 염색한 결과와 점액질 분비 정도를 측정하기 위해 PAS 염색한 결과를 Fig. 7에 제시하였다. NC 군에서는 이상 소견이 관찰되지 않은 반면, CON 군에서는 다량의 염증세포가 침윤되었고, PAS 양성세포의 양이 증가는 것으로 관찰되었다. 반면, AE-A 군의 폐조직 염색 결과, CON 군에 비해 염증세포 침윤과 PAS 양성세포 양이 감소하는 것으로 관찰되었다.
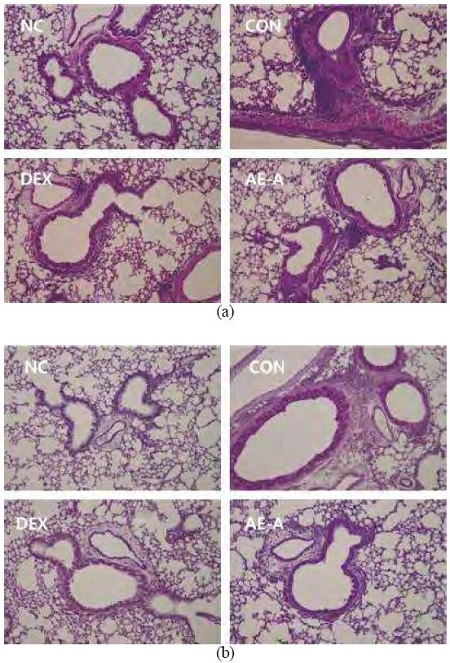
Effect of AE-A on lung histology.Histological examination of lung tissue was performed 24 h after the last OVA challenge. Lung tissues were fixed, sectioned at 4 µm thickness, and stained with H&E solution (a) and PAS reagent to assess mucus production (b). NC; normal control (PBS only), CON; OVA-sensitized/challenged mice, DEX; dexamethasone (3 mg/kg) + OVA-sensitized/challenged mice, AE-A; Adenophora triphylla (100 mg/kg) + OVA-sensitized/challenged mice.
고 찰
본 연구에서는 잔대 부위별(지상부와 지하부) 80% 발효주정 추출물이 염증과 천식에 어떠한 효과를 갖는지 알아보기 위해 LPS로 유도된 RAW 264.7 세포와 기관지 염증을 동반한 천식 동물모델에서 염증반응에 미치는 영향을 평가하였다. 우선, RAW 264.7 세포는 LPS와 같은 외부 자극에 의해 염증반응이 유도되게 되면, NO와 다양한 염증성 사이토카인을 생성한다. 본 연구에서도 RAW 264.7 세포에 LPS를 처리했을 때, LPS를 처리하지 않은 대조구에 비해 NO와 염증성 사이토카인 TNF-α, IL-6의 함량이 크게 증가하였다. 그러나, AE-A와 AE-R은 양성대조물질인 Dex와 마찬가지로 LPS로 유도된 NO 및 염증성 사이토카인 TNF-α와 IL-6의 함량 증가를 유의하게 저해시켰다. NO와 TNF-α, IL-6는 염증 반응의 주요한 매개인자이며, 류마티스 관절염 등과 같은 자가 면역 질환과 관련되어 있어(Brennan FM et al 1998; Ishihara K & Hirano T 2002), 본 연구결과는 AE-A와 AE-R이 병적인 과도한 염증 반응에 대해 저해 효과를 나타냄을 보여준다.
이러한 잔대 추출물(AE)의 염증 반응 저해 효과가 유전자 발현 수준의 조절을 통한 것인지 알아보기 위해 염증 반응에 중요한 역할을 하는 효소에 대해 RT-PCR을 수행하였다. 즉, iNOS와 COX-2는 각각 염증의 매개인자인 NO와 PGE2를 합성하는데 중요한 효소로(Lee HN et al 2011) 이들의 mRNA 발현 수준을 측정하였을 때, AE는 LPS에 의해 유도된 iNOS와 COX-2의 mRNA 발현 증가를 효과적으로 억제시켰다. 특히 AE-A는 AE-R에 비해 PGE2를 합성하는 효소 COX-2의 발현을 감소시키는 것으로 나타났다. 이러한 결과는 AE-A와 AE-R의 항염증 효능이 염증 반응의 매개인자를 생성하는 효소의 전사 조절에 의한 것임을 보여준다.
Kim JH 등(2009)은 잔대의 뿌리와 잎을 물과 에탄올로 추출하고, 항산화 활성을 비교하였을 때, 잔대 잎에서 뿌리보다 총 페놀 함량이 물 추출물의 경우 12배, 에탄올 추출물의 경우 7배 높게 함유되어 있었다. 총 플라보노이드 함량의 경우도 뿌리에 비해 잎에서 물 추출물의 경우 11배, 에탄올 추출물의 경우 6배 증가하였다. 폴리페놀이나 플라보노이드의 항염증 효능에 관해서는 잘 알려져 있어(Chen Y et al 2000; Fan X et al 2015), 잔대 뿌리에 비해 잎에서 페놀 및 플라보노이드의 함량이 높은 것은 본 연구에서 지상부의 항염증 효능이 더 높은 결과와 관련될 것으로 여겨진다. 또한, 만성적 염증과 산화스트레스의 증가는 인슐린저항증, 심혈관질환, 제2형당뇨 등의 비만 관련 합병증이나 대사증후군과 같은 대사적 이상과 연관되는 것이 잘 알려져 있다(Hotamisligil GS 2006). 따라서 잔대 지상부는 항산화능과 항염능이 지하부보다 우수하여 대사적 질환 예방 및 개선 소재로의 활용 가능성이 크다고 할 수 있다.
그 다음으로 in vitro 수준에서 AE-R에 비해 더 높은 항염증 효능을 보인 AE-A를 천식 유발 마우스에 투여하여 그 변화를 관찰하였다. 마우스를 천식 모델로 만들기 위해서는 감작 및 유발을 시키는데, 일반적으로 난백알부민(OVA)을 alum과 함께 혼합하여 1∼2회 복강주사를 통하여 감작시킨 후, 항원을 에어로졸로 만들어 흡입시켜 폐에 국소적으로 야기하는 방법이 널리 사용되며, 난백알부민에 대한 반응이 높은 BALB/c 마우스를 주로 이용한다. 이러한 방법으로 유도된 마우스 모델에서는 천식의 중요한 특징인 기관지의 호산구성 염증반응이 증가한다(Lee DK 2003). 본 연구에서 OVA 처리에 의해 유발된 천식 동물모델에서는 BALF의 중성구, 호산구, 림프구, 대식세포 및 총 세포수가 증가하였고, Th-2 사이토카인 및 혈청 IgE 농도 또한 정상 대조구(NC)에 비해 유의하게 증가하였다. 증가된 총 세포수에 AE-A 투여가 영향을 미치지 않았지만, 염증 세포 중 천식 개선의 대표적 지표인 호산구의 비율을 유의하게 감소시켰으며, IL-4, IL-13 및 혈청 IgE 농도 또한 유의하게 감소시켰다. Th-2 사이토카인은 천식유발에 매우 중요한 인자로 여겨지고 있으며, 최근에는 이들 사이토카인을 조절하는 약물에 대한 연구가 진행되고 있다(Oeser K et al 2015). 천식은 Th-2 반응과 호산구 침윤에 의한 염증반응으로 이 염증의 정도가 천식의 개선에 직접적으로 관련이 있는데, IL-4와 IL-5는 IgE를 생산하는 B세포 분화를 촉진하며, IL-5는 호산구의 증식에 관여한다(Fujitani Y et al 2002). 특히 IL-13은 기도 과민성에 필수적인 Th-2 사이토카인으로 보고되어 있다(Wills-Karp M 1998). 또한, IL-4와 IgE는 염증 진행에 관계된 비만세포의 탈과립(degranulation)이나 감작반응에 중요한 역할을 하는 인자로 혈중 IgE 농도는 천식 발생과 매우 높은 상관관계를 가지는 것으로 알려져 있다(Brugiolo AS et al 2011). 이는 AE-A 투여가 BALF 중 호산구를 감소시키고, Th2 사이토카인인 IL-4, IL-5의 분비를 감소함으로써 기관지 염증반응을 완화하여 점액질 분비를 감소시키고, 기관지 천식의 증상을 개선하는 것으로 사료된다. Roh SS 등(2008)은 천식 동물모델에서 잔대 뿌리 추출물(450 mg/kg)이 기관지 염증을 억제하여 천식 개선효과를 갖는다고 보고하였으나, 잔대 지상부의 천식 개선 효과를 구명한 것은 본 연구가 처음이다.
잔대의 영양성분을 분석한 연구(Ham YA et al 2009a)에서 잔대 뿌리의 수분, 조단백, 조지방, 조회분 및 탄수화물은 각각 3.4%, 9.4%, 1.6%, 3.7%, 81.9%로 탄수화물의 함량이 높게 나타났다. 또한, 무기질 중에 칼륨의 함량이 가장 높게 함유되어 있었고, 비타민 E와 C는 100 g 당 각각 1.1 mg, 5.2 mg의 수준으로 함유되어 있었다. 잔대의 기능성을 나타내는 유효성분에 관한 연구도 여러 개 보고되어 있다. Kang M 등(2013)은 잔대 뿌리로부터 3가지의 인간 유래 암세포주(폐암 A549, 위암 AGS, 간암 HepG2)에 대해 세포독성을 나타내는 사포닌 2종을 분리하였다. 또한, Ahn EK & Oh JS(2013)는 잔대 뿌리에서 분리한 lucopenone이 지방세포 분화를 억제시키고, 관련 전사인사 특히, PPARγ의 발현을 감소시킴을 보고하였다. 글리코시데이즈에 대한 저해 활성을 나타내는 알칼로이드 성분도 잔대 전초로부터 분리된 바 있다(Asano N et al 2000). 잔대 지상부의 함유 성분뿐만 아니라, 항염증 및 항천식의 약리학적 효능을 나타내는 유효성분을 구명하는 추가적 연구가 필요하다.
지금까지 잔대의 효능에 관한 연구는 주로 지하부(뿌리)에 관한 것으로, 본 연구에서 잔대 지상부의 항염 및 항천식 효과를 구명한 것은 잔대의 약리학적 작용에 대해 매우 의미있는 정보를 제공할 수 있을 것이다. 또한, 잔대는 주로 뿌리 부분을 식용 및 약용으로 사용하고 있어, 지상부에 대한 새로운 수요창출이 기대된다.
결 론
본 연구에서는 천식 증상의 완화 및 개선에 효과적인 천연소재로 나타난 잔대를 지상부와 지하부로 구분하여 항염증 효과를 평가하고, 지하부에 비해 효능이 우수한 것으로 나타난 지상부를 가지고 천식 동물모델에서 알레르기성 염증 반응의 개선 효과를 구명하였다. 그 결과, 잔대 추출물은 LPS로 유도된 대식세포에서 NO 및 염증성 사이토카인(TNF-α와 IL-6) 분비량의 증가를 유의하게 억제시켰고, 이것은 염증성 매개 물질 생성과 관련된 효소인 iNOS와 COX-2의 유전자 발현 감소에서 기인한 것으로 나타났다. 그 다음으로 OVA로 유도된 천식모델 마우스에 in vitro에서 활성이 우수한 잔대 지상부 추출물(AE-A)을 경구 투여하여 천식발생 억제 효과를 평가하였다. 그 결과, AE-A 투여는 OVA에 의한 혈중 IgE 증가와 BALF중 IL-4, IL-5, IL-13 등 Th2 사이토카인 분비를 유의적으로 억제하였을 뿐만 아니라, 기관지 염증세포 침윤과 점액질 과다 분비를 감소시켰으며, 이것은 염증세포 중 호산구의 감소를 수반하였다. 따라서 잔대 지상부 추출물은 기관지 염증으로 유도되는 천식을 개선하는데 효과가 있을 것으로 사료된다. 다만, 천식의 진단 지표로 활용되는 기도과민성에 미치는 영향이나 분자생물학적 기전 및 유효성분 구명을 위한 추가 연구가 필요하다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술연구개발사업(과제번호: PJ010052)의 지원에 의해 이루어진 것이며, 동물실험 과정에서 도움을 준 박수정선생에게 감사드립니다.
REFERENCES
-
Ahn, EK., & Oh, JS., (2013), Lupenone isolated from Adenophora triphylla var. japonica extract inhibits adipogenic differentiation through the downregulation of PPARγ in 3T3-L1 cells, Phytother Res, 27(5), p761-766.
[https://doi.org/10.1002/ptr.4779]

-
Asano, N., Nishida, M., Miyauchi, M., Ikeda, K., Yamamoto, M., Kizu, H., Kameda, Y., Watson, AA., Nash, RJ., Fleet, GW., (2000), Polyhydroxylated pyrrolidine and piperidine alkaloids from Adenophora triphylla var. japonica (Campanulaceae), Phytochemistry, 53(3), p379-382.
[https://doi.org/10.1016/S0031-9422(99)00555-5]

-
Baiz, N., Annesi-Maesano, I., (2012), Is the asthma epidemic still ascending?, Clinics in Chest Medicine , 33, p419-429.
[https://doi.org/10.1016/j.ccm.2012.06.001]

-
Brennan, FM., Maini, RN., Feldmann, M., (1998), Role of proinflammatory cytokines in rheumatoid arthritis, Springer Semin Immunopathol, 20, p133-147.
[https://doi.org/10.1007/BF00832003]

-
Brugiolo, AS., Alves, CC., Gouveia, AC., Dias, AT., Rodrigues, MF., Pacifico, LG., Aarestrup, BJ., Machado, MA., Domingues, R., Teixeira, HC., Gameiro, J., Ferreira, AP., (2011), Effects of aqueous extract of Echinodorus grandiflorus on the immune response in ovalbumin-induced pulmonary allergy, Ann Allergy Asthma Immunol , 106, p481-488.
[https://doi.org/10.1016/j.anai.2011.01.008]

-
Ci, X., Chu, X., Xu, X., Li, H., Deng, X., (2012), Short-term roxithromycin treatment attenuates airway inflammation via MAPK/NF-kappaB activation in a mouse model of allergic asthma, Inflamm Res, 61, p749-758.
[https://doi.org/10.1007/s00011-012-0470-6]

-
Chen, Y., Yang, L., Lee, TJ., (2000), Oroxylin a inhibition of lipopolysaccharide-induced iNOS and COX-2 gene expression via suppression of nuclear factor-kappaB activation, Biochem Pharmacol, 59, p1445-1457.
[https://doi.org/10.1016/S0006-2952(00)00255-0]

-
Choi, HJ., Kim, SH., Oh, HT., Chung, MJ., Cui, CB., Ham, SS., (2008), Effects of Adenophora triphylla ethylacetate extract on mRNA levels of antioxidant enzymes in human HepG2 cells, J Korean Soc Food Sci Nutr, 37, p1238-1243.
[https://doi.org/10.3746/jkfn.2008.37.10.1238]

- Chung, KJ., Jung, HJ., Jung, SK., Rhee, HK., (2002), The inhibitory effects of Sabaek-san and Sabaeksan plus Sasam on the IL-6, IL-8 and GM-CSF mRNA levels in human epithelial cells, Korean J Orient Int Med, 23, p15-24.
-
Durrani, SR., Viswanathan, RK., Busse, WW., (2011), What effect does asthma treatment have on airway remodeling? Current perspectives, J Allergy Clin Immunol, 128, p439-448.
[https://doi.org/10.1016/j.jaci.2011.06.002]

-
Fan, X., Zhang, Y., Dong, H., Wang, B., Ji, H., Liu, X., (2015), Trilobatin attenuates the LPS-mediated inflammatory response by suppressing the NF-κB signaling pathway, Food Chem, 166, p609-615.
[https://doi.org/10.1016/j.foodchem.2014.06.022]

-
Fujitani, Y., Kanaoka, Y., Aritake, K., Uodome, N., Okazaki-Hatake, K., Urade, YY., (2002), Pronounced eosinophilic lung inflammation and Th2 cytokine release in human lipocalintype prostaglandin D synthase transgenic mice, J Immunol, 168, p443-449.
[https://doi.org/10.4049/jimmunol.168.1.443]

-
Ham, YA., Choi, HJ., Chung, MJ., Ham, SS., (2009a), Component analysis and antioxidant activity of Adenophora triphylla, J Korean Soc Food Sci Nutr, 38, p274-379.
[https://doi.org/10.3746/jkfn.2009.38.3.274]

-
Ham, YA., Choi, HJ., Kim, SH., Chung, MJ., Ham, SS., (2009b), Antimutagenic and antitumor effects of Adenophora triphylla extracts, J Korean Soc Food Sci Nutr, 38, p25-31.
[https://doi.org/10.3746/jkfn.2009.38.1.025]

-
Hotamisligil, GS., (2006), Inflammation and metabolic disorders, Nature, 444, p860-867.
[https://doi.org/10.1038/nature05485]

-
Ishihara, K., & Hirano, T., (2002), IL-6 in autoimmune disease and chronic inflammatory proliferative disease, Cytokine Growth Factor Rev, 13, p357-368.
[https://doi.org/10.1016/S1359-6101(02)00027-8]

-
Kang, M., Ha, IJ., Chun, J., Kang, SS., Kim, YS., (2013), Separation of two cytotoxic saponins from the roots of Adenophora triphylla var. japonica by high-speed counter-current chromatography, Phytochem Anal, 24, p148-154.
[https://doi.org/10.1002/pca.2394]

-
Kim, JH., Hong, JY., Shin, SR., Yoon, KY., (2009), Comparison of antioxidant activity in wild plant (Adenophora triphylla) leaves and roots as a potential source of functional foods, Int J Food Sci Nutr , 60, p150-161.
[https://doi.org/10.1080/09637480902956594]

- Lee, DK., (2003), Usefulness and limitation of mouse asthma model, Korean J Pediatr, 46, p952-957.
-
Lee, HN., Lim, DY., Lim, SS., Kim, JD., Yoon Park, JH., (2011), Anti-inflammatory effect of ethanol extract from Eupatorium japonicum, Korean J Food Sci Technol, 43, p65-71.
[https://doi.org/10.9721/KJFST.2011.43.1.065]

-
Lee, MY., Seo, CS., Lee, JA., Lee, NH., Kim, JH., Ha, H., Zheng, MS., Son, JK., Shin, HK., (2011), Anti-asthmatic effects of Angelica dahurica against ovalbumin-induced airway inflammation via upregulation of heme oxygenase-1, Food Chem Toxicol, 49, p829-837.
[https://doi.org/10.1016/j.fct.2010.12.004]

-
Oeser, K., Maxeiner, J., Symowski, C., Stassen, M., Voehringer, D., (2015), T cells are the critical source of IL 4/IL 13 in a mouse model of allergic asthma, Allergy, http://onlinelibrary.wiley.com/doi/10.1111/all.12705 Accessed on 24. 8. 2015.
[https://doi.org/10.1111/all.12705]

- Park, DS., (2010), The Edible Wild Vegetable Containing Biological Active Substances, Euliiglobal, Korea, p231-234.
-
Roh, SS., Kim, SH., Lee, YC., Seo, YB., (2008), Effects of radix adenophorae and cyclosporine A on an OVA-induced murine model of asthma by suppressing to T cells activity, eosinophilia, and bronchial hyperresponsiveness, Mediators of Inflammation, Accessed on 2. 1. 2008.
[https://doi.org/10.1155/2008/781425]

-
WILLS-KARP, M., (1998), Interleukin-13: Central mediator of allergic asthma, Science, 282, p2258-2261.
[https://doi.org/10.1126/science.282.5397.2258]