
전립선 비대유도 쥐의 전립선 조직에서 울금 급여에 따른 염증인자의 변화
Abstract
Prostatic inflammation plays a crucial role on benign prostate hyperplasia (BPH) pathogenesis and progression. In this study, BPH was induced by testosterone propinate in castrated rats for 8 weeks. Hot water extract from Curcuma longa L. (CL) was administered orally for 4 weeks along with positive controls, saw Palmetto and finasteride. CL supplementation induced histological changes, reduced expression of TNF-α, IL-6, IL-1β, COX-2, and phospo-p65 in prostate tissue compared with the BPH group. These findings suggest that suppression of pro-inflammatory cytokines could be attributed, at least partly, to the anti-inflammatory action of C. longa, and this action may be helpful to understand the inhibitory effect of Curcuma longa L. in BPH.
Keywords:
Curcuma longa L., benign prostate hyperplasia, pro-inflammatory cytokines, BPH-induced rat서 론
양성 전립선 비대(benign prostate hyperplasia, BPH)는 50대 이후의 남성에서 가장 일반적으로 진단되는 비뇨기질환으로(Berry SJ et al 1984), 그 원인은 정확히 밝혀져 있지는 않지만 노화와 그에 따른 남성호르몬의 변화로 전립선 조직이 과다증식하여 크기가 커짐에 따라 요도를 압박하고(Timms BG & Hofkamp LE 2011), 임상적 증상은 방광 출구 폐색과 하부 요로 증상 등으로 나타나는 복합적 비뇨기계 질환이다(Roehrborn CG 2008). 최근 전립선의 염증(prostatic inflammation)이 BPH 유발에서 주요한 역할을 한다고 보고되고 있으며(Gandaglia G et al 2013). 또한, 임상적이나 조직학적 소견에서 염증이 있다면, 이것은 BPH의 치료나 관리에서 고려될 중요한 요소로 생각되고 있다(Bostanci Y et al 2013).
전립선 비대에서 염증은 조직손상의 원인이 되고, 염증세포로부터의 사이토카인은 국부적 성장인자(growth factor) 생성과 신생혈관 생성(angiogenesis)을 유발하여(Minutoli L et al 2013) 전립선 비대로 이어진다고 생각되는데, 실제로 전립선 비대 환자의 조직에서는 TNF-α를 비롯한 염증성 사이토카인(pro-inflammatory cytokine)이 높게 발현되고, 이에 따른 nuclear factor(NF)-κb가 활성화되는 것으로 보고되고 있다(Nuñez C et al 2008). 정상조직과 구분되는 이러한 발현은 노화에 따른 산화적 스트레스의 결과로 생각되는데(Sikka SC 2003), 활성산소종 및 COX-2의 유도에 의해 염증성 사이토카인이 생성되고, 염증반응으로 나타난다(Elberry AA et al 2014). 실제로, 전립선 비대 치료제로 사용되는 finasteride(Park DS & Shim JY 2008)에서 신생혈관 생성 억제효과가 보고되고 있으며 전립선건강 건강기능식품 소재인 saw palmetto 열매(Minutoli L et al 2013)에서 항염 효과가 보고되고 있다. Saw palmetto 열매 추출물의 항염증 효과는 전립선 비대와 연관된 하부 요로증상(Lower urinary tract symptoms) 등의 부작용의 감소에 효과가 있다고 보고되었으며(Latil A et al 2015), 전립선 비대 동물모델에서 조직무게의 감소를 보였다고 보고되었다(Bernichtein S et al 2015).
울금(turmeric, Curcuma longa L.)은 생강과(Zingiberaceae)에 속하는 다년생초로 열대 및 아열대지역에 분포되어 있고 인도, 중국, 그리고 우리나라 남부에서 재배된다(Ho JN et al 2012). 울금의 항염 효과는 Kim J 등(2015)의 연구에서, LPS로 유도한 급성 폐 손상에 효과가 있으며, 울금의 다당류 분획에서 항염증 효과(Illuri R et al 2015), 염증성 장질환에 대한 울금추출물의 효과(McCann MJ et al 2014) 등을 통하여 다양하게 연구되었다. 본 실험에서는 테스토스테론으로 전립선 비대를 유도한 래트의 모델에서 울금 열수추출물의 급여에 따른 전립선의 조직학적 변화와 염증관련인자의 변화를 추적함으로써, 전립선 비대 유발에 있어 염증관련인자의 감소가 전립선 비대 유발을 감소시킬 수 있는가 그 영향과 상관관계를 검토하고자 한다.
재료 및 방법
1. 실험재료
본 연구에서 사용한 울금 열수추출물(Curcuma longa Hot water extract; CL)은 전라남도 진도군에서 재배 수확된 울금을 세척ㆍ멸균한 후, 건조하여 추출기에서 10배의 물을 넣고 100℃에서 5시간 동안 추출하고, 여과ㆍ농축하여 동결건조(PVTFD10R, 일신랩, Dongduchun, Korea)한 것으로 (주)한국인스팜(Hwasun, Korea)으로부터 공급받아 사용하였다.
2. 실험동물에서 전립선 비대의 유도
실험에 사용된 래트는 대한바이오링크(Eumseong, Korea)에서 7주령(200∼250 g)에 공급받아 사용하였다. 내재성 테스토스테론(Intrinsic testosterone)의 영향을 배제하기 위하여 거세(castration)를 시행하였으며, 전립선 비대 동물모델은 Shin IS 등(2012)의 연구를 참고하였다. 실험동물을 마취시킨 후 배면이 수술자를 향하게 눕혀 고정하고, 음낭 끝 부위의 피부를 절개하여 좌우 고환 및 부고환을 잘라낸 후 절개면을 봉합하여 수술을 실시하였다. 거세를 시행하고 10일 동안 안정화를 시켜 수술부위의 상처를 아물게 하였다. 이후 거세된 래트(castrated rat)에 testosterone propionate(TP)를 투여하여 실험을 개시하였다. 개시 시점의 래트의 몸무게는 250∼300 g 범위에 있었으며, 6마리를 한 군으로 하여 총 7그룹으로, 전립선 비대 유도 이후의 시료 경구 투여에 맞도록 군을 나누었다(Table 1). 실험동물은 사육상자 당 2마리 이하로 수용되었으며, 다른 군끼리 한 사육상자에 있지 않도록 배려하여 배치하였다. Vehicle인 control group으로 사용될 6마리를 제외하고, 나머지 실험동물은 전립선 비대 유도를 위하여 TP를 3 mg/kg BW/day로 피하주사(subcutaneous injection)를 시행하였으며, 연구종료시점까지 몸무게 변화에 따라 투여하였다. 물과 사료는 자유섭취토록 하였으며, TP 투여 4주 후 세 가지 농도의 울금 열수추출물(CL) 혹은 쏘팔메토 오일(JinYong, Suwon, Korea) 혹은 finasteride를 4주 동안 TP 투여와 함께 경구 투여(per oral)를 시행하였다(Fig. 1). 본 실험에서 쏘팔메토 오일과 finasteride는 positive control로 사용하였다. 본 동물실험은 수원대학교 동물실험윤리위원회의 규정을 준수하여 시행하였다.
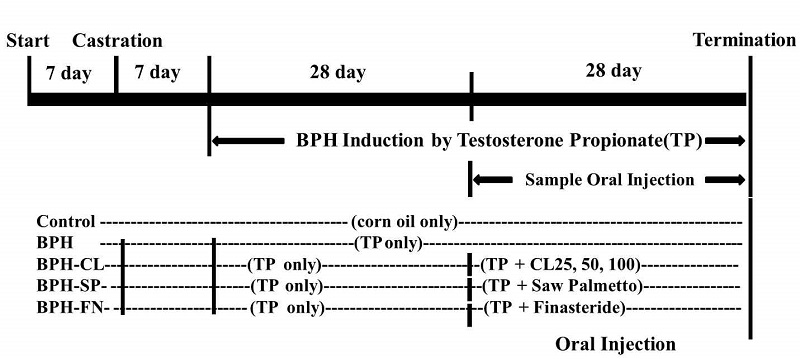
Experimental design of the study.After a week of adatation period, SD rats were castrated and had a week of recovery period. For BPH induction, subcutaneous injection was done to rats with testosterone propionate (3 mg/kg of BW/day) daily for 8 weeks. Curcuma longa L. hot water extract (25, 50 and 100 mg/kg of bw/day, p.o.) was orally administrated for 4 weeks in BPH-CL25, 50 and 100 groups.
3. Western Blot
실험 개시 8주가 경과한 후, 실험동물을 마취하고 희생시킨 후, 전립선을 적출하였다. 적출한 전립선은 PBS에 1회 세척한 후 물기를 가볍게 제거하여 10배의 pH 7.4 PBS(w/v)를 첨가하여 균질화하고 실험에 사용하였다. 전립선 균질액을 3,000 rpm에서 5분간 원심분리하여 상등액을 수거하고, Bradford법으로 단백질을 정량하였다. 각 군간 50 μg protein을 기준으로 8, 10, 15% SDS gel에 전기영동하고, Western blot을 시행하였다. Nitrocellulose membrane에 transfer한 후 5% skim milk로 4℃에서 16시간 동안 blocking을 시행하였으며, 다시 primary 및 secondary antibody를 처리한 후 X-ray film에 인화하였다. 본 실험에 사용된 antibody의 정보는 다음과 같다. Goat polyclonal IgG tumor necrosis factor-alpha(TNF-α, diluted 1:1,000; Santa Cruz Biotechnology, Santa Cruz, CA, USA), rabbit polyclonal IgG interleukin 1 beta(IL-1β, diluted 1:1,000; Santa Cruz Biotechnology), rabbit polyclonal IgG interleukin 6(IL-6, diluted 1:1,000; Santa Cruz Biotechnology), rabbit polyclonal IgG Cyclooxygenese-2(COX-2, diluted 1:1,000; Santa Cruz Biotechnology), rabbit polyclonal IgG NF-κB(diluted 1: 1,000; Santa Cruz Biotechnology), rabbit polyclonal IgG Phospho-p65(diluted 1:1,000; Cell Signaling Technology, Beverly, MA, USA), actin-mouse MAb(diluted 1:1,000; Sigma-Aldrich), rabbit polyclonal IgG NF-κB(diluted 1:1,000; Santa Cruz Biotechnology), rabbit polyclonal IgG Phospho-p65(diluted 1: 1,000; Cell Signaling Technology, Beverly, MA), rabbit polyclonal IgG IκB(diluted 1:1,000; Cell Signaling Technology, Beverly, MA), rabbit polyclonal IgG phospho-IκB(diluted 1: 1,000; Cell Signaling Technology, Beverly, MA)가 사용되었다.
4. 전립선의 조직학적 분석
전립선 조직의 비대 유도에 따른 변화의 조직학적 분석을 위하여 실험동물을 희생하여, 전립선을 적출하고, 4% para formaldehyde(Sigma-Aldrich, St. Louis, MO, USA)로 처리하여 파라핀블록을 만들며, 슬라이스하여 hematoxylin-eosin 염색을 실시하고, 현미경(BX-51, Olympus, Tokyo, Japan)으로 관찰하고 촬영하였다.
결과 및 고찰
1. 염증성 사이토카인에 대한 울금 열수추출물(CL)의 효과
희생된 래트의 전립선을 적출하여 균질화 한 후 immunoblot으로 확인한 염증성 사이토카인인 TNF-α, IL-6, IL-1β의 변화는 Fig. 2와 같다. BPH 군에서 TNF-α의 발현이 증가하였으며, IL-6 및 IL-1β가 증가한 것을 볼 수 있었다. 상대적으로, 양성대조군인 BPH-SP, BPH-FN 군의 발현은 감소하였으며, 울금 급여군인 BPH-CL 군의 각 농도에서 농도의존적으로 현저한 감소가 관찰되었다.
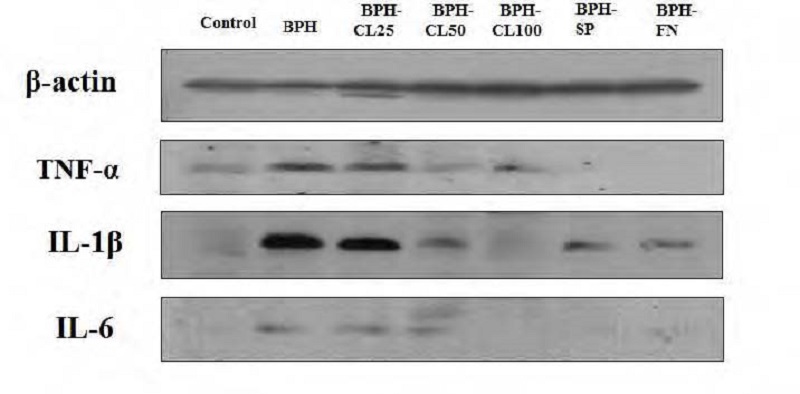
Effects of hot water extract from Curcuma long L. on TNF-α, IL-1β and IL-6 in prostate tissue of BPH-induced rats.Control: corn oil injection; BPH: Testosterone-Propionate (TP), BPH-CL25: TP + CL (25 mg/kg of BW/day), BPH-CL50: TP+ CL(50 mg/kg of BW/day), BPH-CL100: TP + CL (100 mg/kg of BW/day, BPH-SP: TP + saw palmetto (100 mg/kg of BW/day), BPH-FN: TP + finasteride (10 mg/kg of BW/day). Corn oil and TP were injected by subcutaneous injection. CL, saw palmetto, and finasteride were supplied orally.
2. COX-2 및 NF-κb에 대한 CL 급여의 효과
TP로 유도된 전립선 비대조직에서 COX-2의 발현은 Fig. 3과 같다. 전립선 비대와 COX-2의 증가간의 유의적인 관계는 아직 정립되지 않았으나, 전립선 비대에서 증가한다고 알려진 염증성 사이토카인이 상피세포에서 COX-2를 유도하여 전립선 세포의 proliferation을 상승시킨다고 생각되고 있다(Bostanci Y et al 2013; Kramer G & Marberger M 2006). 본 연구에서, Control 군에 비하여 BPH 군에서와 저농도군인 BPH-CL-25에서 COX-2의 증가를 볼 수 있으나, CL의 농도가 증가할수록 positive control 군과 같이 COX-2의 감소를 관찰할 수 있었다.
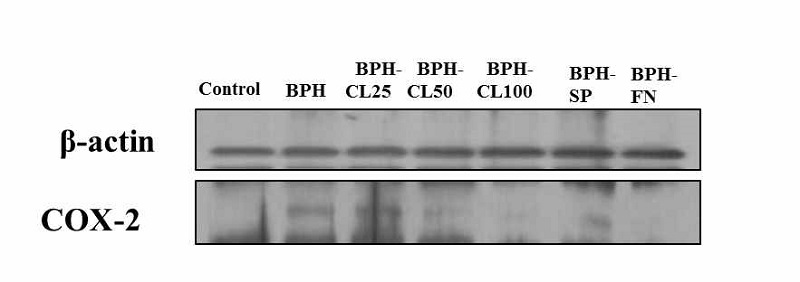
Effects of hot water extract from Curcuma longa L. on COX-2 in prostate tissue of BPH-induced rats.Control: corn oil injection; BPH: Testosterone-Propionate (TP), BPH-CL25: TP + CL (25 mg/kg of BW/day), BPH-CL50: TP+ CL(50 mg/kg of BW/day), BPH-CL100: TP + CL (100 mg/kg of BW/day, BPH-SP: TP + saw palmetto (100 mg/kg of BW/day), BPH-FN: TP + finasteride (10 mg/kg of BW/day). Corn oil and TP were injected by subcutaneous injection. CL, saw palmetto, and finasteride were supplied orally.
Fig. 4에서 p65의 인산화 변화를 보면 BPH 군과 BPH-CL 25 및 CL50 군에서 증가하고, BPH-CL100 군은 Control 군과 같은 수준의 감소경향을 보이는 반면, IκB의 인산화 경향은 높은 농도인 BPH-CL100 군에서 감소하지 않는 결과를 보이고 있다. 인산화의 증가는 세포질(cytoplasm)에 존재하던 Nκ-kb가 핵으로 이동하여 활성화되고, 이러한 과정에서 IκB의 분해(destruction)가 일어나는 것을 의미하며, 이 역시 염증성 사이토카인에 의해 활성화된다고 보고되고 있다(Vendramini-Costa DB & Carvalho JE 2012).
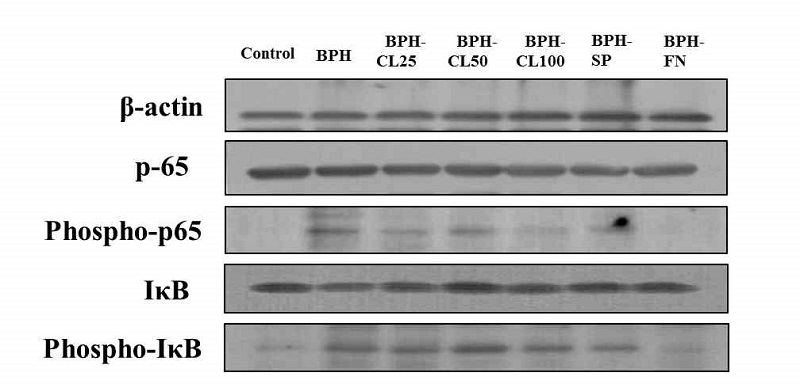
Effects of hot water extract from Curcuma longa L. on NF-κB p65, phospho-NF-κB p65, IκB and phospho-IκB in prostate of BPH-induced rats.Control: corn oil injection; BPH: Testosterone-Propionate (TP), BPH-CL25: TP + CL (25 mg/kg of BW/day), BPH-CL50: TP+ CL(50 mg/kg of BW/day), BPH-CL100: TP + CL (100 mg/kg of BW/day, BPH-SP: TP + saw palmetto (100 mg/kg of BW/day), BPH-FN: TP + finasteride (10 mg/kg of BW/day). Corn oil and TP were injected by subcutaneous injection. CL, saw palmetto, and finasteride were supplied orally.
전립선의 염증은 BPH의 발달과 진행의 원인 중 하나로 간주되며(Aryal M et al 2007; Kramer G & Marberger M 2006), BPH 환자의 전립선 부피와 염증은 관련 있다는 보고가 있다(Ahmad M et al 2012). 전립선 비대가 노화에 따라 증가한다는 사실은 잘 알려져 있으며, 노화에 따른 활성산소종의 증가가 전립선 비대 발달과 진행에 관여한다고 생각되고 있다(Atawia RT et al 2014). 전립선 비대 조직에서는 TNF-α의 발현이 정상 조직에 비하여 유의적으로 상승하는 것으로 보고되었다(Minutoli L et al 2013). IL-6는 정상 전립선 상피세포에서 분비되며, 성장인자로 작용하고(Elberry AA et al 2011), IL-1β는 angiogenic factor로서 암 전이와 혈관 형성에 중요한 역할(Elberry AA et al 2011)을 한다고 알려져 있다. TNF-α와 IL-1β는 ‘알람 사이토카인(alarm cytokine)’으로 정의되며, 마크로파지에 의해 분비되고, inflammation cascade를 시작하는 것으로 알려져 있다. 이들은 COX-2, IL-6 등의 염증성 사이토카인의 발현을 유도하고, 다시 TNF-α와 IL-1β의 생성을 자극하여 염증반응이 증폭된다(Vendramini-Costa DB & Carvalho JE 2012). 이들 염증성 사이토카인들은 전립선의 병리학적 변화와 연관되어 증가되는 것으로 생각되는데, 전립선 비대 억제 효과가 있는 대추야자(Phoenix dactylifera) 추출물의 연구에서(Elberry AA et al 2011) TNF-α와 IL- 6의 mRNA의 발현이 전립선 비대 모델의 경우 유의적으로 증가하였으며, 대추야자 추출물의 농도 증가에 따라 감소하는 경향을 보였다. 또한 붉은 양파 추출물을 통한 연구에서도 추출물의 농도에 따라 전립선 비대 모델에서의 TNF-α와 IL-6, IL-8 등의 발현이 감소하였다(Elberry AA et al 2014).
NF-κB(p50과 p60)는 면역반응과 cell proliferation에 관여하는 전사인자로 finasteride enzyme인 COX-2 등의 발현을 조절하고, 전립선 상피세포와 기질세포(stromal cell)에서 성장인자로 작용하는 finasteride-inflammatory 사이토카인인 IL-6와 IL-8의 발현을 조절한다(Atawia et al 2014). NF-κB는 활성화에 따라 세포질에서 핵으로 이동하게 되며, 전립선 비대 환자에서 p50과 p60은 모두 증가하는 것으로 보고되어 있다(Vendramini-Costa DB& Carvalho JE 2012). 본 연구에서는 세포질과 핵으로 나누지 않고, 전립선 조직 균질액에서 NF-κB의 활성화를 확인하기 위하여 phospho-p65의 증감을 검토하였다. Atawia RT 등(2014)의 연구는 전립선 비대 유도 래트 모델에서 실리마린 급여에 따라 NF-κB의 감소를 보여, 본 연구와 유사한 결과를 보였다.
3. CL 급여에 따른 조직학적 변화
전립선 비대 유발 및 울금 급여군에서 염증변화를 검토한 후, 전립선 비대의 완화 효과를 확인하기 위하여 hematoxylineosin staining을 실시하고, 그 조직학적 변화를 관찰하였다. Fig. 5에서와 같이 Control 군의 조직(A)에 비하여 BPH 군(B)의 전립선 조직의 상피세포는 비후되고, 내강이 좁아져 있음을 관찰할 수 있었다. 양성대조군인 BPH-SP 군(F)과 BPH-FN 군(G), 즉 쏘팔메토 급여군 및 finasteride 급여군에서는 BPH군과 비교하여 상피세포 비후가 감소하고, 내강도 Control 군(A)과 유사하게 회복된 것을 확인할 수 있었다. 울금 열수추출물군에서는 농도별로 저농도인 BPH-CL25 군(C)부터 고농도인 BPH-CL100 군(E)까지 상피세포의 비후 정도가 감소되고 있음을 볼 수 있고, 내강이 Control 군(A)와 유사한 모양으로 유지됨으로써 BPH 군에 비해 전립선 조직의 변화가 감소되는 것을 확인할 수 있었다. Shin IS 등(2012)의 연구에서도 전립선 비대가 일어난 군의 상피세포가 비후되는 변화를 보였으며, finasteride 등의 양성대조군의 변화가 본 연구와 흡사하게 나타났다. 이러한 변화는 앞서 결과에서 확인한 전립선 비대 모델에서 증폭된 염증신호가 울금 급여군에서 감소 경향을 보이는 결과와 경향이 일치하였다.
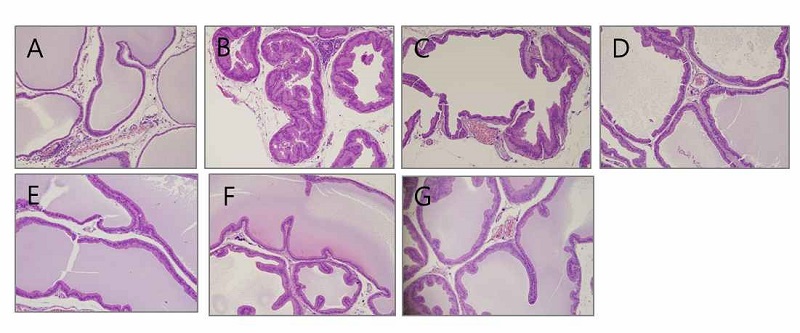
Histopathological examination in the prostate tissue of BPH-induced rats.(A) Control group: corn oil injection; (B) BPH: Testosterone-propionate (TP), (C) BPH-CL25: TP + CL (25 mg/kg of BW/day), (D) BPH-CL50: TP + CL ( 50 mg/kg of BW/day), (E) BPH-CL100: TP + CL (100 mg/kg of BW/day), (F) BPH-SP, TP + saw palmetto (100 mg/kg of BW/day), (G) BPH-FN: TP + finasteride (10 mg/kg of BW/day) (at × 100). Corn oil and TP were injected by subcutaneous injection. CL, saw palmetto, and finasteride were supplied orally.
요 약
본 연구에서는 테스토스테론으로 전립선 비대를 유도한 래트에 울금(Curcuma longa L.)의 열수추출물을 다양한 농도로 급여하여 그에 따른 염증인자의 변화를 검토하였다. 조직학적 분석에서 울금 열수추출물(CL) 급여에 따라 전립선 비대가 완화되는 것을 검토할 수 있었으며, 염증성 사이토카인인 TNF-α, IL-6 및 IL-1β이 전립선 비대 유도군에서 그 발현이 현저히 증가하였으나, 각 농도의 CL 군에서는 농도의존적으로 감소하였다. 또한, CL 급여에 따라 finasteride enzyme인 COX-2와 염증 전사인자인 NF-κb의 활성화의 감소를 확인하였다. 이와 같은 결과는 전립선 비대에서 울금 열수추출물이 항염증 효과로써 전립선 비대의 유발 및 발전을 억제시킬 수 있다는 것을 부분적으로나마 설명할 수 있는 기초 자료가 될 수 있다고 사료된다.
Acknowledgments
본 연구는 농림수산식품부의 기술사업화지원사업(20114-007)에 의해 이루어진 것으로 이에 감사드립니다.
REFERENCES
-
Ahmad, M., Suhail, N., Mansoor, T., Banu, N., Ahmad, S., (2012), Evaluation of oxidative stress and DNA damage in benign prostatic hyperplasia patients and comparison with controls, Indian J Clin Biochem, 27, p385-388.
[https://doi.org/10.1007/s12291-012-0229-4]

- Aryal, M., Pandeya, A., Bas, BK., Lamsal, M., Majhi, S., Pandit, R., Agrawal, CS., Gautam, N., Baral, N., (2007), Oxidative stress in patients with benign prostate hyperplasia, J Nepal Med Assoc, 46, p103-106.
-
Atawia, RT., Mosli, HH., Tadros, MG., Khalifa, AE., Mosli, HA., Abdel-Naim, AB., (2014), Modulatory effect of silymarin on inflammatory mediators in experimentally induced benign prostatic hyperplasia: Emphasis on PTEN, HIF-1α, and NF-κB, Naunyn Schmiedebergs Arch Pharmacol, 387, p1131-1140.
[https://doi.org/10.1007/s00210-014-1040-y]

-
Bernichtein, S., Pigat, N., Camparo, P., Latil, A., Viltard, M., Friedlander, G., Goffin, V., (2015), Anti-inflammatory properties of lipidosterolic extract of Serenoa repens (Permixon®) in a mouse model of prostate hyperplasia, Prostate, 75, p706-22.
[https://doi.org/10.1002/pros.22953]

- Berry, SJ., Coffey, DS., Walsh, PC., Ewing, LL., (1984), The development of human benign prostatic hyperplasia with age, J Urol, 132, p474-479.
-
Bostanci, Y., Kazzazi, A., Momtahen, S., Laze, J., Djavan, B., (2013), Correlation between benign prostatic hyperplasia and inflammation, Curr Opin Urol, 23, p5-10.
[https://doi.org/10.1097/MOU.0b013e32835abd4a]

-
Elberry, AA., Mufti, ST., Al-Maghrabi, JA., Abdel-Sattar, EA., Ashour, OM., Ghareib, SA., Mosli, HA., (2011), Anti-inflammatory and antiproliferative activities of date palm pollen (Phoenix dactylifera) on experimentally-induced atypical prostatic hyperplasia in rats, J Inflamm (Lond), 8, p40-53.
[https://doi.org/10.1186/1476-9255-8-40]

- Elberry, AA., Mufti, S., Al-Maghrabi, J., Abdel Sattar, E., Ghareib, SA., Mosli, HA., Ghareib, SA., (2014), Immunomodulatory effect of red onion (Allium cepa Linn) scale extract on experimentally induced atypical prostatic hyperplasia in Wistar rats, Mediators Inflamm, 640746.
-
Gandaglia, G., Briganti, A., Gontero, P., Mondaini, N., Novara, G., Salonia, A., Sciarra, A., Montorsi, F., (2013), The role of chronic prostatic inflammation in the pathogenesis and progression of benign prostatic hyperplasia (BPH), BJU Int, 112, p432-441.
[https://doi.org/10.1111/bju.12118]

-
Ho, JN., Jang, JY., Yoon, HG., Kim, Y., Kim, S., Jun, W., Lee, J., (2012), Anti-obesity effect of a standardised ethanol extract from Curcuma longa L. fermented with Aspergillus oryzae in ob/ob mice and primary mouse adipocytes, J Sci Food Agric, 92, p1833-1840.
[https://doi.org/10.1002/jsfa.5592]

-
Illuri, R., Bethapudi, B., Anandakumar, S., Murugan, S., Joseph, JA., Mundkinajeddu, D., Agarwal, A., Chandrasekaran, CV., (2015), Anti-Inflammatory activity of polysaccharide fraction of Curcuma longa extract (NR-INF-02), Antiinflamm Antiallergy Agents Med Chem, 14, p53-62.
[https://doi.org/10.2174/1871523014666150407150533]

-
Kim, J., Jeong, SW., Quan, H., Jeong, CW., Choi, JI., Bae, HB., (2015), Effect of curcumin (Curcuma longa extract) on LPS-induced acute lung injury is mediated by the activation of AMPK, J Anesth Sep 3, [Epub ahead of print].
[https://doi.org/10.1007/s00540-015-2073-1]

- Kramer, G., Marberger, M., (2006), Could inflammation be a key component in the progression of benign prostatic hyperplasia?, Curr Opin Urol, 16, p25-29.
-
Latil, A., Pétrissans, MT., Rouquet, J., Robert, G., de la Taille, A., (2015), Effects of hexanic extract of serenoa repens (permixon® 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia, Prostate, 75, p1857-1867.
[https://doi.org/10.1002/pros.23059]

-
McCann, MJ., Johnston, S., Reilly, K., Men, X., Burgess, EJ., Perry, NB., Roy, NC., (2014), The effect of turmeric (Curcuma longa) extract on the functionality of the solute carrier protein 22 A4 (SLC22A4) and interleukin-10 (IL-10) variants associated with inflammatory bowel disease, Nutrients, 6, p4178-4190.
[https://doi.org/10.3390/nu6104178]

-
Minutoli, L., Bitto, A., Squadrito, F., Marini, H., Irrera, N., Morgia, G., Passantino, A., Altavilla, D., (2013), Serenoa repens, lycopene and selenium: A triple therapeutic approach to manage benign prostatic hyperplasia, Curr Med Chem, 20, p1306-1312.
[https://doi.org/10.2174/0929867311320100007]

-
Nuñez, C., Cansino, JR., Bethencourt, F., Pérez-Utrilla, M., Fraile, B., Martinez-Onsurbe, P., Olmedilla, G., Paniagua, R., Royuela, M., (2008), TNF/IL-1/NIK/NF-κB transduction pathway: A comparative study in normal and pathological human prostate (benign hyperplasia and carcinoma), Histopathology, 53, p166-176.
[https://doi.org/10.1111/j.1365-2559.2008.03092.x]

-
Park, DS., Shim, JY., (2008), Histologic influence of doxazosin and finasteride in benign prostatic hyperplasia accompanying chronic inflammation, Urol Int, 81, p441-446.
[https://doi.org/10.1159/000167844]

-
Roehrborn, CG., (2008), Pathology of benign prostatic hyperplasia, Int J Impotence Res, 20, pS11-S18.
[https://doi.org/10.1038/ijir.2008.55]

-
Shin, IS., Lee, MY., Jung, DY., Seo, CS., Ha, HK., Shin, HK., (2012), Ursolic acid reduces prostate size and dihydrotestosterone level in a rat model of benign prostatic hyperplasia, Food Chem Toxicol, 50, p884-888.
[https://doi.org/10.1016/j.fct.2012.01.007]

-
Sikka, SC., (2003), Role of oxidative stress response elements and antioxidants in prostate cancer pathobiology and chemoprevention-A mechanistic approach, Curr Med Chem, 10, p2679-2692.
[https://doi.org/10.2174/0929867033456341]

-
Timms, BG., Hofkamp, LE., (2011), Prostate development and growth in benign prostatic hyperplasia, Differentiation, 82, p173-183.
[https://doi.org/10.1016/j.diff.2011.08.002]

-
Vendramini-Costa, DB., Carvalho, JE., (2012), Molecular link mechanisms between inflammation and cancer, Curr Pharm Des, 18, p3831-3852.
[https://doi.org/10.2174/138161212802083707]


