
증포 횟수를 달리하여 만든 선식을 첨가한 고지방식이가 비만 쥐의 혈당과 염증지표에 미치는 영향

Abstract
This study was conducted to evaluate the effects of Sunsik prepared by steaming -drying cycles- on blood glucose and inflammatory markers in high fat diet-induced obese rats. The experimental animals were divided into five groups and subjected to diets for 8 weeks; normal diet (control), high fat diet (HF), and high fat diet+10% supplementation of Sunsik (1HF, 3HF, 7HF, 9HF). The results showed body weight, food efficiency ratio, blood glucose and insulin levels of high fat diet groups were significantly higher than those of the control group. Increased glucose levels by high fat diet were reduced to normal levels by the four Sunsik supplementations. Insulin resistance (HOMA-IR) of the HF group was significantly higher than those of the control group, whereas supplementation with the four types of Sunsik reduced insulin resistance to similar levels as the control group. Increased insulin secretion and leptin levels of high fat diet-induced obese rats were significantly reduced by supplementation with the four types of Sunsik. C-reactive protein (CRP) of inflammation related components was significantly higher than the control group. However, increased CRP concentration by high fat diet was significantly reduced by supplemen- tation with Sunsik.
Keywords:
Sunsik, steming-drying cycles, blood glucose, C-reactive protein, leptin, adiponectin서 론
비만은 신체활동과 성장에 필요한 에너지를 초과하여 섭취된 열량이 중성지방의 형태로 지방조직에 과잉 축적된 것으로 주로 에너지 대사 불균형으로 나타나는 질환이다(Kopelman PG 2000). 체지방의 과잉 축적은 경제성장과 더불어 소득수준의 향상, 식습관의 변화, 신체 활동량의 감소 및 가공식품의 섭취량 증가 등에 의한 열량 섭취의 증가로 비만과 더불어 당뇨, 동맥경화, 심혈관계 질환 등의 성인병을 증가시키는 원인으로 작용하고 있다(Kopelman PG 2000; Moon SJ 1996). 2010년 국민건강영양조사를 분석한 결과에서 우리나라 정상체중 성인에 비해서 비만인은 고혈압, 이상지혈증, 당뇨병이 동반될 위험이 2배 이상 높다는 연구 결과가 보고되었다(Ministry of Health & Welfare 2011).
비만 환자의 영양소 섭취패턴을 평가한 연구에서는 지방 섭취율이 열량 대비 25.8%인 것으로 나타났으며, 지방 섭취량의 증가는 비만 유병률을 증가시키는 요인으로 작용한다(Kim et al 2007). 증가된 지방 섭취는 내장지방을 축적시키게 되며, 그 결과, 간문맥 혈의 유리지방산 농도를 높여서 인슐린 저항성을 높이는 고인슐린혈증(hyperinsulinemia)을 유발하여 영양대사 이상을 초래하게 된다(Cho et al 1978). 특히 복부비만 환자는 인슐린 저항성으로 말초조직에서 포도당의 이용에 장애가 생기고, 췌장에서는 정상혈당 유지를 위해서 더 많은 인슐린을 분비하게 된다. 그 결과, 고인슐린혈증 상태가 지속되어 췌장의 랑게르한스섬의 β-세포 기능 저하와 간에서 당 신생의 증가로 공복 혈당이 높아져 제2형 당뇨병으로 발전하게 된다(Miyazaki et al 2002; Kershaw & Flier 2004).
또한 체지방 조직 내에 과잉으로 축적된 지방은 지방세포에서 특이적으로 발현되어 유도된 염증유발 내분비 물질을 분비시켜서 염증반응으로 인한 대사성 질환을 유발하는 것으로 알려졌다(Kershaw & Flier 2004). 염증반응 지표의 대표적인 물질로 C-반응성 단백질(C-reactive protein, CRP)은 지방섭취량이나 지방세포에서 발현되어 체지방량이 높을수록 농도가 증가되는 것으로 나타났다(Lee et al 2012a). 또, 다른 물질로 렙틴(leptine)은 OB(Lep) gene에서 발현된 펩티드 호르몬으로 백색 지방량과 밀접한 관련이 있으며, 렙틴의 작용이 활발하면 식욕과 음식 섭취량을 감소시키는 동시에 교감신경을 자극해 모든 기관의 에너지 소비량을 증가시켜 체중을 조절하게 된다(Han et al 2012). Huang et al(2004)은 비만 및 과체중의 청소년에서 혈청 렙틴은 인슐린 저항성과 관계가 있다고 보고하였으며, Franks et al(2005)은 렙틴이 비만과는 무관하게 대사증후군의 증상을 악화시킨다고 보고하였다. 그 반면에, 아디포넥틴(adiponectin)은 동맥경화나 심혈관계 질환 등에 대한 방어 인자로 알려져 있으며, 비만한 사람이나 제2형 당뇨병 환자에서는 그 농도가 감소되는 것으로 나타났다(Havel PJ 2002; Baek et al 2010).
위의 연구 결과를 토대로 본 연구에서는 고지방 식이로 유도된 비만 쥐에게 선식을 공급하여 혈당 및 염증반응 관련 인자에 미치는 효과를 보고자 실시하였다. 선식의 제조는 약재를 찜통이나 시루 속에 넣어 수열과 증기를 이용하여 가열하고 말리는 증포 과정을 9번 반복하여 나타난 약성의 변화로 치료효과를 높이는 것으로 알려진 구증구포(九蒸九炮)법으로 실시하였다(Choi et al 2009; Kim et al 2011). 구증구포를 통한 효능 증진에 관한 연구로는 생지황을 아홉 번 찌고 건조한 것이 가장 대표적이며, 숙지황은 증포 횟수가 증가함에 따라서 성분 변환에 의한 악성빈혈 치료 효능이 증가한 것으로 밝혀졌다(Lee et al 2011; Ma et al 2000). 또한 구증구포로 처리한 참깨에 멥쌀을 넣어 만든 죽은 근골과 간 및 신장의 기운을 도와주는 것으로 나타났다(Kim HC 2003).
따라서 본 연구에서는 고지방식이로 유도된 비만 쥐에게 증포 횟수를 다르게 처리한 선식을 첨가하여 섭취시켰을 때, 혈당과 인슐린 저항성 및 염증 관련 인자에 미치는 선식의 효과를 알아보고자 실시하였다.
연구방법
1. 실험재료 및 선식제조
본 실험에서는 총 24종의 식재료로 두류 2종류(30.0%, w/w)는 쥐눈이콩과 백태콩, 곡류 9종류(61.5%, w/w)는 겉보리, 찰보리, 붉은팥, 흑미, 찹쌀현미, 율무, 수수, 차조 및 옥수수, 서류 2종류(2.0%, w/w)로 감자와 고구마, 채소 6종류(2.0%, w/w)로는 호박, 우엉, 표고버섯, 양배추, 연근 및 시금치, 과일 4종류(4.0%, w/w)로는 사과, 딸기 및 밀감, 그리고 천연 감미료 1종류(0.5%, w/w)로는 스테비아를 일정 비율로 구성하여 선식을 제조하였다. 단백질과 불포화지방산의 주된 공급원으로 쥐눈이콩과 백태콩을, 탄수화물의 급원으로는 현미, 보리, 율무 및 수수, 옥수수, 감자 및 고구마를, 그리고 천연색소인 생리활성물질(phytochemicals)을 함유한 급원식품으로는 붉은팥, 흑미, 수수, 차조, 호박을 이용하였다. 비타민 A와 엽산의 함유량을 높이기 위해서 시금치를, 섬유질의 섭취량을 높이기 위해서는 표고버섯 및 양배추를, 그리고 무기질, 비타민 B 복합체 및 비타민 C 등이 골고루 함유되도록 하기 위한 식품 구성을 위하여 과일류로 사과, 딸기 및 밀감을 사용하였다. 두류와 곡류 식품 모두는 전라북도에서 수확한 것으로 사용하였으며, 서류, 과일류 및 채소류는 산마을 쇼핑몰(http://www.sanmall)에서 판매되는 분말제품으로 사용하였다. 그리고 스테비아는 대농스테비아(Daenong Stevia, Korea)에서 분말상태로 구입하여 이용하였다.
선식의 제조방법은 모든 두류와 곡류를 깨끗이 세척한 후, 일반음용수로 실온에서 14시간 동안 불린 다음, 대용량 전기찜솥(Auto clave ED-PAC, Edun Mesuring Inst., Korea)에서 115℃ 이상에서 2시간 30분 증자한 다음 실온에서 10분 정도 뜨거운 열기 배출시킨 후 내부온도 75∼85℃ 정도가 되도록 식히는 과정을 총 9회 반복하였다. 이후 전기건조기(HDG- 220, Grand Korea Co., Korea)를 이용하여 60℃에서 40시간 동안 건조하여 수분 10% 이하로 만들었다. 그런 다음 볶음솥(Gwangmyung Machine, Korea)을 이용해서 물성에 따라 90∼95℃에서 6∼7분 동안 볶은 후 주문 제작된 제분기(IFPM Co., Korea)를 이용하여 100∼120 mesh로 분쇄해서 선식을 제조하였다. 분쇄한 두류와 곡류 분말에 일정비율의 서류, 채소류, 과일류 및 천연감미료를 첨가하여 증포 횟수에 따라서 1증1포, 3증3포, 7증7포, 그리고 9증9포 선식을 제조하였다.
2. 실험동물 및 식이구성
실험동물은 12주령된 SD계(HyoChang Science, Daegu, Korea) 수컷 흰쥐 48마리를 2주 동안 일반고형사료(Jeilfeed Co, Korea)로 적응시킨 다음 난괴법으로 6군(C, HF, 1HF, 3HF, 7HF, 9HF)으로 나눈 후 Table 1에서 제시한 바와 같이, AIN-93 정제식이 조성에 의거하여 제조한 식이를 8주 동안 공급하였다. 고지방식이는 옥수수기름 대신에 포화지방산의 함유량이 높은 라드(20% w/w)와 콜레스테롤(1%, w/w)를 함유한 식이를 제조하여 대사증후군의 특징을 갖는 비만을 유도하였다. 단백질원으로 카제인(casein)의 식이조성 비율은 정상군과 고지방식이군에서 20%인 반면에, 10%의 선식 첨가식이군에서는 선식 내의 쥐눈이콩과 백태콩에 의한 단백질 보충으로 카제인 단백질을 10% 공급하였다.
그런 다음 체중과 사료 섭취량은 1주일에 한 번 일정한 시간에 12시간 절식시킨 상태에서 측정하였으며, 식이와 음용수는 자유로이 먹도록 하였다. 실험동물 사육실의 환경온도는 22±1℃, 상대습도는 65±5%로 유지하였으며, 명함은 12시간 주기(09:00∼21:00)로 조절하였다. 사료효율은 식이섭취량과 체중증가량을 이용하여 구하였다.
3. 시료의 채취 및 장기 무게
실험식이로 사육한 흰쥐를 12시간 절식시킨 후 CO2로 마취하여 개복한 후 헤파린으로 처리된 주사기를 이용하여 복부대정맥에서 혈액을 채취하였다. 그리고 실온에서 1시간 동안 방치시킨 후, 3,000 rpm에서 15분간 원심분리하여 혈장을 분리하고, 분석 시까지 —70℃에서 보관하였다.
4. 혈당 및 인슐린 관련 인자
공복혈당은 12시간 이상 절식시킨 후 꼬리정맥에서 혈액을 채혈한 후 혈당측정기(Accucheck, Germany)를 이용하여 측정하였으며, 인슐린 농도는 insulin ELISA (Enzyme-Linked Immunosorbent Assay) kit를 사용하여 microplate reader (Ther- mo Scientific, USA)로 측정하였다. 인슐린 저항성(HOMA-IR : homeostasis model assessment of insulin resistance index)과 췌장의 β-세포의 인슐린 분비능(HOMA-β)은 Chung et al(2010)과 Matthews et al(1985)의 공식에 의거하여 계산하였다.
5. 염증지표 측정
혈청 내 염증 관련 지표인 C-반응성 단백질(C-response pro- tein, CRP)는 쥐의 CRP 특이적 항체를 이용한 CRP ELISE kit (Biovision, USA)를 이용하여 450 nm microplate reader를 이용하여 측정하였다. 렙틴(leptin)의 농도는 항체에 효소를 결합시켜 항원-항체반응을 확인하는 leptin rat ELISA kit(Abcan, UK, USA)를 사용하여 450 nm에서 microplate reader를 이용하여 측정하였다. 아디포넥틴(adiponectin) 농도는 항인간 아디포넥틴 항체를 이용하여 항원-항체반응을 유발하여 확인하는 아디포넥틴 ELISA kit (Abcan, UK, USA)를 사용하여 450 nm에서 microplate reader를 이용하여 측정하였다.
6. 통계처리
실험을 통하여 얻어진 자료는 SPSS software(statistical pac- kage for social science, version 21.0, SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 그 결과는 평균±표준편차(standard error)로 표시하였다. 실험결과는 일원배치 분산분석(one way analysis of variance)을 한 후 Duncan's multiple- range test에 의해 p<0.05 수준에서 각 실험군의 평균치의 통계적 유의성을 검정하였다.
결과 및 고찰
1. 성장상태 및 장기무게
실험동물의 성장상태는 Table 2에서 제시한 바와 같이, 최초 체중은 모든 실험군 간에 유의적인 차이 없이 임의배치하였으며, 실험 종료 시 마지막 체중에서는 C 군이 427.6±6.79 g으로 p<0.05 수준에서 유의적으로 가장 낮은 체중을 보인 반면에, HF 군은 C 군에 비해서 12.9%의 체중증가량을 보였다. 그러나 고지방식이와 함께 선식을 공급시킨 1HF, 3HF, 7HF, 9HF 군에서 체중증가량의 감소는 보였으나, C 군의 수준에는 미치지 못하였다. 식이효율은 고지방식이 섭취군 중에서 HF 군에서 가장 높았고, 이러한 결과는 고지방식이의 높은 칼로리로 인해 나타난 결과로 해석된다(Jang & Jeong 2010). 그러나 이때 공급된 선식 중에서 9증9포 선식을 공급시킨 9 HF 군에서 p<0.05 수준에서 낮은 사료효율을 보였다.

Effect of Sunsik by steming-drying cycles on initial body weight, final body weight, body weight gain, and FER in high fat diet rats for 8 weeks
체중 100 g 당 조직의 무게로 환산한 결과는 Table 3에서 제시하였다. 간 조직의 무게는 C 군에 비해서 고지방식이를 섭취한 모든 군에서 유의적으로 높았으며, 이는 고지방과 콜레스테롤을 첨가한 식이를 섭취한 흰쥐의 간 조직에 지방이 침착되어 간 무게가 증가하였다는 Moon et al(2010)의 연구 결과와 일치하였다. 신장과 비장의 무게는 모든 실험군 간에 유의적인 차이는 없었다. 따라서 고지방식이를 섭취한 본 실험 동물의 간, 신장, 그리고 비장의 중량에 대하여 4종류 선식의 공급이 별다른 영향을 미치지 못한 것으로 나타났다.
2. 혈당 및 인슐린 관련 인자
포도당, 인슐린 농도 및 인슐린 저항성과 분비능은 Table 4에서 제시하였다. 포도당 농도는 C 군의 105.3±3.13 mg/dL에 비해서 HF 군은 112.9±5.40 mg/dL로 p<0.05 수준에서 유의적으로 높았다. 그러나 1HF, 3HF, 7HF, 그리고 9HF 군의 포도당 농도는 각각 97.6±5.88, 94.5±4.25, 95.0±4.03, 그리고 99.1±5.08 mg/dL로 비슷한 수준을 보였으며, C 군의 포도당 농도와는 유의적인 차이가 없었다. Hyun et al(2008)은 현미, 수수, 보리, 율무로 구성된 선식을 소화장애가 없는 여대생을 대상으로 실험한 결과, 혈당수치를 저하시켰으며, 그 기전은 선식의 식이성분 중 수용성 식이섬유가 점성의 젤을 형성하여 위 배출 시간을 지연시켜 소화흡수 속도를 조절시킨 결과라고 설명하였다(Nishimune et al 1991). 특히 단백질, 각종 비타민과 무기질이 풍부한 현미가 함유하고 있는 섬유질과 폴리페놀(polyphenol), 감마오리자놀(γ-oryzanol), GABA (γ-aminobutyric acid), 옥타코사놀(octacosanol)과 같은 생리활성물질은 항암, 항산화, 혈압 강하, 콜레스테롤과 혈당 저하효과가 보였다(Xu et al 2001). 그리고 수수와 보리가 함유하고 있는 β-glucan은 혈당조절 효과가 있는 것으로 보고되었고(Niba & Hoffman 2002; Lee & Oh 2004), Takahashi et al (1986)은 율무의 coixans A, B, C 성분이 alloxan으로 유도된 당뇨 쥐의 혈당을 감소시켰다고 하였다. 이외에도 Lee et al (2004)은 streptozotocin(STZ)으로 유도된 당뇨 쥐의 혈당과 인슐린 감수성에 쥐눈이콩 분말이 개선효과를 보였다고 밝혔다. 이상의 선행 연구 결과들(Nishimune et al 1991; Xu et al 2001; Niba & Hoffman 2003; Lee & Oh 2004; Takahashi et al 1986; Lee et al 2004)로 미루어 볼 때, 본 연구의 선식에 함유된 현미, 보리, 쥐눈이콩, 수수, 율무가 위의 기전을 통하여 혈당 강하 효과를 나타낸 것으로 사료된다.

Effect of Sunsik by steming-drying cycles on blood glucose, insulin, HOMA-IR and HOMA-β levels in high fed diet for 8 weeks
인슐린 농도는 C 군의 1.31±0.10 ng/mL에 비해서 HF, 1HF, 3HF, 7HF, 그리고 9HF 군은 각각 1.78±0.03, 1.62±0.04, 1.61± 0.02, 1.57±0.02, 그리고 1.49±0.02 ng/mL로 p<0.05 수준에서 유의적으로 높은 농도를 보였다. 그러나 고지방식이로 증가된 인슐린 농도는 4종류의 선식 공급으로 유의적으로 낮출 수 있었으며, 이때 증포 횟수에 따른 차이는 없었다. 인슐린 저항성(HOMA-IR)은 C 군의 6.20±0.60에 비해서 HF 군은 8.75±0.60로 고지방식이에 의해 높아졌으나, 1HF, 3HF, 7HF, 그리고 9HF 군에서 각각 6.74±0.30, 6.73±0.29, 6.62±0.29, 그리고 6.59±0.35로 p<0.05 수준에서 고지방식이에 의해 증가된 인슐린 저항성은 4종류의 선식 공급으로 정상식이 섭취군의 수준으로 낮출 수 있었다. 인슐린 저항성은 주로 말초조직인 근육과 지방 및 간 조직에서 당대사의 결함으로 일어나며, 특히 제2형 당뇨병은 췌장 β-세포에서의 인슐린 분비기능의 장애와 말초조직의 인슐린 저항성이 주요 병인으로 보고되었다(Mykkanen et al 1999; Porte & Kahn 1989). 인슐린 분비능(HOMA-β)은 C 군의 0.26±0.02에 비해서 HF 군은 0.35±0.03, 1HF 군은 0.35±0.02, 3HF 군은 0.36±0.02, 7HF 군은 0.35±0.02, 그리고 9HF 군은 0.32±0.01로 p<0.05 수준에서 C 군보다 고지방식이군 모두 유의적으로 낮은 분비능을 보였다. 그러나 선식의 증포 횟수에 따른 인슐린 분비능의 차이는 없는 것으로 나타났다.
Feskens EJM(1991)과 Ferranini et al(1983)은 정상 혈당을 보인 사람이라도 식사 중 포화지방산과 콜레스테롤의 섭취량이 많을수록 내당능 장애를 일으킨다고 보고하였다. 이는 지방의 섭취와 당뇨병 발생이 밀접한 관계가 있음을 시사하고 있으며, 본 연구 결과도 이와 유사한 경향을 보였다. Lee & Shin(1998)의 전분가수분해율 및 혈당지수에 관한 연구에서는 곡류를 단독으로 섭취하는 것보다 곡류와 두류의 혼합식을 섭취했을 때 혈당반응 및 혈당지수(glycemic indec, GL)를 낮추는 것으로 나타났으며, 이러한 결과는 곡류의 단독 사용보다는 두류와 함께 사용함으로써 혈당 저하에 상승효과를 얻을 수 있음을 시사하고 있다.
본 실험에서도 고지방식이에 의한 대사증후군 지표로 정상식이군에 비해서 고지방식이군에서 혈당과 인슐린 저항성이 유의적으로 높은 반면에, 인슐린 분비능은 낮았다. 그러나 현미, 겉보리, 백태콩, 검은콩, 수수 및 율무와 같은 곡류나 두류가 함유된 선식의 공급으로 포도당과 인슐린 농도 및 인슐린 저항성은 다소 조절할 수 있는 것으로 나타났다.
3. C-반응성 단백질 농도
C-반응성 단백질의 농도는 Fig. 1과 같이 C 군의 72.2±1.55 ng/mL에 비해서 HF 군은 87.8±9.82 ng/mL로 p<0.05 수준에서 유의적으로 높았다. 그러나 선식을 공급시킨 1HF, 3HF, 7HF, 그리고 9HF 군의 CRP 농도는 각각 77.7±7.52, 78.5±8.32, 75.0±7.21, 그리고 75.7±4.25 ng/mL로 HF 군에 비해서 유의적으로 낮은 농도를 보였으며, 이때 선식의 증포 횟수에 따른 유의적인 차이는 없었다. CRP는 간에서 생성되는 비특이적인 급성기 단백질로서 각종 염증반응을 유도하므로 심혈관계 질환 및 당뇨병의 발병을 예측하는 지표 중 하나로 이용되고 있으며(Kengne et al 2012). 역학 연구에서는 CRP와 비만도는 양의 상관성이 있는 것으로 보고되었다(Ozuğz et al 2012; Lee et al 2012b; Montenegro-Neto et al 2011). 또한 식이지방과 CRP와의 관련성에 관한 연구에서는 지방 섭취량이 높은 청년기 남성에서 CRP의 농도가 높았으며, 구체적인 지방산 조성으로는 포화지방산이나 트랜스지방산과는 양의 상관관계를, 불포화지방산과는 음의 상관관계를 가지는 것으로 보고되었다(Lee et al 2012a). 본 연구에서도 고지방식이 섭취로 높아진 염증성 반응 단백질인 CRP의 농도는 선식의 공급으로 낮출 수 있었으나, 선식의 증포 횟수에 따른 차이는 없는 것으로 나타났다.
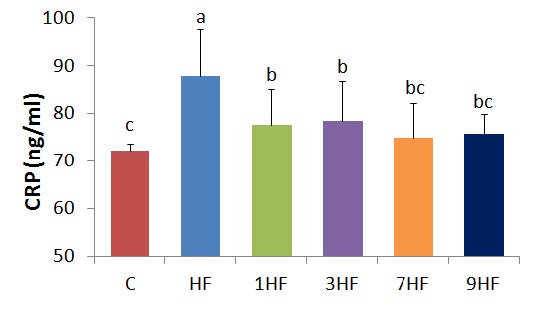
Effect of Sunsik by steming-drying cycles on CRP level in high fed diet for 8 weeks.C : normal diet, HF : high fat diet, 1HF : high fat diet+10% 1 times steaming Sunsik, 3HF : high fat diet + 10% 3 times steaming Sunsik, 7HF : high fat diet + 10% 7 times steaming Sunsik, 9HF : high fat diet + 10% 9 times steaming Sunsik. Values are means±S.D., N=8.Means with the same lettered superscripts on bars are not significantly different by Duncan's multiple range test(p<0.05).
4. 렙틴 농도
렙틴 농도는 Fig. 2에서와 같이 C군의 1.99±0.02 ng/mL에 비해서 HF군은 2.56±0.05 ng/mL로 p<0.05 수준에서 유의적으로 높았다. 그러나 1HF 군은 1.78±0.04, 3HF 군은 1.81±0.05, 7HF 군은 1.86±0.06, 그리고 9HF 군은 1.88 ±0.03 ng/mL로 고지방식이에 의해 증가된 렙틴의 농도는 4종류의 선식 공급으로 p<0.05 수준에서 유의적으로 C 군의 수준으로 낮출 수 있었다. 렙틴 농도의 감소는 체지방 함량의 감소와 관련이 있으며, 체지방량이 감소함에 따라 렙틴의 농도는 유의적으로 감소되는 것으로 나타났다(Rahmouni & Haynes 2001). 렙틴은 지방세포에서 주로 분비되는 단백질로서 중추신경계에 작용하여 식욕은 억제시키고, 에너지 소비는 촉진시켜서 에너지 항상성을 유지시키는 호르몬이다. 비만인은 혈중 렙틴의 농도가 정상인에 비해 높으며, in vitro 실험에서도 지방세포의 체지방 축적량에 비례하여 렙틴의 분비가 증가하는 것으로 알려져 있다.
렙틴의 수준은 혈당과 인슐린 등의 영향도 받는데, Havel et al(1998)의 보고에서 STZ를 투여한 생쥐의 렙틴 농도는 단기간(24∼48 hr)부터 감소하기 시작하여 인슐린 농도 결핍이 일어나는 2주 동안 감소하였다. 이러한 렙틴 농도의 감소는 당뇨 초기에는 인슐린 결핍에 의한 영향이며, 당뇨 중ㆍ후반기에는 인슐린의 결핍으로 포도당이 지방조직으로 이동이 감소됨에 따라서 유발된 체중과 지방조직의 감소에 의한 영향이라고 설명하였다. 또한 렙틴 농도가 증가할 경우 여러 합병증이 유발하게 되는데, Buettner et al(2006)은 지방 조직 내 지방 저장량의 증가로 인하여 혈청 렙틴이 증가할 경우, 렙틴 수용체의 변이로 인슐린 저항성이 나타났다고 하였으며, Wallace et al(2001)은 렙틴의 증가는 관상동맥 질환의 독립적 위험인자라고 보고하였다. 그러나 본 연구에서는 고지방식이로 증가된 렙틴의 농도는 선식의 공급으로 정상수준 또는 그 이하로 낮출 수 있었으며, 선식의 증포 횟수에 따른 유의적인 효과 차이는 없었다.
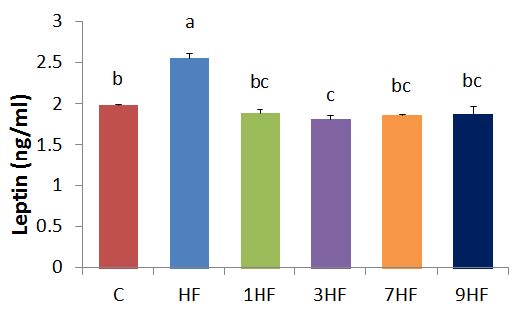
Effect of Sunsik by steming-drying cycles on leptin level in high fed diet for 8 weeks.C : normal diet, HF : high fat diet, 1HF : high fat diet+10% 1 times steaming Sunsik, 3HF : high fat diet + 10% 3 times steaming Sunsik, 7HF : high fat diet + 10% 7 times steaming Sunsik, 9HF : high fat diet + 10% 9 times steaming Sunsik. Values are means±S.D., N=8.Means with the same lettered superscripts on bars are not significantly different by Duncan's multiple range test(p<0.05).
5. 아디포넥틴 농도
아디포넥틴의 농도는 Fig. 3에서와 같이 C 군의 1.10±0.03 ng/mL에 비해서 HF 군은 1.82±0.19 ng/mL로 p<0.05 수준에서 유의적으로 높은 함량을 보였다. 그러나 고지방식이에 의해 증가된 아디포넥틴 농도는 1HF 군은 1.09±0.83 ng/mL, 3HF 군은 1.01±0.04 ng/mL, 7HF 군은 1.07±0.05 ng/mL 그리고 9HF 군은 1.15 ±0.03 ng/mL로 C 군과 유의적으로 비슷한 농도를 보였고, 선식의 증포 횟수에 따른 유의적인 차이는 없었다. 지방세포의 분화과정에서 발현되어 분비되는 물질 중 아디포넥틴은 비만인의 경우 그 농도가 높은 수치를 보였고, 근육과 간 조직의 인슐린 감수성 증가와 지방의 산화와도 관련되어 있다고 보고되었다(Lee et al 2005; Yamauchi et al 2001; Berg et al 2001). 또한 아디포넥틴은 항당뇨, 항염증 그리고 항동맥경화력을 가진 것으로 알려졌으며, 주로 제2형 당뇨병 및 관상동맥 질환이 유발되었을때 혈중 농도는 감소되는 경향을 보였다(Barton et al 2003; Kumada et al 2003). 이외에 체지방량이 증가하여 아디포넥틴 농도가 낮아지면 염증이나 대사성 질환으로 비만, 고지혈증 및 심혈관계 질환이 높아지는 것으로 보고되었다(Maury & Brichard 2010).
식이패턴과 혈중 아디포넥틴 농도와 관련된 연구에서 식이지방량과 아디포넥틴 농도와의 일관성이 있는 연구결과는 아직까지 보고되지 않고 있으며(Lee et al 2012a), 고지방식이로 유도된 비만 생쥐의 지방조직 내에서는 아디포넥틴 유전자 발현되지 않았다는 보고도 있다(Desmarchelier et al 2013). 그 반면에, 아디포넥틴은 포화지방산과 트랜스지방산과는 음의 상관관계를, 불포화지방산과는 양의 상관관계를 그리고 채소섭취량과도 양의 상관관계가 있는 것으로 조사되었다(Lee et al 2012a). 그러나 본 연구에서는 고지방식이에 의해 높아진 아디포넥틴의 농도는 선식의 공급으로 정상식이와 비슷한 농도로 조절되었으나, 선식의 증포 횟수에 따른 유의적인 차이는 없었다.
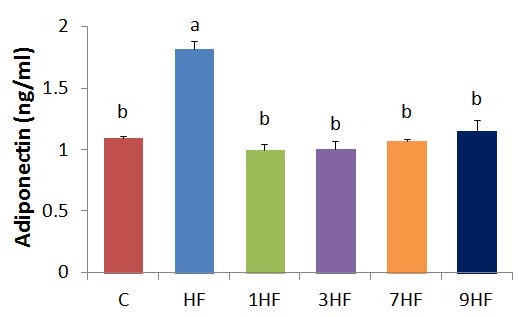
Effect of Sunsik by steming-drying cycles on adiponectin level in high fed diet for 8 weeks.C : normal diet, HF : high fat diet, 1HF : high fat diet+10% 1 times steaming Sunsik, 3HF : high fat diet + 10% 3 times steaming Sunsik, 7HF : high fat diet + 10% 7 times steaming Sunsik, 9HF : high fat diet + 10% 9 times steaming Sunsik. Values are means±S.D., N=8.Means with the same lettered superscripts on bars are not significantly different by Duncan's multiple range test(p<0.05).
요약 및 결론
본 연구에서는 고지방식이로 유도된 비만 쥐에게 찌고 말리는 증포 횟수를 달리하여 만든 선식(1증1포, 3증3포, 7증7포, 9증9포)의 섭취가 혈당 및 염증 관련 인자에 미치는 효과를 알아보고자 실시하였다. 실험 동물로 SD계 숫쥐를 6개의 실험군(C, HF, 1HF, 3HF, 7HF, 9HF)으로 나눈 다음 실험식이를 8주간 섭취시켰다. 그 결과, 정상식이 섭취군인 C 군에 비해 고지방식이 섭취군인 HF 군은 12.9%의 체중증가량을 보였다. 그러나 고지방식이와 함께 4종류의 선식을 각각 식이 내 10%(w/w) 수준으로 첨가한 실험식이를 섭취시킨 실험군의 체중증가량은 감소하였으나, 정상수준에는 미치지 못하였다. 식이효율 역시 고지방식이 섭취로 증가되었으나, 9증9포 선식을 공급시킨 9 HF 군에서 p<0.05 수준에서 가장 낮은 사료효율을 보였다.
혈당과 관련된 인자 중 혈당 농도는 C 군에 비해서 HF 군은 p<0.05 수준에서 유의적으로 높았으나, 4종류의 선식 공급으로 고지방식이에 의해 증가된 혈당은 정상수준으로 낮추었다. 인슐린 농도는 C 군의 1.31±0.10 ng/mL에 비해서 HF, 1HF, 3HF, 7HF, 그리고 9HF 군이 각각 1.78±0.03, 1.62±0.04, 1.61±0.02, 1.57±0.02, 그리고 1.49±0.02 ng/mL로 p<0.05 수준에서 유의적으로 높은 농도를 보였으며, 선식의 증포 횟수에 따른 효과의 차이는 없었다. C 군에 비해서 HF 군에서 높아진 인슐린 저항성(HOMA-IR)은 4종류의 선식 공급으로 C 군 수준으로 낮출 수 있었다. 인슐린 분비능(HOMA-B)은 C 군의 0.26±0.02에 비해서 HF 군은 0.35±0.03, 1HF 군은 0.35± 0.02, 3HF 군은 0.36±0.02, 7HF 군은 0.35±0.02, 그리고 9HF 군은 0.32±0.01로 p<0.05 수준에서 정상식이 섭취군보다 고지방식이 섭취군 모두 유의적으로 낮은 인슐린 분비능을 보였다. 그러나 고지방식이에 의해 변화된 혈당과 관련 인자에 대한 선식의 증포 횟수에 따른 유의적인 효과 차이는 관찰되지 않았다.
염증 유발 관련 성분 중 C-반응성 단백질 농도는 C 군의 72.2 ±1.55 ng/mL에 비해서 HF 군은 87.8±9.82 ng/mL로 p<0.05 수준에서 고지방식이에 의해 유의적으로 증가되었다. 그러나 4종류의 선식공급으로 p<0.05 수준에서 유의적으로 낮출수 있었다. 렙틴의 농도는 C 군에 비해서 HF 군이 p<0.05 수준에서 유의적으로 높았으나, 4종류의 선식 공급으로 p<0.05 수준에서 유의적으로 정상수준까지 낮출 수 있었다. 아디포넥틴 농도 역시 C 군의 1.10±0.03 ng/mL에 비해서 HF 군은 1.82 ±0.19 ng/mL로 p<0.05 수준에서 유의적으로 높은 농도를 보였으며, 4종류의 선식을 공급시켰을 때 정상식이군과 유의적으로 같은 농도를 보였다. 그러나 고지방식이 섭취에 의해 변화된 혈당과 관련 인자에 대한 선식의 증포 횟수에 따른 유의적인 효과 차이는 관찰되지 않았다.
이상의 결과에서 고지방식이 섭취로 유발된 체중, 사료효율 및 인슐린 저항성의 증가는 4종류의 선식을 각각 10% 수준으로 혼합시켜 섭취했을 때 유의적으로 낮출 수 있었다. 또한 고지방식이에 의하여 유도된 염증반응 물질인 CRP와 렙틴의 농도도 선식의 공급으로 다소 조절되었으나, 혈당 및 염증 관련 조절 인자에 대하여 선식의 증포 횟수에 따른 효과 차이는 없는 것으로 나타났다. 그러나 선식의 섭취로 인해 혈당조절이 개선되어 대사성 질환의 예방과 치료에 도움이 될 것으로 사료된다.
REFERENCES
- Baek, HS., Kim, YD., Park, YS., Shin, JH., Oh, JW., Lee, HB., (2010), Asthma development partially linked to adiponectin and leptin in overweight children, Pediatr Allergy Respir Dis, 20, p48-58.
-
Barton, M., Carmona, R., Ortmann, J., Krieger, JE., Traupe, T., (2003), Obesity- associated activation of angiotensin and endothelin in the cardiovascular system, Internal J Biochem Cell Bio, 35, p826-837.
[https://doi.org/10.1016/S1357-2725(02)00307-2]

-
Berg, AH., Combs, TP., Du, X., Brownlee, M., Scherer, PE., (2001), The adipocyte-secreted protein Acrp30 enhances hepatic insulin action, Nature Med, 7, p947-953.
[https://doi.org/10.1038/90992]

-
Buettner, C., Pocai, A., Muse, ED., Etgen, AM., Myers, MG. Jr, Rossetti, L., (2006), Critical role of STAT3 in leptin’s metabolic actions, Cell Metabol, 4, p49-60.
[https://doi.org/10.1016/j.cmet.2006.04.014]

- Cho, HI., Kim, CK., Paik, BR., Lim, KB., Yoo, WS., (1978), Clinical study on plasma free fatty acid and glucose tolerance in occlusive cerebrovascular disease, Oriantal J Internal Med, 21, p695-699.
- Choi, JH., Hwang, SJ., Jeong, SN., Lee, YK., Jin, MH., Park, SG., Lee, CK., (2009), Anti-aging effect of skin with 9 repetitive steaming and fermenting process herbal composition extract, J Herbology, 24, p101-106.
-
Chung, JO., Cho, DH., Chung, DJ., Chung, MY., (2010), Determining the factors that influence the insulin requirements in type 2 diabetic patients, Endocrinol Metab, 25, p110-118.
[https://doi.org/10.3803/EnM.2010.25.2.110]

-
Desmarchelier, C., Ludwig, T., Scheundel, R., Rink, N., Bader, BL., Klingenspor, M., Daniel, H., (2013), Diet-induced obesity in ad libitum-fed mice: Food texture overrides the effect of macronutrient composition, British J Nutr, 109, p1518-1527.
[https://doi.org/10.1017/S0007114512003340]

-
Franks, PW., Brage, S., Luan, J., Ekelund, U., Rahman, M., Farooqi, IS., Halsall, I., Rahilly, S., Wareham, NJ., (2005), Leptin predicts a worsening of the feature of the metabolic syndrome independently of obesity, Obes Res, 13, p1476-84.
[https://doi.org/10.1038/oby.2005.178]

-
Ferranini, E., Barrett, EJ., Bevilacqus, S., DeFronzo, RA., (1983), Effect of fatty acids on glucose metabolism and utilization in man, J Clin Invest, 72, p1737-47.
[https://doi.org/10.1172/JCI111133]

- Feskens, EJM., Bowles, CH., Kromhout, D., (1991), Carbohydrate intake and body mass index in relation to the risk of glucose intolerance in an elderly populstion, AM J Clin Nutr, 54, p136-140.
- Han, SR., Park, SH., Kwon, OJ., Ahm, YM., Lee, BC., Ahn, SY., (2012), Effects in metabolism and adipocyte inflammation induced by the complex herbal medicine composed of Cornus officinalis, Discorea rhizoma, Aurantii frutus, Mori folium in Obese Type 2 Diabetes mouse model, J Kor Oriental Med, 33, p184-199.
-
Havel, PJ., (2002), Control of energy homeostasis and insulin action by adipocyte hormones: Leptin, acylation stimulating protein and adiponectin, Curr Opin Lipidol, 13, p51-59.
[https://doi.org/10.1097/00041433-200202000-00008]

- Havel, PJ., Uriu-Hare, JY., Liu, T., Stanhope, KL., Stern, JS., Keen, CL., Ahrén, B., (1998), Marked and rapid decreases of circulating leptin in streptozotocin diabetic rats: reversal by insulin, Ame J Physiolo Reg Integrative and Comparative Physiology, 274, p1482-1491.
-
Huang, KC., Lin, RCY., Kormas, N., Lee, LT., Chen, CY., Gill, TP., Caterson, ID., (2004), Plasma leptin is associated with insulin resistance independent of age, body mass index, fat mass, lipid and pubertal development in nondiabetic adolescents, Int J Obes, 28, p470-475.
[https://doi.org/10.1038/sj.ijo.0802531]

- Hyun, MR., Park, HJ., Seo, GY., Park, YH., (2008), Effects of cereals sunsik on blood glucose level in university woman, Soonchunhyang J Nat Sci, 14, p29-36.
-
Jang, YS., Jeong, JM., (2010), Effects of phyto-extract mixture on adiposity and serum lipid levels in obese mice induced by high fat diet, J Korean Soc Food Sci Nutr, 39, p1439-1445.
[https://doi.org/10.3746/jkfn.2010.39.10.1439]

-
Kengne, AP., Batty, GD., Hamer, M., Stamatakis, E., Czernichow, S., (2012), Association of C-reactive protein with cardiovascular disease mortality according to diabetes status: pooled analyses of 25,979 participants from four U.K. prospective cohort studies, Diabetes Care, 35, p396-403.
[https://doi.org/10.2337/dc11-1588]

-
Kershaw, EE., Flier, JS., (2004), Adipose tissue as an endocrine organ, J Clin Endocrinology & Metabolism, 89, p2548-2556.
[https://doi.org/10.1210/jc.2004-0395]

- Kim, SH., Kim, JY., Ryu, KA., Sohn, CM., (2007), Evaluation of the dietary diversity and nutrient intakes in obese adults, Kor J Community Nutrition, 12, p583-591.
- Kim, HC., (2003), Dietetics of Chinese Medicine, Kyunghee University Press, Korea, p142-144.
-
Kim, HJ., Lee, JY., You, BR., Kim, HR., Choi, JE., Nam, KY., moon, BD., Kim, MR., (2011), Antioxidant activities of ethanol extracts from black ginseng prepared by steaming-drying cycles, J Korean Soc Food Sci Nutr, 40, p156-162.
[https://doi.org/10.3746/jkfn.2011.40.2.156]

- Kopelman, PG., (2000), Obesity as medical problem, Nature, 404, p635-643.
-
Kumada, M., Kihara, S., Sumitsuji, S., Kawamoto, T., Matsumoto, S., Ouchi, N., Arita, Y., Okamoto, Y., Shimomura, I., Hiraoka, H., Nakamura, T., Funahashi, T., Funahashi, T., Matsuzawa, Y., (2003), Association of ypoadiponectinemia with coronary artery disease in men, Arteriosclerosis, Thrombosis, and Vascular Bio, 23, p85-89.
[https://doi.org/10.1161/01.ATV.0000048856.22331.50]

-
Lee, DH., Kwak, DH., Kim, SM., Ju, EJ., Choi, HG., Kim, OH., Hwang, JB., Bae, NG., Jung, KY., Han, JC., Park, HD., Choo, KY., (2004), Effect of small black soybean powder on blood glucose and insulin senstivity in streptozotocin-induced diabetic rats, J Korean Soc Food Sci Nutr, 33, p1618-1625.
[https://doi.org/10.3746/jkfn.2004.33.10.1618]

- Lee, JS., Shin, HK., (1998), Correlation between glycemic index and in vitro starch hydrolysis of cerelas, Kor J Food Sci Technol, 30, p1229-1235.
- Lee, JY., Kim, NY., Oh, HL., Lee, KJ., Yang, KH., Doh, ES., Kim, MR., (2011), Antioxidant activity of Rehmanniae radix preparata prepared from dried root through steaming-drying cycles, J East Asian Soc Dietary, 21, p838-843.
-
Lee, SH., Park, MY., Kim, SK., Min, YK., (2012a), Comparison of the lipid levels, C-reactive protein and adiponectin in adolescent male by fat intake, Kor J Nutr, 45, p303-314.
[https://doi.org/10.4163/kjn.2012.45.4.303]

-
Lee, SW., Jo, HH., Kim, MR., You, YO., Kim, JH., (2012b), Association between obesity, metabolic risks and serum osteocalcin level in postmenopausal women, Gynecol Endocrinol, 28, p472-477.
[https://doi.org/10.3109/09513590.2011.633660]

- Lee, YH., Oh, SH., (2004), Effect of resistant starch on human glycemic response, Korean J Community Nutr, 9, p528-535.
-
Lee, YY., Lee, NS., Cho, YM., Moon, MK., Jung, HS., Park, YJ., Park, HJ., Youn, BS., Lee, HK., Park, KS., Shin, HD., (2005), Genetic association study of adiponectin polymorphisms with risk of type 2 diabetes mellitus in Korea population, Diabetes, 22, p569-575.
[https://doi.org/10.1111/j.1464-5491.2005.01460.x]

- Ma, JY., Ha, CS., Sung, HJ., Zee, OP., (2000), Hemopoietic effects of Rhizoma rehmanniae preparata on cyclophosphamideinduced pernicious anemia in rats, Kor J Pharma, 31, p325-334.
-
Matthews, DR., Hosker, JP., Rudenski, AS., Naylor, BA., Treacher, DF., Turner, RC., (1985), Homeostasis model assessment: Insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man, Diabetologia, 28, p412-419.
[https://doi.org/10.1007/BF00280883]

-
Maury, E., Brichard, SM., (2010), Adipokine dysregulation, adipose tissue inflammation and metabolic syndrome, Molecular & Cellular Eendocrinol, 314, p1-16.
[https://doi.org/10.1016/j.mce.2009.07.031]

- Ministry of Health & Welfare, (2011), 2010 National Health and Nutrition Survey.
-
Miyazaki, Y., Glass, L., Triplitt, C., Wajcberg, E., Mandarino, LJ., DeFronzo, RA., (2002), Abdominal fat distribution and peripheral and hepatic insulin resistance in type 2 diabetes mellitus, Am J Physiol Endocrinol Metab, 283, p1135-1143.
[https://doi.org/10.1152/ajpendo.0327.2001]

- Montenegro-Neto, AN., da Silva-Simõs, MO., de Medeiros, AC., Portela Ada, S., Ramos de Queiroz Mdo, S., Cunha-Montenegro, R., Irany-Knackfuss, M., (2011), The correlation between anthropometric measurements and biochemical cardiovascular risk markers in the hypertensive elderly, Rev Salud Publica (Bogota), 13, p421-432.
- Moon, JH., Sung, JH., Choi, IW., Kim, YS., (2010), Anti-obesity and hypolipidemic activity of taro powder in mice fed with high fat and cholesterol diets, Kor J Food Sci Technol, 42, p620-626.
- Moon, SJ., (1996), Nutritional problems in Korean, Korean J Nutr, 29, p371-380.
-
Mykkanen, L., Zaccaro, DJ., Hales, CN., Festa, A., Haffner, SM., (1999), The relation of proinsulin and insulin to insulin sensitivity and acute insulin response in subjects with newly diagnosed typ II diabets the insulin resistance atheroscelerosis study, Diabetologia, 42, p1060-1066.
[https://doi.org/10.1007/s001250051271]

-
Niba, LL., Hoffman, J., (2003), Resistant starch and β-glucan levels in grain sorghum(Sorghum bicolor M.) are influenced by soaking and autoclaving, Food Chem, 81, p113-118.
[https://doi.org/10.1016/S0308-8146(02)00386-2]

- Nishimune, T., Yakushiji, T., Suminoto, T., Taguchi, S., Konishi, Y., Nakahara, S., Ichikawa, T., Kunita, N., (1991), Glycemic response and fiber content of some foods, Am J Clin Nutr, 54, p414-419.
- Ozuğz, U., Ergü, G., Iş ık, S., Göay, F., Tüücü, Y., Akbaba, G., Berker, D., Güer, S., (2012), Association between C-reactive protein, carotid intima-media thickness and P-wave dispersion in obese premenopausal women: An observational study, Anadolu Kardiyol Derg, 12, p40-46.
-
Porte, D., Kahn, SE., (1989), Hyperproinsulinemia and amyloid in NIDDM: Clues to etiology of islet β-cell dysfunction?, Diabetes, 38, p1333-1336.
[https://doi.org/10.2337/diab.38.11.1333]

-
Rahmouni, K., Haynes, WG., (2001), Leptin signaling pathways in the central nervous system: Interactions between neuropeptide Y and melanocortins, Bioessays, 23, p1095-1099.
[https://doi.org/10.1002/bies.10018]

-
Takahashi, M., Konno, C., Hikino, H., (1986), Isolation and hypoglycemic activity of coixans A, B and C. Glycans of Coix lachryma-jobi var. ma-yuen seeds, Planta Med, 52, p65-65.
[https://doi.org/10.1055/s-2007-969074]

-
Wallace, AM., McMahon, AD., Packard, CJ., Kelly, A., Shepherd, J., Gaw, A., Sattar, N., (2001), Plasma leptin and the risk of cardiovascular disease in the West of Scotland Coronary Prevention Study (WOSCOPS), Circulation, 104, p3052-3056.
[https://doi.org/10.1161/hc5001.101061]

-
Xu, Z., Hua, N., Godber, JS., (2001), Antioxidant activity of tocopherols, tocotrienols, and γ-oryzanol components from rive bran against cholesterol oxidation accelerated by 2,2’-azobis (2-methylpropion amidine), J Agric Food Chem, 49, p2077-2081.
[https://doi.org/10.1021/jf0012852]

-
Yamauchi, T., Kamon, J., Waki, H., Terauchi, Y., Kubota, N., Hara, K., Mori, Y., Ide, R., Murakami, K., Tsuboyama-Kasaoka, N., Ezaki, O., Akanuma, Y., Gavrilova, O., Vinson, C., Reitman, ML., Kagechika, H., Shudo, K., Yoda, M., Nakano, Y., Tobe, K., Nagai, R., Kimura, S., Tomita, M., Froguel, P., Kadowaki, T., (2001), The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity, Nature Med, 7, p941-946.
[https://doi.org/10.1038/90984]
