추출 시간이 계내금(Galli stomachichum corium)의 항산화 및 단백질 효소 활성에 미치는 영향
 ; Ju-Hyeon Park1
; Ju-Hyeon Park1 ; Woo-Deung Sim2
; Woo-Deung Sim2 ; Seung-Myeong Seo2 ; Mi-Sook Kim3 ; Tae-Eon Kim4 ; Gyo-Nam Kim5 ; Ji-Hwan Hwang5, †
; Seung-Myeong Seo2 ; Mi-Sook Kim3 ; Tae-Eon Kim4 ; Gyo-Nam Kim5 ; Ji-Hwan Hwang5, †
Abstract
Kyenegum (Galli stomachichum corium), or dried gizzard, is rich in protein and has long been used as a digestive aid. While previous research has focused on the pharmacological properties of Kyenegum, studies on its natural antioxidant and food additive potential have been limited. Therefore, this study aimed to investigate the antioxidant activity, protease activity, and total protein content of Galli Stomachichum Corium water extracts (GW) prepared using distilled water as a solvent. Various assays, including the total phenolic assay, 2,2-diphenyl-1-picrylhydrazy (DPPH) radical scavenging activity, copper reduction assay, Folin-Ciocalteu assay, and the Bradford protein assay, were performed. Kyenegum was extracted over different time periods (0 hr, 6 hr, 12 hr, 18 hr, and 24 hr). As a positive control for antioxidant activities, vitamin C (ascorbic acid) was used. The total phenolic content of GW significantly increased from 0 hr to 24 hr (0.93, 5.70, 8.20, 10.01, and 11.35 μg GAE/mL, at the above-mentioned time periods, respectively). The DPPH radical scavenging activity of GW was highest at 6 hr (12.42%) compared to GW extracted at other times. The protease activity and total phenolic content showed a time-dependent increase. Overall, these findings suggest that Kyenegum could serve as a natural antioxidant and food additive ingredient.
Keywords:
Galli stomachichum corium, natural antioxidant, food additive, enzyme, protein서 론
효소의 산업적 이용은 치즈 제조 시 사용되는 송아지의 위 속의 응유효소인 레닛을 제조하는 데 시작되었으며, 전분당화 효소를 식품 제조에 사용하다가 최근에는 의약품 제조, 특수 용도의 식품, 의약품 및 화학용품 등을 제조하는 데 다양하게 활용되면서 그 사용 범위가 확대되고 있다(Bae BC 1978). 단백질 분해효소(protease)는 단백질의 펩타이드 결합을 가수분해하는 효소로 동물 및 식물을 비롯하여 세균 및 곰팡이 등 다양한 미생물에서도 생산되며 식품, 사료 및 의약품 등의 제조에 다양하게 이용되고 있다(Lee YK 등 2012). 단백질 분해효소 중에는 식물로부터 유래된 papain, bromelain 및 keratinase 등이 있고, 동물에서 유래된 trypsin, chymotrypsin, pepsin 및 rennin 등이 있다(Godfrey T & West S 1996).
닭고기의 소비 증가로 인해 닭의 모래주머니 등 각종 부산물의 발생량 또한 증가하고 있다(Kim DW 2007). 계내금(Galli stomachichum corium)은 꿩과 동물인 집닭의 모래주머니 내벽을 건조시킨 것으로 한방에서는 소화를 촉진시키는 것으로 보고되고 있으며 계내금에는 폴리페놀 성분인 탄닌이 다량 함유되어 있다(Bae BC 1978). 불규칙적인 타원형 형태로 2 mm의 두께이며 표면은 황록색과 황갈색을 띠며 주름을 가진다(Kang BS 등 1999). 계내금에는 ventriculin이 함유되어 있어 위액분비를 촉진시키고, 체내에 흡수되면 위벽의 신경근을 흥분시켜 위액의 분비량을 증가시켜 소화를 촉진시키는 것으로 잘 알려져 있다(Kim SG 1996; Kim DW 등 2007). 계내금을 활용한 연구는 2000년대 초에 계내금의 효소학적 특성을 확인한 연구와 단백질 분해효소의 특성을 보고한 연구가 있으며, 이후 계내금과 관련한 연구는 전무한 실정이다(Kim DW 2007; Park JH & Kim DW 2011). 일반적으로 닭을 포함하는 조류는 포유동물에 비해 치아가 약하기 떄문에 닭의 소화기관인 모래주머니 내에는 단백질 분해효소가 잔존할 것으로 사료된다(Park JH & Kim DW 2011). 단백질 가수분해물 제조를 위해서는 식품으로부터 단백질을 추출하여야 하며, 식품 가공 분야에서는 식품으로부터 단백질 추출을 위해 주로 물리적, 화학적 및 효소 추출법을 사용하고 있다(Jang HL & Yoon KY 2015).
항산화는 각종 요인에 의해 발생한 자유 라디칼에 의해 산화적 스트레스를 완화시키는 작용을 말하며 자유 라디칼은 하나 또는 그 이상의 비공유전자쌍을 가지고 있는 원자, 분자 및 화합물을 말한다. 산소 분자에 비공유전자쌍을 가진 것을 활성산소종이라고 하며 생체 내 대표적 자유 라디칼의 일종이다(Muller FL 등 2007). 활성산소종과 그 유도체는 생체 내에서 단백질 및 DNA 등을 손상시켜 세포의 노화와 변형을 초래하며 여러 가지 질병을 유발하게 된다(Kang KA 등 2006). 이러한 활성산소종을 제거함으로써 생체 내 산화적 스트레스로 인하여 생성되는 산화물질들을 억제 또는 중화시켜 활성산소종으로부터의 세포손상을 방어하는 역할을 한다(Choi JI 등 2009).
이에 본 연구에서는 닭에서 폐기되는 여러 부산물 중 닭의 모래주머니인 계내금을 활용하여 추출 시간을 달리한 계내금 추출물을 제조하고 이의 항산화 활성을 확인하였다. 항산화 활성은 대표적인 DPPH 라디칼 소거 활성을 비롯해 총 폴리페놀 함량을 분석하고 환원력을 평가하였다. 더 나아가 계내금 추출물의 이화학적 활성을 확인하기 위해 단백질 분해효소 활성과 단백질 함량을 측정하였다. 따라서 본 연구를 통해서 소화 촉진을 위해 섭취하거나 폐기되는 계내금의 항산화 활성을 확인하고 식품 첨가물의 가능성 및 감칠맛 증진을 위한 천연 조미료로서 가능성을 확인하고자 하였다.
재료 및 방법
1. 실험 재료
본 실험에서 사용된 계내금은 농업회사법인 현대 CNF㈜(Jinju, Korea)에서 구매하였다. Skim milk powder는 MBcell(Seoul, Korea)에서 구입하였고, bovine serum albumin(BSA)와 protein assay dye reagent concentrate는 Bio-Rad(Hercules, CA, USA)에서 구매하였다. Potassium phosphate monobasic, potassium phosphate dibasic anhydrous 및 94.5% 에탄올은 Daejung(Seoul, Korea)에서 구입하였고, dimethyl sulfoxide(DMSO)는 Junsei Chemical Co., Ltd.(Tokyo, Japan)에서 구매하였다. Folin-Ciocalteu’s reagent, sodium carbonate, trichloroacetate, gallic acid, 2,2-diphenyl-1-picrylhydrazy(DPPH), ascorbic acid, copper(Ⅱ) chloride, neocuproine 및 L-tyrosine은 Sigma-Aldrich(St. Louis, MO, USA)에서 구매하였다.
2. 계내금 추출물 제조
본 실험에서는 생계내금을 60℃에서 4 hr 동안 농산물 건조기(Shinil, Daegu, Korea)에서 건조시킨 후 20배수의 증류수를 용매로 하여 50℃에서 6 hr, 12 hr, 18 hr 및 24 hr 동안 추출하여 계내금 추출물(Galli stomachichum corium water extracts, GW)을 제조하였다. 이후 각 계내금 추출물을 0.2 mm 필터지(ADVANTEC, Seoul, Korea)를 이용해 필터링을 하였다. GW의 추출 시간에 따른 추출물은 GW0, GW6, GW12, GW18 및 GW24로 명명하였다. 추출 시간에 따른 계내금 추출물은 온도로 인한 변성을 방지하기 위해 0℃에서 보관하였으며 항산화 활성, 단백질 분해효소 활성 및 단백질 함량을 평가하였다.
3. 총 폴리페놀 함량
총 폴리페놀의 함량의 분석법으로는 널리 사용되고 있는 Folins-Denis 방법으로 측정하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 총 폴리페놀 함량은 Folin-Ciocalteu’s reagent을 이용하여 측정하였다. 50%(v/v) Folin-Ciocalteu’s reagent는 Folin-Ciocalteu’s reagent와 증류수를 같은 비율로 하여 제조해 본 실험에 사용하였다. 미리 준비해 둔 시약과 200 μL의 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24를 빛이 들어오지 않는 환경에서 1 hr 동안 반응시켰다. 반응이 끝난 뒤 96-well plate에 200 μL 씩 분주하여 microplate reader(Molecular Devices, Sunnyvale CA, USA)를 사용하여 725 nm에서 흡광도를 측정하였다. 본 실험에 사용한 추출물과 동일한 방법으로 gallic acid를 표준물질로 사용하여 증류수에 녹여 표준곡선을 작성한 후 총 폴리페놀 함량을 구하였다. 표준농도곡선은 y=0.0418x—0.0583이고 R2값은 0.9989이며, 표준농도곡성에 대입하여 gallic acid equivalent(GAE)로 환산하여 μg GAE/mL로 나타내었다.
4. DPPH 라디칼 소거 활성
추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 항산화 활성을 확인하기 위해 DPPH 라디칼 소거 활성을 분석하였으며 94.5% 에탄올에 DPPH 시약을 용해하여 사용했다. 190 μL의 0.2 mM DPPH 시약과 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24를 200 μL가 되도록 96-well plate에 각각 10 μL 분주 후 37℃에서 30 min 동안 반응시켰다. 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 다음과 같은 식으로 계산하였으며, 양성대조군으로는 비타민 C(ascorbic acid)를 이용했으며 증류수로 희석하여 계내금 추출물과 같은 농도로 제조하여 이후 과정은 동일하게 평가하였다.
5. 환원력
추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 환원력을 통해 항산화 활성을 확인하기 위해 copper reduction을 평가하였다. CuCl2를 이용해 Cu+2에서 Cu+1로 환원되는 정도를 파악하여 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 환원력을 평가하였다. 20 μL의 1 mM CuCl2, 80 μL의 0.625 mM neocuproine, 60 μL의 10 mM potassium phosphate buffer 및 40 μL의 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24를 96-well plate에 각각 분주하여 빛이 들어오지 않는 환경에서 실온에서 1 hr 동안 반응시켰다. 반응시킨 후 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 454 nm에서 흡광도를 측정하였다. 본 실험의 양성대조군으로는 항산화 물질로 잘 알려진 비타민 C(ascorbic acid)를 증류수에 녹여 사용하였으며, 결과 값은 Cu+1/neocuproine의 extinction coefficient(7.95 × 103M-1cm-1)를 이용하여 흡광도로부터 계산된 Cu+1의 농도로 표시하였다.
6. 단백질 분해효소 활성
추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 단백질 분해효소 활성을 측정하기 위해 folin assay를 실시하였다. 실험에 필요한 2% skim milk는 증류수와 희석하여 미리 제조하였다. 200 μL의 2% skim milk에 200 μL의 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24를 분주하여 60℃에서 1 hr 동안 반응시켰다. 반응이 끝난 후 단백질을 침전시키기 위해 400 μL의 0.4 M trichloroacetate를 첨가하고 12,000 rpm으로 5 min 동안 원심분리를 하였다. 200 μL의 원심분리된 추출물에 1 mL의 0.4 M sodium carbonate와 200 μL의 50%(v/v) Folin-Ciocalteu’s reagent를 첨가하고 50℃의 빛이 들어오지 않는 환경에서 30 min 동안 반응시켰다. 반응이 끝난 후에 96-well plate에 200 μL 씩 분주하여 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 725 nm에서 흡광도를 측정하였다. 본 실험에 사용한 추출물과 동일한 방법으로 L-tyrosine을 표준물질로 사용하여 증류수에 녹여 표준곡선을 작성하였으며 단백질 분해효소 활성은 식품의약품안전처의 식품공전 표기법에 따라 다음과 같이 계산하였다. 표준곡선의 방정식은 y=0.1554x—0.1117이고 R2값은 0.999이었다.
7. 총 단백질 함량
추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24에 함유된 총 단백질 함량을 측정하기 위해 bradford assay를 실시하였다. Protein assay dye regent concentrate 시약은 4배수의 증류수와 희석하여 사용하였으며 495 μL의 protein assay dye regent concentrate에 5 μL의 GW0, GW6, GW12, GW18 및 GW24를 각각 분주하여 실온에서 5 min 동안 반응시켰다. 반응이 끝난 후 96-well plate에 200 μL씩 분주하여 microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 사용하여 595 nm에서 흡광도를 측정하였다. 본 실험에 사용한 추출물과 동일한 방법으로 BSA를 표준물질로 사용하여 증류수에 녹여 표준곡선을 작성한 후 총 단백질 함량을 구하였고, 표준곡선의 방정식은 y=0.0003x+0.0005이고 R2값은 0.999이었다.
8. 통계분석
모든 실험 데이터는 3회 반복을 통해 이루어졌으며, 평균±표준편차로 표현하였다. 통계처리는 Statistical Package for Social Science(Ver. 18, SPSS Inc., Chicago, IL, USA)를 이용하여 분석하였으며, 각 구간에 대한 유의성 차이는 Duncan’s test 방법에 따라 각 구간의 유의성 차이(p<0.05)를 검증하였다.
결과 및 고찰
1. 총 폴리페놀 함량
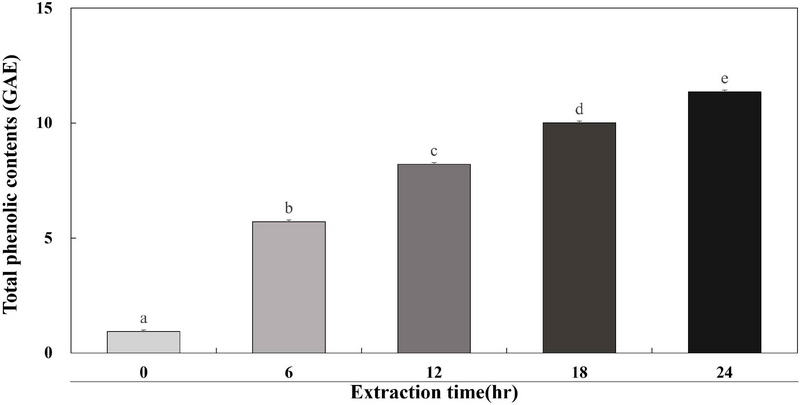
폴리페놀의 함량은 색, 향, 맛 및 건강에 유익한 영양을 주는 영양성분들의 양과 질에 기여하며(Jeong CH 등 2009), 폴리페놀 화합물은 식물계에 존재하는 2차 대사산물로 항산화 효과가 있어 생체 내의 노화 방지와 질병 예방 등에 도움을 주는 것으로 보고되었다(Jung HJ 등 2004). 계내금의 총 폴리페놀 함량을 조사하기 위해 total phenolic assay를 실행하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24 결과는 Fig. 1에 나타내었다. GW0, GW6, GW12, GW18 및 GW24의 총 폴리페놀 함량은 0.93, 5.70, 8.20, 10.01 및 11.35 μg GAE/mL로 확인하였다. 추출하는 시간이 증가할수록 계내금 추출물 내의 총 폴리페놀 함량이 증가하는 것을 확인하였다. Kim SH 등(2023)은 섬쑥부쟁이의 활용도를 높이기 위해 각 농도의 효소를 처리한 결과 0.8%의 효소 농도와 1.6%의 효소 농도를 1 hr와 2 hr 동안 처리하였을 때 각 효소 처리군은 처리 시간이 길어짐에 따라 총 폴리페놀 함량이 증가하는 것을 확인하였다. Yoo BR(2015)은 산수유 나무의 열매, 꽃 및 잎을 증류수와 에탄올을 용매로하여 추출물을 제조하고 총 폴리페놀 함량을 확인한 결과 열매, 꽃 및 잎의 증류수 및 에탄올 추출물 모두 1 hr, 3 hr, 4 hr, 6 hr, 12 hr, 24 hr 및 48 hr 동안 추출하였을 때 총 폴리페놀 함량이 추출 시간 의존적으로 증가하는 것으로 확인하였다. An GH 등(2020)은 느타리버섯과 귀리의 혼합비율, 추출 온도 및 추출 시간에 따른 총 폴리페놀 함량을 확인하기 위해 1:1, 1:3 및 3:1의 비율로 70℃와 100℃에서 3 min과 10 min 동안 추출하였다. 70℃와 100℃ 각 온도에서 추출 시간이 길어짐에 따라 총 폴리페놀 함량이 증가하는 것으로 확인하였다. Lee SJ 등(2012)은 한의학에서 이용되는 천연 식물 소재인 와송 추출물과 그 혼합물의 총 폴리페놀 함량을 측정하였으며 와송 열수 추출물의 총 폴리페놀 함량은 9.21 mg/g, 와송 추출물과 사인 추출물을 혼합한 복합물의 총 폴리페놀 함량은 192.12 mg/g으로 확인하였다. 본 연구에서 추출 시간이 증가함에 따라 계내금 추출물의 총 폴리페놀 함량이 증가하는 것을 확인하였으며 앞선 연구를 비롯하여 추출 시간이 증가할수록 총 폴리페놀 함량이 증가하는 것으로 판단된다.
2. DPPH 라디칼 소거 활성
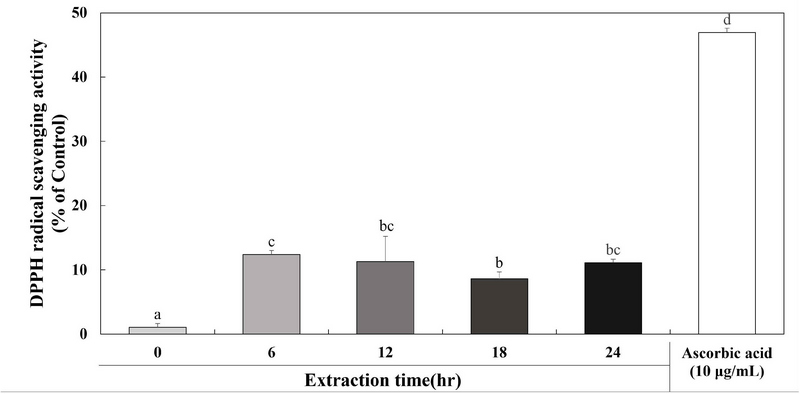
DPPH 라디칼 소거 활성 측정은 안정적인 자유 라디칼인 DPPH가 항산화 활성을 가지는 물질과 만나면서 전자를 잃으며 짙은 자색에서 황색으로 탈색되어 바뀌는 원리를 이용해 항산화 활성을 측정하는 방법이다(Blois MS 1958). 추출 시간에 따른 계내금 추출물의 항산화 활성을 확인하기 위해 DPPH 라디칼 소거 활성을 평가하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24 결과는 Fig. 2에 나타내었다. 양성대조군으로는 항산화 활성을 가진 물질로 잘 알려진 비타민 C(ascorbic acid)를 사용했으며 10 μg/mL의 농도와 비교하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 DPPH 라디칼 소거 활성은 1.07%, 12.42%, 11.31%, 8.63% 및 11.12%로 확인되었으며 6 hr 이상의 시간 동안 추출했을 때부터 최대의 DPPH 라디칼 소거 활성을 나타내는 것을 확인할 수 있다. Sung HM 등(2018)은 현초를 1 hr, 2 hr, 3 hr 및 4 hr 동안 열수 추출한 현초 추출물의 DPPH 라디칼 소거 활성을 평가한 결과 12.5 μg/mL의 농도에서 추출 시간이 증가함에 따라 DPPH 라디칼 소거 활성이 증가하는 것을 확인하였다. Kim SH 등(2023)은 효소 처리 농도 및 시간에 따른 추출물의 농도별 DPPH 라디칼 소거 활성 변화를 조사하였으며 효소 처리 농도 및 처리 시간에 따라 추출물 250, 500, 750 및 1,000 μg/mL의 농도에서 DPPH 라디칼 소거 활성은 효소 처리 농도 및 시간에 따라 농도 의존적으로 DPPH 라디칼 소거 활성이 높아지는 것을 확인하였다. Yoo BR(2015)은 산수유 나무의 열매, 꽃 및 잎을 증류수와 에탄올을 용매로 하여 추출물을 제조하고 DPPH 라디칼 소거 활성을 확인한 결과 열매, 꽃 및 잎의 증류수 및 에탄올 추출물 모두 1 hr, 3 hr, 4 hr, 6 hr, 12 hr, 24 hr 및 48 hr 동안 추출하였을 때 DPPH 라디칼 소거 활성이 시간 의존적으로 증가하는 것을 확인하였으며, 에탄올을 용매로 하여 12 hr와 24 hr 동안 추출한 추출물이 DPPH 라디칼 소거 활성이 가장 높은 것으로 나타났다. Oh ST(2017)는 닭고기를 이용해 패티를 제조하여 DPPH 라디칼 소거 활성을 측정한 결과 닭고기(1 mg/mL 처리)의 DPPH 라디칼 소거 활성은 32.07%로 확인되었다. 따라서 추출 시간에 따라 항산화 활성에 영향을 끼치는 것을 확인하였으며 추출 시간이 일정한 시간을 넘어가면 최대 활성을 보이고 일정하게 유지되는 것으로 판단된다.
3. 환원력
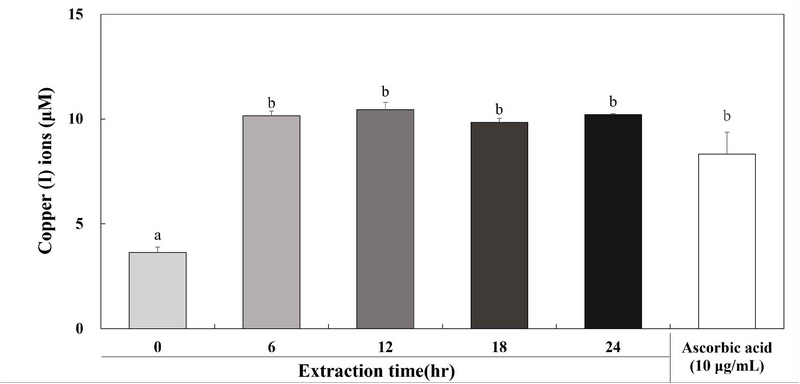
환원력을 통한 전자공여는 항산화 활성의 주요한 작용기전 중 하나라 알려져 있다(Huang D 등 2005). 항산화 반응은 수소 원자가 자유 라디칼 사슬을 분해함으로써 시작되며, 환원력과 함께 수반된다(Gordon MH 1990; Duh PD 1998). 추출 시간에 따른 계내금 추출물의 항산화 활성을 확인하기 위해 Cu2+ 이온에서 Cu1+ 이온으로 환원시키는 활성을 측정하는 방법인 copper reduction을 실행하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24 결과는 Fig. 3에 나타내었다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24의 구리 이온 환원력은 3.63, 10.15, 10.45, 9.84 및 10.21 μM로 확인되었으며 6 hr 이상의 시간부터 높은 구리 이온 환원력을 나타내는 것을 확인할 수 있다. 양성대조군으로는 항산화 활성을 가진 물질로 잘 알려진 비타민 C(ascorbic acid)를 사용했으며 10 μg/mL의 농도에서 8.32 μM을 나타내었다. Yoo BR(2015)은 산수유 나무의 열매, 꽃 및 잎을 증류수와 에탄올을 용매로 하여 추출물을 제조하고 환원력을 확인한 결과 열매, 꽃 및 잎의 증류수 및 에탄올 추출물 모두 1 hr, 3 hr, 4 hr, 6 hr, 12 hr, 24 hr 및 48 hr 동안 추출하였을 때 환원력이 시간 의존적으로 증가하는 것을 확인하였으며 다른 추출물에 비해 잎 물 추출물과 잎 에탄올 추출물의 환원력이 가장 강하게 나타났다. Kim JM 등(2015)은 느릅나무의 뿌리껍질인 유근피를 0%, 40% 및 80%의 농도의 에탄올을 용매로 하여 1 hr, 2 hr 및 3 hr 동안 추출한 추출물의 환원력을 확인한 결과 추출 시간이 증가함에 따라 증가하는 것을 확인하였다. Xu XM 등(2007)은 해송이 버섯 열수 추출물의 8월, 10월 및 11월의 시기와 0.5 hr, 1 hr, 2 hr, 3 hr 및 4 hr 동안의 추출 시간에 따른 환원력을 확인하였으며 모든 시기에서 환원력이 추출 시간 의존적으로 증가하였으며 11월에 채취한 해송이 버섯의 환원력이 가장 높은 것으로 나타내었다. Kim JG 등(2003) 한약재로 많이 사용되는 목통, 삼릉 및 치자의 항산화 활성을 알아보기 위하여 환원력을 측정한 결과 목통은 용량에 따라 유의적인 차이는 없었으며 삼릉은 열수 추출물의 환원력이 메탄올 추출물에 비하여 높은 것을 확인하였다. 치자의 경우에는 열수추출에 비해 70% 메탄올과 100% 메탄올로 추출하였을 때 항산화 활성이 높은 것을 확인하였다. 앞선 연구와 본 연구의 결과로 보아 추출 시간이 환원력에 영향을 주는 것으로 판단된다.
4. 단백질 분해효소 활성
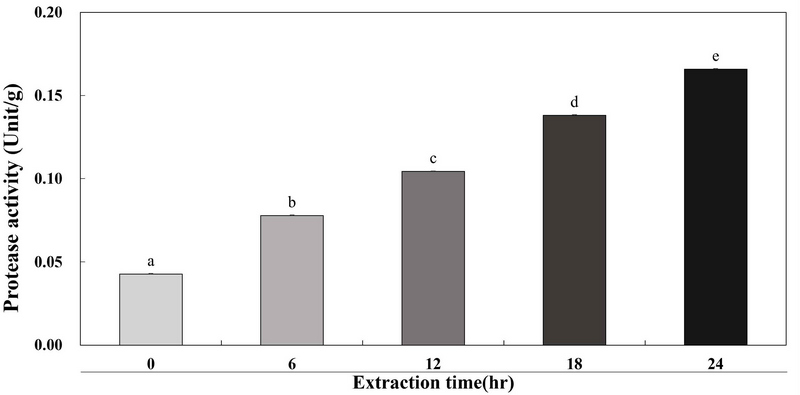
계내금 추출물의 단백질 분해효소 활성을 조사하기 위해 folin assay를 실행하였다. 시간에 따라 추출한 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24 결과는 Fig. 4에 나타내었다. 추출 시간에 따른 계내금 추출물의 단백질 분해효소 활성은 0.04, 0.08, 0.10, 0.14 및 0.17 unit/g로 시간대별로 단백질 분해효소 활성이 증가하는 것을 확인할 수 있다. Kim DW(2007)은 계내금 추출물의 추출 온도와 시간에 따른 효소활성도를 확인한 결과 60℃의 온도에서 4 hr에서 6 hr 동안 추출을 하였을 때 효소활성도(× 105 units/mL)가 높은 것으로 확인되었다. Kim MR(2010)은 효소종류에 따른 대두단백, 카제인, 글루텐 및 젤라틴을 20 min 간격으로 200 min 동안 단백질 가수분해 활성을 확인한 결과 30 min 이내에서 빠른 가수분해 활성을 보였으며 시간이 증가함에 따라 단백질 가수분해 활성이 증가하는 것을 확인하였다. Lee HS 등(2017)은 식용 곤충으로 잘 알려진 흰점박이꽃무지를 alcalase, bromelain, flavourzyme, neutrase 및 papain와 같은 단백질 가수분해 효소에 따른 단백질 가수분해물을 확인하였으며 유효성 아미노산의 농도는 flavourzyme 9.99 mg/mL, alcalase 9.35 mg/mL, neutrase 7.60 mg/mL, papain 6.65 mg/mL 및 bromelain 6.40 mg/mL 순으로 flavourzyme 단백질 가수분해물이 유효성 아미노산의 농도가 가장 높은 것을 확인하였다. 계내금 추출물의 단백질 분해효소 활성이 추출 시간이 증가하는 것을 확인하여 이를 다른 첨가물에 처리하면 아미노산 함량이 증가하여 감칠맛이 증가할 것으로 사료된다. 아미노산 중에서 글루탐산 성분이 감칠맛에 기인한다는 것을 밝혀냈다(Mouritsen OG 2019).
5. 총 단백질 함량
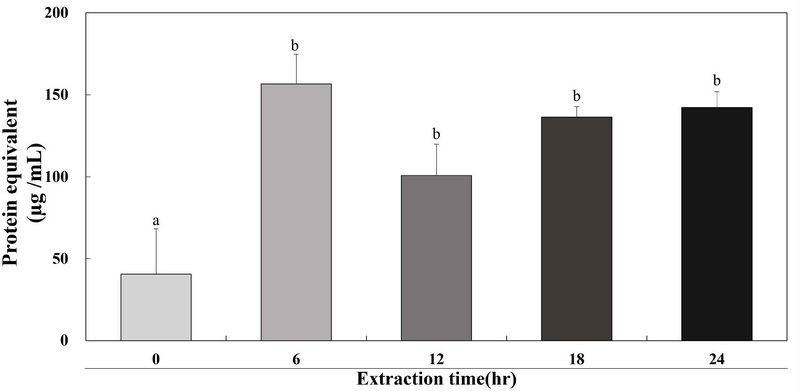
계내금 추출물의 총 단백질 함량을 조사하기 위해 bradford assay를 실행하였다. 추출 시간에 따른 계내금 추출물 GW0, GW6, GW12, GW18 및 GW24 결과는 Fig. 5에 나타내었다. 추출 시간에 따른 계내금 추출물의 총 단백질 함량은 40.61, 156.61, 100.83, 136.39 및 142.17 μg/mL(w/v-dry weight)로 6 hr 동안 추출했을 때 최대의 총 단백질 함량을 가지는 것을 확인하였다. Cho KO(1991)은 돼지의 무릎뼈를 1 hr, 3 hr, 6 hr, 9 hr 및 12 hr 동안의 시간에 따라 가열 농축하여 제조한 돼지 무릎뼈 용출액의 단백질 함량은 0.73, 0.89, 2.14, 3.21 및 4.12 g/100 g(w/w-dry weight)으로 12 hr 동안 가열하여 추출한 용출액에서 최대 단백질 함량을 나타내었다. Kim JH 등(2011)은 효소제 처리, 추출 온도 및 추출 시간에 따른 단백질 함량을 측정하였으며 95℃에서 6 hr, 12 hr 및 18 hr 동안 추출하였을 때 554.0, 601.2 및 618.6 mg/100 g(w/w-dry weight)으로 나타났으며 120℃에서 15 min, 30 min 및 60 min 동안 추출하였을 때 668.2, 697.6 및 724.2 mg/100 g(w/w-dry weight)으로 처리 시간이 증가하면 단백질함량이 증가하는 결과를 확인하였다. Kim SM 등(2019)은 건조된 식용 곤충의 총 단백질 함량을 평가한 결과 누에 65.4%, 쌍별귀뚜라미 64.5%, 흰점박이꽃무지 유충 53.9% 및 갈색거저리 유충 52.8%로 확인하였다. 추출 시간이 길어질수록 함유되는 총 단백질 함량이 증가하는 것으로 판단되며 닭의 모래주머니인 계내금을 활용하여 단백질 함량을 증진시킬 수 있는 식품 첨가물로써 활용할 수 있을 것으로 사료된다.
요 약
본 연구에서는 추출 시간에 따른 계내금 추출물을 제조하고 항산화 활성, 단백질 분해효소 활성 및 총 단백질 함량을 평가하고자 하였다. 단백질 분해효소의 활성을 확인하기 위해 단백질 변성이 일어나지 않는 50℃의 온도로 설정하여 평가하였다. DPPH 라디칼 소거 활성, 환원력 및 총 폴리페놀 함량 측정을 통해 항산화 활성을 확인하였으며, folin assay를 통해 단백질 분해효소 활성을 측정하였다. 또한, bradford assay를 통해 계내금 추출물의 총 단백질 함량을 측정하였다. 항산화 성분으로 잘 알려진 비타민 C(ascorbic acid)를 양성대조군으로 사용하였으며 계내금 추출물은 6 hr 동안 추출한 추출물부터 높은 항산화 활성을 확인하였으며 환원력에서 최대 10.45 μM로 높은 활성을 나타내었다. 계내금 추출물의 단백질 분해효소 활성을 확인한 결과 추출 시간 의존적으로 증가하는 것을 확인하였다. 본 연구를 통해서 계내금 추출물은 6 hr 동안 추출한 추출물부터 최대의 항산화 활성을 가지는 것을 확인하였으며 계내금을 소화를 촉진시키는 성분으로 사용할 뿐만 아니라 단백질이 변성되지 않는 조건에서 추출하여 식품 첨가물로 활용될 수 있을 것으로 사료된다.
Acknowledgments
이 논문은 3단계 산학연협력 선도대학 육성사업(LINC3.0)으로 지원(1345370676, 천연물의 단백질분해능을 이용한 아미노산이 증진된 스틱형 멸치육수 개발)을 받아 연구되었음.
References
- An GH, Han JG, Kim OT, Cho JH (2020) Changes of biological activities and nutrition contents by different extraction conditions in the mixtures of roasted edible mushrooms and grain additives for the development of mushroom tea. J Mushrooms 18(4): 344-356.
- Bar BC (1978) Bonchoyakjardogam. ADNET, Seoul, Korea.
-
Blois MS (1958) Antioxidant determinations by the use of a stable free radical. Nature 181(4617): 1198-1200.
[https://doi.org/10.1038/1811199a0]

- Cho KO (1991) The study on extracting efficient nutrients in pigs’ kneecap broth. Sookmyung Women University Journal of the Graduate School Student Association 9: 147-163.
-
Choi JI, Kim YJ, Kim JH, Song BS, Yoon Y, Byun MW, Kwon JH, Chun SS, U Lee JW (2009) Antioxidant activities of the extract fractions from Suaeda japonica. J Korean Soc Food Sci Nutr 38(2): 131-135.
[https://doi.org/10.3746/jkfn.2009.38.2.131]

-
Duh PD (1998) Antioxidant activity of burdock (Arctium lappa Linn): Its scavenging effect on free radical and active oxygen. J Am Oil Chem Soc 75(4): 455-461.
[https://doi.org/10.1007/s11746-998-0248-8]

- Godfrey T, West S (1996) Industrial Enzymology. 2nd ed. Macmillan Publishers, London, UK. p 3.
-
Gordon MH (1990) The mechanism of antioxidant action in vitro. pp 1-18. In: Food antioxidants. Hudson BJF (ed). Springer, Dordrecht, Amsterdam, Netherland.
[https://doi.org/10.1007/978-94-009-0753-9_1]

-
Huang D, Ou B, Prior RL (2005) The chemistry behind antioxidant capacity assays. J Agric Food Chem 53(6): 1841-1856.
[https://doi.org/10.1021/jf030723c]

-
Jang HL, Yoon KY (2015) Optimized pH condition of protein extraction of Gastrodia elata Blume by alkaline method. Korean J Food Preserv 22(2): 256-260.
[https://doi.org/10.11002/kjfp.2015.22.2.256]

- Jeong CH, Kang ST, Joo OS, Lee SC, Shin YH, Shim KH, Cho SH, Choi SG, Heo HJ (2009) Phenolic content, antioxidant effect and acetylcholinesterase inhibitory activity of Korean commercial green, puer, oolong, and black teas. J Korean Food Preserv 16(2): 230-237.
- Jung MS, Lee GS, hae HJ (2004) In vitro biological activity assay of ethanol extract of Radish. J Korean Soc Appl Biol Chem 47(1): 67-71.
- Kang BS (1999) Bonchohak. ADNET, Gyeonggido, Korea. p 374.
- Kang KA, Zhang R, Kang DG, Kim JS, Hyun JW (2006) Screening of antioxidative effect of combined medicinal plants on oxidative stress. Environmental Mutagens and Carcinogens 26(1): 7-11.
- Kim DW (2007) A enzymatical characteristics study of Kyenegum. Kor J Herbology 22(4): 29-34.
- Kim JG, Kang YM, Eom GS, Ko YM, Kim TY (2003) Antioxidative avtivity and antimicrobial activity of extracts from medicinal plants (Akebia quinate Decaisn, Scirus fluviatilis A. Gray, Gardenia jasminoides for. grandiflora Makino). J Agric Life Sci 37(4): 69-75.
-
Kim JH, Yoo CJ, Sin KA, Jang SY, Park NY, Jeong YJ (2011) Changes in properties of deer antler by proteolysis and extraction conditions. J Korean Soc Food Sci Nutr 40(1): 89-93.
[https://doi.org/10.3746/jkfn.2011.40.1.089]

-
Kim JM, Cho ML, Seo KE, Kim WS, Jung TD, Kim YH, Kim DB, Shin GH, Oh JW, Lee JS, Lee JH, Kim JY, Lee DW, Lee OH (2015) Effect of extraction conditions on in vitro antioxidant activities of root bark extract from Ulmus pumila L. J Korean Soc Food Sci Nutr 44(8): 1172-1179.
[https://doi.org/10.3746/jkfn.2015.44.8.1172]

-
Kim MR (2010) Bitterness and solubility of soy protein, casein, gluten, and gelatin hydrolysates treated with various enzymes. J Korean Soc Food Sci Nutr 39(4): 587-594.
[https://doi.org/10.3746/jkfn.2010.39.4.587]

- Kim SG (1996) Physiology of Domestic Animal Academi. Academy Chicago Publishers, Chicago. pp 206-208.
-
Kim SH, Yoon SR, Jeong YJ (2023) Quality characteristics of Aster glehni extract depending on the concentration and time of enzyme treatment. Korean J Food Preserv 30(4): 654-662.
[https://doi.org/10.11002/kjfp.2023.30.4.654]

- Kim SM, An CW, Han JA (2019) Characterization and application of the proteins isolated from edible insects. Korean J food Sci Technol 51(6): 537-542.
- Lee HS, Ryu HJ, Song HJ, Lee SO (2017) Enzymatic preparation and antioxidant activities of protein hydrolysates from Protaetia brevitarsis larvae. J Korean Soc Food Sci Nutr 46(10): 1164-1170.
-
Lee SH, Shin JH, Kang JR, Hwang CR, Sung NJ (2012) In vitro evaluation of biological activities of Wa-song (Orostachys japonicus A. Berger) and Korean traditional plants misture. J Korean Soc Food Sci Nutr 41(3): 295-301.
[https://doi.org/10.3746/jkfn.2012.41.3.295]

-
Lee YK, Oh YS, Roh DH (2012) Production properties on extracellular protease from Chryseobacterium novel strain JK1. Korean J Microbiol 48(1): 48-51.
[https://doi.org/10.7845/kjm.2012.48.1.048]

- Ministry of Food and Drug Safety (2023) Food Code. https://various.foodsafetykorea.go.kr, (accessed on 8. 1. 2024).
-
Mouritsen OG (2019) Koku in food science and physiology: Recent research on a key concept in palatability. Vol Ⅲ. pp 33-45. In: The quest for Umami. Nishimura T, Kuroda M (eds). Springer, Singapore.
[https://doi.org/10.1007/978-981-13-8453-0_3]

-
Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (2007) Trends in oxi-dative aging theories. Free Radic Biol Med 43(4): 477-503.
[https://doi.org/10.1016/j.freeradbiomed.2007.03.034]

- Oh ST (2017) Development of processed foods to increase the availability of non-preferred parts of chicken. MS Thesis Kyungnam National University of Science and Technology, Jinju. p 39.
- Park JH, Kim DW (2011) A study on the extracting characteristics of velvet antlers using Kyenegum protease. Kor J Herbology 26(4): 89-94.
-
Sung HM, Seo YS, Yang EJ (2018) Anti-oxidant and antiinflammatory activities of hot water extract obtained from Geranium thunbergii using different extraction temperatures and times. J Korean Soc Food Sci Nutr 47(10): 1006-1013.
[https://doi.org/10.3746/jkfn.2018.47.10.1006]

-
Xu XM, Jun JY, Jeong IH (2007) A study on the antioxidant activity of Hae-Songi mushroom (Hypsizigus marmoreus) hot water extracts. J Korean Soc Food Sci Nutr 36(11): 1351-1357.
[https://doi.org/10.3746/jkfn.2007.36.11.1351]

- Yoo BR (2015) Antioxidant and Antimicrobial Activities of Extracts from Different Parts of Cornus officinalis according to Extraction Time. Seoul National University of Science and Technology, Seoul. pp 10-35.