안토시아닌 조성이 다른 베리류 3종의 열안정성 비교
Abstract
Anthocyanins are natural pigments responsible for the red, purple, and blue colors in berries. The stability of anthocyanins can be affected by various factors, such as pH, temperature, and other components. This study investigated the degradation kinetics of anthocyanins in representative berries. Among the most consumed berries in the Korean population, black chokeberry, black mulberry, and blueberry were chosen due to their high anthocyanin contents. The berries contained anthocyanins with different aglycones and sugar moieties as follows: cyanidin-3-galactoside (63%) and cyanidin-3-arabinoside (30%) in black chokeberries, cyanidin-3-glucoside (70%) and cyanidin-3-rutinoside (25%) in black mulberries, and malvidin-3-galactoside (35%), malvidin-3-arabinoside (16%), and delphinidin-3-galactoside (14%) in blueberries. After heating at 100℃ for 60 min, the degradation of anthocyanins was highest in the black chokeberries (62%), followed by blueberries (54%) and black mulberries (50%). Within the same aglycone, glycosylated anthocyanins with glucose had higher retention compared to those with galactose or arabinose. Lightness (L*) showed a tendency to increase with increasing heating time. Color difference (ΔE*) was lowest in the black mulberries and highest in the blueberries. These results indicate that the thermal stability of anthocyanins was in the following order: black mulberry > blueberry > black chokeberry.
Keywords:
anthocyanin, black chokeberry, black mulberry, blueberry, degradation kinetics서 론
식품에 널리 분포된 안토시아닌은 과일, 채소, 꽃에 존재하는 수용성 색소로서 붉은색, 보라색 및 청색을 띤다(Francis FJ & Markakis PC 1989). 안토시아닌 또는 이를 함유한 식품의 추출물은 항산화, 항염증, 항암 등의 건강증진 효과를 나타냈다(Kim YH 등 2008). 우리 국민의 안토시아닌 섭취량에 대한 식품군별 기여도를 비교한 Ryu D & Koh E(2017)의 연구에서 과일류의 기여도가 가장 높았다. 2010년 이후 베리류의 건강증진 효과가 알려지고 건강에 대한 소비자의 관심이 높아지면서 베리류의 소비가 꾸준하게 증가하고 있다. 2020년 국민영양통계(Korea Health Industry Development Institute 2022) 자료에 보고된 다소비 과일 10종의 안토시아닌 함량을 비교하였을 때 베리류인 블루베리, 아로니아, 오디가 상위권을 차지하였다(Table 1). 블루베리(Vaccinium corymbosum)는 2002년에 미국에서 수퍼푸드로 선정된 후에(Time 2012) 기능성 과일로 주목을 받으면서 재배면적과 소비량이 증가하였다. 아로니아(Aronia melanocarpa)는 black chokeberry라고도 불리며 안토시아닌 함량이 블루베리의 4배, 딸기의 23배, 포도의 80배라고 보고되었다(Kraemer-Schafhalter A 등 1998). 뽕나무(Morus alba) 열매인 오디(black mulberry)는 식용될 뿐만 아니라 한약재로도 이용되고 있다.
베리류에 다량 함유된 안토시아닌은 온도, 빛, 산소, pH 등에 노출되면 손실되기 쉬운 불안정한 화합물이다(Cho SB 등 2003; Sadilova E 등 2006; Fan L 등 2019). 베리류의 안토시아닌은 안토시아니딘 6종(cyanidin, malvidin, petunidin, peonidin, pelargonidin, delphinidin)에 당(1∼3개)이 결합된 배당체 형태이다(Veberic R 등 2015; Chen J 등 2022). 기본 골격을 이루는 안토시아니딘에 결합된 당의 종류 및 개수와 다른 구성성분(copigments, 유기산 등)이 안토시아닌의 안정성에 영향을 준다고 알려져 있다(Woodward G 등 2009; Zhao CL 등 2017; Nikolic M 등 2020).
베리류는 주로 생과로 섭취되지만, 일부는 열처리 등의 가공을 거쳐 통조림, 잼, 분말 등으로 판매된다. 아로니아를 100℃에서 150분 동안 가열하였을 때 안토시아닌 함량이 61% 감소하였으며(Hwang ES & Ki KN 2013), 오디 농축액을 80℃에서 600분 가열 시 안토시아닌 함량이 92% 감소하였고(Kara Ş & Erçelebi EA 2013), 블루베리를 산성 조건(pH 3)에서 80℃로 10시간 가열하였을 때 안토시아닌 함량이 82% 감소하였다(Liu Y 등 2018). 이처럼 가열 공정은 안토시아닌을 파괴하여 항산화 활성을 15∼26% 감소시켰다(Peron DV 등 2017). 한편, 오디(Morus nigra L.)를 60℃∼80℃에서 10시간 가열하였을 때 명도(L*)가 감소하여 색이 짙어졌다(Kara Ş & Erçelebi EA 2013). 선행연구 결과는 안토시아닌을 함유한 베리류의 열처리 공정이 안토시아닌 함량 뿐만 아니라 색에도 영향을 준다는 것을 보여준다. 지금까지 동일한 열처리가 블루베리, 아로니아, 오디의 안토시아닌 함량 및 색에 미치는 영향을 연구한 논문은 전무하다.
따라서, 본 연구에서는 우리 국민이 섭취하는 대표적인 베리류인 블루베리, 아로니아, 오디를 동일한 온도에서 가열하여 안토시아닌 함량 및 색의 변화를 비교하고, 안토시아닌의 파괴 속도에 영향을 미치는 인자를 확인하고자 하였다.
재료 및 방법
1. 시약
안토시아닌의 표준품으로 cyanidin-3-galactoside, cyanidin-3-arabinoside, pelargonidin-3-glucoside, petunidin-3-glucoside, peonidin-3-glucoside, malvidin-3-glucoside, delphinidin-3-glucoside를 Extrasynthese(Genay Cedex, France)에서 구입하였다. Cyanidin-3-glucoside, 2,2’-azino-bis(3–ethylbenzothiazoline-6-sulfonic acid)(ABTS), 6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid(Trolox), potassium persulfate, Folin-Ciocalteu reagent는 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였다. 메탄올, 염산, formic acid, water는 Samchun Pure Chemicals(Pyeongtaek, Korea) 제품을 사용하였다.
2. 재료
2020년 국민영양통계(Korea Health Industry Development Institute 2022)의 식품별 섭취량 자료를 이용하여 한국인이 섭취하는 10대 과일을 선별하고, 선행연구 결과를 토대로 국내산 과일의 안토시아닌 함량을 내림차순으로 정렬하였다(Table 1). 상위 3개 과일인 아로니아(Aronia melanocarpa ‘Viking’), 오디(Morus alba ‘Cheongil’), 블루베리(Vaccinium corymbosum ‘Duke’)를 최종 시료로 선별하였다. 아로니아는 경상남도 통영, 오디는 전라북도 고창, 블루베리는 충청남도 천안의 지역 농장에서 온라인으로 구매하였다. 모든 시료는 —80℃에서 보관하였다.
3. 열처리 및 추출
시료를 냉장 온도에서 24시간 해동시킨 후 블렌더(I8800, IEP, Namyangju, Korea)를 이용하여 1분씩 분쇄하는 과정을 3회 반복하였다. 분쇄된 시료 20 g을 시험관에 칭량하여 100℃로 예열된 항온 수조(JSSB-30T, JSR, Gongju, Korea)에 넣고 0, 20, 40, 60분 동안 가열하였다. 가열된 시료 10 g을 시험관에 칭량하여 추출용매(0.1 N HCl: methanol=15:85, v/v) 100 mL를 첨가하고 40 kHz로 설정된 초음파기(Power Sonic 410, Hwashin Instrument Co., Ltd., Seoul, Korea)로 20분간 추출하였다. 추출액을 7,000 rpm에서 20분간 원심분리(LaboGene 2236R, Daejeon, Korea)하여 상층액을 안토시아닌, 총 페놀, ABTS 라디칼 소거능 측정에 사용하였다.
4. HPLC 분석
High performance liquid chromatograph(1260 Infinity, Agilent Technologies, Santa Clara, CA, USA)를 이용하여 안토시아닌을 분석하였다. 베리 추출액을 polytetrafluoroethylene syringe filter(PTFE, 0.45 μm, Whatman, London, UK)로 여과하였다. 컬럼은 Eclipse Plus C18(5 μm, 250 nm × 4.6 mm, Agilent Technologies)을 사용하였고, 시료 주입량은 10 μL이었으며 유속은 0.6 mL/min이었다. 이동상은 A(formic acid: methanol: water=5:20:75, v/v/v), B(methanol), C(water)였으며, 시간에 따른 조성 변화는 다음과 같았다: 0∼15분, 100∼80% A, 0∼18% B, 0∼2% C; 15∼30분, 80∼60% A, 18∼36% B, 2∼4% C; 30∼45분, 60∼0% A, 36∼90% B, 4∼10% C. 안토시아닌 피크는 표준시료의 검출시간 및 ultra-visible spectrum과 비교하여 확인하고, 520 nm에서 모니터링되었다. 표준시료인 cyanidin-3-glucoside, cyanidin-3-galactoside, cyanidin-3-arabinoside, pelargonidin-3-glucoside, petunidin-3-glucoside, peonidin-3-glucoside, malvidin-3-glucoside, delphinidin-3-glucoside를 0∼100 mg/L 범위로 표준곡선을 작성하여 안토시아닌을 정량하고 mg/100 g fresh weight(FW)로 나타냈다.
5. 안토시아닌의 Degradation Kinetics
아로니아, 오디, 블루베리에 존재하는 안토시아닌의 파괴 속도를 비교하기 위해 파괴 속도 상수(k)와 반감기(t1/2)를 아래에 제시된 Soldatkina LM 등(2017)의 방정식을 이용하여 계산하였다.
C0는 HPLC로 측정된 가열 전 시료의 안토시아닌 함량, Ct는 20, 40, 60분 가열된 시료의 안토시아닌 함량, k는 속도 상수(rate constant), t는 가열시간(min), t1/2는 안토시아닌 함량의 50%가 파괴되는 데 걸리는 시간을 의미한다.
6. 색도
분쇄한 시료 10 g을 petri dish에 담아서 색차계(Colorflex EZ, Hunter Lab, Reston, VA, USA)를 이용하여 명도(L*), 적색도(a*), 황색도(b*), 색상각(hue)을 측정하였다. 색 변화(ΔE*)는 Jiang T 등(2019)의 방정식을 사용하여 산출하였다.
L*, a*, b*는 가열 전 시료의 색도이고, L*a, a*a, b*a는 가열 후 시료의 색도를 나타낸다.
7. Brown Index(BI)
분쇄한 시료 10 g에 증류수를 1:10(w/v) 비율로 섞고 0.45 μm PTFE 필터로 여과하여 420 nm와 520 nm에서 흡광도(Biochrom Libra S22, Biochrom, Santa Barbara, CA, USA)를 측정하고, Sinela A 등(2017)이 보고한 아래 방정식을 이용하여 갈색지수(BI)를 산출하였다.
A420, A520은 420 nm, 520 nm에서 측정된 흡광값을 나타낸다.
8. pH와 당도
분쇄된 시료 10 g을 시험관에 담고 pH meter(3200P, Agilent Technologies, Shanghai, China)를 이용하여 pH를 측정하였다. 당도는 분쇄된 시료 2 g을 0.45 μm PTFE 필터로 여과하고 디지털 당도계(PAL-1, Atago Co., Ltd., Tokyo, Japan)를 이용하여 측정하였다.
9. 총 페놀
총 페놀 함량은 Singleton VL 등(1999)의 Folin-Ciocalteu 방법을 이용하여 측정되었다. 추출액 100 μL에 10% Folin-Ciocalteu reagent 750 μL를 첨가하고 5분간 반응시킨 후에 7.5% 탄산나트륨용액 750 μL와 혼합하였다. 암소에서 혼합액을 60분간 반응시키고 725 nm에서 흡광도를 측정하였다. 표준시료인 갈산(gallic acid)를 0∼200 mg/L 범위로 제조하여 표준곡선을 작성하고 시료의 총 페놀 함량을 산출하였다. 총 페놀 함량은 갈산 당량(gallic acid equivalent, mg GAE/100 g FW)으로 나타냈다.
10. 항산화 활성
항산화 활성은 Re R 등(1999)의 ABTS 라디칼 소거능을 이용하여 측정하였다. 7 mM ABTS 시약과 2.45 mM potassium persulfate를 2:1(v/v)로 혼합하고 암소에서 12∼16시간 동안 반응시켰다. 734 nm에서 흡광값이 0.70±0.02이 될 때까지 5 mM phosphate buffer(pH 7.4)를 이용하여 반응액을 희석하였다. Trolox 표준용액(0∼2 mM)을 제조하여 표준곡선을 작성하고 시료의 항산화 활성을 산출하였다. 항산화 활성은 Trolox 당량(Trolox equivalents, mmol TE/100 g FW)으로 나타냈다.
11. 통계분석
모든 실험은 3회 측정하여 평균±표준편차로 나타내고, SPSS Statistics(ver. 24.0, SPSS Inc. Chicago, IL, USA)로 통계처리 하였다. 일원 배치 분산분석(One-way ANOVA)을 실시하고 Duncan’s multiple range test(p<0.05)로 시료 간의 차이를 검증하였다. 총 페놀 함량과 항산화 활성의 가열 전후차이는 t-test를 이용하여 유의성을 검증하였다.
결과 및 고찰
1. 베리류 3종의 안토시아닌 프로파일
베리류 3종을 HPLC로 분석하여 안토시아닌 조성을 Table 2에 제시하였다. 아로니아, 오디, 블루베리에서 검출된 안토시아닌은 각각 4종, 3종, 10종이었다. 베리류 3종의 안토시아닌을 비당체(aglycone)를 기준으로 분류한 결과, 아로니아는 cyanidin(100%)으로만, 오디는 cyanidin(95%)과 pelargonidin(5%)으로, 블루베리는 malvidin(53%), delphinidin(23%), cyanidin(14%), peonidin(6%), petunidin(4%)으로 이루어졌다. 이와 같이 베리류 3종의 안토시아니딘 조성이 달랐다. 아로니아의 주요 안토시아닌은 cyanidin-3-galactoside (63%)이었으며, 나머지는 cyanidin-3-arabinoside(30%)와 cyanidin-3-xyloside(4%), cyanidin-3-glucoside(3%)였다. 이러한 안토시아닌 조성은 선행연구 결과와 유사하였다. Soldatkina LM 등(2017)의 연구에서 아로니아의 주요 안토시아닌은 cyanidin-3-galactose였으며 총 함량의 68.9%를 차지하였다. Taheri R 등(2013)은 아로니아 안토시아닌의 함량 순서는 cyanidin-3-galactoside>cyanidin-3-arabinoside>cyanidin-3-glucoside라고 하였다. 오디는 cyanidin-3-glucoside(70%)와 cyanidin-3-rutinoside(25%), 블루베리는 malvidin-3-galactoside(35%), malvidin-3-arabinoside(16%) 및 delphinidin-3-galactoside(14%)가 주요 안토시아닌이었다. Jang M 등(2022)의 연구에서도 오디의 대표적인 안토시아닌은 cyanidin-3-glucoside으로 총 안토시아닌 함량의 58.3%이었다. Li D 등(2016)의 연구에서 블루베리의 주요 안토시아닌은 malvidin-3-galactoside(15.1%)이었다. 총 안토시아닌 함량은 아로니아가 178.35 mg/100 g FW으로 가장 높았으며, 블루베리(156.21 mg/100 g FW), 오디(115.44 mg/100 g FW) 순이었다. Kim SJ 등(2019)은 블루베리와 아로니아의 안토시아닌 함량이 각각 549.33, 1,149.06 mg/100 g FW라고 보고하였다. Choi IS 등(2012)은 오디 품종 3가지의 안토시아닌 함량이 9.01∼206.60 mg/100 g FW라고 보고하였다. 본 연구의 대상 시료인 아로니아의 안토시아닌 함량은 선행연구 결과보다 낮았지만, 오디는 선행 결과와 비슷하였다. 식품의 안토시아닌 조성 및 함량은 품종, 재배 방법, 기후, 토양 등에 의해 달라진다고 알려져 있다(Bueno JM 등 2012; Kim SJ 등 2019; Jang M 등 2022). 이는 베리류 3종의 안토시아닌 함량과 조성이 선행연구 결과와 차이가 나는 이유를 설명해 준다.
2. 가열시간에 따른 안토시아닌의 함량 변화
베리류 3종을 100℃에서 가열하였을 때 시간에 따른 안토시아닌 함량을 Table 2에 제시하였다. 가열시간이 길어질수록 안토시아닌의 함량은 유의적으로 감소하였다. 아로니아, 오디, 블루베리의 안토시아닌 잔존율은 각각 38%, 50%, 46%이었다. 안토시아닌의 파괴 속도 상수(k)는 아로니아(0.0156), 블루베리(0.0118), 오디(0.0114) 순으로 감소하였고, 반감기는 아로니아(32.05 min), 블루베리(42.37 min), 오디(43.86 min) 순으로 증가하였다(Fig. 1). 이는 오디에 존재하는 안토시아닌이 가장 안정하고, 아로니아의 안토시아닌이 가장 불안정함을 의미한다. 한편, 아로니아의 안토시아닌 중에서 cyanidin-3-glucoside의 잔존율(69%)이 가장 높았고, cyanidin-3-galactoside와 cyanidin-3-arabinoside의 잔존율은 각각 39%, 30%로 글루코스 배당체에 비해 절반 정도였다(Table 2). Soldatkina LM 등(2017)의 연구에서도 cyanidin-3-galactoside가 주요 안토시아닌인 아로니아와, cyanidin-3-glucoside가 주요 안토시아닌인 블랙베리, 엘더베리를 50℃, 75℃, 100℃에서 300분간 가열하였을 때 아로니아의 안토시아닌이 가장 불안정하였다. 블루베리에서 peonidin-3-glucoside의 잔존율이 63%인 반면에, peonidin-3-arabinoside는 전량 파괴되었다(Table 2). 이는 글루코스가 결합된 안토시아닌이 아라비노스(arabinose)가 결합된 안토시아닌보다 안정하다는 Yue X & Xu Z(2008)의 결과와 일치하였다. Ichiyanagi T 등(2001)의 연구에서도 야생 블루베리를 95℃에서 120분 동안 가열하였을 때 안토시아닌 배당체의 가수분해 속도가 아라비노스>갈락토스>글루코스 순이었다. 아로니아와 블루베리에 함유된 안토시아닌은 당 1개가 결합된 화합물인 반면에, 오디의 안토시아닌은 당 2개가 결합된 cyanidin-3-rutinoside가 총 함량의 25%를 차지하였다(Table 2). Zhao CL 등(2014)은 안토시아닌에 결합된 당의 개수가 증가할수록 분자의 크기는 증가하고 평면성(coplanarity)은 감소하여 플라빌리움 양이온을 입체적으로 보호해 줌으로써 안토시아닌의 안정성을 높인다고 하였다. 이는 오디의 안토시아닌이 가장 안정하고 아로니아의 안토시아닌 손실이 높은 이유를 설명해 준다.
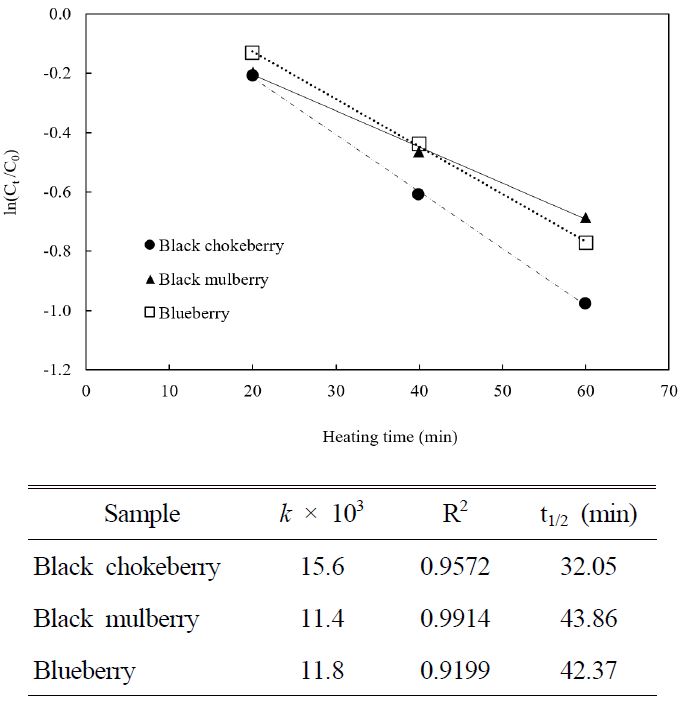
Degradation kinetics of anthocyanins in black chokeberry, black mulberry, and blueberry during heating at 100℃ for 60 min.k and t1/2 represent degradation rate constant and half-time, respectively.
Kırca A 등(2007)은 pH 2.5∼7에서 70℃, 80℃, 90℃로 가열된 자색당근(black carrot) 주스의 pH가 높을수록 안토시아닌 함량이 빠르게 감소했다고 하였다. Torskangerpoll K & Andersen ØM(2005)은 pH 1.1∼10.5 조건에서 안토시아닌의 안정성을 비교하고 pH 2∼3에서 안토시아닌이 가장 안정하다고 보고하였다. Loypimai P 등(2016)의 연구에서도 흑미겨(black rice bran)를 pH 2∼5에서 60℃, 80℃, 100℃로 20분 동안 가열하였을 때 pH 2, 60℃에서 안토시아닌이 가장 안정하였다. 베리류 3종에서 오디의 pH(4.5)는 아로니아(3.4)와 블루베리(3.3)에 비해 높은 편이었다. 이를 토대로 아로니아와 블루베리의 안토시아닌이 더 안정할 것으로 예측하였지만, 실제로는 오디 안토시아닌의 잔존율이 더 높았다. 이는 안토시아닌의 안정성에 pH 이외의 다른 인자의 영향이 크다는 것을 시사한다. Kırca A 등(2007)은 자색당근을 90℃에서 11, 30, 45, 64°Brix 및 pH 4.3으로 열처리하였을 때 당도가 증가할수록 안토시아닌의 안정성이 감소했다고 보고하였다. 하지만, 본 연구에서는 당도가 가장 높은 오디(14.4°Brix)의 안토시아닌이 가장 안정하고, 당도가 가장 낮은 아로니아(8.0°Brix)의 안토시아닌이 가장 불안정하였다. 이러한 결과는 베리류에 존재하는 안토시아닌의 안정성과 당 함량은 양의 상관관계가 있음을 의미한다. 당 함량에 따른 안토시아닌의 열안정성에 대한 추가연구가 필요하다고 생각된다.
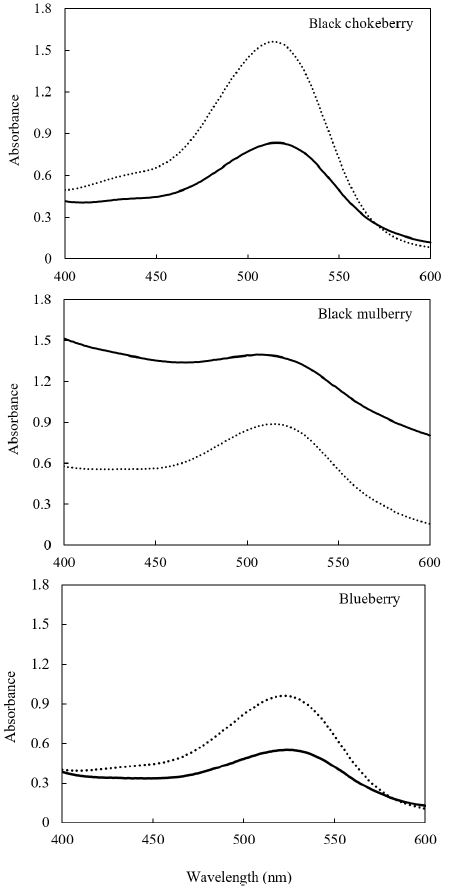
Copigmentation은 안토시아닌이 copigments(aromatic phenolic acids, flavonoids, hydrolyzable tannins)와 비공유결합을 통해 안토시아닌의 분자 크기를 증가시키거나 불안정한 플라빌리움 양이온을 보호하여 안토시아닌의 안정성을 높인다고 알려져 있다(Zhao CL 등 2017; Fan L 등 2019). 이러한 화학반응은 안토시아닌의 최대 흡광 파장을 오른쪽으로 이동시키는 bathochromic shift 또는 최대 흡광 파장의 세기(intensity)를 증가시키는 hyperchromic effect를 나타낸다. 베리류 3종의 가열(100℃, 60분) 전후 스펙트럼을 Fig. 2에 제시하였다. 아로니아와 블루베리는 최대 파장(514 nm, 516 nm)이 가열 후에 오른쪽으로 2 nm 이동하여 bathochromic shift를 나타냈다. Hwang SJ 등(2014)은 아로니아와 블루베리의 방향족 페놀산 함량은 각각 110.0 mg/g FW, 27.4 mg/g FW이며 플라보노이드 함량은 각각 5.3 mg/g FW, 1.6 mg/g FW이라고 하였다. Wilsk-ajeszka J & Korzuchowska A(1996)는 안토시아닌과 클로로겐산(chlorogenic acid)의 copigmentaion은 pH 3.2∼3.7에서 가장 높다고 보고하였다. 이는 아로니아(pH 3.4)와 블루베리(pH 3.3)에서 bathochromic shift가 나타난 이유를 설명해 준다. 하지만, 아로니아와 블루베리는 가열 후에 최대 파장의 세기가 감소하는 hypochromic effect를 나타냈다. Molaeafard S 등(2021)의 연구에서도 체리(sour cherry)를 100℃에서 가열하였을 때 hypochromic effect가 나타났다. Trouillas P 등(2016)은 안토시아닌의 플라빌리움 양이온의 2번 탄소가 물 분자와 결합하면 무색의 헤미케탈(hemiketal)이 생성되어 hypochromic effect를 나타낸다고 하였다. 이는 아로니아와 블루베리에 존재하는 안토시아닌이 불안정하여 copigmentation에 의해 안정화되지 못하고 가열에 의한 손실이 더 컸음을 나타낸다.
3. 색도
베리류 3종의 가열시간에 따른 색 변화를 Table 3에 제시하였다. 가열시간이 길어질수록 아로니아와 블루베리의 명도가 유의적으로 증가하였다. 한편, 블루베리의 색상각(hue)은 가열시간이 길어질수록 유의적으로 감소하였지만, 오디는 유의적으로 증가하였다. Sadilova E 등(2006)의 연구에서 딸기, 엘더베리, 자색당근을 95℃에서 7시간 동안 가열하였을 때 명도와 색상각이 증가하였다. Kara Ş & Erçelebi EA(2013)의 연구에서는 80℃에서 가열한 오디의 적색도와 황색도는 명확한 경향을 나타내지 않았으나 명도가 감소하였다. 오디는 가열시간에 따라 황색도가 유의적으로 증가하였지만, 나머지 두 시료는 증가하다가 감소하였다. 선행연구와의 차이는 가열온도 및 시간이 달랐기 때문으로 생각된다. 60분 가열 후에 색 변화(ΔE*)는 블루베리가 가장 높았고 오디가 가장 낮았다. Sadilova E 등(2006)은 엘더베리, 딸기, 자색당근을 95℃에서 7시간 가열했을 때 ΔE*값이 낮은 자색 당근의 안토시아닌 열안정성이 가장 높았다고 하였다. 본 연구에서도 ΔE*값이 낮은 오디의 안토시아닌이 가장 안정하였다. 베리류의 주요 색소는 안토시아닌이므로 안토시아닌이 안정할수록 색 변화가 작았던 것으로 유추된다. 아로니아와 블루베리의 갈색지수가 유의적으로 증가하였지만 오디는 뚜렷한 경향을 보이지 않았다(Table 3). Jiang T 등(2019)의 연구에서도 자색고구마를 90℃에서 60시간 가열하였을 때 갈색지수가 증가하였다. Suhl HJ 등(2003)의 연구에서도 오디 추출물(pH 2∼5, 80℃, 90℃, 100℃)을 180분간 가열하였을 때 갈색지수가 증가하였다. 가열과정에서 안토시아닌이 파괴되었거나 효소적 또는 비효소적 갈변반응에 의해 갈색지수가 증가한 것으로 사료된다.
4. 총 페놀 함량과 항산화 활성
베리류 3종의 총 페놀의 함량 및 ABTS 라디칼 소거능을 Fig. 3에 제시하였다. 아로니아는 가열 전후 모두 총 페놀 함량이 가장 높았다. Kim SJ 등(2019)의 연구에서도 국내산 베리류의 총 페놀 함량은 아로니아가 530.49 mg/100 g FW로 블루베리(344.72 mg/100 g FW)보다 높았다. 베리류 3종은 가열 후에 총 페놀 함량이 유의적으로 증가하는 경향을 나타냈다(Fig. 3A). Sadilova E 등(2006)은 딸기를 95℃에서 7시간 가열하였더니 pelargonidin-3-glucoside와 cyanidin-3-glucoside가 분해되어 protocatechuic acid, 4-hydrobenzoic acid, phloroglucinaldehyde를 생성하였으며, 엘더베리의 cyanidin-3,5-diglucoside와 cyanidin-3-glucoside-xyloside는 protocatechuic acid와 phloroglucinaldehyde로 분해되었다고 보고하였다. 이는 안토시아닌이 저분자의 방향족 화합물로 분해되어 총 페놀 함량이 증가하였음을 시사한다.
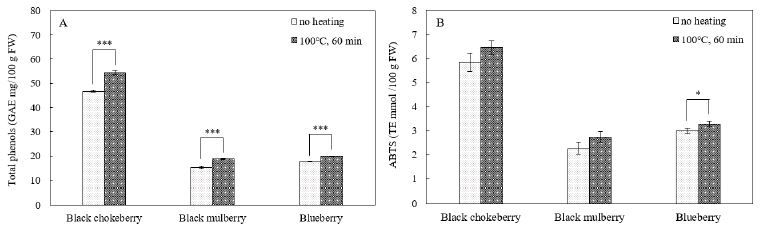
Changes of total phenols content (A) and ABTS radical scavenging activity (B) in black chokeberry, black mulberry, and blueberry before and after heating at 100℃ for 60 min.* p<0.05, *** p<0.001 by t-test.
ABTS 라디칼 소거능은 베리류 3종에서 모두 증가하였다(Fig. 3B). 블루베리가 유의적인 차이를 보인 반면에 아로니아와 오디는 유의적인 변화를 보이지 않았다. Lee MY 등(2012)은 폴리페놀 함량은 항산화 활성과 양의 상관관계가 있다고 보고하였다. 본 연구에서도 총 페놀 함량이 가장 높은 아로니아의 ABTS 라디칼 소거능이 가장 높았다. 가열에 의한 안토시아닌 분해는 라디칼을 제거하는 페놀기(phenol group)를 증가시켜 ABTS 라디칼 소거능을 높인 것으로 생각된다.
요약 및 결론
아로니아는 cyanidin-3-galactoside(63%)와 cyanidin-3-arabinoside(30%), 오디는 cyanidin-3-glucoside(70%)와 cyanidin-3-rutinoside(25%), 블루베리는 malvidin-3-galactoside(35%)와 malvidin-3-arabinoside(16%)가 주요 안토시아닌이었다. 100℃에서 60분간 가열하였을 때 안토시아닌 파괴율은 오디(50%)가 가장 낮았고 아로니아(62%)가 가장 높았다. 이는 오디에 존재하는 안토시아닌이 가장 안정함을 보여준 것이다. 오디의 주요 안토시아닌은 글루코스가 결합된 배당체이지만 아로니아와 블루베리의 주요 안토시아닌은 갈락토스가 결합된 배당체였다. 또한, 오디에는 당이 2개인 안토시아닌이 25%인 반면에 블루베리와 아로니아는 당이 1개인 배당체만 존재하였다. 오디는 당도와 pH가 다른 두 시료에 비해 높았다. 60분 동안 가열 후에 모든 시료의 총 페놀 함량이 유의적으로 증가하였고, ABTS 라디칼 소거능은 블루베리에서만 유의적으로 증가하였다. 이러한 결과는 베리류 3종에 존재하는 안토시아닌의 조성뿐만 아니라 당과 pH가 안토시아닌의 안정성에 영향을 준다는 것을 보여준 것이다. 앞으로 안토시아닌의 열분해 기전을 연구하여 총 페놀 함량이 증가한 이유가 밝혀져야 할 것이다.
Acknowledgments
본 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2020R1A2C1004117). 이 논문은 서울여자대학교 교내연구비의 지원을 받았음(2022-0082).
References
-
Bueno JM, Sáez-Plaza P, Ramos-Escudero F, Jiménez AM, Fett R, Asuero AG (2012) Analysis and antioxidant capacity of anthocyanin pigments. Part II: Chemical structure, color, and intake of anthocyanins. Crit Rev Anal Chem 42(2): 126-151.
[https://doi.org/10.1080/10408347.2011.632314]

-
Chen J, Shu Y, Chen Y, Ge Z, Zhang C, Cao J, Li X, Wang Y, Sun C (2022) Evaluation of antioxidant capacity and gut microbiota modulatory effects of different kinds of berries. Antioxidants 11(5): 1020.
[https://doi.org/10.3390/antiox11051020]

- Cho SB, Kim HJ, Yoon JI, Chun HS (2003) Kinetic study on the color deterioration of crude anthocyanin extract from Schizandra fruit (Schizandra chinensis fructus). Korean J Food Sci Technol 35(1): 23-27.
-
Choi IL, Kwak EJ (2014) Comparison of antioxidant activities and bioactive compounds between Bokbunja (Rubus coreanus Miq.) and other berries. Food Sci Biotechnol 23(5): 1677-1682.
[https://doi.org/10.1007/s10068-014-0228-8]

-
Choi IS, Moon YS, Kwak EJ (2012) Composition of resveratrol and other bioactive compounds, and antioxidant activities in different mulberry cultivars. Korean J Hortic Sci Technol 30(3): 301-307.
[https://doi.org/10.7235/hort.2012.12040]

-
Fan L, Wang Y, Xie P, Zhang L, Li Y, Zhou J (2019) Copigmentation effects of phenolics on color enhancement and stability of blackberry wine residue anthocyanins: Chromaticity, kinetics and structural simulation. Food Chem 275: 299-308.
[https://doi.org/10.1016/j.foodchem.2018.09.103]

-
Francis FJ, Markakis PC (1989) Food colorants: Anthocyanins. Crit Rev Food Sci Nutr 28(4): 273-314.
[https://doi.org/10.1080/10408398909527503]

-
Hwang ES, Ki KN (2013) Stability of the anthocyanin pigment extracted from aronia (Aronia melancocarpa). Korean J Food Sci Technol 45(4): 416-421.
[https://doi.org/10.9721/KJFST.2013.45.4.416]

-
Hwang SJ, Yoon WB, Lee O, Cha SJ, Kim JD (2014) Radical-scavenging-linked antioxidant activities of extracts from black chokeberry and blueberry cultivated in Korea. Food Chem 146: 71-77.
[https://doi.org/10.1016/j.foodchem.2013.09.035]

-
Ichiyanagi T, Oikawa K, Tateyama C, Konishi T (2001) Acid mediated hydrolysis of blueberry anthocyanins. Chem Pharm Bull 49(1): 114-117.
[https://doi.org/10.1248/cpb.49.114]

-
Jang M, Kim JY, Kim GC, Kang HJ, Hwang IG (2022) Anthocyanin content in mulberry according to cultivars and growing region. J Korean Soc Food Sci Nutr 51(3): 289-294.
[https://doi.org/10.3746/jkfn.2022.51.3.289]

-
Jiang T, Mao Y, Sui L, Yang N, Li S, Zhu Z, Wang C, Yin S, He J, He Y (2019) Degradation of anthocyanins and polymeric color formation during heat treatment of purple sweet potato extract at different pH. Food Chem 274: 460-470.
[https://doi.org/10.1016/j.foodchem.2018.07.141]

-
Kara Ş, Erçelebi EA (2013) Thermal degradation kinetics of anthocyanins and visual colour of Urmu mulberry (Morus nigra L.). J Food Eng 116(2): 541-547.
[https://doi.org/10.1016/j.jfoodeng.2012.12.030]

-
Kim DO, Chun OK, Kim YJ, Moon HY, Lee CY (2003) Quantification of polyphenolics and their antioxidant capacity in fresh plums. J Agric Food Chem 51(22): 6509-6524.
[https://doi.org/10.1021/jf0343074]

-
Kim DO, Heo HJ, Kim YJ, Yang HS, Lee CY (2005) Sweet and sour cherry phenolics and their protective effects on neuronal cells. J Agric Food Chem 53(26): 9921-9928.
[https://doi.org/10.1021/jf0518599]

- Kim SJ, Kim H, Hur YY, Im DJ, Lee DH, Park SJ, Jung SM, Chung KH (2019) Anthocyanin and polyphenol analysis and antioxidant activity of small fruit and berries in Korea. Korean J Plant Res 32(5): 407-414.
-
Kim SK, Bae R, Na H, Song JH, Kang HJ, Chun C (2012) Changes in fruit physicochemical characteristics by fruit clusters in June-bearing strawberry cultivars. Korean J Hortic Sci Technol 30(4): 378-384.
[https://doi.org/10.7235/hort.2012.12027]

- Kim YH, Kim DS, Woo SS, Kim HH, Lee YS, Kim HS, Ko KO, Lee SK (2008) Antioxidant activity and cytotoxicity on human cancer cells of anthocyanin extracted from black soybean. Korean J Crop Sci 53(4): 407-412.
-
Kırca A, Özkan M, Cemeroğlu B (2007) Effects of temperature, solid content and pH on the stability of black carrot anthocyanins. Food Chem 101(1): 212-218.
[https://doi.org/10.1016/j.foodchem.2006.01.019]

- Korea Health Industry Development Institute (2022) 2020 National Food & Nutrition Statistics. https://www.khidi.or.kr, (accessed on 22. 12. 2022).
-
Kraemer-Schafhalter A, Fuchs H, Pfannhauser W (1998) Solid-phase extraction (SPE)-a comparison of 16 materials for the purification of anthocyanins from aronia melanocarpa var Nero. J Sci Food Agric 78(3): 435-440.
[https://doi.org/10.1002/(SICI)1097-0010(199811)78:3<435::AID-JSFA139>3.0.CO;2-Q]

-
Lee MY, Yoo MS, Whang YJ, Jin YJ, Hong MH, Pyo YH (2012) Vitamin C, total polyphenol, flavonoid contents and antioxidant capacity of several fruit peels. Korean J Food Sci Technol 44(5): 540-544.
[https://doi.org/10.9721/KJFST.2012.44.5.540]

-
Li D, Meng X, Li B (2016) Profiling of anthocyanins from blueberries produced in China using HPLC-DAD-MS and exploratory analysis by principal component analysis. J Food Compost Anal 47: 1-7.
[https://doi.org/10.1016/j.jfca.2015.09.005]

-
Liu Y, Liu Y, Tao C, Liu M, Pan Y, Lv Z (2018) Effect of temperature and pH on stability of anthocyanin obtained from blueberry. J Food Meas Charact 12(3): 1744-1753.
[https://doi.org/10.1007/s11694-018-9789-1]

-
Loypimai P, Moongngarm A, Chottanom P (2016) Thermal and pH degradation kinetics of anthocyanins in natural food colorant prepared from black rice bran. J Food Sci Technol 53(1): 461-470.
[https://doi.org/10.1007/s13197-015-2002-1]

-
Molaeafard S, Jamei R, Marjani AP (2021) Co-pigmentation of anthocyanins extracted from sour cherry (Prunus cerasus L.) with some organic acids: Color intensity, thermal stability, and thermodynamic parameters. Food Chem 339: 128070.
[https://doi.org/10.1016/j.foodchem.2020.128070]

-
Nikolic M, Pavlovic A, Mitic M, Mitic S, Tosic S, Mrmosanin J, Pecev-marinkovic E (2020) Effect of thermal processing on anthocyanin degradation in two bilberry jam formulations. Rev de Chim 71(3): 34-44.
[https://doi.org/10.37358/RC.20.3.7971]

-
Park JS, Chon SU, Moon EW, Jeong CY (2016) Effects of polyphenol and anthocyanin contents of Punica granatum fruit parts on their antioxidant and anticancer activities. Korean J Food Preserv 23(4): 553-559.
[https://doi.org/10.11002/kjfp.2016.23.4.553]

- Park SW, Jung YS, Ko KC (1997) Quantitative analysis of anthocyanins among mulberry cultivars and their pharmacological screening. J Kor Soc Hort Sci 38(6): 722-724.
-
Peron DV, Fraga S, Antelo F (2017) Thermal degradation kinetics of anthocyanins extracted from juçara (Euterpe edulis Martius) and “Italia” grapes (Vitis vinifera L.), and the effect of heating on the antioxidant capacity. Food Chem 232: 836-840.
[https://doi.org/10.1016/j.foodchem.2017.04.088]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26(9-10): 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Ryu D, Koh E (2017) Estimated dietary anthocyanin intakes and major food sources of Koreans. J East Asian Soc Diet Life 27(4): 378-386.
[https://doi.org/10.17495/easdl.2017.8.27.4.378]

-
Sadilova E, Stintzing FC, Carle R (2006) Thermal degradation of acylated and nonacylated anthocyanins. J Food Sci 71(8): C504-C512.
[https://doi.org/10.1111/j.1750-3841.2006.00148.x]

-
Sinela A, Rawat N, Mertz C, Achir N, Fulcrand H, Dornier M (2017) Anthocyanins degradation during storage of Hibiscus sabdariffa extract and evolution of its degradation products. Food Chem 214: 234-241.
[https://doi.org/10.1016/j.foodchem.2016.07.071]

-
Singleton VL, Orthofer R, Lamuela-Raventós RM (1999) Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Meth Enzymol 299: 152-178.
[https://doi.org/10.1016/S0076-6879(99)99017-1]

-
Soldatkina LM, Novotna VO, Salamon I (2017) Degradation kinetics of anthocyanins in acidic aqueous extracts of berries. Вісник ОНУ Хімія 22(1): 55-66.
[https://doi.org/10.18524/2304-0947.2017.1(61).94711]

-
Suhl HJ, Noh DO, Kang CS, Kim JM, Lee SW (2003) Thermal kinetics of color degradation of mulberry fruit extract. Mol Nutr Food Res 47(2): 132-137.
[https://doi.org/10.1002/food.200390024]

-
Taheri R, Connolly BA, Brand MH, Bolling BW (2013) Underutilized chokeberry (Aronia melancocarpa, Aronia arbutifolia, Aronia prunifolia) accessions are rich sources of anthocyanins, flavonoids, hydroxycinnamic acids, and proanthocyanidins. J Agric Food Chem 61(36): 8581-8588.
[https://doi.org/10.1021/jf402449q]

- Time (2012) 10 Summer Superfoods (With Recipes). https://healthland.time.com, (accessed on 15. 12. 2022).
-
Torskangerpoll K, Andersen ØM (2005) Colour stability of anthocyanins in aqueous solutions at various pH values. Food Chem 89(3): 427-440.
[https://doi.org/10.1016/j.foodchem.2004.03.002]

-
Trouillas P, Sancho-García JC, De Freitas V, Gierschner J, Otyepka M, Dangles O (2016) Stabilizing and modulating color by copigmentation: Insights from theory and experiment. Chem Rev 116(9): 4937-4982.
[https://doi.org/10.1021/acs.chemrev.5b00507]

-
Veberic R, Slatnar A, Bizjak J, Stampar F, Mikulic-Petkovsek M (2015) Anthocyanin composition of different wild and cultivated berry species. LWT 60(1): 509-517.
[https://doi.org/10.1016/j.lwt.2014.08.033]

-
Wilska-Jeszka, J., & Korzuchowska, A (1996) Anthocyanins and chlorogenic acid copigmentation-influence on the colour of strawberry and chokeberry juices. Z Lebensm Unters Forsch 203(1): 38-42.
[https://doi.org/10.1007/BF01267767]

-
Woodward G, Kroon P, Cassidy A, Kay C (2009) Anthocyanin stability and recovery: Implications for the analysis of clinical and experimental samples. J Agric Food Chem 57(12): 5271-5279.
[https://doi.org/10.1021/jf900602b]

-
Yue X, Xu Z (2008) Changes of anthocyanins, anthocyanidins, and antioxidant activity in bilberry extract during dry heating. J Food Sci 73(6): C494-C499.
[https://doi.org/10.1111/j.1750-3841.2008.00845.x]

-
Zhao CL, Chen ZJ, Bai XS, Ding C, Long TJ, Wei FG, Miao KR (2014) Structure–activity relationships of anthocyanidin glycosylation. Mol Divers 18(3): 687-700.
[https://doi.org/10.1007/s11030-014-9520-z]

-
Zhao CL, Yu YQ, Chen ZJ, Wen GS, Wei FG, Zheng Q, Wang CD, Xiao XL (2017) Stability-increasing effects of anthocyanin glycosyl acylation. Food Chem 214: 119-128.
[https://doi.org/10.1016/j.foodchem.2016.07.073]