
저염 조개젓의 항산화 활성에 대한 밀가루풀 첨가의 영향
Abstract
It is necessary to reduce the salt content in high-salt food such as jeotkal because salt consumption raises the risk of development of chronic diseases. This study, therefore, prepared low-salt fermented clam by replacing salt with wheat flour because grains are known to produce lactic acid which prevents decay during the fermentation process. The pH, salinity and antioxidant activity were then studied. Low-salt fermented clam was prepared by replacing 0, 10 and 20 g of salt with wheat flour. The fermented clam showed no change in pH despite the addition of wheat flour. The salinity of the fermented clam decreased with the addition of wheat flour. The total phenolic content of low-salt fermented clam did not show a significant change with the addition of wheat flour but the total flavonoid content increased. DPPH radical scavenging activity of the fermented clam did not significantly change with the addition of wheat flour. The ABTS radical scavenging activity was higher in the fermented clam without wheat flour. The addition of wheat flour increased the reducing power of the fermented clam. These results showed that the addition of grain such as wheat as a substitue for salt could reduce salinity and improve the antioxidant activity of jeotkal.
Keywords:
fermented clam, wheat flour, antioxidant activity, radical scavenging activity, reducing power서 론
젓갈은 어류, 조개류와 갑각류 등 다양한 해산물을 주원료로 하여 식염과 부재료를 첨가하여 제조하는 발효식품이다(Suh HK 1987). 젓갈 생산량은 1995년 새우젓 4,599 톤, 오징어젓 1,733 톤, 멸치젓 1,502 톤, 어리굴젓 63 톤, 조개젓이 35 톤에서(Kim YM 1996) 2018년 9,118 톤, 오징어젓 4,252 톤, 멸치젓 9,012 톤, 어리굴젓 396 톤, 조개젓 145 톤으로(KOSIS 2019) 증가하였다. 생산량 측면에서는 조개젓이 새우젓이나 멸치젓에 비해 적으나, 제조하는 지역은 매우 다양하며, 관서, 중부, 남부, 관북 4개 지역에서 제조되고 있는 젓갈은 명란젓, 참게젓과 조개젓뿐이다(Suh HK & Yoon SS 1987). 젓갈은 원재료에서 유래된 유리아미노산 등 풍부한 단백질 급원이며, 발효과정을 통해 젓갈 특유의 독특한 향미를 생성하고, 김치 제조 시 부재료나 다양한 식품의 곁들임 식품으로 이용되고 있다(You BJ & Chang MH 1992).
그러나 젓갈 제조에 사용되는 식염의 나트륨 성분은 건강에 유해하다는 결과가 다수 보고되고 있어 고식염 식품인 젓갈의 소비를 제한하는 원인이 되고 있다(Kim YM 1996; Ahn HJ 등 2000). 나트륨 섭취가 고혈압(Williams JS 등 2005; Takagi Y 등 2017), 비만 및 대사증후군(Oh SW 등 2017), 신장질환(Nerbass FB 등 2015; Ogna A 등 2016), 암(Deckers AG 등 2014), 간질환(Huh JH 등 2015) 등 만성질환과 관련되며, 나트륨 섭취 제한이 자가면역질환 환자의 염증반응을 완화시킨다는 연구(Scrivo R 등 2017) 등이 보고되었다. 이와 함께 현대인의 건강에 대한 관심이 높아지면서 저염식품을 선호하는 경향이 강해져(Rho J & Kim H 2013; Woo SJ 등 2015), 염분함량을 줄인 저염 젓갈을 생산하려는 다양한 시도가 이루어지고 있다.
오징어 젓갈의 경우, 염도를 줄이기 위하여 감마선 조사를 통한 멸균처리(Kim DH 등 1999; Kim JH 등 1999), 원육의 수분활성도 저하와 papain 및 포도당 첨가(Jo JH 등 1998), 살균 고춧가루 첨가(Lee HS 등 2000) 등에 관한 연구가 보고되었다. 멸치젓은 식염 대체제로 에틸알코올, 젖산과 솔비톨 첨가(Cha YJ 등 1983b), NaCl를 KCl로 대체(Cha YJ & Lee EH 1985)한 연구가 있으며, 그 외에 에틸알코올, 젖산과 솔비톨을 첨가한 정어리젓(Cha YJ 등 1983a), 숙성직전 감마선을 조사한 저염 새우젓의 품질에 대한 연구(Ahn HJ 등 2000), 식염의 양을 감소시켜 제조한 저염명란젓(Han JS 등 2005) 등의 연구가 보고되었다. 조개젓갈의 경우에도 구연산으로 식염을 대체한 저염 조개젓갈 가공에 관한 연구(You BJ & Chang MH 1992)가 보고되었다. 이러한 연구들은 대부분 제조된 저염젓갈의 품질특성에 관한 연구로 첨가된 부재료에 의한 젓갈의 생리활성에 대한 영향을 연구한 결과는 매우 드물다. 저염젓갈의 경우, 첨가된 부재료에 의해 생리활성이 증가할 것으로 기대되며, 이에 대한 연구가 필요하다고 판단된다.
젓갈은 식염을 첨가한 젓과 식염 외에 고춧가루, 곡류 등을 추가로 첨가한 식해로 크게 구분할 수 있다(Suh HK 1987; Kim YM 1996; Song HS & Kim SH 2017). 젓갈 중 젓은 단백질, 펩타이드 등이 자가소화나 미생물 분비 효소의 작용으로 분해되어 숙성되고, 식해는 제조과정에서 탄수화물의 발효로 발생된 젖산에 의해 부패가 방지되는 차이점을 가진다(Suh HK 1987; Kim YM 1996; Lee KH 등 1999). 식해는 전통적으로 쌀밥이나 밀가루를 첨가한 우럭식해, 가자미식해, 전어식해 등 다양한 식해가 제조되고 있는 것으로 보고되었고, 젓 중에도 소금과 곡류를 첨가하여 제조한 토하젓, 어리굴젓 등이 보고되고 있으나, 그 종류가 제한적이다(Suh HK 1987).
본 연구는 식해 제조 시 첨가한 곡류의 발효에 의해 생성된 젖산으로 인해 부패가 억제되고, 저장성이 증가하는 원리(Kim YM 1996)를 응용하여 조개염장제품을 제조하였고, 소금과 곡류를 넣은 경우 젓으로 명명하는 분류기준(Suh HK 1987)에 따라 조개젓으로 구분하였다. 이에 따라 저염젓의 생산을 위해 소금의 양을 줄이고 보존성을 높이기 위해 대체제로 곡류 중 쉽게 구입할 수 있는 밀가루를 첨가하여 저염 조개젓을 제조하였다. 저염 젓갈은 염도의 감소로 건강에 유익한 영향을 가지며, 동시에 항산화 활성과 같은 생리활성이 개선되어 유익한 효과가 증대된 제품을 공급하게 될 것으로 기대된다. 따라서 본 연구는 저염 젓갈 제조 시 곡류의 첨가에 따른 젓갈의 항산화 활성의 변화를 조사하였다.
재료 및 방법
1. 조개젓의 제조
조개젓의 재료인 바지락, 천일염, 밀가루(중력분)는 광주 재래시장에서 구입하여 사용하였다. 조개젓의 제조는 일반적인 젓갈의 제조과정을 따라(Ko YA 등 2017) 바지락은 껍질과 이물질을 제거하고, 염도 3% 소금물에서 세척 후 물기를 빼고 사용하였다. 소금의 양은 예비실험을 통해 염도 5% 정도를 유지할 수 있도록 밀가루를 첨가하지 않은 대조구는 바지락의 12.5%를 첨가하였는데, 소금물에 세척한 바지락 320 g과 소금 40 g을 켜켜이 쌓아 제조하였다. 실험구인 밀가루첨가군에서 소금을 대체할 밀가루풀은 밀가루와 물을 3:2의 비율로 섞어 풀이 형성되도록 약한 불에 가열하여 준비하였다. 첨가군은 첨가되는 소금의 반량과 밀가루풀을 섞어 주고 소금물에 세척한 바지락을 약하게 버무려 바지락이 으깨지지 않게 하면서 섞어준 뒤 남은 소금을 켜켜이 쌓아 제조한 후 저염젓갈의 특성상 저온발효를 위해 10℃에서 2주간 발효하였다. 밀가루 함량에 따른 차이를 알아보기 위하여 밀가루풀 10 g과 20 g을 각각 첨가한 2가지의 실험구를 준비하였다(Table 1). 발효 후 조개젓을 막자사발로 간 후에 거즈로 짠 여과액은 원심분리(MF300, Hanil Scientific Inc., Gimpo, Korea) 후 상등액을 1 g/mL의 농도로 희석하여 항산화 실험의 시료로 사용하였다.
2. pH 및 염도 측정
각 조개젓의 pH는 조개젓 2 g과 증류수 20 mL를 혼합하여 균질화한 후 pH meter(CyberScan pH 510, EUTECH, Singapore)로 측정하였고, 염도는 염도측정기(GMK-555N, Gwon Co., Seoul, Korea)를 이용하여 측정하였다.
3. 총 페놀 함량 측정
각 조개젓의 총 페놀 함량은 Folin-Ciocalteu 방법을 변형하여 측정하였다(Kim HJ 등 2015). 2% Na2CO3 용액 20 mL를 조개젓 여과액 0.2 mL와 섞어 충분히 혼합하고, 2분 후 50% Folin-Ciocalteu's 시약 0.2 mL를 가하여 다시 혼합하고, 상온에서 30분 방치한 후 750 nm에서 흡광도(T60UV-Visible Spectrophotometer, PG instrument Limited, Leicestershire, UK)를 측정하였다. Quercetin을 표준물질로 사용하여 μg Quercetin Equivalent(QE)/g으로 표시하였다.
4. 총 플라보노이드 함량 측정
총 플라보노이드 함량은 조개젓 여과액 0.2 mL에 diethylene glycol 2 mL, 1 N NaOH 0.2 mL를 첨가하여 37℃의 water bath(B-491, Buchi labortechnik AG, Switzerland)에서 1시간 반응시킨 후, 420 nm의 흡광도에서 측정하였다. 표준물질로 quercetin을 사용하여 mg QE/g으로 나타내었다(NFRI 1990).
5. DPPH Radical 소거 활성
Blois MS(1958)의 방법을 변형한 2,2-diphenyl-1-picrylhydrazyl(DPPH) radical 소거활성법을 이용하였다. 조개젓 여과액 0.5 mL에 0.4 mM DPPH 용액 5 mL를 가하여 30분간 암실에 방치한 다음 517 nm에서 흡광도를 측정하였다. Trolox((±)-6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid, TEAC)를 표준 물질로 사용하여 μg Trolox Equivalent Antioxidant Capacity(TEAC)/g으로 표시하였다.
6. ABTS Radical 소거 활성
2,2-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) radical 소거 활성의 측정은 Fellegrini N 등(1999)의 방법에 의해 측정하였다. 7 mM ABTS와 140 mM potassium persulfate를 16시간 동안 암소에 방치하여 ABTS 양이온을 형성시킨 후, 734 nm에서 흡광도 값이 0.7±0.002가 되도록 조절하여 ABTS solution을 조제하였다. 조개젓 여과액 150 μL와 ABTS solution 3 mL를 30초 동안 섞은 후 2.5분간 incubation 하여 734 nm에서 흡광도를 측정하였다. Trolox를 표준물질로 사용하여 μg TEAC/g으로 표시하였다.
7. 환원력 측정
환원력은 Oyaizu M(1986)의 방법을 변형하여 측정하였다. 조개젓 여과액 100 μL에 0.2 M sodium phosphate buffer(pH 6.6) 500 μL, 1% potassium ferricyanide 50 μL를 각각 혼합하여 50℃에서 20분 동안 반응시킨 후 10% trichloroacetic acid 2.5 mL를 가하였다. 위 반응액을 650 rpm에서 10분간 원심분리하여 상층액 500 μL에 증류수 500 μL, 1% ferric chloride 100 μL를 가하여 혼합한 후 반응액의 흡광도 값을 700 nm에서 측정하였다. Trolox를 표준물질로 사용하여 μg Trolox Equivalent Reducing Power(TERP)/g으로 표시하였다.
8. 통계처리
모든 실험 결과는 3회 이상 반복하여 그 값을 평균±표준편차로 표시하였으며, SPSS 18.0(SPSS Inc., Chicago, IL, USA)을 이용하여 p<0.05 수준에서 Duncan’s multiple range test로 차이를 검증하였다.
결과 및 고찰
1. pH 및 염도
본 연구는 소금의 양을 줄이고 밀가루풀의 첨가량에 따라 0 g(FCW0), 10 g(FCW10), 20 g(FCW20), 세 가지의 조개젓을 제조하여 pH와 염도를 분석하였고, 그 결과는 Table 2와 같다. 조개젓의 일반성분 함량은 수분 76.5%, 단백질 8.5%, 지질 1.0%, 회분 12.5%, 탄수화물 1.5%인데(RDA 2012), 본 연구에서 제조된 조개젓은 밀가루 첨가에 따라 탄수화물의 양이 증가하였을 것으로 사료된다.
밀가루의 첨가량 변화에 따른 유의적인 차이 없이 pH는 5.52±0.03∼5.54±0.02였다. 산이나 염을 첨가하여 초기 pH를 달리하여 명란젓을 보관하며 품질특성을 알아본 결과, pH가 낮은 경우 산 생성량, 아미노태 질소 생성량 등이 증가하는 등(Kim SM & Lee KT 1997) 젓갈의 pH 변화는 미생물의 생육(Kim JH 등 1999) 및 젓갈의 숙성발효(Kim YM 1996)에 영향을 미친다. 다만 본 연구에서는 조개젓의 pH가 밀가루 첨가에 따라 변하지 않으므로 pH에 의한 품질 차이는 없을 것으로 사료된다. 일반적인 조개젓의 pH는 숙성 후 5.60∼6.20 정도로 유지된다고 보고되었는데(You BJ & Chang MH 1992), 본 연구도 비슷한 결과를 보였다. 고춧가루를 첨가한 조개젓의 경우 pH가 4.96이라고 보고하여(Lee KH 등 1999) 부재료의 특성에 따라 pH가 영향을 받을 수 있으나, 밀가루 풀의 첨가는 pH에 영향을 미치지 않은 것으로 판단된다. 명란젓의 경우, 10℃에서 저장하면서 pH의 변화를 측정한 결과, 초기 pH 6.5, 5일째 6.2, 20일경 다시 6.5로 상승하였다(Kim SM & Lee KT 1997). 재료에 따라 pH 변화는 다를 것이라 예상되나, 저장기간에 따른 pH 변화는 크지 않을 것임을 예상할 수 있다.
조개젓의 염도는 대조구가 4.80±0.17%, FCW10이 4.10±0.26%, FCW20이 3.20±0.17%로 밀가루 첨가량이 증가함에 따라 유의적으로 감소하였다(p<0.05). 조개젓의 경우, 일반적으로 15∼20%의 염도를 갖는 제품이 생산되고 있으나, 저염젓갈을 생산하는 경향이 강해지면서 다양한 방법과 소재로 5∼8% 수준의 염도를 가지는 젓갈이 생산되고 있다(Kim YM 2008). 본 연구는 예비실험을 통해 대조구에서 5% 정도의 염도를 나타내는 소금의 양을 첨가하였다. 실험구의 경우, 소금을 대체하여 밀가루를 첨가하였기 때문에 염도가 감소하는 경향을 나타내었다.
2. 총 페놀 및 총 플라보노이드 함량
밀가루를 첨가한 조개젓의 항산화 활성을 조사하기 위하여 항산화 성분으로 알려진 총 페놀 함량과 총 플라보노이드 함량을 분석하여 Fig. 1 및 Fig. 2에 각각 나타내었다. 총 페놀의 함량은 밀가루 무첨가군이 743.37±123.00 μg QE/g으로 가장 높게 나타났으며, 10% 첨가군에서 642.78±43.38 μg QE/g으로 통계적으로 유의적인 차이는 없었다(p<0.05). 밀에는 ferulic acid, catechin, epigallocatechin gallate, luteolin과 같은 페놀 화합물이 존재하며(Donkor ON 등 2012), 조개류의 항산화 성분은 carotenoid, 타우린, n3-불포화지방산 등이며(Luan HM 등 2011; Lee DS 등 2017), 단백질 가수분해물 및 티로신과 같은 페놀구조를 가진 아미노산을 포함하고 있다(Luan HM 등 2011; Nazeer RA 등 2013). 지방산 및 페놀구조를 가진 화합물은 본 연구에서 사용된 Folin-Ciocalteu 방법에 의한 총페놀 정량에서 결과에 영향을 미치는 성분이다(Prior RL 등 2005; Harju AM & Venäläinen M 2006). 따라서 조개류의 지방산이나 티로신과 같은 성분들이 Folin-Ciocalteu 방법에 의한 총페놀 정량에 영향을 미친 것으로 사료된다.
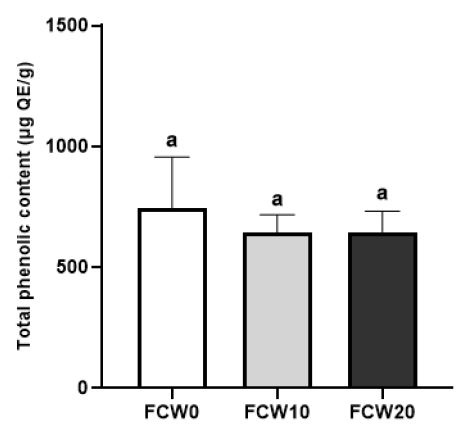
Total phenolic content of fermented clam with wheat flour at 10℃ for 2 weeks.FCW0(Control): fermented clam with wheat flour paste 0 g, FCW10: fermented clam with wheat flour paste 10 g, FCW20: fermented clam with wheat flour paste 20 g, Values with a same letter are not significantly different by Duncan’s multiple range test (p<0.05).
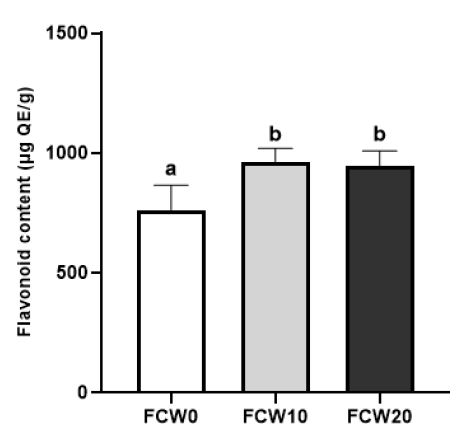
Flavonoid content of fermented clam with wheat flour at 10℃ for 2 weeks.FCW0(Control): fermented clam with wheat flour paste 0 g, FCW10: fermented clam with wheat flour paste 10 g, FCW20: fermented clam with wheat flour paste 20 g, Values with a same letter are not significantly different by Duncan’s multiple range test (p<0.05).
총 플라보노이드 함량의 경우, FCW10이 964.55±44.13 μg QE/g, FCW20이 945.06±51.86 μg QE/g으로 762.93±83.98 μg QE/g인 대조구에 비해 유의적으로 높았다(p<0.05). 총 페놀의 경우, 밀가루 무첨가군과 첨가군 사이에 유의적 차이가 없었으나, 총 플라보노이드의 경우 밀가루 첨가군은 대조군에 비해 높게 나타났는데, 밀가루풀의 제조를 위해 가열하는 과정에서 폴리페놀 성분이 분해되고, 비수용성 폴리페놀 성분은 플라보노이드로 전환되어(Lee YK 등 2012) 밀가루 첨가 전후의 페놀성분은 유의적인 차이가 없었으나, 플라보노이드 함량은 밀가루 첨가 후 증가한 것으로 사료된다.
3. DPPH 및 ABTS 라디칼 소거 활성
밀가루를 첨가한 조개젓의 라디칼 소거 활성은 DPPH 방법과 ABTS 방법의 2가지로 측정하였고, 그 결과를 Fig. 3 및 Fig. 4에 각각 나타내었다. DPPH 라디칼 소거 활성은 FCW20이 72.35±0.54 μg TEAC/g으로 가장 높게 나타났으며, FCW10이 64.85±3.34 μg TEAC/g으로 가장 낮게 나타났으나, 68.49±1.13 μg TEAC/g을 나타낸 대조군과 유의적인 차이는 없었다(p<0.05). 이러한 결과는 비록 10% 첨가는 유의적인 차이를 나타내지 않았으나, 20% 첨가 시 소거능이 증가하였으므로 밀가루 첨가 시 항산화 효과의 증가가 나타날 수 있음을 보여준다. ABTS 방법에 의한 라디칼 소거 활성은 대조군이 235.25±7.67 μg TEAC/g으로 가장 높게 나타났으며, FCW10이 88.44±11.48 μg TEAC/g으로 가장 낮게 나타났고, FCW20은 FCW10에 비해 증가하여 밀가루 첨가량 증가에 따라 DPPH와 마찬가지로 라디칼 소거능이 유의적으로 증가하였다(p<0.05). 조개의 메탄올 추출물에서 DPPH 라디칼 소거능이 보고되었으며(Pawar RT & Nagvenkar SS 2013), 젖산균과 효모로 발효한 밀을 처리한 세포에서 항산화 효과를 가진 글루타치온의 농도가 증가하고, 지질 산화를 억제하는 항산화 효과가 나타났다고 보고되어(La Marca M 등 2013) 비록 기작은 다르지만 밀이 발효 후에도 항산화효과를 나타낸 본 연구결과와 일치한다.
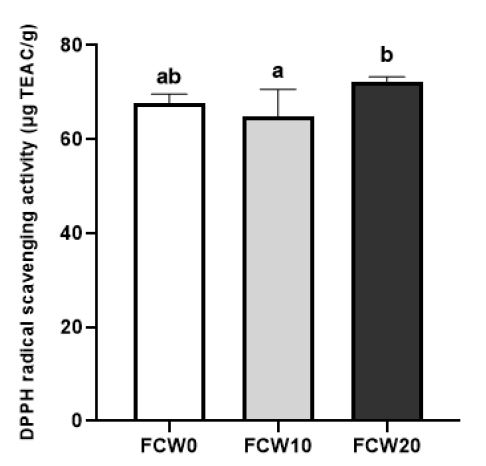
DPPH radical scavenging activity of fermented clam with wheat flour at 10℃ for 2 weeks.FCW0(Control): fermented clam with wheat flour paste 0 g, FCW10: fermented clam with wheat flour paste 10 g, FCW20: fermented clam with wheat flour paste 20 g, Values with a same letter are not significantly different by Duncan’s multiple range test (p<0.05).
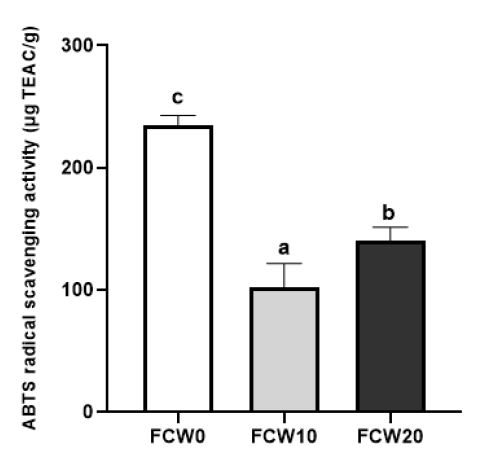
ABTS radical scavenging activity of fermented clam with wheat flour at 10℃ for 2 weeks.FCW0(Control): fermented clam with wheat flour paste 0 g, FCW10: fermented clam with wheat flour paste 10 g, FCW20: fermented clam with wheat flour paste 20 g, Values a the same letter are not significantly different by Duncan’s multiple range test (p<0.05).
DPPH 방법과 ABTS 방법은 항산화물질이 라디칼을 제거하는 기작을 기반으로 항산화활성을 측정한다는 점에서는 같으나, DPPH 방법의 경우 2,2-diphenyl-1-picrylhydrazyl 라디칼이 수소 및 전자를 제공받으면 환원되는 수소-공여 항산화 기작에 기반을 두고 있으나, ABTS 방법은 수소-공여 항산화 기작뿐만 아니라, 연쇄-절단형 기작을 동시에 측정하는 방법으로 차이가 있으며(Blois MS 1958; Kwak JH 등 2010; Lee SH 2015), DPPH는 주로 소수성 화합물의 라디칼 소거능을 측정하는 반면, ABTS는 친수성과 소수성 화합물 동시에 소거능을 측정한다고 보고되었다(Kim JB 등 2014). 따라서 두 가지의 라디칼 소거 활성 측정법에 따라 다른 항산화 활성의 경향을 나타난 결과들이 보고되었다(Park JS & Han I 2015). 본 연구에서도 DPPH에 의한 라디칼 소거 활성과 ABTS 방법에 의한 라디칼 소거 활성의 결과가 다른 경향을 나타내었다. Kim JB 등(2014)은 피조개를 다양한 용매를 추출하여 DPPH 및 ABTS 라디칼 소거능을 검사한 결과, 대체로 ABTS 라디칼 소거능이 더 크게 나타났고, 용매에 따라 다른 양상을 나타내었다고 보고하였으며, Joy M & Chakraborty K(2017)는 조개류에서 발견된 항산화물질인 2가지의 C18과 C21 meroterpeno 2H-pyranoid들의 라디칼 소거능을 비교한 결과, 2가지 모두 ABTS 라디칼 소거능이 DPPH 라디칼 소거능보다 높다고 보고하여 본 연구에서 조개젓갈의 ABTS 라디칼 소거능이 DPPH보다 높게 나타난 결과와 일치한다. 이러한 결과에 따라 조개의 항산화 성분들은 연쇄-절단형 기작에 의한 라디칼 소거능이 강하고, 소수성 화합물과 함께 친수성인 항산화물질이 존재한다고 사료된다.
4. 환원력
환원력은 항산화 기작의 하나로 ferric(Fe3+) 복합체를 ferrous(Fe2+) 형태로 환원시키는 능력을 측정한다(Nam SH 등 2003). 밀가루를 첨가한 조개젓의 환원력은 Fig. 5에 나타내었다. FCW10의 환원력이 59.90±0.04 μg TERP/g으로 가장 높게 나타났으며, 대조군이 54.94±0.02 μg TERP/g으로 가장 낮게 나타났다(p<0.05). 조개의 환원력에 대한 선행 연구로는 피조개 추출물의 농도 증가에 따라 환원력이 증가한다는 보고가 있었으며(Kim JB 등 2014), 밀에서도 헥산, 클로로포름, 메탄올 등 다양한 추출 용매를 적용하여 환원력을 측정하였는데, 비록 추출 용매에 따라 환원력의 차이는 있었으나 밀이 환원력을 나타낸다고 보고되었다(Pavikumar P 등 2015). 이러한 보고에 따르면 조개와 밀은 환원력을 가지고 있으며, 발효과정에서 변화가 있을 것으로 사료된다. 본 연구 결과에 따라 발효된 조개도 환원력을 가지며, 밀가루 첨가에 의해 증가함을 알 수 있었다. 다만 밀가루 증가량에 따라 환원력은 감소하여 이에 대한 설명을 위해서는 발효 중 밀가루의 환원력 변화에 대한 추가 연구가 필요할 것으로 보인다.
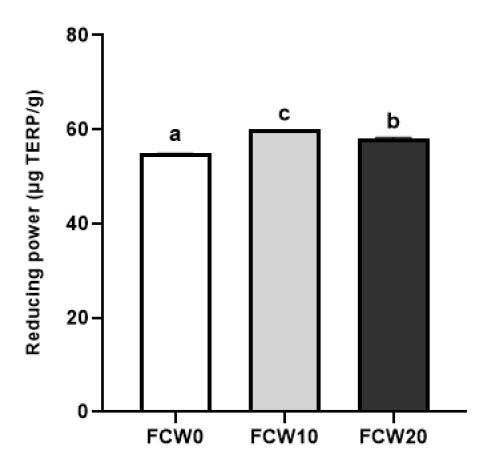
Reducing power of fermented clam with wheat flour at 10℃ for 2 weeks.FCW0(Control): fermented clam with wheat flour paste 0 g, FCW10: fermented clam with wheat flour paste 10 g, FCW20: fermented clam with wheat flour paste 20 g, Values with a same letter are not significantly different by Duncan’s multiple range test (p<0.05).
요 약
소비자들의 건강에 대한 관심 증가와 젓갈에 첨가되는 식염이 심장질환, 간질환, 당뇨병 등 만성질환에 유해한 효과를 미친다는 사실이 알려지면서 저염 젓갈의 생산에 대한 요구가 증가되고 있다. 이에 따라 본 연구에서는 식해에 첨가되는 곡류가 발효과정에서 젖산을 생산하여 보존성을 높인다는 원리를 응용하여 식염을 밀가루로 대체하여 조개젓갈을 제조하였다. 그 결과, 밀가루를 첨가한 조개젓과 첨가하지 않은 조개젓 사이에 품질의 중요한 지표가 되는 pH는 변화가 없었으나, 밀가루 첨가군의 염도가 감소하였음을 알 수 있었다. 대표적인 항산화 성분인 페놀화합물의 경우 밀가루 첨가군과 무첨가군 사이에 차이가 나타나지 않았으며, 플라보노이드의 함량은 밀가루 첨가군이 높게 나타났다. DPPH 라디칼 소거 활성은 밀가루 첨가군과 무첨가군 사이에는 유의적인 차이가 없었으나, 밀가루 첨가량 증가에 따라 소거활성이 증가하였다. ABTS 라디칼 소거 활성의 경우 밀가루 무첨가군이 높게 나타나, 다른 결과들과 상반된 경향을 보였다. 환원력은 밀가루 첨가군이 무첨가군에 비해 높은 활성을 나타내었다. 결과적으로 저염조개젓에 첨가된 밀가루는 염도를 낮추고 항산화활성을 증가시키므로 다양한 어패류의 젓갈 제조에 응용 가능하며, 나트륨 함량은 감소되고 건강기능성이 강화된 젓갈의 섭취는 소비자들의 건강에 이바지할 수 있을 것이다.
References
- Ahn HJ, Lee CH, Lee KH, Kim JH, Cha BS, Byun MW (2000) Processing of low salted and fermented shrimp using gamma irradiation before optimum fermentation. Korean J Food Sci Technol 32(5): 1107-1113.
-
Blois MS (1958) Antioxidant determination by the use of a stable free radical. Nature 181: 1199-1200.
[https://doi.org/10.1038/1811199a0]

- Cha YJ, Chung SY, Ha JH, Jeong IC, Lee EH (1983a) Studies on the processing of low salt fermented sea foods. 4. changes of microflora during fermentation of low salted sardine. Bull Korean Fish Soc 16(3): 211-215.
- Cha YJ, Lee EH (1985) Studies on the processing of low salt fermented sea foods. Bull Korean Fish Soc 18(3): 206-213.
- Cha YJ, Park SH, Cho SY, Lee EH (1983b) Studies on the processing of low salt fermented sea foods. 4. processing of low salt fermented anchovy. Bull Korean Fish Soc 16(4): 363-367.
-
Deckers AG, van den Brandt PA, van Engeland M, Soetekouw PMMB, Baldewijns MMLL, Goldbohm RA, Schouten LJ (2014) Long-term dietary sodium, potassium and fluid intake; exploring potential novel risk factors for renal cell cancer in the Netherlands Cohort Study on diet and cancer. Br J Cancer 110: 797-801.
[https://doi.org/10.1038/bjc.2013.771]

-
Donkor ON, Stojanovsk L, Ginn P, Ashton J, Vasiljevic T (2012) Germinated grains-sources of bioactive compounds. Food Chem 135: 950-959.
[https://doi.org/10.1016/j.foodchem.2012.05.058]

-
Fellegrini N, Ke R, Yang M, Rice-Evans C (1999) Screening of dietary carotenoids and carotenoid-rich fruit extract for antioxidant activities applying 2,2'-azinobis (3-ethylenbenzothiazoline-6-sulfonic acid) radical cation decolorization assay. Method Enzymol 299: 379-389.
[https://doi.org/10.1016/S0076-6879(99)99037-7]

- Han JS, Cho HR, Cho HS (2005) Study for the establishment of the quality index of low-salted Myungran-jeot. Korean J Food Cookery Sci 21(4): 440-446.
-
Harju AM, Venäläinen M (2006) Measuring the decay resistance of Scots pine heartwood indirectly by the Folin– Ciocalteu assay. Can J For Res 36: 1797-1804.
[https://doi.org/10.1139/x06-074]

-
Huh JH, Lee KJ, Lim JS, Lee MY, Park HJ, Kim MY, Kim JW, Chung CH, Shin JY, Kim HS, Kwon SO, Baik SK (2015) High dietary sodium intake assessed by estimated 24-h urinary sodium excretion is associated with NAFLD and hepatic fibrosis. PLoS ONE 10(11): e0143222.
[https://doi.org/10.1371/journal.pone.0143222]

- Jo JH, Oh SW, Kim YM, Chung DH (1998) Conditions of water activity of raw material and adding levels of papain and glucose for processing fermented squid with low salt concentrations. Korean J Food Sci Technol 30(1): 62-68.
-
Joy M, Chakraborty K (2017) First report of two new antioxidative meroterpeno 2H-pyranoids from short-necked yellow-foot clam Paphia malabarica (family:Veneridae) with bioactivity against pro-inflammatory cyclooxygenases and lipoxygenase. Natural Product Res 31(6): 615-625.
[https://doi.org/10.1080/14786419.2016.1209670]

- Kim DH, Kim JH, Yook HS, Ahn HJ, Kim JO, Sohn CB, Byun MW (1999) Microbiological characteristics of gamma irradiated and low-salted fermented squid. Korean J Food Sci Technol 31(6): 1619-1627.
-
Kim HJ, Park BG, Han I (2015) Effect of drying and extraction methods on antioxidant activity of Gnaphalium affine D. DON. J Korean Soc Food Sci Nutr 44(5): 695-701.
[https://doi.org/10.3746/jkfn.2015.44.5.695]

-
Kim JB, Kim JM, Lee YM, Baek IS, Lee SC (2014) Antioxidant activity and acetylcholinesterase inhibitory activity of ark shell (Scapharca broughtonii). Korean J Food Cook Sci 30(2): 212-218.
[https://doi.org/10.9724/kfcs.2014.30.2.212]

- Kim JH, Lee KH, Ahn HJ, Cha BS, Byun MW (1999) Effects of gamma irradiation on microbiological and sensory qualities in processing of low salted and fermented squid. Korean J Food Sci Technol 31(4): 1050-1056.
- Kim SM, Lee KT (1997) The shelf-life extension of low-salted myungran-jeot 1. Ethe effects of pH control on the shel-flife of low-salted myungran-jeot. J Korean Fish Soc 30(3): 459-465.
- Kim YM (1996) Processing technique and quality control of fermented seafood. Bull Food Technol 9: 65-86.
- Kim YM (2008) Present status and prospect of fermented seafood industry in Korea. Food Sci Industry 41(4): 16-33.
-
Ko YA, Kim SH, Song HS (2017) Effect of salt concentration and fermentation temperature on changes in quality index of salted and fermented anchovy during fermentation. J Food Hyg Saf 32(1): 27-34.
[https://doi.org/10.13103/JFHS.2017.32.1.27]

- KOSIS (Korean Statistical Information Service) (2019) Fishery Production Survey. http://kosis.kr, (accessed on 4. 11. 2019).
- Kwak JH, Choi GN, Park JH, Kim JH, Jeong HR, Jeong CH, Heo HJ (2010) Antioxidant and neuronal cell protective effect of purple sweet potato extract. J Agric Life Sci 44(2): 57-66.
-
La Marca M, Beffy P, Pugliese A, Longo V (2013) Fermented wheat powder induces the antioxidant and detoxifying system in primary rat Hepatocytes. PLoS ONE 8(12): e83538.
[https://doi.org/10.1371/journal.pone.0083538]

-
Lee DS, Lee SH, Jeon YJ, Cheong SH (2017) Antioxidant effects of short-neck clam (Tapes philippinarum) water extract containing taurine against AAPH-induced oxidative stress in zebrafish embryos. Adv Exp Med Biol 975(2): 1035-1046.
[https://doi.org/10.1007/978-94-024-1079-2_82]

- Lee HS, Lee WD, Koh BH, Lee MS (2000) Preparation of squid-jeotkal with pasteurized red pepper. II. Shelf-life extension of squid-jeotkal. J Food Hyg Saf 15(1): 18-24.
- Lee KH, Kim JH, Cha BS, Kim JO, Byun MW (1999) Quality evaluation of commercial salted and fermented seafoods. Korean J Food Sci Technol 31(6): 1427-1433.
- Lee SH (2015) Antioxidative and antibacterial effects of extracts from different parts of Epimedium korearum Nakai. MS Thesis Duksung Women’s University, Seoul. pp 41-44.
-
Lee YK, Lee SI, Kim JS, Yang SH, Lee IA, Kim SD, Suh JW (2012) Antioxidant activity of green tea fermented with Monascus pilosus. J Appl Biol Chem 55(1): 19-25.
[https://doi.org/10.3839/jabc.2011.054]

-
Luan HM, Wang LC, Yu H, Jin Y, Ji J (2011) Antioxidant activities and antioxidative components in the surf clam, Mactra veneriformis. Natural Product Res 25(19): 1838-1848.
[https://doi.org/10.1080/14786419.2010.530268]

- Nam SH, Jang SM, Kang MY (2003) Varietal difference in antioxidative activity of ethanolic extracts from colored rice bran. J Korean Soc Agric Chem Biotechnol 46(1): 16-22.
-
Nazeer RA, Prabha KR, Kumar NS, Ganesh RJ (2013) Isolation of antioxidant peptides from clam, Meretrix casta (Chemnitz). J Food Sci Technol 50(4): 777-783.
[https://doi.org/10.1007/s13197-011-0395-z]

-
Nerbass FB, Pecoits-Filho R, McIntyre NJ, McIntyre CW, Taal MW (2015) High sodium intake is associated with important risk factors in a large cohort of chronic kidney disease patients. Eur J Clin Nutr 69(7): 786-790.
[https://doi.org/10.1038/ejcn.2014.215]

- NFRI (1990) Manuals of Quality Characteristic Analysis for Food Quality Evaluation (2). National Food Research Institute, Skuba, Japan. p 61.
-
Ogna A, Ogna VF, Bochud M, Guessous I, Paccaud F, Burnier M, Wuerzner G (2016) Association between obesity and glomerular hyperfiltration: The confounding effect of smoking and sodium and protein intakes. Eur J Nutr 55(3): 1089-1097.
[https://doi.org/10.1007/s00394-015-0923-0]

-
Oh SW, Koo HS, Han KH, Han SY, Chin HJ (2017) Associations of sodium intake with obesity, metabolic disorder, and albuminuria according to age. PLoS ONE 12(12): e0188770.
[https://doi.org/10.1371/journal.pone.0188770]

-
Oyaizu M (1986) Studies on product of browning reactions: Antioxidative activities of products of browning reaction prepared from glucosamine. Jpn J Nutr 44: 307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Park JS, Han I (2015) Effect of extraction solvent on the physiological properties of Korean pear peel (Pyrus pyrifolia cv. Niitaka). Korean J Food Sci Technol 47(2): 254-260.
[https://doi.org/10.9721/KJFST.2015.47.2.254]

-
Pavikumar P, Shalini G, Jeyam M (2015) Wheat seedlings as food supplement to combat free radicals: An in vitro approach. Indian J Pharm Sci 77(5): 592-598.
[https://doi.org/10.4103/0250-474X.169025]

-
Pawar RT, Nagvenkar SS (2013) Protective role of edible clam Paphia malabarica (Chemnitz) against lipid peroxidation and free radicals. Turk Biyokimya Dergisi 38(2): 138-144.
[https://doi.org/10.5505/tjb.2013.69875]

-
Prior RL, Wu X, Schaich K (2005) Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. J Agric Food Chem 53(10): 4290-4302.
[https://doi.org/10.1021/jf0502698]

- RDA (Rural Development Administration) 2012. Standard Food Composition Table. 8th ed. Kyomunsa. Paju, Korea. p 368.
-
Rho J, Kim H (2013) A study on the knowledge, dietary behavior related to sodium, attitudes towards a low-salt diet of adults in the Jeonbuk area. Korean J Human Ecol 22(4): 693-705.
[https://doi.org/10.5934/kjhe.2013.22.4.693]

-
Scrivo R, Massaro L, Barbati C, Vomero M, Ceccarelli F, Spinelli FR, Riccieri V, Spagnoli A, Alessandri C, Desideri G, Conti F, Valesini G (2017) The role of dietary sodium intake on the modulation of T helper 17 cells and regulatory T cells in patients with rheumatoid arthritis and systemic lupus erythematosus. PLoS ONE 12(9): e0184449.
[https://doi.org/10.1371/journal.pone.0184449]

-
Song HS, Kim SH (2017) Effect of fermentation temperature and salt concentration on changes in quality index of salted shrimp during fermentation. J Food Hyg Saf 32(5): 355-362.
[https://doi.org/10.13103/JFHS.2017.32.5.355]

- Suh HK (1987) A study on the regional characteristics of Korean chotkal-The ways of preservation of chotkal-. Korean J Dietary Culture 2(2): 149-161.
- Suh HK, Yoon SS (1987) A study on the regional characteristics of Korean chotkal-The kinds and materials of chotkal-. Korean J Dietary Culture 2(1): 45-54.
-
Takagi Y, Kadowaki H, Kobayashi I, Ito K, Shirai M, Asai F (2017) Effects of high-sodium intake on systemic blood pressure and vascular responses in spontaneously diabetic WBN/Kob-Leprfa/fa rats. Clin Exp Pharmacol Physiol 44(2): 305-312.
[https://doi.org/10.1111/1440-1681.12700]

-
Williams JS, Williams GH, Jeunemaitre X, Hopkins PN, Conlin PR (2005) Influence of dietary sodium on the renin –angiotensin–aldosterone system and prevalence of left ventricular hypertrophy by EKG criteria. J Human Hypertension 19: 133-138.
[https://doi.org/10.1038/sj.jhh.1001784]

- Woo SJ, Cho YH, Cung Y, Park YH (2015) Knowledge, Attitude, practice and related factors about low salt diet in university students. J Korean Soc School Comm Health Edu 16(2): 89-100.
- You BJ, Chang MH (1992) Processing of low salt fermented sauce of shellfish with citric acid pretreatment. Korean J Food Sci Technol 24(6): 541-546.

