
배초향 추출물의 항산화 및 항당뇨 효과
 ; Eun Young Lee2
; Eun Young Lee2 ; Ji Yeon Lee2, 3
; Ji Yeon Lee2, 3 ; Yun Ji Lee4
; Yun Ji Lee4 ; Seung Eun Lee4
; Seung Eun Lee4 ; Kyung Hye Seo4, †
; Kyung Hye Seo4, † ; Hyung Don Kim4, †
; Hyung Don Kim4, †
Abstract
Agastache rugosa (AR) is a perennial and medicinal plant, known for its antioxidant, lipid lowering, anti-inflammatory, antibacterial and anti-viral effects. This study investigated the potential of AR as an antioxidant and digestive enzyme inhibitory agent. The antioxidative, α-amylase and α-glucosidase inhibitory activities were examined using AR extracts. Antioxidative activities were measured by in vitro DPPH and ABTS radical scavenging activties. The total phenolic and flavonoid contents of AR 70% ethanol extract were 34.51 mg GAE/g, and 14.04 mg GAE/g, respectively, which were greater than values obtained in water extract. ABTS radical-scavenging and DPPH radical-scavenging IC50 values of the AR 70% ethanol extract were 95.00 μg/mL and 631.52 μg/mL, respectively, which exhibited higher activity than the water extract. The α-amylase inhibitory activity showed 70% inhibition at 1.0 mg/mL concentration of 70% ethanol extract, whereas 35% α-glucosidase inhibitory activity was observed at 0.5 mg/mL 70% ethanol extract. Both inhibitory activities of AR 70% ethanol extract were more potent than the water extract. Taken together, our results confirm that AR 70% ethanol extract exhibits concentration-dependent antioxidant activity and antidiabetic effects. We propose that AR 70% ethanol extract has great potential to be applied as an inhibitory natural substance for digestive enzymes in functional foods.
Keywords:
Agastache rugosa, antioxidant activity, anti-diabetic inhibitory, α-amylase, α-glucosidase서 론
당뇨병은 비정상적으로 혈중 포도당 농도가 지속적으로 증가하는 대사성 질환으로 기전에 따라 1형과 2형으로 나뉜다. 제 1형 당뇨병은 자가면역에 의한 베타세포 파괴로 인슐린이 분비되지 않아서 발생하고, 제 2형 당뇨병은 췌장 베타세포의 인슐린 분비 장애로 저항성이 증가되어 발생한다(Tan SY 등 2019). 당뇨병에 의한 기능 부전과 합병증은 사회적 비용과 사망률을 높이는 심각성을 유발하며, 당뇨병 유병률은 전 세계적으로 급격히 증가하는 추세이다. 2018년 국민건강 영양조사 결과에서 우리나라의 만 30세 이상 당뇨병 유병률은 2001년 8.9%에서 2018년 12.9%로 증가하였고, 2030년에는 500만 명 이상의 당뇨병 환자가 발생할 것으로 예측되는 바 경제적 부담 증가와 함께 사회적 관심이 높아지고 있다(The Korea National Health and Nutrition Examination Survey, 2018).
당뇨병은 고혈당(hyperglycemia)을 특징으로 하며 고혈당증에 의한 산화적 스트레스의 증가는 이상지질혈증, 췌장 β-세포 기능 장애, 포도당 내성 손상 및 당뇨 합병증으로 이어지는 원인이 된다(Laybutt DR 등 2002). 고혈당증에 의한 활성산소종(reactive oxygen species, ROS)의 생성은 생체 내 항산화 방어 기전의 저하로 인한 자유라디칼 증가 및 산화적 스트레스에 의한 조직손상과 관련이 높다고 알려져 있는바, 고혈당과 항산화작용과 밀접한 관련이 있는 것으로 알려져 있다(Ola MS 등 2018). 항당뇨 효능을 나타내는 천연물 연구에서 가장 먼저 확인이 필요한 것은 항산화 활성이라고 할수 있다. 식물에서 유래된 페놀 화합물의 대표적인 플라보노이드는 여러 경로를 통해 세포 사멸을 억제하는 것으로 보고된 바(Ishige K 등 2001), 항산화 활성이 우수한 천연 물질을 탐색해 혈당을 낮추는 효과를 가지는 약용식물들에 관한 항당뇨성 기능성 식품 소재로 개발해야 할 필요성이 강조되었다(Lee JY 등 2019; Li YY 등 2019).
항당뇨 기능성 식품들의 기전에는 소화과정 중 당의 흡수를 떨어뜨려 혈당을 낮추거나 췌장 베타세포의 활성을 촉진시키는 것, 포도당 생성 억제 및 운반체(glucose transporter 4)를 자극한 혈당 조절 등이 있다(Wang SG 2011). 당뇨병의 효율적인 관리 중 하나는 소화 기관에서 탄수화물 가수 분해 효소인 α-glucosidase 및 α-amylase의 억제로 포도당의 흡수를 지연시켜 식후 혈당 상승을 억제하고, 인슐린 분비반응을 감소시키는 것이다(Hui T & Lei C 2017). 따라서 소장의 α-amylase와 α-glucosidase의 저해활성은 포도당의 흡수를 지연시킬 수 있어 혈당수치 상승억제의 지표로써 사용되며, 새로운 소재의 항당뇨 활성을 탐색하는데 많이 활용된다. 한국인의 경우, 탄수화물 섭취 비율이 높아 α-amylase 및 α-glucosidase 등의 소화효소 활성 억제는 혈당 수준의 증가를 상당히 감소시킬 수 있어 II 형 당뇨병과 관련된 고혈당증의 관리에 필수 전략으로 여겨진다. 다양한 혈당강하제 중 α-glucosidase 억제제인 acarbose, voglibose 등은 소장에서 탄수화물의 분해를 지연시킴으로써 식후 혈중 당 농도의 급격한 상승을 막을 수 있다(Yoo HJ 2012). 그러나 당뇨병의 치료와 관련된 경구 투여 약물들은 부작용들이 보고되고 있어(Lee HW 2008), 인체 내 부작용을 줄이고 항당뇨 효과를 가지는 천연물 치료제 개발에 대한 많은 연구가 절실히 필요하다(Salimifar M 등 2013). 당뇨병 예방을 위한 이러한 시대적 요구는 천연물에 대한 기대로 이어져 천연소재의 항당뇨 기전에 대한 연구가 증가하고 있으며, 부작용을 최소화하고 인슐린 저항성을 개선시킬 수 있는 천연물 소재 개발에 대한 연구에 집중되어지고 있다.
배초향(Agastache rugosa, AR)은 꿀풀과의 다년생 초본으로 22종이 보고 되었으며, 최근 배초향 추출물(Agatri® 코스맥스엔비티(주), 제2020-5호)이 건강기능식품 기능성 원료로 등록되었다(Ministry of Food and Drug Safety, 2020). 한의학에서는 식욕 부진, 오심, 구토, 장관질환 치료를 위한 약초 요법으로 사용되어 왔다(Li YY 등 2019). 선행 연구들에 따르면 배초향(AR)은 항산화 효능을 가지고 있어 간염, 소화기 질환, 항염증 작용에 효과(Kim KS 등 2001)가 있으며, 항암(Jun HJ 등 2010), 항균(Song JH 등 2001), 항진균(Shin S & Kang CA 2003) 및 항바이러스 활성(Min BS 등 1999)을 포함하여 다양한 약리학적 및 생리학적 특성을 가지고 있다. 지금까지 알려진 배초향(AR) 성분들이 항산화 활성과 산화관련 질환의 생리학적인 유용성이 우수한 것으로 밝혀졌으나, 아직 항당뇨 활성에 대한 구체적인 연구결과는 전무하다. 따라서 본 연구에서는 배초향 추출물의 총 폴리페놀 함량을 측정한 후 in vitro 항산화 활성을 평가하고, 탄수화물 소화효소인 α-amylase, α-glucosidase 저해 활성 평가를 통한 혈당상승 억제력을 확인하여 배초향의 항당뇨 기능성 소재로의 이용 가능성을 제시하고자 한다.
재료 및 방법
1. 배초향 추출물 제조
실험에 사용된 배초향 시료는 2018년 충북 음성군 인삼특작부 포장에서 수확한 것으로 지상부를 동결건조기(PVTFD 50R, Ilshin Bio, Seoul, Korea)에서 건조하여 분말화 하였다. 추출을 위해 건조된 배초향 지상부 100 g을 시료와 용매비율을 1:10으로 하여 70% 에탄올과 물로 실온에서 24시간 동안 교반 추출기(Orbital shaker SH30, FINEPCR, Gunpo, Korea)로 3회 추출하였다. 추출용액은 여과해서 농축하고 용매를 제거한 후 동결 건조하였다. 추출물은 100 mg/mL의 농도로 DMSO(Sigma-Aldrich, St. Louis, MO, USA)에 녹여 희석하여 실험에 사용하였다.
2. 총 페놀(TPC)과 플라보노이드(TFC) 함량 측정
총 페놀(total phenolic compounds) 측정법은 Folin-Dennis법(Folin O & Denis W 1912)에 따라 분석하였다. 추출물 500 μL(100 mg/mL)를 2 N Folin-Ciocalteu 시약 50 μL와 3 분간 혼합하였고 20% 탄산나트륨 용액 100 μL를 넣었다. 1 시간 후, 흡광도는 multi-plate reader(Biotek, Winooski, Vermont, USA)를 사용하여 725 nm에서 측정하였다. 총 플라보노이드(total flavonoid compounds)는 Pourmorad F 등(2006)의 방법을 약간 수정하여 진행하였다. 각 추출물(100 μg/mL) 150 μL를 10% 알루미늄 염화물 용액 10 μL, 1 M 아세트산 칼륨용액 10 μL 및 증류수 280 μL와 혼합하였다. 혼합물을 실온에서 30분 동안 반응시킨 후 multi-plate reader를 사용하여 415 nm에서 측정하였다. 배초향 추출물의 총 페놀 함량은 garllic acid의 용량(mg GAE/g)으로 총 플라보노이드 함량은 catechine acid의 용량(mg CAE/g)으로 표시하였다.
3. HPLC에 의한 항산화 물질 분석
추출물을 물에 용해시키고, 에틸 아세테이트 / 에테르(1:1=v/v)로 분배하여 페놀이 풍부한 분획을 얻었다. 각 분획을 감압 농축기(Rotavapor® R-300, Büchi Labortechnik, New castle, USA)로 농축시키고, 메탄올(각각 10 mg/mL)에 용해시키고, 0.22 μm PVDF membrane(Immun-Blot PVDF Membrane, Bio-Rad, Hercules, CA, USA)으로 여과하고, HPLC로 분석하였다.
산화 방지제 성분인 phenolic acids(PAs)는 PDA 검출기가 장착된 Waters HPLC(ACME 9000 system, Younglin, Anyang, Korea)로 분석하였다. 정성 및 정량 분석을 위한 화합물의 분리는 35℃에서 C-18 컬럼(INNO, 250 × 4.6 mm, 5 μL, Young Jin Biochrom, Sungnam, Korea)을 사용하는 역상 시스템을 사용하여 수행되었다. Homogenistisic acid, protocatechinic acid, gentisic acid, chlorogenic acid, caffeic acid, propionic acid, coumaric acid, ferulic acid, veratric acid, cinnamic acid, quercetin, naringin, hesperidin(Sigma-Aldrich, St. Louis, MO, USA)이 PAs 표준물질로 사용되었다. 모든 표준액은 0.22 μm PVDF membrane을 통해 여과된 메탄올을 가하여 제조하였다. 이동상은 용매 A(물 중 0.5% 아세트산) 및 용매 B(아세토니트릴 중 0.5% 아세트산)로 구성되었다. 검출기는 UV detector(280 nm)로 유속은 1.0 mL/min이며, 주입량은 10 μL로 하였다.
4. ABTS+ 라디칼 소거활성 측정
ABTS 라디칼소거활성은 Re 등(1999)의 방법을 변형하여 측정하였다. 증류수에 7.4 mM 2,2'- azino-bis(3-ethylbenzothiazoline-) 6-sulfonic acid(ABTS) 암모늄염(Sigma-Aldrich, St. Louis, MO, USA)과 2.6 mM 칼륨과 황산염을 함유한 ABTS 용액을 준비하였다. 배초향 시료 20 μL와 ABTS 용액 180 μL를 섞어 실온으로 암실에서 30 분간 배양하였다. 흡광도는 734 nm에서 multi-plate reader를 사용하여 측정하였으며, 모든 실험은 3회 반복 측정하였고, 총 항산화력은 표준물질인 L-ascorbic acid와 비교하여 산출하였다. 소거 활성은 다음 식에 따라 반-최대 억제 농도(IC50)는 50% 억제를 나타내는 샘플 농도의 ABTS+ 라디칼 소거 활성을 결정하였다.
5. DPPH 라디칼 소거 활성 측정
DPPH(1,1-diphenyl-2-picryl hydrazyl radical) 라디칼 소거 활성은 Moreno MI 등 (2010)의 방법을 약간 변형하여 사용하였다. 95% 에탄올에 DPPH 300 μM을 함유한 DPPH 용액을 제조하였다. 다음으로 시료 50 μL와 DPPH 용액 200 μL를 섞어 실온에서 알루미늄 호일로 덮어 암실에서 30분간 두었다.
흡광도는 517 nm에서 multi-plate reader를 사용하여 측정하였으며, 소거 활성은 다음 식에 따라 계산되었다. 반-최대 억제 농도(IC50)는 50% 억제를 나타내는 샘플 농도의 자유 라디칼 소거 활성을 결정하였다.
6. α-Glucosidase 및 α-Amylase의 억제 활성 측정
배초향 추출물의 소화효소 억제효과를 평가하기 위하여 α-glucosidase 및 α-amylase 활성 비색 분석 키트(Biovision K938, K482 Milpitas Blvd, Milpitas, CA, USA)를 이용하여 측정하였다. α-Glucosidase 억제 활성 측정을 위한 배초향 추출물의 농도는 0.5 mg/mL, 0.25 mg/mL, 0.125 mg/mL로 하여 각 농도 별 추출물 50 μL와 10 μL α-glucosidase를 각 well에 첨가하고, 분석 완충액을 총 부피 60 μL/well로 첨가하였다. 20 μL의 α-glucosidase 기질 혼합물을 각 well에 첨가하고, 410 nm에서 1시간 동안 흡광도를 측정하였다. α-Amylase 억제 활성은 acarbose 1,000 μg/mL를 96-well plate에 첨가하고, 배초향 추출물 농도를 1.0 mg/mL, 0.5 mg/mL, 0.25 mg/mL로 하여 각 농도별 추출물 50 μL를 각각의 well에 첨가한 후, 50 μL의 α-amylase를 넣고 빛을 차단하여 상온에 10분간 활성화시켰다. 50 μL의 기질 혼합물을 넣고, 20분간 흡광도 410 nm에서 측정하였다. 시료와 양성 대조군인 acarbose는 1,000 μg/mL의 농도로 하였다.
7. 통계 처리
모든 실험은 3회 반복하여 실시하였으며, 평균 ± 표준편차로 표기하였다. 실험결과는 SPSS package(version 21)를 사용하여 분산분석(ANOVA) 검정을 수행한 후, 유의성 검정은 Duncan’s multiple range test로 p<0.05 수준에서 실시하였다. 배초향 추출물의 항산화 활성 및 소화효소 저해활성 간의 상관관계 분석은 Pearson’ correlation coefficient로 실시하였다.
결과 및 고찰
1. 수율, 총 폴리페놀 및 총 플라보노이드 함량
식물의 2차 대사 산물인 폴리페놀계 물질 중 플라보노이드는 가장 널리 분포되어 있는 페놀화합물로 항산화, 항균, 항염증, 항 알레르기 및 항암 등 다양한 생물학적 효과를 나타내며, 자유 라디칼 소거와 산화방지 효과에서 천연 항산화제로 작용한다(Blois MS 1958). 배초향 추출물의 총 폴리페놀 및 총 플라보노이드 함량은 Table 1과 같다. 배초향(AR)에 함유되어 있는 물 추출물(ARW)과 70% 에탄올 추출물(ARE)의 총 페놀함량은 각각 12.91 mg GAE/g, 34.51 mg GAE/g으로 70% 주정 추출물(ARE)이 물 추출물(ARW)보다 3배 정도 많았다. ARW와 ARE의 플라보노이드 함량도 각각 1.06 mg CAE/g, 14.04 mg CAE/g으로 ARE이 ARW보다 14배 정도 높게 나타났다. 추출방법에 따른 배초향의 ARW와 ARE 추출수율은 각각 27%와 32%로 두 용매 간에 유의적인 차이는 없었다. 동일한 시료라도 추출조건에 따라 총 폴리페놀 함량이 차이가 난다는 보고(Choi KS & Lee HY 1999)와 유사한 결과를 보였다.
2. 배초향 추출물의 HPLC를 이용한 페놀 함량 분석
배초향 추출물의 페놀 성분은 Table 2와 같다. ARE에서 quercetin의 함량이 17.00±0.29 mg/g으로 가장 높았고, 그 다음은 ferulic acid 0.76±0.03 mg/g, ρ-coumaric acid 0.04±0.01 mg/g, caffeic acid 0.03±0.01 mg/g 순으로 나타났다. ARW에서는 Ferulic acid 0.30±0.04 mg/g, p-coumaric acid 0.17±0.03 mg/g으로 나타났으며 quercetin과 caffeic acid는 검출되지 않았다.
Quercetin과 ferulic acid는 양파껍질과 적포도주와 같은 자연 식품 및 음료에 존재하는 페놀 화합물로 다량 함유된 페놀화합물로 인하여 항산화, 항암, 항고혈압, 항염증 등 여러 생리활성이 보고되어 있다(Alshatwi AA 2010; Kim DS & Lim SB 2018). 본 연구의 HPLC 분석을 통해 ARE에서 ferulic acid, quercetin 및 caffeic acid를 확인하였고, 선행 연구의 배초향 성분 분석 보고들과 일치하였다(Sylwia Z 등 2016; Lee JJ 등 2017). 그 외의 페놀과 플라보노이드도 면역질환, 암 등의 질병 억제 효과를 가지고 있으며, free radical을 소거하는 주요 인자로 작용하여 강력한 항산화 소재로 보고되었다(Desta KT 등 2016). 선행 연구결과와 같이 배초향 추출물의 페놀 성분은 항산화 잠재성을 기반으로 다양한 질환을 예방할 수 있을 것으로 판단된다.
3. 라디칼 소거 활성
활성산소와 free radical은 인체 내에서 각종 질병과 세포의 노화를 일으키며, 세포 지질과산화와 DNA에도 손상을 준다(Hong SC 등 2009). DPPH radical 소거 활성은 페놀화합물의 항산화 활성의 지표가 되며, 식물 추출물 등에서 항산화제로 작용할 수 있는 물질을 확인할 때 이용된다(Kang YH 등 1995). 배초향 추출물의 항산화 효과를 알아보기 위하여 DPPH radical 소거 활성과 ABTS+ radical 소거 활성을 비교한 결과는 Table 3과 같다. 항산화제로 잘 알려진 ascorbic acid(AA)를 양성 대조군으로 하여 분석한 결과, 대조구인 AA의 DPPH IC50 값은 4.36 μg/mL이었으며, 배초향의 물 추출(ARW)과 70% 에탄올 추출(ARE)의 DPPH IC50 값은 각각 1,608.96 μg/mL, 631.52 μg/mL로 나타났다. Lee JY 등(2007)은 배초향의 지상부 70% 에탄올 추출에서 DPPH에 의한 free radical 소거 활성이 높게 나타나 우수한 항산화 활성을 나타내었다고 보고하였다. 본 연구결과에서도 ARE의 DPPH IC50 값이 ARW보다 항산화 활성이 2.5배 더 높게 나타났다.
ABTS+ 소거 활성을 비교한 IC50 값은 대조구인 AA가 5.9 μg/mL, ARW은 126.65 μg/mL, ARE은 94.99 μg/mL로 ARE이 ARW보다 소거 활성이 강한 것으로 나타났다. 본 연구에서 대조군으로 AA를 사용하였을 때 ARE의 항산화력이 ARW보다 2배 이상 높았는데, Kim CW 등(2015)의 모시풀잎 추출물 항산화력 평가에서 70% 에탄올 조건에서 가장 우수한 활성을 나타내었다고 하였다. Lee JY 등(2019)도 추출방법에 따른 두충 껍질 추출물의 항산화 효과를 확인한 결과 물 추출물보다 에탄올 추출물에서 페놀 및 플라보노이드 함량이 높았고, 이로 인해 에탄올 추출물은 DNA의 산화적 손상에 대한 항산화 효과가 높은 것으로 보고하였다. 본 연구에서 얻어진 결과는 배초향 추출방법에 따라 in vitro 항산화 활성과 총 페놀과 플라보노이드 함량이 현저히 차이가 난다는 Park YS(2002)의 보고와 일치하였다.
4. α-Glucosidase 및 α-Amylase 저해효과
배초향 추출물의 α-glucosidase와 α-amylase 활성저해 효과를 측정한 결과는 Fig. 1에서 보는 바와 같다. 배초향 추출물 0.5 mg/mL의 농도에서 α- glucosidase 활성저해 효과에서 대조군인 acarbose는 74%의 활성 저해를 보였으며, ARW은 28% 억제하였고, ARE은 35%의 억제 효과를 나타냈다. Shin SM 등(2012)은 죽엽 물추출물과 70% 에탄올 추출물의 α-glucosidase 활성을 측정한 결과, 70% 에탄올 추출물에서는 농도 의존적으로 저해 활성이 높아지는 경향을 보였으나, 물추출물에서는 저해 활성이 없다고 하였는데, 본 연구의 결과와 비슷한 경향이었다. Nam SM 등(2015)은 산사 추출물의 α-glucosidase 저해능은 용매의 에탄올 함량이 높을수록 커지는 경향이 나타났다고 하였다. 본 연구 결과에서도 ARE가 농도 의존적인 α-glucosidase 억제 활성을 나타내는 것으로 확인되었다.
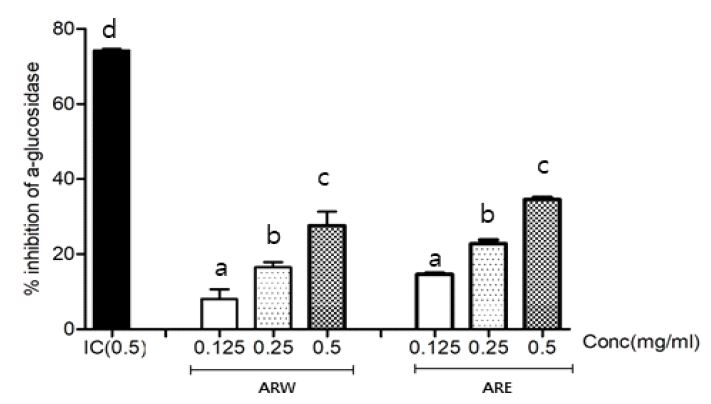
Inhibition of α-glucosidase of Agastache rugosa extracts.IC: Inhibitor control (acarbose), ARW: Water extract of Agastache rugosas, ARE: 70% ethanol extract of Agastache rugosa. α-glucosidase inhibition activity of AR extract and acarbose was measured at 0.5 mg/mL.Values are means of triplicate determinations±S.D. (n=3).a∼d Means with different letters on the same column are significantly different at p<0.05 by Duncan’s test.
Fig. 2에서 배초향 추출물 1.0 mg/mL의 농도에서 α-amylase 활성저해 효과 역시 ARW가 70% 억제효과를 보인 반면, 물추출물은 1%의 저해효과를 보였다. Lee HW(2008)는 상백피 추출물의 α-amylase 저해활성을 측정한 결과, acarbose가 66% 억제효과를 보였을 때 상백피 70% 에탄올 추출물이 61%의 α-amylase 저해활성을 보였고, 백복령 70% 에탄올 추출물도 60%의 억제효과를 보여 acarbose의 활성과 비슷한 결과로 나타나 혈당강하 물질로 활용 가능성을 보고하였다. 이는 배초향 70% 에탄올 추출물에 대한 α-amylase 저해활성 효과와 비슷한 결과로 ARE가 소화효소 저해 및 혈당저하 기능성 소재라고 판단된다.
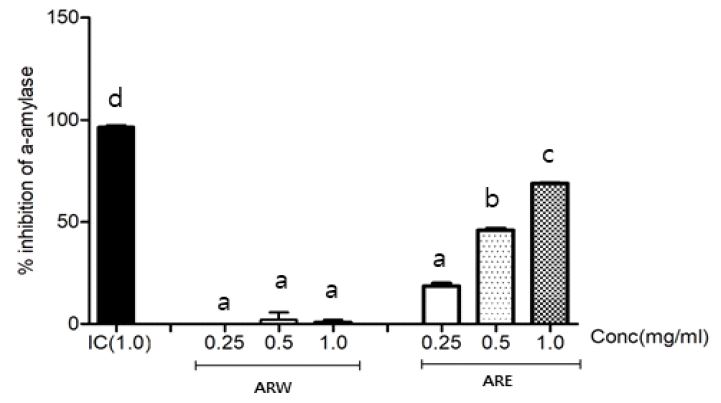
Inhibition of α-amylase of Agastache rugosa extracts.IC: Inhibitor control (acarbose), ARW: Water extract of Agastache rugosas, ARE: 70% ethanol extract of Agastache rugosa. α-amylase inhibition activity of AR extract and acarbose was measured at 1 mg/mL.Values are means of triplicate determinations±S.D. (n=3).a~d Means with different letters on the same column are significantly different at p<0.05 by Duncan’s test.
최근 항산화 작용과 당뇨병과는 밀접한 연관이 있는 것으로 보고되고 있다(Hoang A 등 2020; Reyes LM 등 2020). Lee JH & Lee SR(1994)은 페놀성 물질의 함량, 종류, 형태에 따라 효소 활성도 달라진다고 하였으며, α-glucosidase 효소억제 활성도 폴리페놀의 양과 종류에 따라 달라진다고 하였다. Agus L 등(2019)은 gallic acid, quercetin 및 rutin이 실험군의 acarbose보다 α-glucosidase를 유의하게 억제하였고, 그 중 quercetin이 가장 우수한 억제활성을 나타냈다고 하였다. Tadera K 등(2006)은 6종의 플라보노이드에서 α-amylase 억제 활성을 비교한 결과, quercetin이 강력한 억제 활성을 보였으며, Zheng Y 등(2020)과 Jeong EY 등(2012)은 ferulic acid가 α-amylase와 α-glucosidase에 대한 우수한 억제활성이 나타났다고 보고하였다. 본 연구에서도 Fig. 3에서와 같이 ARE에서 가장 많이 검출된 quercetin과 ferulic acid의 페놀성 화합물들이 α-glucosidase와 α-amylase 효소 활성 저해에 관계가 있는 것으로 판단된다. 향후 배초향 분획물을 활용한 추가적 연구 및 구체적인 성분 분석 연구를 위한 이론적 근거로 제시될 수 있을 것이다.
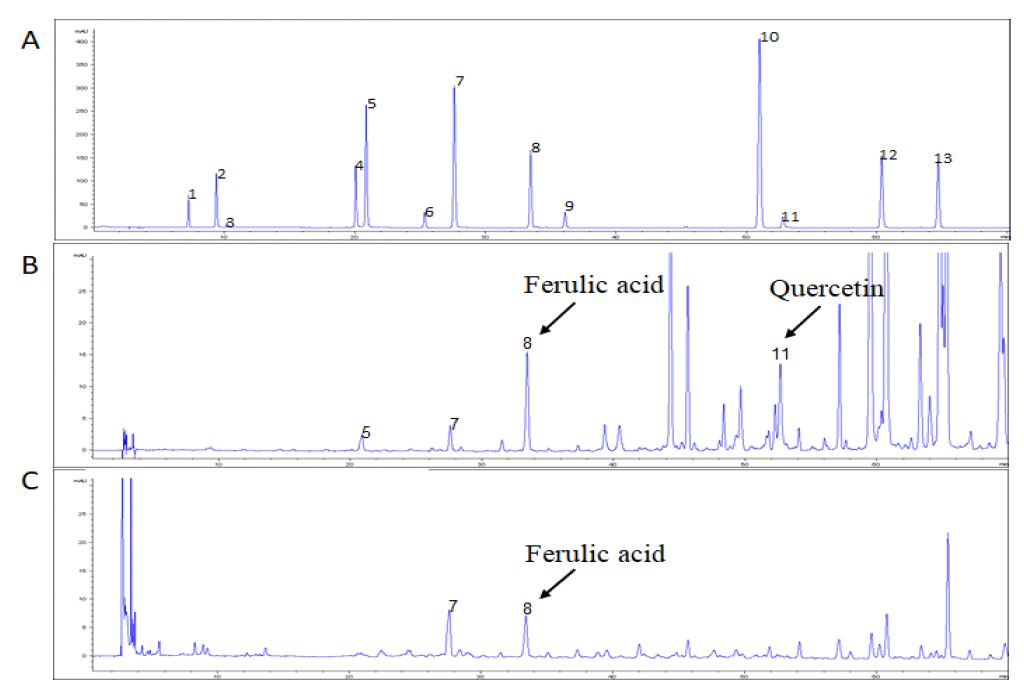
The chromatography of PAs, ARW and ARE using by HPLC analysis.PAs: Phenolic acids ARW: Water extract of Agastache rugosas, ARE: 70% ethanol extract of Agastache rugosa. Peak identification; 1: homogenistisic acid, 2: protocatechinic acid, 3: gentisic acid, 4: chlorogenic acid, 5: caffeic acid, 6: propionic acid, 7: coumaric acid, 8: ferulic acid, 9: veratric acid, 10: cinnamic acid, 11: quercetin, 12: naringin, 13: hesperidin. (A): Chromatogram of standard solutions for PAs analysis (100 μg/mL each). (B) Chromatogram of ARE (10 mg/mL). (C) Chromatogram of ARW (10 mg/mL).
5. 상관관계
배초향 추출물의 항산화 활성 및 소화효소 저해활성 간의 상관관계를 분석한 결과는 Table 4와 같이 나타났다. DPPH와 ABTS+는 IC50값으로 상관관계를 분석하였다. 먼저 α-amylase 저해 활성은 플라보노이드 함량 1.000(p<0.01), 폴리페놀 함량 0.951(p<0.01)과 높은 양의 상관관계를 나타내었다. DPPH 라디칼 소거능 —0.998 (p<0.01)과 ABTS 라디칼 소거능 —0.904(p<0.05)에서 음의 상관관계를 나타내었다.
α-Glucosidase 저해 활성은 ABTS 라디칼 소거능 —0.904(p<0.05)와 DPPH 라디칼 소거능 IC50 —0.831(p<0.05)에서 음의 상관관계를 나타내었고, 플라보노이드함량 0.851(p<0.05)과 폴리페놀 함량 0.832(p<0.05)는 양의 상관관계를 나타내었다.
DPPH 라디칼 소거능 IC50은 플라보노이드 함량 —0.999(p<0.01), 폴리페놀 함량 —0.950(p<0.01)과 높은 음의 상관관계를 나타내었다. ABTS 라디칼 소거능도 플라보노이드 함량 —0.999(p<0.01), 폴리페놀 함량 —0.950(p<0.01)과 높은 음의 상관관계를 나타내었다. 결과적으로 배초향 추출물은 항산화 활성과 소화효소 저해 활성 간에 모두 높은 상관관계를 나타냈다(p<0.01). Kenjiro T 등(2006)의 연구에서 플라보노이드 성분과 α-glucosidase 저해 활성이 상관관계가 있으며, 특히 페놀 함량과 α-amylase은 상관관계가 높게 나타나 페놀성분이 α-amylase 저해 활성에 영향을 준다고 하였다. Lee JY 등(2019)의 쑥부쟁이의 총 페놀과 플라보노이드의 함량은 항산화 활성과 서로 상관관계가 존재하였다고 하여 본 연구 결과와 일치하였으며, 이는 총 폴리페놀과 플라보노이드 함량이 항산화 활성에도 영향을 미치는 것으로 확인되었다. 배초향의 추출물에 용해되어 있는 페놀화합물 성분과 종류도 용매에 따라 달라지면서 ARW와 ARE에서 활성에 차이가 나는 것으로 판단된다. ARE가 대표적인 당뇨병치료제인 acarbose 활성의 약 70% 이상을 나타냄에 따라(Fig. 1), 총 폴리페놀과 플라보노이드 함량이 추출 방법에 따라 크게 달라지며, 그 차이가 항산화 활성에도 영향을 미치는 것으로 보인다. 또한 ARE의 페놀 화합물은 a-glucosidase와 α-amylase 소화효소에 대해 저해능이 있을 것이라고 판단되었다.
요 약
본 연구는 배초향(Agastache rugosa)의 항산화 및 항당뇨 효과를 평가하여 당뇨 조절을 위한 항산화제 및 혈당 상승 억제제로서의 가능성을 확인하고자 하였다. 배초향 추출물의 총 폴리페놀, 플라보노이드 함량과 in vitro 항산화 활성 및 소화효소 저해 활성을 조사한 결과, ARE가 ARW보다 총 페놀과 플라보노이드 함량이 높았고, 항산화 활성 및 소화효소 저해 활성도 높았다. 항당뇨 활성을 측정하는 α-glucosidase 저해활성에서는 ARW와 ARE가 큰 차이를 보이지 않았지만, α-amylase 저해활성은 큰 차이를 보였으며, ARE가 18∼70%의 α-amylase 억제 활성을 나타내었다(당뇨병 치료제 acarbose의 70%). 활성 간의 상관관계를 살펴본 결과, 추출물의 항산화활성과 탄수화물 소화효소 억제효과가 총 페놀 및 플라보노이드함량과 높은 상관성을 가지는 것으로 볼 때, ARW에 비해 상대적으로 높은 ARE의 항산화 및 소화효소 저해 활성은 페놀 화합물, 특히 플라보노이드 화합물 때문임을 알 수 있었다. 따라서 ARE는 우수한 항당뇨 기능성 소재라고 판단된다.
Acknowledgments
This work was carried out with the support of “Cooperative Research Program for Agriculture Science and Technology Development (Project No. PJ01361602)” and the RDA Fellowship Program of National Institute of Horticultural and Herbal Science, Rural Development Administration, Republic of Korea.
REFERENCES
-
Agus L, Adelina S, Adit WS, Kris HT (2019) Antioxidant, α-glucosidase inhibitory activity and molecular docking study of gallic acid, quercetin and rutin: A comparative study. Mol Cell Biomed Sci 3(2): 67-74.
[https://doi.org/10.21705/mcbs.v3i2.60]

-
Alshatwi AA (2010) Catechin hydrate suppresses MCF-7 proliferation through TP53/Caspase-mediated apoptosis. J Exp Clin Cancer Res 29(1): 167-176.
[https://doi.org/10.1186/1756-9966-29-167]

-
Blois MS (1958) Antioxidant determination by the use of a stable free radical. Nature 181(4617):1199-1200.
[https://doi.org/10.1038/1811199a0]

- Choi KS, Lee HY (1999) Characteristics of useful components in the leaves of baechohyang (Agastache rugosa O. Kuntze). J Korean Soc Food Sci Nutr 28(2): 326-32.
-
Desta KT, Kim GS, Kim YH, Lee WS, Lee SJ, Jin JS, Abd A, Shin HC, Shim JH, Shin SC (2016) The polyphenolic profiles and antioxidant effects of Agastache rugosa Kuntze (Banga) flower, leaf, stem and root. Biome Chromatogr 30(2): 225-231.
[https://doi.org/10.1002/bmc.3539]

- Folin O, Denis W (1912) On phosphotungstic-phosphomolybdic compounds as color reagents. J Biol Chem 12(2): 239-243.
-
Hoang A, Xuan TD, Dieu NT, Quan NV, Trang LT (2020) Antioxidant and a-amylase inhibitory activities and phytocompounds of clausena indica fruits. Medicines 7(3): 1-11.
[https://doi.org/10.3390/medicines7030010]

- Hong SC, Jeong JB, Park GH, Kim JS, Seo EW, Jeong HJ (2009) Anti-oxidant effect of Agastache rugosa on oxidative damage induced by H2O2 in NIH 3T3 cell. Korean J Plant Res 22(6): 498-505.
-
Hui T, Lei C (2017) α-Glucosidase and α-amylase inhibitors from seed oil: A review of liposoluble substance to treat diabetes. Crit Rev Food Sci Nutr 57(16): 3438-3448.
[https://doi.org/10.1080/10408398.2015.1129309]

-
Ishige K, Schubert D, Sagara Y (2001) Flavonoids protect neuronal cells from oxidative stress by three distinct mechanisms. Free Radic Biol Med 30(4): 433-446.
[https://doi.org/10.1016/S0891-5849(00)00498-6]

-
Jeong EY, Cho KS, Lee HS (2012) α-Amylase and α-glucosidase inhibitors isolated from Triticum aestivum L. sprouts. J Korean Soc Appl Biol Chem 55(1): 47-51.
[https://doi.org/10.1007/s13765-012-0008-1]

-
Jun HJ, Chung MJ, Kevin D, Raymond L. R, Houng SJ, Cho SY, Jeun JG, Kim JY, Kim KH, Park KW, Kim CT, Lee SJ (2010) Nutrigenomic analysis of hypolipidemic effects of Agastache rugosa essential oils in HepG2 cells and C57BL/6 mice. Food Sci Biotechnol 19(1): 219-227.
[https://doi.org/10.1007/s10068-010-0030-1]

- Kang YH, Park YK, Oh SR, Mood KD (1995) Studies on the physiological functionality of pineneedle and mugwort extracts. Korean J Food Sci Technol 27(6): 978-984.
-
Kenjiro T, Yuji M, Kouta T, Tomoko M (2006) Inhibition of α-glucosidase and α-amylase by flavonoids. J Nutr Sci Vitaminol 52(2): 149-153.
[https://doi.org/10.3177/jnsv.52.149]

-
Kim CW, In MJ, Kim DC (2015) In vitro antioxidant activity of ethanol extract from Boehmeria nivea L. leaves. Food Eng Prog 19(1): 76-81.
[https://doi.org/10.13050/foodengprog.2015.19.1.76]

-
Kim DS, Lim SB (2018) Composition of phenolic compounds and antioxidant activities of subcritical water extracts of onion skin. J Korean Soc Food Sci Nutr 47(4): 403-413.
[https://doi.org/10.3746/jkfn.2018.47.4.403]

- Kim KS, Kim SK, Kim YH, Kim YH, LEE JC (2001) Comparison of essential oil composition extracted from Agastache rugosa by steam distillation and supercritical fluid extraction. J Korean Soc Tobacco Sci 23(1): 65-70.
-
Laybutt DR, Kaneto H, Hasenkamp W, Grey S, Jonas JC, Sgroi DC, Groff A, Ferran C, Bonner-Weir S, Sharma A, Weir GC (2002) Increased expression of antioxidant and antiapoptic genes in is lets that may contribute to β-cell survival during chronic hyperglycemia. Diabetes 51(2): 413-456.
[https://doi.org/10.2337/diabetes.51.2.413]

-
Lee HW (2008) DPP-4 inhibitors and the relations between rosiglitazone and the risk of myocardial infarction. J Korean Med Assoc 51(4): 371-337.
[https://doi.org/10.5124/jkma.2008.51.4.371]

- Lee JH, Lee SR (1994) Some physiological activity of phenolic substances in plant foods. Korean J Food Sci Technol 26(3): 317-323.
-
Lee JJ, Lee JH, Gu MJ, Han JH, Cho WK, Ma JY (2017) Agastache rugosa Kuntze extract, containing the active component rosmarinic acid, prevents astherosclerosis through up-regulation of the cyclin-dependent kinase inhibitors p21WAF1/CIP1 and p27KIP1. J Funct Foods 30(6): 30-38.
[https://doi.org/10.1016/j.jff.2016.12.025]

- Lee JY, Kang JR, Whang WK. (2007) Antioxidant activity of MeOH extract of aerial part from Agastache rugosa O. Kuntze. J Kor Soc Cosm 13(3): 1396-1403
-
Lee JY, Park JY, Kim HD, Lee SE, Lee JH, Lee YJ, Seo KH (2019) Anti-oxidant and anti-adipocyte differentiation of Aster glehni and Aster yomena. J Nutr Health 52(3): 250-257.
[https://doi.org/10.4163/jnh.2019.52.3.250]

-
Li YY, Stewart DA, Ye XM, Yin LH (2019) A metabolomics approach to investigate kukoamine B-A potent natural product with anti-diabetic properties. Front Pharmacol 9(1575): 1-15.
[https://doi.org/10.3389/fphar.2018.01575]

-
Min BS, Hattori M, Lee HK, Kim YH (1999) Inhibitory constituents against HIV-1 protease from Agastache rugosa. Arch Pharm Res 22(1): 75-77.
[https://doi.org/10.1007/BF02976440]

- Ministry of Food and Drug Safety (2020) Health Functional Foods Actual Output Report. http://www.mfds.go.kr, (accessed on 17. 7. 2020)
-
Moreno MI, Isla MI, Sampietro AR, Vattuone WA (2010) Comparison of the free radicalscavenging activity of propolis from several regions of Argentina. J Ethnopharmacol 71(1-2): 109-114.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

-
Nam SM, Kang IJ, Shin MH (2015) Anti-diabetic and anti-oxidative activities of extracts from Crataegus pinnatifida. J East Asian Soc Diet Life 25(2): 270-277.
[https://doi.org/10.17495/easdl.2015.4.25.2.270]

-
Ola MS, Al-Dosari D, Alhomida AS (2018) Role of oxidative stress in diabetic retinopathy and the beneficial effects of flavonoids. Curr Pharm 24(19): 2180-2187.
[https://doi.org/10.2174/1381612824666180515151043]

- Park YS (2002) Antioxidative activities and contents of polyphenolic compound of medicinal herb extracts. J East Asian Soc Diet Life 12(1): 23-31.
- Pourmorad F, Hosseinimehr SJ, Shahabimajd N (2006) Antioxidant activity, phenol and flavonoid contents of some selected Iranian medicinal plants. Afr J Biotech 5(11): 1142-1145.
-
Reyes LM, Aparicio OE, Avila SH, Gómez T, Martínez E, Pedraza J (2020) Natural antioxidants effects on endoplasmic reticulum stress-related diseases. Food Chem Toxicol 138(4): 111229.
[https://doi.org/10.1016/j.fct.2020.111229]

-
Salimifar M, Fatehi-Hasanabad Z, Fatehi M (2013) A review on natural products for controlling type 2 diabetes with an emphasis on their mechanisms of actions. Curr Diabetes Rev 9(5): 402-411.
[https://doi.org/10.2174/15733998113099990076]

-
Shin S, Kang CA (2003) Antifungal activity of the essential oil of Agastache rugosa Kuntze and its synergism with ketoconazole. Lett Appl Microbiol 36(2): 111-115.
[https://doi.org/10.1046/j.1472-765X.2003.01271.x]

-
Shin SM, Jeong YJ, Park DW, Ko H, GT Kim, EH Kim (2012) Screening for anti-diabetic effects of prescribed Korean traditional medicines. Korean J Plant Res 25(6): 670-681.
[https://doi.org/10.7732/kjpr.2012.25.6.670]

- Song JH, Kim MJ, Kwon HD, Park IH (2001) Antimicrobial activity and components of extracts from Agastache rugosa during growth period. J Food Sci Nutr 6(1): 10-15.
-
Sylwia Z, Joanna KO, Mariusz D, Jan O, Adam M (2016) Characterization of polyphenols in Agastache rugosa leaves and inflorescences by UPLC-qTOF-MS following FCPC separation. J Liq Chromatogr Relat Technol 39(4): 209-219.
[https://doi.org/10.1080/10826076.2016.1147461]

-
Tadera K, Minami Y, Takamatsu K, Matsuoka T (2006) Inhibition of alpha-glucosidase and alpha-amylase by flavonoids. J Nutr Sci Vitaminol 52(2): 149-53.
[https://doi.org/10.3177/jnsv.52.149]

-
Tan SY, Mei W, Sim YJ, Wong SS, Mohamed E, Tan SH, Ling L, Rong T, Annan NC, Bhattamisra SK, Candasamy M (2019) Type 1 and 2 diabetes mellitus: A review on current treatment approach and gene therapy as potential intervention. Diabetes Metab Syndr 13(1): 364-372.
[https://doi.org/10.1016/j.dsx.2018.10.008]

- The Korea National Health and Nutrition Examination Survey (2018) https://knhanes.cdc.go.kr, (accessed on 26. 10. 2019)
- Wang SG (2011) Review of herbs and dietary supplements for glycemic control in diabetes. Natural Science 22(10): 109-128.
-
Yoo HJ (2012) Pharmacotherapy for postprandial hyperglycemia in type 2 diabetes. J Korean Diabetes 13(1): 39-43.
[https://doi.org/10.4093/jkd.2012.13.1.39]

-
Zheng Y, Tian J, Yang W, Chen S, Liu D, Fang H, Zhang H, Ye X (2020) Inhibition mechanism of ferulic acid against α-amylase and α-glucosidase. Food Chem 317(12): 6346.
[https://doi.org/10.1016/j.foodchem.2020.126346]

