감초와 눈꽃동충하초 균사체 배양추출물의 항산화 활성 및 암세포에 대한 세포독성
Abstract
This study examined the antioxidant activity and cytotoxicity of the ethanol extract of Glycyrrhizae radix (GR) and ethanol extract of Glycyrrhizae radix cultured with Paecilomyces japonica mycelium (GRPM). The total polyphenol contents of GR and GRPM were 50.55 mg GAE/g and 63.97 mg GAE/g, respectively, and the corresponding total flavonoid contents were 6.87 mg QE/g and 11.39 mg QE/g. These results mean that the polyphenol and flavonoid contents of GRPM increased during the culture of Glycyrrhizae radix with Paecilomyces japonica mycelium. In the DPPH and ABTS assay, GRPM exhibited higher antioxidant activity than GR. The MTT and SRB assay showed that the cytotoxicity of GRPM was significantly higher than that of GR on all human cancer cells tested, including A549, Hep3B, and HeLa cells. In addition, the numbers of A549 cells treated with GRPM decreased and most cells did not attach to the plates and were constricted. These results suggest that GRPM can be used as a functional material with good antioxidant activity and cytotoxicity.
Keywords:
Glycyrrhizae radix, Paecilomyces japonica mycelium, antioxidant activity, cytotoxicity서론
우리나라 국민들의 식생활이 서구화되면서 고혈압, 동맥경화, 당뇨병, 암 등과 같은 성인병의 발생이 증가하고 있으며, 이에 따라 국민들이 건강에 대한 관심이 높아져 질병의 예방 및 개선에 효과적인 생리활성을 가진 전통 약용식물에 대한 수요도 증가하고 있다.
약용식물 중 한약 조제 시 원료로 많이 사용되는 감초(Licorice, Glycyrrhizae radix)는 콩과에 속하는 다년생 초본 식물로 주로 뿌리가 이용되며, 맛이 달고 독이 없으며 따뜻한 기운을 가지고 있어 약제 외에도 건강음료, 감미료 등의 소재로 식품산업에서 이용되고 있다. 감초에 함유된 사포닌 계통의 감미성분인 glycyrrhizin은 항산화, 항염증, 항바이러스, 간 보호 효과 등을 가지고 있고(Sohn EJ 등 2003; Matsui S 등 2004; Wan XY 등 2009; Wolkerstorfer A 등 2009), liquiritigenin 성분은 항균 활성이 뛰어나며, 특히 그람 음성균인 Bacillus cereus, Listeria monocytogenes에대한 항균 효과가 높은 것으로 보고되었다(Ahn EY 등 1998; Kim E & Kim M 2016).
눈꽃동충하초(Paecilomyces japonica)는 약용버섯의 일종인 동충하초의 대표적인 속으로 분생자병속에 포자를 형성하는 불완전균이며, 동충하초는 혈당 강하 효과, 신장 및 간 보호 기능 등의 생리활성을 가지고 있는 것으로 알려져 있다(Kwon YM 등 2001; Wang Y 등 2010). 눈꽃동충하초에 대한 선행연구로는 알코올을 과량 투여한 흰쥐에 인진쑥과 눈꽃동충하초 투여가 지질대사 개선 및 간독성 저하에 미치는 영향을 분석한 연구(Han EK 등 2009), 눈꽃동충하초 물추출물이 흰쥐의 알코올 분해 및 대사에 미치는 영향에 대한 연구(Kim JM 등 2008), 눈꽃동충하초가 고지방 식이를 섭취한 흰쥐의 지질대사에 미치는 영향에 대한 연구(Koh J & Choi MA 2003), 눈꽃동충하초를 첨가한 민속주 제조에 관한 연구(Lee DH 등 2002) 등이 수행되었으나, 대부분 동충하초의 자실체를 이용한 연구로 균사체를 이용한 연구는 아직 미흡한 실정이다. 버섯류의 유용한 생리활성 물질은 자실체뿐만 아니라 균사체에도 존재하는 것으로 알려져 최근에는 균사체 이용에 대한 관심이 증가하고 있다. 또한 균류는 생장하면서 배지에 함유된 성분을 다양한 기능성을 가진 물질로 전환할 수 있는 능력을 가지고 있어 최근에는 천연물에 균사체를 배양하여 천연물의 생리활성을 더욱 증가시키기 위한 연구들이 수행되고 있다(Zhang MW 등 2016; Ryu JS 2012). 따라서 본 연구에서는 감초의 생리적 활성을 증가시켜 새로운 기능성 소재로서의 이용 가능성을 살펴보기 위하여 감초에 눈꽃동충하초 균사체를 고체배양하고, 배양추출물의 항산화 활성 및 암세포에 대한 세포독성 효과를 분석하였다.
재료 및 방법
1. 재료 및 시약
본 실험에 사용한 감초는 대구광역시 약령시장에서 구입하였으며, 눈꽃동충하초 균사체(Paecilomyces japonica)는 산림청 국립산림과학원에서 분양받아 사용하였다. 실험에 사용된 gallic acid, quercetin, 2,2-diphenyl-1-picryl-hydrazyl (DPPH), 2-2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), L-ascorbic acid, dimethylsulfoxide (DMSO), trichloroacetic acid(TCA), thiazoly blue tetrazolium bromide(MTT), sulforhodamine B(SRB), Folin-Ciocalteu's phenol reagent는 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입하였으며, potato dextrose agar(PDA), potato dextrose broth(PDB)는 Acumedia(Lansing, MI, USA)에서 구입하였다. 또한 세포 배양을 위한 Dulbecco's modified eagle's minimal essential medium(DMEM/High glucose), Roswell Park Memorial Institute medium(RPMI-1640, with L-glutamin), fetal bovine serum(FBS)는 Hyclone Co.(Logan, UT, USA)에서 구입하였다.
2. 균사체 배양 및 배양물 제조
멸균된 PDA 배지에 균사체를 접종하여 25℃에서 7일간 배양하고, 액체종균 제조를 위해 활성화된 균총을 PDB에 접종하여 25℃에서 5일간 진탕배양하였으며, 배양 후 homogenizer(400 Mark Ⅱ, Seward, UK)로 균질화하여 사용하였다. 감초는 증류수에 1시간 동안 침지하고, 121℃에서 15분간 고압 멸균하여 냉각한 후, 제조한 액체종균을 접종하고 25℃ 배양기에서 10일간 배양하였다.
3. 추출물 조제
감초 및 감초와 눈꽃동충하초 균사체 배양물에 20배(w/v)의 80% 에탄올을 가하여 상온에서 24시간 동안 추출하였다. 추출액은 여과지로 여과하고 감압농축기(LABOROTA 4000-efficient, Heidolph Instruments GmbH & Co., KG, Germany)로 농축시킨 후 동결건조기(EYELA, Tokyo Rikakikai Co., Tokyo, Japan)를 이용하여 동결건조하여 -20℃에서 냉동보관하였다.
4. 총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin-Denis 법(Singleton VL & Rossi JA 1965)에 따라 측정하였다. 증류수 5 mL와 0.1 M sodium acetate buffer(pH 5.5)에 용해한 시료 1 mL를 혼합한 후 Folin-Ciocalteu 시약 0.5 mL를 첨가하여 8분간 방치한 후 7% Na2CO3 10 mL를 첨가하였다. 혼합액의 최종 부피가 25 mL가 되도록 증류수를 채우고 암소에서 2시간 방치한 후 UV/visible spectrophotometer(DU 800, Beckman, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 시료 g당 gallic acid mg 당량(mg GAE/g)으로 구하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
5. 총 플라보노이드 함량
총 플라보노이드 함량은 Moreno MI 등(2000)의 방법에 따라 측정하였다. 시험관에 10% aluminum nitrate 0.1 mL와 1 M의 aqueous potassium acetate 0.1 mL, 80% ethanol 4.3 mL를 넣어 혼합한 뒤 0.1 M sodium acetate buffer(pH 5.5)에 용해한 시료 0.5 mL를 첨가하여 실온에서 40분간 방치한 후, UV/visible spectrophotometer를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 시료 g당 quercetin mg 당량(mg QE/g)으로 구하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
6. DPPH 라디칼 소거 활성
DPPH 라디칼 소거 활성은 Blois MS(1958)의 방법에 따라 측정하였다. 0.1 M sodium acetate buffer(pH 5.5)에 용해한 시료 1 mL와 7.5 × 10—5 M DPPH 용액 2 mL를 혼합하여 37℃에서 30분간 반응시킨 후 UV/Vis spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였다. 대조군으로 L-ascorbic acid를 사용하였고, DPPH 라디칼 소거 활성은 아래의 식을 이용하여 구하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
7. ABTS 라디칼 소거 활성
ABTS 라디칼 소거 활성은 Re R 등 (1999)의 방법을 사용하여 측정하였다. 7 mM의 ABTS 용액과 2.45 mM의 potassium persulfate를 1:1로 혼합하여 암소에서 12시간 방치시킨 뒤, 5 mM potassium phosphate buffer(pH 7.4)를 이용하여 413 nm에서 흡광도가 0.7∼0.8이 되도록 희석하였다. ABTS 희석용액 4 mL와 0.1 M sodium acetate buffer(pH 5.5)에 용해한 시료 40 µL를 혼합하여 1분간 반응시킨 후 UV/visible spectrophotometer를 이용하여 413 nm에서 흡광도를 측정하였다. 대조군으로 L-ascorbic acid를 사용하였고, ABTS 라디칼 소거 활성은 DPPH 라디칼 소거능 측정에 사용한 식을 이용하여 구하였으며, 3회 반복 실험하여 평균값으로 표시하였다.
8. 세포주 배양
실험에 사용한 암세포는 A549(인체 폐암 세포), Hep3B(인체 간암 세포), HeLa(인체 자궁경부암 세포)이며, 한국세포주은행(Korea Cell Line Bank, Seoul, KCLB, Korea)에서 분양받아 사용하였다. 배양 시 HeLa 및 A549는 RPMI-1640, Hep3B는 DEME 배지를 사용하였고, 10%의 FBS 및 1%의 penicillin-streptomycin을 배양액에 첨가하였으며, 37℃, 5% CO2 조건에서 계대배양하였다.
9. MTT Assay
추출물의 암세포 증식 억제 효과를 측정하기 위해 Carmichael J 등(1987)의 방법을 사용하여 MTT assay를 실시하였다. 배양한 암세포를 1 × 105 cell/mL로 희석하여 96 well plate에 180 μL씩 분주하고, 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 배양 후 배지 80 μL를 제거하고, 각 well에 농도별 시료를 100 μL씩 첨가하여 위와 동일한 조건에서 48시간 동안 배양하였다. 여기에 5 μg/mL MTT 용액 20 μL를 첨가하고 4시간 배양한 후, 배양액을 제거하고 DMSO:ethanol(1:1) 용액 150 μL를 첨가하여 30분간 진탕배양한 뒤 ELISA reader(VersaMax, Molecular Device, Silicon Valley, CA, USA)를 이용하여 550 nm에서 흡광도를 측정하였다. 암세포 증식 억제 효과는 아래의 식을 이용하여 세포독성으로 구하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
10. SRB Assay
SRB assay는 Doll R & Peto R(1981)의 방법을 이용하였다. 배양한 세포를 5 × 104 cells/mL로 희석하여 96 well plate에 분주하고 37℃, 5% CO2 incubator에서 24시간 배양한 후, 농도별 시료 100 μL를 첨가하여 동일한 조건에서 48시간 동안 배양하였다. 배양 후 배지를 제거하고 10% TCA 100 μL를 첨가하여 4℃에서 1시간 동안 방치하였다. 그 후, TCA를 제거하고 멸균수로 5회 세척한 다음 실온에서 건조한 뒤 0.4% SRB 용액을 100 μL씩 첨가하여 30분간 염색하였다. 이를 1% acetic acid로 5회 세척하고 다시 실온에서 건조시킨 후, 10 mM tris buffer(pH 10.5) 100 μL를 첨가하고 ELISA reader를 이용하여 540 nm에서 흡광도를 측정하였다. 암세포에 대한 세포독성은 MTT assay와 동일한 식으로 계산하였으며, 3회 반복 실험하여 평균값으로 나타내었다.
11. 암세포 형태 관찰
추출물 처리 시 암세포의 형태학적 변화 관찰을 위해 A549 cell을 96 well plate에 1 × 105 cells/mL로 분주하여 37℃, 5% CO2 incubator에서 24시간 동안 배양한 후, 농도별 추출물을 각각 처리하여 48시간 배양 후에 inverted microscope(Axioplan 2 etc, Carl Zeiss, Germany)를 이용하여 세포형태를 관찰하였다.
12. 통계처리
본 실험의 자료들은 SPSS(version 20) program으로 t-test 및 분산분석(ANOVA, analysis of variance)으로 통계분석하였으며, 시료들 간의 유의성 검증은 Duncan's multiple range test를 이용하여 실시하였다.
결과 및 고찰
1. 총 폴리페놀 함량
감초 추출물(GR)및 감초와 눈꽃동충하초 균사체 배양추출물(GRPM)에 대한 총 폴리페놀 함량을 Table 1에 나타내었다. GR 및 GRPM의 총 폴리페놀 함량은 각각 50.55 mg GAE/g, 63.97 mg GAE/g으로 나타나, 감초에 눈꽃동충하초 균사체를 배양했을 때 본래 감초보다 유의적으로 총 폴리페놀 함량이 증가한 것을 확인할 수 있었다. Joung EM 등(2010)의 연구에서도 배양기간에 따른 버섯균사체 인삼배양물의 총 폴리페놀 함량을 측정한 결과, 원료 인삼 추출물에 비해 버섯균사체로 배양한 인삼 추출물의 총 폴리페놀 함량이 높게 나타나 본 연구결과와 유사하였으며, 이러한 결과들을 통해 균사체에 의한 배양과정에서 폴리페놀 화합물이 증가함을 확인할 수 있었다. 폴리페놀 화합물은 자연계에 널리 분포되어 있는 천연 성분으로 분자 구조에 다수의 하이드록실기(—OH)를 가지고 있는데, 이들은 라디칼을 쉽게 제거함으로써 산화억제 작용을 나타낸다. 따라서 균사체와의 배양을 통해 폴리페놀 화합물이 증가됨으로써 배양물의 항산화 활성이 증가되는데 기여할 수 있을 것으로 보였다.
2. 총 플라보노이드 함량
GR 및 GRPM의 총 플라보노이드 함량은 Table 1에 제시한 것과 같이 GR은 6.87 mg QE/g, GRPM은 11.39 mg QE/g으로, 감초보다 눈꽃동충하초 균사체로 배양한 감초 추출물의 총 플라보노이드 함량이 유의적으로 높게 나타났다. Park MH & Kim MR(2017)도 창출을 영지버섯 균사체로 배양하였을 때 본래 창출보다 총 플라보노이드 함량이 증가했다고 보고하였으며, Kim DB 등(2014)도 노루궁뎅이버섯을 이용하여 발효한 가시오가피 추출물이 가시오가피 추출물보다 총 플라보노이드 함량이 높다고 보고하여 본 연구와 유사한 결과를 보였다. 따라서 이들 연구 결과들을 볼 때 균사체와의 발효과정 동안 플라보노이드 성분이 증가함을 확인할 수 있었다.
3. DPPH 라디칼 소거 활성
DPPH 라디칼은 비교적 안정한 화합물로 항산화 활성을 갖는 물질을 만나면 라디칼이 소거되어 탈색되는 원리를 이용하여 항산화 활성을 검정하는데 자주 사용되는 물질이다. DPPH 라디칼 소거 활성법은 간단하면서도 비용이 저렴하여 항산화 활성 측정에 대표적으로 사용되고 있는 방법이다(Yoo KM 등 2007). GR과 GRPM의 DPPH 라디칼에 소거 활성은 Fig. 1과 같다. 이 그래프를 이용하여 IC50값을 구한 결과, 대조군인 L-ascorbic acid는 29.87 μg/assay로 가장 높은 라디칼 소거 활성을 보였으며, GR은 200.47 μg/assay, GRPM은 181.32 μg/assay의 값을 나타내 GR에 비해 GRPM의 DPPH 라디칼 소거 활성이 높게 나타났다. GRPM의 라디칼 소거 활성은 300 μg/assay 이상에서 GR보다 유의적으로 높았으며, 500 μg/assay, 700 μg/assay, 1,000 μg/assay에서 85.25%, 86.71%, 87.42%의 높은 라디칼 소거 활성을 보여 500 μg/assay 이상의 농도에서는 대조군과 유의한 차이가 없었다. Joung EM 등(2010)은 원료 인삼 추출물보다 버섯균사체로 배양한 인삼 추출물의 DPPH 라디칼 소거능이 높게 나타났다고 하였으며, Shin YK 등(2008)도 장수상황버섯 균사체로 발효시킨 한약재 추출물의 DPPH 라디칼 소거능을 측정한 결과 한약재에 따라 차이는 있었으나 발효 전 한약재에 비해 발효 후 한약재의 라디칼 소거능이 높게 나타났다고 보고하여, 본 연구결과는 균사체와의 배양 시 항산화 활성이 증가한 이들 선행연구와 일치하였다.
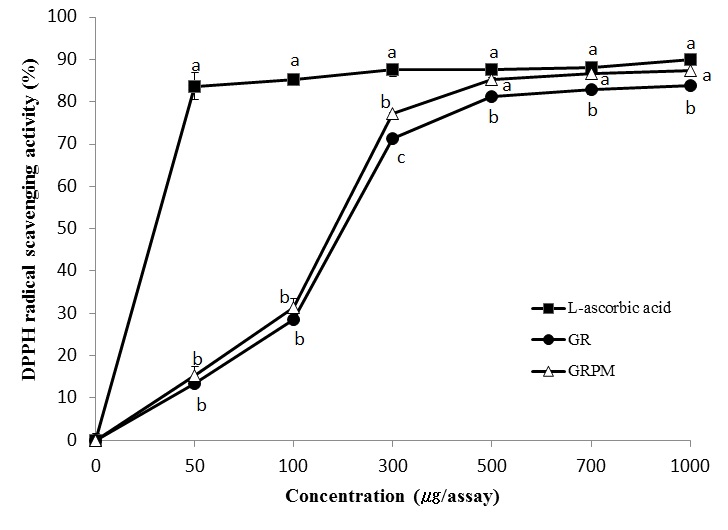
DPPH radical scavenging activity of ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium. GR: ethanol extract from Glycyrrhizae radix, GRPM: ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium. Means with the different letters are significantly different at the same concentration by Duncan's multiple range test (p<0.05).
4. ABTS 라디칼 소거 활성
ABTS 라디칼 소거활성 측정은 potassium persulfate와의 반응으로 생성된 ABTS 라디칼이 검체에 있는 항산화 물질에 의해 제거되어 라디칼 특유의 청록색이 탈색되는 원리를 이용하여 측정하는 방법이다(Won JH & Kim M 2016). GR과 GRPM의 ABTS 라디칼 소거 활성은 Fig. 2와 같이 나타났다. Fig. 2를 토대로 구한 각 시료의 IC50값을 비교한 결과, 대조군인 L-ascorbic acid는 25.06 μg/assay, GR은 37.99 μg/assay, GRPM은 35.53 μg/assay로 나타나 GR과 GRPM의 ABTS 라디칼 소거 활성은 L-ascorbic acid에 비해 낮았으나, GR과 GRPM의 라디칼 소거 활성도 상당히 높은 것으로 나타났다. 특히 GRPM은 100 μg/assay에서 92.79%, 300 μg/assay에서 98.47%의 라디칼 소거 활성을 보여 매우 높은 항산화성을 가지고 있음을 확인할 수 있었다. 한편, 300 μg/assay 이상의 농도에서는 모든 시료의 라디칼 소거 활성이 95% 이상으로 이미 거의 한계치에 도달하였기 때문에 GR과 GRPM의 라디칼 소거 활성이 대조군과 유의적인 차이를 보이지 않았다. 상황버섯 균사체를 이용하여 발효한 홍삼과 비발효홍삼의 ABTS 라디칼 소거능에 대한 IC50값을 측정한 연구에서도 발효홍삼은 2.6 mg/mL, 비발효홍삼은 5.2 mg/mL로 나타나 균사체를 이용하여 발효한 홍삼의 라디칼 소거능이 증가하였다고 보고하였다(Ryu JS 2012). 본 실험에서 측정한 DPPH 라디칼 소거 활성 결과와 ABTS 라디칼 소거 활성 결과를 종합적으로 살펴볼 때, 두 결과에서 모두 전체적으로 GRPM이 GR보다 높은 라디칼 소거 활성을 보여 눈꽃동충하초 균사체를 이용하여 배양하는 과정을 통해 항산화성이 증가함을 확인할 수 있었다. Kim SJ 등(2004)은 버섯균사체를 뽕나무 첨가 배지에서 배양시키는 과정에서 버섯균의 생물 전환 능력에 의해 배지에 함유된 항산화성이 낮은 화합물이 항산화성이 높은 물질로 전환되었다고 보고하였는데, 본 연구에서도 눈꽃동충하초 균사체가 감초에서 배양되는 과정에서 생물 전환 능력에 의해 폴리페놀 화합물, 플라보노이드 화합물 등의 항산화 물질들이 증가한 것으로 나타났다. 또한 여러 선행연구에서 항산화 활성과 총 폴리페놀 및 플라보노이드 함량 사이에 양의 상관관계가 있다고 보고하여 이들 물질의 증가가 항산화성 증가에 영향을 준다고 하였는데(Kwak CS 등 2005, Kim EJ 등 2012), 본 연구에서도 GRPM의 총 폴리페놀과 총 플라보노이드 함량이 GR보다 높게 나타나 이들이 라디칼 소거 활성 증가에 기여했을 것으로 생각된다.
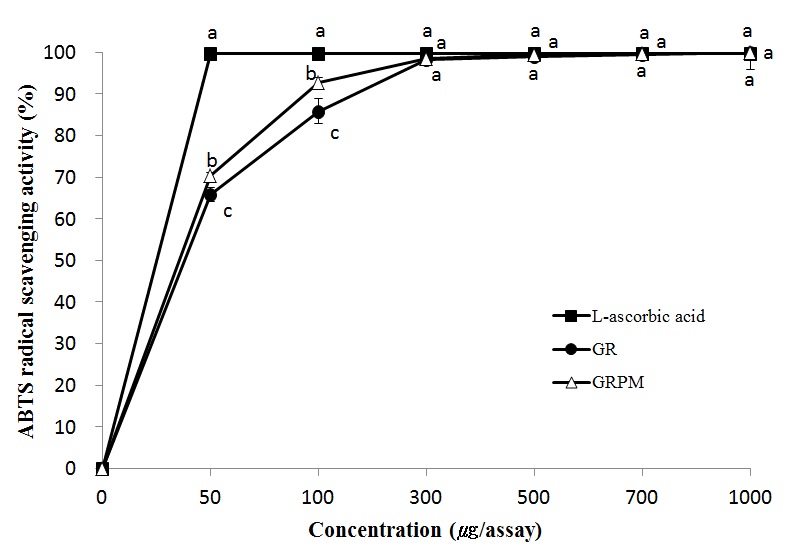
ABTS radical scavenging activity of ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium.GR: ethanol extract from Glycyrrhizae radix, GRPM: ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium. Means with the different letters are significantly different at the same concentration by Duncan's multiple range test (p<0.05).
5. MTT Assay
MTT assay는 살아있는 세포내에 존재하는 미토콘드리아의 탈수소효소작용에 의해 노란색을 띄는 MTT tetraxolium이 보라색의 불용성 MTT formazan으로 환원되는 원리를 이용한 방법이다(Denizot F & Lang R 1986). GR 및 GRPM을 이용하여 암세포인 A549, Hep3B, HeLa에 대해 MTT assay를 실시한 결과는 Fig. 3과 같다. 두 시료 모두 실험에 사용된 모든 암세포에 대해 농도 의존적으로 세포독성 효과를 나타내었으며, 그 정도는 시료와 암세포의 종류에 따라 차이가 있었다. 인체 폐암 세포인 A549의 경우 200∼800 ppm 농도에서 GR은 3.77∼35.23%, GRPM은 16.15∼81.96%의 세포독성을 나타내었다. 400 ppm을 제외한 모든 농도에서 GRPM이 GR에 비해 높은 세포독성을 나타났으며, 특히 600 ppm, 800 ppm에서는 GRPM의 세포독성이 GR에 비해 2배 이상 더 높게 나타나 암세포에 대한 세포 증식 억제 효과가 강함을 보여주었다. 인체 간암세포인 Hep3B에 대한 세포독성 측정 결과, 200∼800 ppm 농도에서 GR은 12.46∼65.78%, GRPM은 52.20∼91.34%의 세포독성을 보였으며, 모든 농도에서 GR에 비해 GRPM의 세포독성이 유의적으로 높았다. 또한 GRPM은 600 ppm부터 Hep3B에 대해 90%가 넘는 높은 세포독성 효과를 나타내었다. 자궁경부암 세포인 HeLa에 대한 세포독성 측정 결과, 200∼800 ppm 농도에서 GR은 14.54∼86.22%, GRPM은 27.77∼96.10%의 세포독성을 보였으며, 모든 농도에서 GRPM의 세포독성이 GR보다 유의적으로 높았다. GRPM은 400 ppm의 낮은 농도에서도 92.89%의 세포독성을 나타내어 HeLa에 대한 높은 암세포 증식 억제 효과를 확인할 수 있었다. 표고버섯 균사체로 배양한 감초 추출물의 항암 효과를 분석한 Bae MJ & Ye EJ(2007)의 연구에서도 Hep3B에 대해 1∼3 mg/mL 농도에서 감초 추출물이 33.26∼52.77%, 감초 균사체 추출물이 78.81∼100%의 세포 증식 억제율을 나타내었으며, 같은 농도에서 HeLa에 대해 감초 추출물이 4.62∼7.16%, 감초 균사체 추출물이 28.67∼97.73%의 세포 증식 억제율을 나타내어, 감초 추출물보다 감초 균사체 추출물의 암세포 증식 억제율이 확연히 높다고 보고하였다. 또한 유방암 세포인 MCF-7의 증식 억제율과 고형암 억제효과도 감초 추출물에 비해 감초 균사체 추출물이 높다고 보고하여 감초에 균사체를 배양하는 과정을 통해 암세포에 대한 증식 억제 활성이 증가된 본 연구결과와 일치함을 확인할 수 있었다.
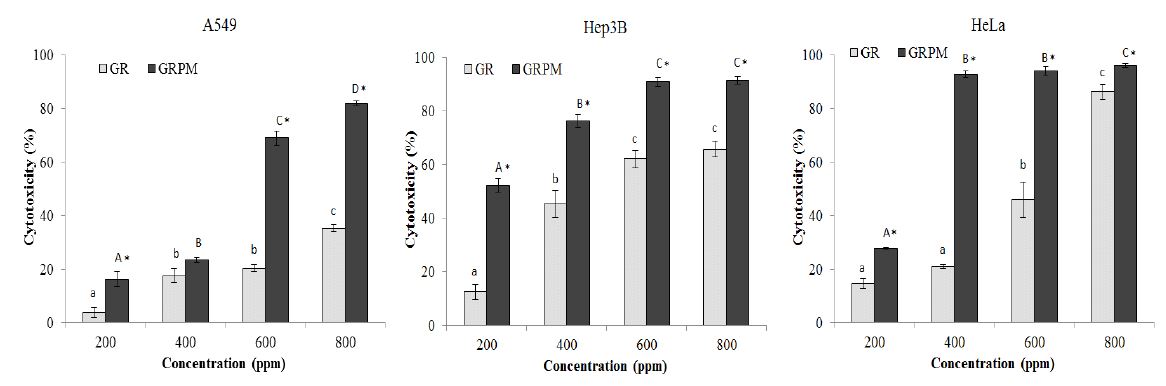
Cytotoxicity of ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium on human cancer cell lines by MTT assay.GR: ethanol extract from Glycyrrhizae radix, GRPM: ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium. Means with small letters (a~c) are significantly different among different concentrations of GR by Duncan's multiple range test (p<0.05). Means with capital letters (A~D) are significantly different among different concentrations of GRPM by Duncan’s multiple range test (p<0.05). Means with star marks are significantly different between GR and GRPM at the same concentration by t-test (p<0.05).
6. SRB Assay
SRB assay는 sulforhodamine B(SRB)로 살아있는 세포내 핵단백질을 염색하여 세포 독성을 측정하는 방법으로(Skehan P 등 1988), 본 연구에서는 더욱 신뢰성 있는 결과를 얻기 위하여 MTT assay뿐만 아니라, SRB assay도 함께 실시하여 세포독성을 측정하였다. SRB assay를 이용하여 측정한 GR과 GRPM의 세포독성 결과는 Fig. 4와 같다. A549에 대한 세포독성 측정 결과, 200∼800 ppm의 농도에서 GR은 3.77∼37.45%, GRPM은 35.66∼80.94%의 세포독성을 보였으며, GRPM은 GR에 비해 모든 농도에서 유의적으로 높은 세포독성을 보였다. 특히 400∼800 ppm에서 GRPM은 GR보다 40% 이상 더 높은 세포독성을 나타내었다. Hep3B에 대한 세포독성 측정 결과, 200∼800 ppm에서 GR은 5.43∼58.35%, GRPM은 30.27∼76.73%의 세포독성을 보였으며, 모든 농도에서 GRPM이 GR보다 높은 세포독성을 나타내었다. HeLa에 대한 세포독성 측정 결과, GR은 25.12∼86.74%, GRPM은 26.48∼91.30%의 세포독성을 보여 다른 암세포에 비해 세포독성이 높게 나타났다. 마늘 첨가 복합배지에서 배양된 영지버섯 균사체를 이용하여 SRB assay를 수행한 Mun HC 등(2004)의 연구에서도 마늘 추출물에 비해 마늘 첨가 복합배지에서 배양된 균사체 추출물의 항암 활성이 높게 나타나 균사체와의 배양 시 항암 활성의 증강 효과를 확인하였다고 보고하였는데, 본 연구에서도 이와 같은 암세포 증식 억제 효과를 볼 수 있었다.
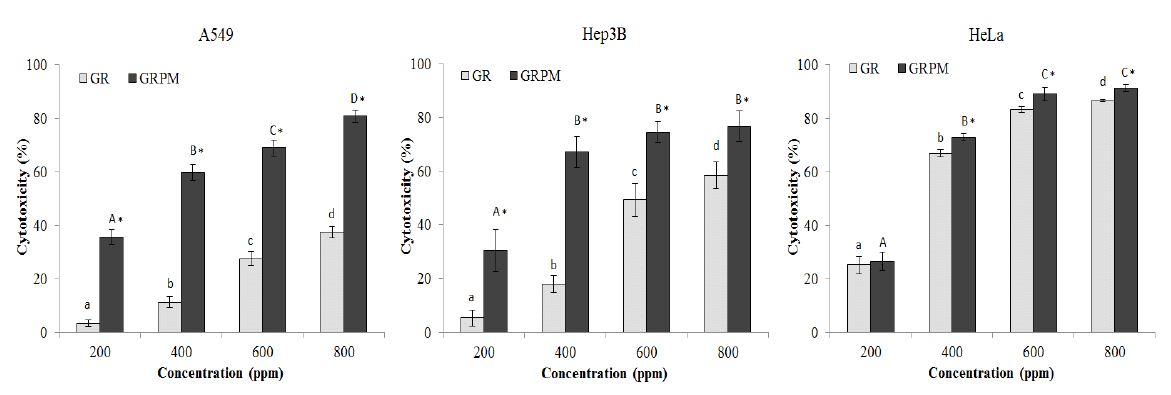
Cytotoxicity of ethanol extracts from Glycyrrhizae radix and Glycyrrhizae radix cultured with Paecilomyces japonica mycelium on human cancer cell lines by SRB assay.GR: ethanol extract from Glycyrrhizae radix, GRPM: ethanol extract from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium. Means with small letters (a~d) are significantly different among different concentrations of GR by Duncan's multiple range test (p<0.05). Means with capital letters (A~D) are significantly different among different concentrations of GRPM by Duncan's multiple range test (p<0.05). Means with star marks are significantly different between GR and GRPM at the same concentration by t-test (p<0.05).
MTT assay와 SRB assay를 통해 GR 및 GRPM의 암세포에 대한 세포독성 결과를 보면, 두 assay에서 모두 GRPM은 모든 암세포에서 GR보다 높은 세포독성을 나타내 일치된 결과를 보여주었다. 또한 A549에 대해서는 GRPM의 세포독성이 GR에 비해 현저히 큰 효과를 나타냈으며, HeLa에 대해 가장 높은 암세포 증식 억제 효과를 보였다. Park JH 등(2011)은 감초에서 분리한 glabridin, glabrol, abyssinone II, isoliquiritigenin이 암세포에 대해 세포독성 효과가 있다고 하였고, Hatano T 등(1988)은 플라보노이드 계통인 liquiritin, isoliquiritin, apioliquiritin, liquiritigenin, glycyrol, glycyrin, licoricidin 및 licoricone과 페놀 계통인 licopyranocoumarin, glycocoumarin 등이 감초의 주요 생리활성 성분이라고 보고하였는데, 본 연구에서도 눈꽃동충하초 균사체와의 배양 후 감초의 총 플라보이드 함량과 총 폴리페놀 함량이 증가한 결과를 보여 암세포의 증식 억제 효과 증진에 기여했을 것으로 사료된다.
7. 암세포 형태 관찰
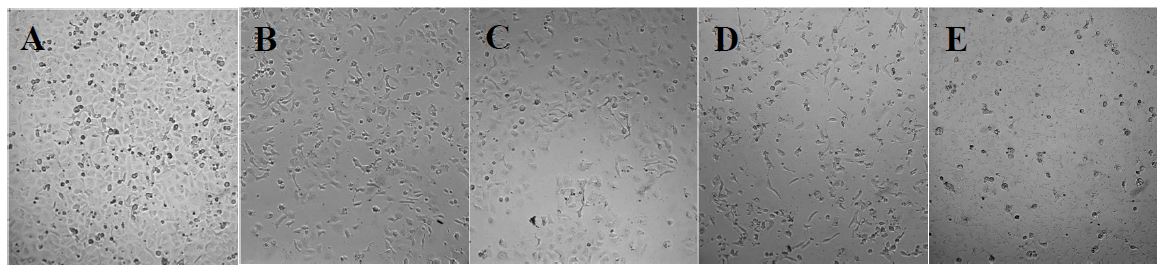
GR과 GRPM을 A549 세포에 처리한 후 세포의 형태 변화를 관찰한 결과(Fig. 5), 시료를 처리하지 않은 대조군은 암세포가 well plate에 조밀하게 부착되어 정상적인 증식이 이루어진 모습을 보였으나, GR을 처리한 군에서는 시료의 농도가 증가할수록 부착된 세포의 수가 감소하고, 세포가 응축되어 있는 모습을 확인할 수 있었다. 또한 GRPM을 처리한 군은 GR 처리군에 비해 암세포의 수가 확연하게 감소하였으며, 특히 800 ppm 처리군에서는 대부분의 세포가 well plate에 부착되지 못하고 배양액에 부유하고 있는 모습을 볼 수 있었다. 이러한 세포 수와 형태의 변화를 볼 때, GRPM은 GR에 비해 A549 세포에 대해 더 많은 변화를 유발하여 더 높은 세포 증식 억제 활성을 나타냄을 확인할 수 있었다. 이는 인동초 추출물과 인동초로 배양한 표고버섯 균사체 추출물이 Hep3B 세포에 미치는 영향을 분석한 Bae MJ 등(2007)의 연구에서 세포 형태 변화 관찰 시 인동초 추출물 처리군에 비해 인동초 균사체 추출물 처리군이 세포의 전체적인 수와 형태에 더 많은 영향을 주었다고 한 결과와 같은 양상이었다.
요약
본 연구에서는 감초의 생리활성을 증가시키기 위해 감초에 눈꽃동충하초 균사체를 고체배양하고 에탄올 추출물을 제조하여 항산화 활성 및 암세포에 대한 세포독성 효과를 분석하였다. GR과 GRPM의 총 폴리페놀 함량은 50.55 mg GAE/g, 63.97 mg GAE/g이었으며, 총 플라보노이드 함량은 6.87 mg QE/g, 11.39 mg QE/g이었다. DPPH 라디칼 소거 활성 측정에서 IC50값이 GR은 200.47 μg/assay, GRPM은 181.32 μg/assay로 나타났으며, ABTS 라디칼 소거 활성 측정에서도 IC50값이 GR은 37.99 μg/assay, GRPM은 35.53 μg/assay로 나타나 GR에 비해 GRPM의 항산화 활성이 높게 나타났으며, 이를 통해 감초와 눈꽃동충하초 균사체의 배양과정에서 항산화성이 증가된 것이 확인되었다. 암세포 A549, Hep3B, HeLa에 대한 MTT assay를 실시한 결과, GRPM이 GR에 비해 유의적으로 높은 세포독성을 나타내었으며, GRPM은 Hep3B에 대해 600 ppm 이상의 농도에서 90%가 넘는 세포독성을 보였고, HeLa에 대해서도 400 ppm 이상의 농도에서 90% 이상의 높은 세포독성을 보여 강한 암세포 증식 억제 효과를 가지고 있는 것으로 나타났다. SRB assay에서도 GRPM이 GR에 비해 유의적으로 높은 세포독성을 보여 MTT assay와 일치하는 결과를 보였다. GR 및 GRPM을 처리한 A549 세포의 형태 변화를 관찰한 결과, 시료를 처리하지 않은 대조군에서는 암세포의 정상적인 증식이 이루어진 반면, GR을 처리한 세포는 부착된 세포 수가 감소하고 세포가 응축되어 있었으며, GRPM을 처리한 세포는 GR 처리군에 비해 세포 수가 확연하게 감소하였고, 대부분의 세포가 well plate에 부착되지 못하고 배양액에 부유하고 있었다. 이들 결과를 볼 때 눈꽃동충하초 균사체와 배양함으로써 감초의 항산화 활성 및 암세포에 대한 세포 증식 억제 효과가 증가되는 것이 확인되어 감초와 눈꽃동충하초 균사체 배양물이 기능성 식품소재로 활용될 수 있을 것으로 보인다.
References
- Ahn, EY, Shin, DH, Baek, NI, Oh, JA, (1998), Isolation and identification of antimicrobial active substance from Glycyrrhiza uralensis Fisch, Korean J Food Sci Technol, 30(3), p680-687.
-
Bae, MJ, Ye, EJ, (2007), Effect of mycelia extracts from Lentinus edodes mushroom-cultured Lonicera japonica Thunberg on anticancer and antiallergy activities, J Korean Soc Food Sci Nutr, 36(4), p424-430.
[https://doi.org/10.3746/jkfn.2007.36.4.424]

- Bae, MJ, Yee, ST, Ye, EJ, (2007), Anti-cancer and anti-allergy activity of mycelia extracts of Lentinus edodes mushroomcultured Glycyrrhiza radix, J East Asian Soc Dietary Life, 17(1), p43-50.
-
Blois, MS, (1958), Antioxidant determinations by use of a stable free radical, Nature, 181(4617), p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Carmichael, J, DeGraff, WG, Gazdar, AF, Minna, JD, Mitchell, JB, (1987), Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing, Cancer Res, 47(4), p936-942.
-
Denizot, F, Lang, R, (1986), Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability, J Immunol Methods, 89(2), p271-277.
[https://doi.org/10.1016/0022-1759(86)90368-6]

-
Doll, R, Peto, R, (1981), The causes of cancer : Quantitive estimates of avoidable risks of cancer in the United States today, J Natl Cancer Inst, 66(6), p1191-1308.
[https://doi.org/10.1093/jnci/66.6.1192]

-
Han, EK, Jin, YX, Yoo, YS, Jung, EJ, Lee, JY, Chung, CK, (2009), Effect of Artemisia capillaris and Paecilomyes japonica on the reduction of hepatotoxicity and lipid metabolism induced by ethanol, J Korean Soc Food Sci Nutr, 38(8), p1016-1023.
[https://doi.org/10.3746/jkfn.2009.38.8.1016]

-
Hatano, T, Kagawa, H, Yasuhara, T, Okuda, T, (1988), Two new flavonoids and other constituents in licorice root: Their relative astringency and radical scavenging effects, Chem Pharm Bull, 36(6), p2090-2097.
[https://doi.org/10.1248/cpb.36.2090]

-
Joung, EM, Kim, HY, Hwang, IG, Jeong, JH, Yu, KW, Lee, JS, Jeong, HS, (2010), Changes of antioxidant activities on cultured ginseng with mushroom mycelia during cultivation, J Korean Soc Food Sci Nutr, 39(9), p1346-1352.
[https://doi.org/10.3746/jkfn.2010.39.9.1346]

-
Kim, DB, Shin, GH, Lee, JS, Lee, OH, Park, IJ, Cho, JH, (2014), Antioxidant and nitrite scavenging activities of Acanthopanax senticosus extract fermented with different mushroom mycelia, Korean J Food Sci Technol, 46(2), p205-212.
[https://doi.org/10.9721/KJFST.2014.46.2.205]

-
Kim, E, Kim, M, (2016), Antimicrobial and anti-inflammatory activities of extracts from Glycyrrhizae radix cultured with Paecilomyces japonica, J East Asian Soc Diet Life, 26(3), p215-222.
[https://doi.org/10.17495/easdl.2016.6.26.3.215]

-
Kim, EJ, Choi, JY, Yu, MR, Kim, MY, Lee, SH, Lee, BH, (2012), Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants, Korean J Food Sci Technol, 44(3), p337-342.
[https://doi.org/10.9721/KJFST.2012.44.3.337]

-
Kim, JM, Park, JH, Kim, MK, Chun, HS, (2008), Effects of Paecilomyces tenuipes water extract on the alcohol metabolism of rats, J Korean Soc Food Sci Nutr, 37(3), p396-400.
[https://doi.org/10.3746/jkfn.2008.37.3.396]

-
Kim, SJ, Lim, DK, Hyung, SW, Kim, MS, Kim, MN, Lee, KK, Ha, YL, (2004), Inhibition of lipid autoxidation by the extract of the submerged- liquid culture of mushroom in the medium containing mulberry tree powder, J Korean Soc Food Sci Nutr, 33(2), p249-254.
[https://doi.org/10.3746/jkfn.2004.33.2.249]

-
Koh, J, Choi, MA, (2003), Effect of Paecilomyces japonica on lipid metabolism in rats fed high fat diet, J Korean Soc Food Sci Nutr, 32(2), p238-243.
[https://doi.org/10.3746/jkfn.2003.32.2.238]

-
Kwak, CS, Kim, SA, Lee, MS, (2005), The correlation of antioxidative effects of Korean common edible seaweeds and total polyphenol content, J Korean Soc Food Sci Nutr, 34(8), p1143-1150.
[https://doi.org/10.3746/jkfn.2005.34.8.1143]

- Kwon, YM, Cho, SM, Kim, JH, Lee, JH, Lee, YA, Lee, SJ, Lee, MW, (2001), Hypoglycemic effect of Cordyceps militaris, Kor J Pharmacogn, 32(4), p327-329.
-
Lee, DH, Kim, JH, Kim, NM, Pack, JS, Lee, JS, (2002), Manufacture and physiological functionality of Korean traditional liquors by using Pacilomyces japonica, Korean J Mycology, 30(2), p142-146.
[https://doi.org/10.4489/KJM.2002.30.2.142]

-
Matsui, S, Matsumoto, H, Sonoda, Y, Ando, K, Aizu-Yokota, E, Sato, T, Kasahara, T, (2004), Glycyrrhizin and related compounds down-regulate production of inflammatory chemokines IL-8 and eotaxin 1 in a human lung fibroblast cell line, International Immunopharmacology, 4(13), p1633-1644.
[https://doi.org/10.1016/j.intimp.2004.07.023]

-
Moreno, MI, Isla, MI, Sampietro, AR, Vattuone, MA, (2000), Comparison of the free radical-scavenging activity of propolis from several regions of Argentina, J Ethnopharmacol, 71(1-2), p109-114.
[https://doi.org/10.1016/S0378-8741(99)00189-0]

- Mun, HC, Lee, HS, Park, JH, Kim, DH, Lee, SY, Seong, NS, Bang, JK, Jung, HG, Lee, HY, (2004), Enhancement of immune activities of Ganoderma lucidum mycelium cultured with garlic enriched medium, Korean J Medicinal Crop Sci, 12(1), p24-30.
- Park, MH, Kim, MR, (2017), Analysis of antioxidant activity and cytotoxicity against human cancer cell lines of extract from Atractylodes rhizoma fermented with Ganoderma lucidum mycelium, Korean J Food Nutr, 30(3), p454-463.
-
Park, JH, Wu, Q, Yoo, KH, Yong, HI, Cho, SM, Chung, IS, Baek, NI, (2011), Cytotoxic effect of flavonoids from the roots of Glycyrrhiza uralensis on human cancer cell lines, J Appl Biol Chem, 54(1), p67-70.
[https://doi.org/10.3839/jabc.2011.012]

-
Re, R, Pellegrini, N, Proteggente, A, Pannala, A, Yang, M, Rice-Evans, C, (1999), Antioxidant activity applying an improved ABTS radical cation decolorization assay, Free Radical Biology & Medicine, 26(9-10), p1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

- Ryu, JS, (2012), Chemical composition and biological functions of red ginseng (Panax ginseng C. A. Meyer) fermented by Phelinus linteus mycelia, Ph D Dissertation Dankook University, Yongin.
- Singleton, VL, Rossi, JA, (1965), A colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, Am J Enol Vitic, 16(3), p144-158.
-
Skehan, P, Storeng, R, Scudiero, D, Monks, A, McMahon, J, Visteca, D, Warren, JT, Bokesch, H, Kenney, S, Boyd, MR, (1988), New colorimetric cytotoxicity assay for anticancer-drug screening, J Nat Cancer Inst, 82(13), p1107-1112.
[https://doi.org/10.1093/jnci/82.13.1107]

- Shin, YK, Jang, HS, Kim, JS, Ryu, HY, Kim, JK, Kwun, IS, Sohn, HY, (2008), Solid fermentation of medicinal herb using Phellinus baumii mycelium and anti-thrombin and anti-oxidation activity of its methanol extract, Kor J Microbiol Biotechnol, 36(3), p201-208.
- Sohn, EJ, Kang, DG, Lee, AS, Lee, YM, Yin, MH, Yeum, KB, Noh, SY, Lee, HS, (2003), Antioxidant activities of Glycyrrhizin and its effect on renal expression of Na, K-ATPase in gentamicin-induced acute renal failure rats, Korean J Oriental Physiology & Pathology, 17(2), p542-548.
-
Wan, XY, Luo, M, Li, XD, He, P, (2009), Hepatoprotective and anti-epatocarcinogenic effects of glycyrrhizin and matrine, Chemico-Biological Interactions, 181(1), p15-19.
[https://doi.org/10.1016/j.cbi.2009.04.013]

-
Wang, Y, Yin, H, Lv, X, Wang, Y, Gao, H, Wanga, M, (2010), Protection of chronic renal failure by a polysaccharide from Cordyceps sinensis, Fitoterapia, 81(5), p397-402.
[https://doi.org/10.1016/j.fitote.2009.11.008]

-
Wolkerstorfer, A, Kurz, H, Bachhofner, N, Szolar, OHJ, (2009), Glycyrrhizin inhibits influenza a virus uptake into the cell, Antiviral Research, 83(2), p171-178.
[https://doi.org/10.1016/j.antiviral.2009.04.012]

-
Won, JH, Kim, M, (2016), Analysis of antioxidative and antimutagenic activities of ethanol extracts from pericarp and seeds of wild grape (Vitis coignetiea), J East Asian Soc Dietary Life, 26(2), p192-199.
[https://doi.org/10.17495/easdl.2016.4.26.2.192]

- Yoo, KM, Kim, D, Lee, CY, (2007), Evaluation of different methods of antioxidant measurement, Food Sci Biotechnol, 16(2), p177-182.
-
Zhang, MW, Park, MH, Kim, M, (2016), Study on antioxidant activity and cytotoxicity in cancer cells of extract from waxy sorghum fermented with Phellinus linteus mycelium, J East Asian Soc Diet Life, 26(5), p418-426.
[https://doi.org/10.17495/easdl.2016.10.26.5.418]