내산성이 우수한 Acetobacter pasteurianus AFY-4 균주를 이용한 다래 식초 초산발효 최적화
Abstract
Acetobacter pasteurianus AFY-4 was isolated from fermented vinegar in Hongcheon-gun, Gangwon-do. The A. pasteurianus AFY-4 strain had a higher tolerance to low-pH. Optimization of acetic acid fermentation of hardy kiwi (Actinidia arguta) was conducted using the A. pasteurianus AFY-4 strain based on the response surface methodology (RSM). The optimization of acetic acid fermentation for producing hardy kiwi vinegar was determined by five levels of initial ethanol, initial acetic acid, and acetic acid bacteria (AAB) inoculum volume, using the central composite design. The acetic acid yield and residual ethanol for acetic acid fermentation of hardy kiwi optimized by the RSM were significantly different. The optimal conditions for acetic acid fermentation of hardy kiwi vinegar were 8.95% of the initial ethanol, 1.86% of the initial acetic acid, and 25.02% of the AAB inoculum volume.
Keywords:
Acetic acid bacteria, Acetobacter pasteurianus, hardy kiwi, Actinidia arguta, vinegar서 론
식초는 동서양의 대표적인 발효식품 중 하나로 오랫동안 이용되어 왔으며, 특유의 강한 산성으로 인하여 식품 내 유해 미생물 생육 저해효과를 가지며, 유기산, 에스테르, 아미노산, 당류 등을 포함한 독특한 방향과 신맛을 가진 식품이다(Jeoung YJ & Lee MH 2000). 식초는 여러 원료를 효모에 의해 알코올 발효한 후, 초산균으로 초산 발효하여 제조한 것으로 조미료 이외에 식품 보존효과와 의약용으로도 이용되어 왔다(Ha YD & Kim KS 2000; Jeoung YJ & Lee MH, 2000). 또한, 식초는 알칼리성 식품으로서 피로회복, 항당뇨, 항비만, 항노화, 항종양 및 소화 및 식용 촉진 효능, 동맥경화 예방, 혈압상승 및 당뇨병, 비만에 관한 효과 등의 기능성이 보고되어(Kim DH 1999; Lee WJ & Kim SS 1998) 최근 건강식품으로서의 인식이 확산되고 있으며, 단순 조미용뿐만 아니라 음용으로도 소비량이 꾸준히 증가하고 있는 추세이다(Park HJ 등 2014). 식품공전에서 식초의 식품 규격은 초산으로서의 총산이 4.0∼20.0%이고, 초산균이 초산 발효 시, 기질로 이용하는 에탄올과 초산 농도에 대한 내성 정도에 따라 최종 산도가 결정된다고 알려져 있다(Yoon HN 1998). 식초는 곡물식초와 과실식초로 나눌 수 있으며, 과실주를 원료로 하는 과실식초의 경우 과실식초 제조를 위한 초산균(Acetic acid bacteria)의 에탄올 저항성, 아황산 저항성, 고산도 생성 균주에 관한 연구가 주를 이루고 있고(Park KS 등 1994; Park MH 등 2002; Yim EJ 등 2015), 과실 원료인 유자, 감귤 미숙과, 매실, 아로니아 등을 이용한 건강 기능성 식초에 대한 연구가 보고되었다(Kang SK 등 2006; Kim YD 등 1996; Park HJ 등 2014; Yi MR 등 2014). 하지만 토종 과수인 다래를 이용한 과실식초에 대한 연구는 미비한 실정이다.
다래(Actinidia arguta)는 낙엽활엽 다년생 덩굴성 식물로 다래나무과(Actinidiaceae)에 속하며, 내병충성과 내한성이 강한 수종으로 우리나라 산지 전역 및 중국과 일본 등에서 자생한다(Park YK 2007). 다래는 과육의 색상이 화려하고 hexanal로 대표되는 독특한 향과 단맛, 신맛의 조화가 잘 이루어진 과일로서(Okamoto G & Goto S 2005), 참다래(키위)와 달리 과실 표면에 털이 없는 것이 특징으로 외피까지 함께 식용이 가능하다(Jin DE 등 2014). 다래는 폴리페놀과 비타민 C가 풍부하여 높은 항산화 활성을 가지고, 미네랄 중 특히 Ca, Fe, P, Zn 함량이 높으며, 루테인 및 미오이노시톨을 다량 함유하는 것으로 보고되었다(Fisk CL 등 2006; Latocha P 2007; Latocha P & Krupa T 2008; Latocha P 등 2010; Nishiyama I 등 2005; Nishiyama I 등 2004; Okamoto G & Goto S, 2005). 다래는 성숙한 딸기, 파인애플, 바나나, 배, 멜론과 유사한 달콤하고 강한 풍미를 함유하여 관능적으로 향이 우수한 것으로 보고되었으나(Matich AJ 등 2003), 맛이 가장 우수할 때 과실이 쉽게 손상되어 품질이 급격하게 감소하는 단점이 있어(Kim AN 등 2015) 다래를 이용한 가공품 개발이 절실한 실정이다.
본 연구에서는 관능적 요소와 기능성이 우수한 토종 과수 다래와 내산성이 우수한 Acetobacter pasteurianus AFY-4 균주를 이용하여 고산도 다래식초 제조를 위한 최적 초산 발효조건을 확립하고자 하였다.
재료 및 방법
1. 균주 분리
초산 생성능과 내산성이 우수한 초산균을 선발하기 위하여 전국에서 수집한 발효식초 40점을 막걸리에 접종하여 25℃에서 15일간 배양하여 막걸리식초를 제조하였다. 막걸리식초를 YCM 배지(Yeast extract 0.5%, CaCO3 1.0%, Mannitol 2.5%, Ethanol 3.0%)에 2.0% Agar를 첨가한 고체 배지에 사면 도말하여 30℃에서 5일 동안 배양 후, 집락(colony) 주변에 투명환(clear zone)이 생성된 균주 126점을 순수 분리하였다. 투명환 지름 10 mm 이상의 초산 생성능이 우수한 균주를 1차 선발한 후, pH 3.5로 조정한 YCM 배지에서 30℃에서 5일 동안 배양하여 600 nm에서 흡광도를 측정하여 내산성을 갖는 균주를 2차로 선발하였다.
2. 균주 동정
선발 균주를 동정하기 위하여 universal primer 27F (5’-AG AGTTTGATCCTGGCTCAG-3’)와 1492R (5’-GGTTACCTT GTTACGACTT-3’)을 사용하여 16S rRNA 유전자 부위를 PCR(Applied Biosystems, USA)로 증폭한 후, 전기영동(Mupid-exU, Advance, Japan)을 사용하여 DNA를 분리한 후, PCR 산물을 정제하여 염기서열을 분석하였다. 얻어진 염기서열은 NCBI(National Center for Biotechnology Information)에서 BLAST(Basic Local Alignment Search Tool) 프로그램의 BLASTn 기능을 이용하였고, GenBank에 등록되어 있는 염기서열을 이용하여 MEGA v 4.0 프로그램으로 Maximum Likelihood 방법(Tamura K & Nei M, 1993)에 따라 각각의 계통수에서 각 분자에 대한 bootstrap을 1,000회 실시하여 계통수를 작성하였다. 최종 선발된 균주를 Acetobacter pasteurianus AFY-4로 명명하였다.
3. 균주 생육비교
온도, pH, 초기 알코올 도수, 초기 초산 농도 조건을 달리하여 배양한 A. pasteurianus AFY-4 균주의 생균수와 초산생성 농도를 측정하였다. 온도에 따른 생육 영향을 비교하기 위하여 YCM 배지에서 AFY-4 균주를 15∼35℃에서 5일간 배양하였고, pH에 의한 영향은 YCM 배지의 알코올 도수를 6%로 희석 후, 초산균 배지의 pH를 2, 3, 4, 5, 6, 7로 조정하여 30℃에서 5일간 배양하였다. 또한 초기 알코올 도수에 의한 영향을 확인하기 위하여 YCM 배지의 알코올 도수를 5~10%로 조정한 후, 30℃에서 5일간 배양하였다. 초기 초산농도 영향은 YCM 배지의 최종 초산 농도가 0.2, 0.4, 0.8, 1.6, 3.2 및 4.0% 되도록 조정한 후, 30℃에서 5일간 배양하여 비교하였다.
4. 주사전자현미경 관찰
A. pasteurianus AFY-4 균주 배양액을 13,200 rpm에서 10분 동안 원심분리하여 상등액은 제거하고, 0.1 M phosphate buffer(pH 7.2)로 cell pellet을 2회 세척하였다. 10 배수의 4% Glutaraldehyde를 첨가 후, 2시간 동안 냉장보관하며 세포를 고정시켰다. 13,200 rpm에서 1분간 원심분리하여 상등액을 제거한 후, 0.1 M phosphate buffer(pH 7.2)로 15∼30분 동안 2회 세척하였다. 차례대로 30%, 50%, 70% 90% 에탄올을 이용하여 10∼30분 동안 1회 세척한 후, 100% 에탄올로 30분간 2회 세척하였다. 남은 에탄올을 제거하기 위해 Critical Point Dryer로 3∼4시간 동안 건조시킨 후, 30분∼1시간 정도 Pt로 시료를 코팅하였다. 고분해능 주사현미경(Ultra High Resolution Scanning Electron Microscope, Hitachi S-4800, Hitachi, Japan)을 이용하여 초산균을 40K배, 80K배 확대하여 관찰하였다.
5. 알코올 발효
다래는 강원도 원주시 다래농가에서 구입한 것을 사용하였고, 식초 제조용 술로서 다래 와인을 제조하였다. 다래원료의 20% 중량의 물을 가한 후, 설탕을 사용하여 24 °Brix로 농도를 맞추었다. 알코올 발효 균주로 Saccharomyces cerevisiae MA8-3을 이용하였고, YPD broth(Yeast extract 1%, peptone 2%, dextrose 2%)에 접종하여 shaking incubator(ISS-4075R, JEIO TECH, Korea)에서 25℃, 48시간, 200 rpm 조건으로 배양하였다. 전배양한 효모배양액을 가수 및 당을 첨가한 다래에 2% 접종한 후, 25℃에서 7일간 발효한 후, 여과지(Whatman filter paper No. 2)로 여과하여 사용하였다.
6. 실험계획 및 반응표면분석
다래 식초의 초산발효 최적화를 위하여 Design Expert 10(Stat-Easy Co., Minneapolis, MN, USA)을 사용하여 반응표면분석(Response surface methodology, RSM)을 실시하였고, 실험계획은 중심합성계획법으로 설계하였다. 다래 식초 최적화를 위한 독립변수는 3가지로 초기 알코올 도수(X1) 5∼9%, 초기 초산농도(X2) 0.5∼2.5%, 초산균 접종부피(X3) 10∼30% 조건을 5수준(-2, -1, 0, 1, 2)으로 부호화하여 중심합성실험계획에 의하여 실험을 설계하여 총 16개의 설정된 조건으로 실험을 수행하였다(Table 1). 반응변수로는 초산 생성농도(Y1), 잔류 알코올 도수(Y2)로 설정하였다. 다래 식초의 발효 최적조건은 일원배치분산분석(ANOVA test) 및 회귀분석을 이용하였고, 모델의 적합성 여부는 F-검정으로 유의성을 검증하였다. 각 성분들의 반응을 확인하기 위하여, response surface 3D plot을 이용하였다.
7. 초산 발효
여과된 다래 알코올 발효액을 중심합성실험계획법에 따라 초기 알코올 도수, 초기 초산농도, 초산균 접종농도를 조정한 후, 30℃에서 14일 동안 초산 발효하여 다래 식초를 제조하였다.
8. pH 및 당도
시료 10 mL를 채취하여 13,200 rpm에서 1분간 원심분리한 상등액을 시험용액으로 하였다. 미리 표준용액으로 보정한 pH meter(Starter 3100, Ohaus, New Jersey USA)로 3회 이상 반복하여 pH를 측정하였다. 당도는 시료 디지털 굴절당도계(ATAGO, Japan)를 이용하여 측정하고 ̊Brix로 표기하였다.
9. 총산
총산은 시료 10 mL를 취하여 0.1% 페놀프탈레인 지시약을 첨가하고 0.1N NaOH 용액으로 pH 8.2가 될 때까지 적정하여 소비된 NaOH 용액의 소비량을 구한 후, 초산(%, w/w)으로 환산하여 표시하였다.
10. 알코올 도수 및 흡광도
알코올 도수는 알코올 분석기(Alcohol and extract meter, Alex 500, Anton Paar, Austria)를 이용하여 3회 반복하여 측정하였고, 흡광도는 Spectrophotometer(Beckman Coulter, DU 730, USA)를 사용하여 600 nm에서 3회 반복 측정하였다.
결과 및 고찰
1. 초산균 분리 및 선발
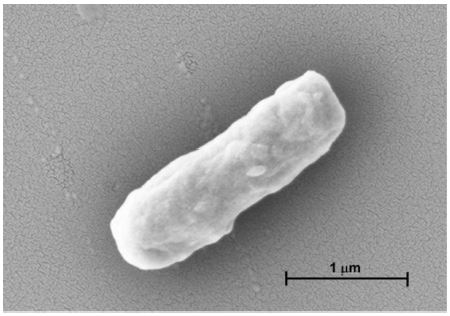
초산균 배지에 CaCO3을 첨가하면 초산균에 의하여 생성된 초산에 의하여 CaCO3이 분해되어 투명환(clear zone)이 생성되는 원리를 이용하여 투명환의 크기가 클수록 초산 생성능이 우수한 것으로 판단하여 투명환 크기가 높은 균주를 선발하였다(Kim SW 등 2008). 전국에서 수집한 발효식초 40점으로부터 126점의 초산균을 분리하여 투명환(clear zone) 지름이 10 mm 이상으로 초산 생성능이 우수한 14점을 동정하였다. 1차 선발 균주 14점에 대하여 pH 3.5에서의 내산성을 평가하여 Table 2에 나타내었다. 초산 생성능과 내산성이 모두 우수한 균주로서 SC16-01, SC16-02, SC16-03, SC26-01 총 4개 균주가 2차 선발되었다. SC16-01 균주는 Lactobacillus paracasei(JQ680434.1)와 염기서열이 99% 일치하였고, SC16-02 균주는 Planomicrobium sp.(JF274802.1)로, SC16-03 균주는 L. satsumensis(KU060283.1)로 각각 동정되었다. SC26-01 균주는 A. pasteurianus(AB906396.1)와 상동성이 99%로 유연관계가 가장 가까운 것으로 확인되었다. 식약처가 허가한 식초 제조용 GRAS(generally recognized as safe) 균주로서 A. pasteurianus와 A. aceti만이 식초제조에 제한적으로 인정되고 있으므로(Yim EJ 등 2015), 다래식초 초산발효를 위한 초산균으로서 최종적으로 SC26-01 균주를 선발하였다. 균주명은 A. pasteurianus AFY-4 균주로 명명하였고, 다른 종과의 계통학적 유연관계를 Fig. 1에 나타내었다. 주사전자현미경을 이용하여 형태학적 특성을 조사한 결과, AFY-4 균주는 2.024 μm 길이의 간균으로 확인되었다(Fig. 2). 또한 균주의 균 표면과 주변 균체와 연결되어 있는 작고 가는 물질이 확인되었고, 이는 식초 발효 시 식초 표면에 생성되는 초산균막의 구성성분으로 추정된다.

Strains properties about acetic acid productivity, acid tolerance, and 16S rRNA-based identification isolated from Korean fermented vinegars
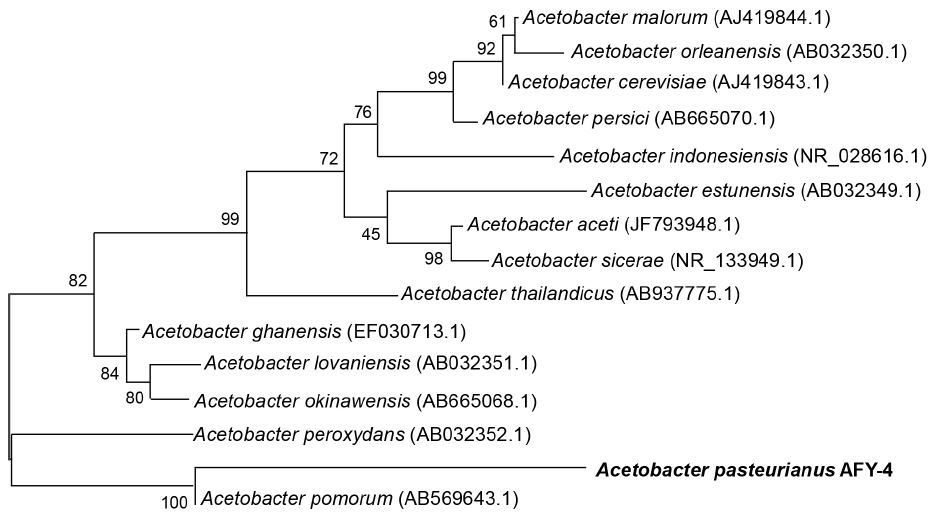
Phylogenetic tree based on 16 rRNA region gene sequences between A. pasteurianus AFY-4 strain and related species.
2. 생육변수에 의한 영향
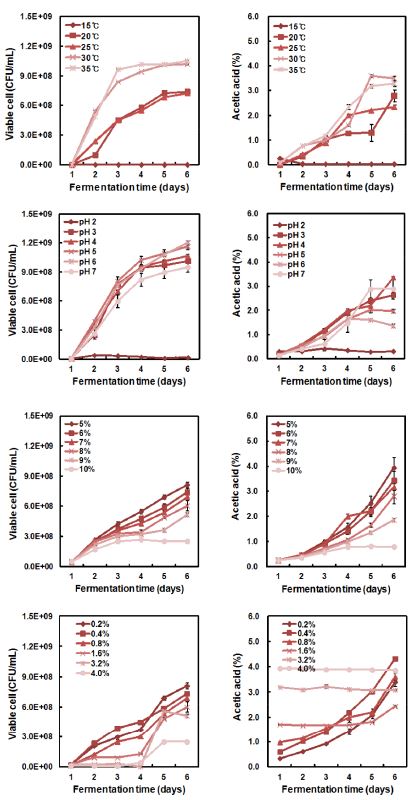
생육온도에 따른 영향을 확인한 결과, AFY-4 균주는 15℃에서 생육하지 못하는 것으로 나타났으며, 20∼35℃ 생육온도에서는 생육과 초산발효가 가능한 것으로 나타났다. 특히 30℃와 35℃에서 생육과 초산생성이 모두 우수한 것으로 확인되었다(Fig. 3). 이는 같은 Acetobacter속에 속하는 A. pomorum KJY8 균주가 20∼35℃에서 초산생성이 우수한 결과와 유사하였다. 매실즙 배지에서 배양한 초산균(Kim YD 등 1996)과 유자즙 배지에서 배양한 초산균(Kang SK 등 2006)은 온도가 25℃보다 낮아지면 발효속도와 증식율이 급격히 낮아진다고 보고되었다. AFY-4 균주는 30∼35℃에서 증식과 발효가 원활하게 나타났으며, 최적 초산 발효온도를 30℃로 선정하였다.
AFY-4 균주는 강산성인 pH 2에서는 생육하지 않았으며, pH 3∼7에서 균주의 생육이 모두 원활히 이루어졌고, 특히 초산 생성농도는 pH 3∼4에서 각 2.6%, 3.4%로 약산성에서 생육과 초산 생성농도가 더 높은 것으로 나타났다(Fig. 3). Park KS 등(1994)은 Acetobacter sp. FM-10 균주가 pH 3 이하와 7 이상에서 증식속도가 저하되었고, pH 4∼6에서 균의 발육이 양호하였고, 특히 pH 5에서 최적 증식을 나타내었다고 보고하였다. 다래 착즙액의 pH는 4.0으로서 AFY-4 균주는 pH 3.5에서 생육과 초산 생성능이 우수하기 때문에 다래 식초 제조에 적합한 것으로 사료된다.
초기 초산농도를 0.4∼4.0%로 하여 AFY-4 균주의 생육을 비교한 결과, AFY-4 균주는 초기 초산농도 0.2∼1.6%에서 2.4∼4.3% 농도의 초산을 생성하였으며, 특히 초기 초산농도 0.4%에서 가장 높은 초산 생성능을 나타내었다(Fig. 3). Chung DH(1980)의 보고에 따르면 초기 초산농도가 높을 때, 초산균의 유도기가 길어지고, 초산 생성이 감소함으로써 초산균의 증식에 영향을 미친다고 하였으며, 본 연구에서도 초기 초산농도가 3.2% 이상에서는 생육이 감소하고, 균이 증식하더라도 초산을 생성하지 못하는 것으로 나타나 초기 초산농도를 3.2% 미만으로 설정해야 한다고 판단하였다. Kim YD 등(1996)의 연구에서는 매실즙 배지의 초기 초산농도가 2%, 3%일 때 발효 7일째에 산도가 5.8%, 6.3%로 나타났으며, 4% 초산농도에서는 초산 생성이 약간 증가하였으나, 발효가 되지 않은 것으로 보고된 것과 유사하였다. 또한 Woo SM 등(2007)의 보고에 따르면 초기 초산농도를 2.0∼0.5%으로 조정하여 참다래를 초산 발효한 결과, 초산 생성농도가 초기 초산농도 1.0%, 1.5%에서 가장 높게 나타난 후, 초산 농도 2.0%에서 감소한 결과와 유사하였다.
초기 알코올 도수에 따른 AFY-4의 초산 생성농도를 비교한 결과, 알코올 도수 5% 처리구에서 3.9%, 6% 처리구에서 3.4%, 7% 처리구에서 3.2%, 8% 처리구에서 2.8%, 9% 처리구에서 1.9%로 나타났다. 또한 알코올 도수 10% 이상에서는 생육과 초산 생성능이 저해되는 것으로 나타났다(Fig. 3). Kim SW 등(2008)에 따르면 초기 알코올 도수가 8%일 때 초산 발효속도가 지연된다고 보고하였으며, Kang SK 등(2006)도 유자식초 제조를 위해 분리한 초산균이 알코올 도수 9% 처리구에서 균이 생육이 억제되어 초산이 생성되지 않았다고 보고하였다. AFY-4 균주는 알코올 도수 10%에서는 생육이 억제되어 초산 발효 시, 초기 알코올 도수를 10% 미만으로 설정해야 하는 것으로 사료된다.
3. 다래식초 초산발효 반응표면분석
다래식초의 초산발효 최적 조건을 확립하기 위하여 중심합성 실험계획법에 의하여 설계된 16개 조건의 실험을 실시하였다. 반응변수로 초산 생성농도(Y1), 잔류 알코올 도수(Y2)를 측정하였고, 결과는 Table 3에 나타내었다. 반응변수 초산 생성농도, 잔류 알코올 도수에 대한 반응표면 분석결과, R2가 각각 0.9928, 0.9638으로 초산 생성농도에 대한 결정계수가 더 높았고, 두 변수에 대한 p-value가 모두 <0.0001로 유의성이 인정되어(Table 4), 3가지 독립 변수에 의한 2가지 반응변수에 대한 반응표면분석 모델이 통계적으로 유의한 것을 확인하였다.

Experimental combination data under different conditions for initial ethanol (X1), initial acetic acid (X2) and acetic acid bacteria inoculum volume (X3) for analysis of RSM and their responses about acetic acid yield (Y1) and residual ethanol (Y2)
4. 다래식초 초산발효 최적화
다래 식초의 초산발효 최적화를 위하여 Canonical 모형의 수치 최적화(Numerical optimization) 및 모형적 최적화(Graphical optimization)를 수행하였다(Fig. 4). 3가지 독립변수 범위 내에서 반응변수인 초산 생성농도(Y1)는 최대로, 잔류 알코올 도수(Y2)는 최저로 설정하여 모델화에 의해 결정된 반응식을 활용하여 최적 수치점을 예측하였다. 초기 알코올 도수 8.95%, 초기 초산농도는 1.86%, 초산균 접종 농도 25.02%로 하였을 때, 초산 생성농도는 8.15%, 잔류 알코올도수는 0.004%로 예측되었다(Table 5). Park HJ 등(2014)은 아로니아 발효조건 최적화 조건으로 초기 알코올 도수 7.78%, 초기 초산농도 1.58%, 초산균 접종부피 19.39%로 보고하였고, Kim SW 등(2008)은 양파식초 최적 초산 생성조건으로 초기 알코올 도수 5%, 초기 초산농도 2%, 종초 접종농도 10%로 보고하였다. 식초 제조 시 최적 알코올 도수는 원료에 따라 다양하게 보고되었는데, 매실식초 4∼6%(Kim YD 등 1996), 클로버 식초 4.5%(Yang HC & Choi DS 1979), 보리 6%(Kim HJ 등 1985), 참다래 식초 6%(Woo SM 등 2007), 꾸지뽕 열매 식초 5%(Yim EJ 등 2015), 유자식초 5%(Kang SK 등 2006)로 보고되었다.
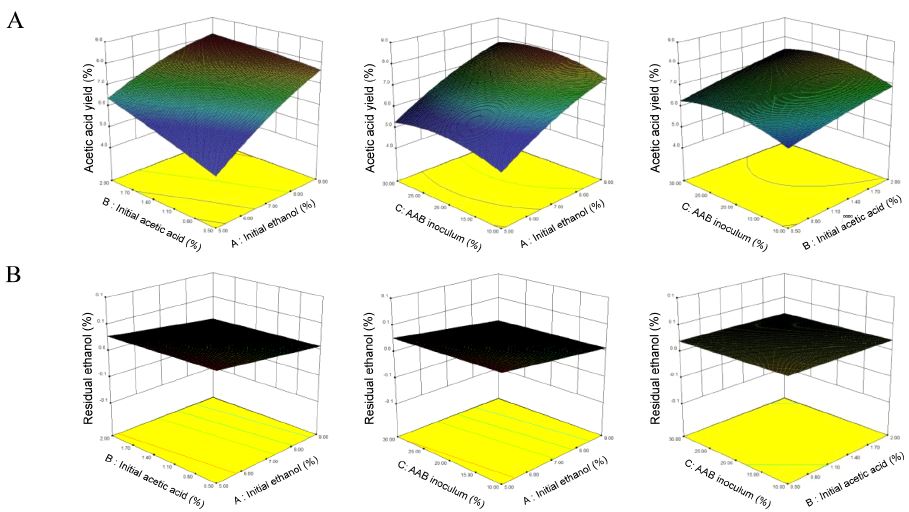
Response surface plots for optimization of acetic acid fermentation of hardy kiwi vinegar using A. pasteurianus AFY-4 (A: Acetic acid yield, B: Residual ethanol).
결 론
본 연구에서는 강원도 홍천군에서 수집한 발효식초에서 초산 생성능과 내산성이 우수한 A. pasteurianus AFY-4 균주를 분리하였다. AFY-4 균주는 배양온도 30~35℃, pH 3∼7, 초기 알코올 도수 5∼9%, 초기 초산농도 0.2∼1.6% 조건에서 생육과 초산생성능이 우수한 것으로 나타났다. 다래 식초의 초산 발효 최적화를 위하여 초기 알코올 도수(X1), 초기 초산농도(X2), 초산균 접종부피(X3)를 3가지 독립변수로 설정하여 중심합성계획법으로 실험설계하여 반응표변분석을 실시한 결과, 반응변수인 초산 생성농도(Y1)와 잔류 알코올 도수(Y2)에 대하여 통계적으로 매우 유의한 것으로 나타났다. 최적 초산발효 조건은 초기 알코올 도수 8.95%, 초기 초산농도 1.86%, 초산균 접종 농도 25.02% 조건에서 초산 생성농도와 잔류 알코올 도수가 각각 8.15%, 0.004%로 예측되었다. 이를 바탕으로 내산성이 우수한 A. pasteurianus AFY-4 균주를 이용한 다래 식초제조의 최적화 조건을 확립하여 표준화된 고산도 다래 식초제조가 가능할 것으로 사료된다.
Acknowledgments
이 논문은 산업통상자원부 지역주력산업육성사업(R0003863)으로 지원되어 수행된 연구 결과이며, 이에 감사드립니다.
References
- Chung, DH, (1980), Studies on the vinegar fermentation, Collection of Thesis Chungang University, Anseong, p181-196.
-
Fisk, CL, McDaniel, MR, Strik, BC, Zhao, Y, (2006), Physicochemical, sensory, and nutritive qualities of hardy kiwifruit (Actinidia arguta ‘Ananasnaya’) as affected by harvest maturity and storage, J Food Sci, 71(3), pS204-S210.
[https://doi.org/10.1111/j.1365-2621.2006.tb15642.x]

- Ha, YD, Kim, KS, (2000), Civilization history of vinegar, Food Ind Nutr, 5(1), p1-6.
- Jeoung, YJ, Lee, MH, (2000), A view and prospect of vinegar industry, Food Ind Nutr, 5(1), p7-12.
-
Jin, DE, Park, SK, Park, CH, Seung, TW, Heo, HJ, (2014), Nutritional compositions of three traditional Actinidia (Actinidia arguta) cultivars improved in Korea, J Korean Soc Food Sci Nutr, 43(12), p1942-1947.
[https://doi.org/10.3746/jkfn.2014.43.12.1942]

- Kang, SK, Jang, MJ, Kim, YD, (2006), Isolation and culture conditions of Acetobacter sp. for the production of citron (Citrus junos) vinegar, Korean J Food Preserv, 13(3), p357-362.
-
Kim, AN, Kang, SW, Heo, HJ, Chun, JY, Choi, SG, (2015), Effect of heat treatment on quality characteristics and antioxidant activity of Korean traditional Actinidia (Actinidia arguta) cultivars puree, Korean J Food Preserv, 22(3), p408-420.
[https://doi.org/10.11002/kjfp.2015.22.3.408]

- Kim, DH, (1999), Studies on the production of vinegar from fig, J Korean Soc Food Sci Nutr, 28(1), p53-60.
- Kim, HJ, Park, SH, Park, CH, (1985), Studies on the production of vinegar from barley, Korean J Food Sci Technol, 17(5), p350-354.
-
Kim, SW, Park, JH, Jun, HK, (2008), Analysis of optimum condition for production of an onionic vinegar by two-step fermentations, J Life Sci, 18(10), p1410-1414.
[https://doi.org/10.5352/jls.2008.18.10.1410]

- Kim, YD, Kang, SH, Kang, SK, (1996), Studies on the acetic acid fermentation using maesil juice, J Korean Soc Food Sci Nutr, 25(4), p695-700.
- Latocha, P, (2007), The comparison of some biological features of Actinidia arguta cultivars fruit, Ann Warsaw Univ of Life Sci-SGGW Horticulture L/A, 28, p105-109.
- Latocha, P, Krupa, T, (2008), The mineral composition of new genotypes of hardy kiwifruit (Actinidia Lindl.) bred at SGGW, Ann Warsaw Univ of Life Sci-SGGW Horticulture L/A, 29, p105-110.
- Latocha, P, Krupa, T, Wołosiak, R, Worobiej, E, Wilczak, J, (2010), Antioxidant activity and chemical difference in fruit of different Actinidia sp, Int J Food Sci Nutr, 61(4), p381-394.
- Lee, WJ, Kim, SS, (1998), Preparation of Sikhe with brown rice, Korean J Food Sci Technol, 30(1), p146-150.
-
Matich, AJ, Young, H, Allen, JM, Wang, MY, Fielder, S, McNeilage, MA, MacRae, EA, (2003), Actinidia arguta: volatile compounds in fruit and flowers, Phytochemistry, 63(3), p285-301.
[https://doi.org/10.1016/s0031-9422(03)00142-0]

-
Nishiyama, I, Fukuda, T, Oota, T, (2005), Genotypic differences in chlorophyll, lutein, and β-carotene contents in the fruits of Actinidia species, J Agric Food Chem, 53(16), p6403-6407.
[https://doi.org/10.1021/jf050785y]

-
Nishiyama, I, Yamashita, Y, Yamanaka, M, Shimohashi, A, Fukuda, T, Oota, T, (2004), Varietal difference in vitamin C content in the fruit of kiwifruit and other Actinidia species, J Agric Food Chem, 52(17), p5472-5475.
[https://doi.org/10.1021/jf049398z]

- Okamoto, G, Goto, S, (2005), Juice constituents in Actinidia arguta fruits produced in Shinjo, Okayama, Sci Rep Fac Agric Okayama Univ, 94, p9-13.
-
Park, HJ, Jeong, SH, Yoon, HH, Jung, JH, Song, JY, (2014), Optimization of the acetic acid fermentation for aronia vinegar using response surface methodology, Korean J Food Cook Sci, 30(6), p792-799.
[https://doi.org/10.9724/kfcs.2014.30.6.792]

- Park, KS, Chang, DS, Cho, HR, Park, UY, (1994), Investigation of the cultural characteristics of high concentration ethanol resistant Acetobacter sp, J Korean Soc Food Sci Nutr, 23(4), p666-670.
- Park, MH, Lyu, DK, Ryu, CH, (2002), Characteristics of high acidity producing acetic acid bacteria isolated from industrial vinegar fermentation, J Korean Soc Food Sci Nutr, 31(3), p394-398.
- Park, YK, Jang, YS, Lee, MH, Kwon, OW, (2007), Comparison of antioxidant capacity and nutritional composition of three cultivars of Actinidia arguta, J Korean For Soc, 96(5), p580-584.
- Tamura, K, Nei, M, (1993), Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees, Mol Biol Evol, 10(3), p512-526.
- Woo, SM, Kim, OM, Choi, IW, Kim, YS, Choi, HD, Jeong, YJ, (2007), Condition of acetic acid fermentation and effect of oligosaccharide addition, Korean J Food Preserv, 14(1), p100-104.
- Yang, HC, Choi, DS, (1979), Physiological characteristics of acetic acid bacteria isolated from clover from clover flower vinegar, Appl Biol Chem, 22(3), p150-159.
-
Yi, MR, Hwang, JH, Oh, YS, Oh, HJ, Lim, SB, (2014), Quality characteristics and antioxidant activity of immature Citrus unshiu vinegar, J Korean Soc Food Sci Nutr, 43(2), p250-257.
[https://doi.org/10.3746/jkfn.2014.43.2.250]

-
Yim, EJ, Jo, SW, Lee, ES, Park, HS, Ryu, MS, Uhm, TB, Kim, HY, Cho, SH, (2015), Fermentation characteristics of mulberry (Cudrania tricuspidata) fruit vinegar produced by acetic acid bacteria isolated from traditional fermented foods, Korean J Food Preserv, 22(1), p108-118.
[https://doi.org/10.11002/kjfp.2015.22.1.108]

- Yoon, HN, (1998), Simultaneous gas chromatographic analysis of ethanol and acetic acid in vinegar, Korean J Food Sci Technol, 30(6), p1247-1251.