
고단백식이를 급여한 마우스에서 상백피 및 상지추출물의 대장염 완화 효능
Abstract
Prolonged ulcerative colitis (UC) is a major risk factor of colorectal cancer (CRC) in human. Many epidemiological and experimental studies have reported that high protein diet (HPD) intake deteriorates the intestinal environment, which can lead to UC and CRC development. Moreover, we previously showed that feeding HPD dose dependently increased colonic tumor development in a chemical induced mouse colon carcinogenesis model. The mulberry tree (Morus alba L), which is distributed widely in east Asia, has a wide spectrum of biological activities including anti-inflammation and anti-carcinogenesis. In this study, we investigated whether the water extracts of mulberry root bark (MRB) and mulberry twig (MT) could ameliorate the level of colitis in HPD fed mice. Six week-old, male ICR mice were grouped into four groups: control (n=3), dextran sodium sulfate (DSS, n=6), DSS+MRB (n=6), and DSS+MT (n=6). All of the mice were fed HPD (50% casein/kg diet) for 4 weeks. On week 3 of the experimental period, mice in all except the control group, were administrated 3% DSS in drinking water for 5 days to induce colitis. At the same time, MRB (600 mg/kg body weight/day) and MT (5 g/kg body weight/day) was orally administered to mice in the MT and MRB group, respectively, for 5 days. The MRB and MT extracts significantly reduced the disease activity index, mucosal thickness, and level of plasma nitric oxide relative to the DSS group. Additionally, plasma IL-6 and colonic myeloperoxidase activities were significantly reduced by MT and MRB, respectively, compared to the DSS group. However, there were no significant differences in colon length, colon weight, and plasma tumor necrosis factor-α between the DSS and MRB or MT group. Taken together, these results suggest that MRB and MT water extracts can be developed as anti-colitis food components, especially when protein ingestion is increased in human.
Keywords:
Colon, inflammation, Morus alba L., mouse, protein diet서 론
만성 궤양성 대장염(ulcerative colitis; UC)은 대장암 발병의 주요 위험인자 중 하나로 10년 이상 UC가 지속된 경우 대장암 발생율이 매년 0.5∼1% 증가하는 것으로 알려져 있다(Harpaz N & Talbot IC 1996). 최근 서구화된 식습관의 변화로 인해 우리나라를 비롯한 아시아 지역 국가에서 궤양성 대장염의 발병이 증가하는 추세에 있는데(Prideaux L 등 2012), 특히 육류를 포함하여 단백질을 과량으로 섭취하였을 때 위와 소장에서 완전히 소화되지 못한 단백질은 대장으로 유입되어 장내 미생물에 의해 부패가 진행되게 된다. 이때 생기는 황화수소, 페놀, 인돌, 암모니아, 곁가지 지방산, 단쇄지방산과 같은 물질은 장 상피세포의 유전적 손상과 세포사멸을 야기하면서 대장암 발병율을 증가시키는 원인이 될 수 있다(Kim E 등 2013). 또한 이로 인해 장내 균총의 균형이 깨어져 면역, 염증반응이 일어나는 것도 대장암의 발병률을 증가시키는 것으로 보인다. 한편, 고단백식(high protein diet; HPD)에 의한 대장암 발병율의 증가는 단백질 종류보다는 단백질의 양과 더 높은 상관관계를 보이는 것으로 보고되었는데, 단백질을 총 에너지의 20% 이상으로 급여했을 때는 카제인, 대두단백질, 붉은색 육류 모두 정상 단백질 식이군(15% 단백질)에 비해서 대장상피세포의 유전적 손상이 증가함을 보였다(Toden S 등 2005; Toden S 등 2006; Toden S 등 2007). 본 연구실에서도 앞서 화학적으로 유도한 마우스 대장암 모델에서 20% 단백질(카제인)을 함유하는 정상식이군에 비해 50% 단백질을 함유하는 HPD군에서 대장의 염증과 종양발생정도가 현저히 증가하는 것을 확인한 바 있다(Byun SY 등 2015; Tak KH 등 2017).
뽕나무는 뽕나무과(Moraceae)의 뽕나무속(Morus)에 속하는 관목식물로서 우리나라를 비롯하여 일본, 중국, 베트남 등 동아시아뿐만 아니라, 유럽 및 미국지역과 아열대 및 열대지역에서도 널리 재배되고 있다. 상백피(mulberry root bark; MRB)는 뽕나무의 뿌리껍질로, 예로부터 한방에서는 해열, 항경련, 항알레르기, 항염증 작용과 더불어 이뇨촉진 등의 효과가 있는 것으로 알려져 왔으며, 상지(mulberry twig; MT)는 뽕나무의 가지로, 한방에서 상지를 말려 만든 상지차는 관절염, 기침, 중풍, 비만에 효과가 있는 것으로 기록되어 있다(Jang YJ 등 2015). 상백피와 상지에는 옥시레스베라트롤(oxyresveratrol), 레스베라트롤(resveratrol), 모라신(moracin) 등과 같은 물질들이 주요 생리활성물질로 함유되어 있으며(Choi SW 등 2013), 최근 이들 성분들의 항암(Ding B 등 2016), 항염(Choi IY 등 2011), 항당뇨(Park SY 등 2016), 항산화(Chang LW 등 2011) 효능 등이 보고된 바 있다. 그러나 아직까지 MRB 및 MT 추출물이 동물의 대장염 및 대장암에 미치는 영향에 대해서는 연구된 바가 없으며, 특히 HPD를 급여한 마우스의 대장염악화를 완화시킬 수 있는지에 대해서는 현재까지 연구된 바가 전무하다.
따라서 본 연구에서는 부작용이 없고 안전한 천연물 성분에 의한 선제적인 대장염 중재를 통하여 대장암 발생을 줄이는 방법을 모색하기 위한 연구의 일환으로 사람의 UC 증상과 비슷한 병태를 나타내는 dextran sodium sulfate(DSS) 유도 마우스 대장염 모델을 이용하여 HPD 급여로 대장염을 악화시켰을 때 MRB와 MT의 열수추출물이 항대장염 효능을 나타내는지를 알아보고자 하였다.
재료 및 방법
1. MRB 및 MT 열수추출물 제조
MRB와 MT 열수추출물은 대구가톨릭대학교 최상원 교수 실험실로부터 제공받아 사용하였다. 제조 방법으로는 뽕나무(Morus alba L.) MRB 및 MT는 봄에 잎이 내돋지 않은 때에 청일뽕 뽕나무로부터 채취 후 MRB는 껍질을 벗기고 MT는 세절하여 흐르는 물에 수세하였다. 일주일간 음지에서 자연 건조한 다음 50±5.0℃의 열풍건조기(COBP-15S, Shinheung, Seoul, Korea)에서 2일간 건조한 것을 실험재료로 사용하였다[수분함량: MRB(9.7±0.46%), MT(7.82±0.2%)]. 다음 세절한 건조 MRB 및 MT(100 g)에 이온수 1.5 L를 각각 가하여 초음파추출기(Power Sonic 420, Hwashintech, Incheon, Korea)에서 2시간 2회 추출한 후 여과(Whatman No. 2, Maidstone, England)하고 진공감압농축기(Eyela, Tokyo, Japan)로 농축하여 MRB 및 MT 열수추출물을 각각 제조하였다[수율: MRB(26.0±2.7%), MT(2.5±0.3%)].
2. 실험동물 사육 및 실험식이
실험동물은 6주령 수컷 ICR 마우스 21마리를 코아텍(주)사(Busan, Korea)로부터 구입하여 사용하였다. 실험동물은 12시간 명암주기를 유지하고, 항온(25±2℃), 항습(50±5%) 환경에서 사육하였다. 마우스는 1주 동안 고형사료를 급여하여 실험환경에 적응시킨 후, 난괴법(randomized complete block design)에 따라 다음과 같이 4군으로 분류하였다: 생리식염수를 공급한 대조군(control, n=3); DSS를 공급한 군(DSS, n=6); DSS와 함께 상백피 열수추출물을 공급한 군(MRB, 600 mg/kg BW/day, n=6); DSS와 함께 상지 열수추출물을 공급한 군(MT, 5 g/kg BW/day, n=6). 실험식이는 AIN-76A diet에 기초하여 카제인 함량을 50%로 증가시킨 HPD로 제조하였으며(Table 1), 4군의 모든 동물들에게 총 4주간 급여하였다. 실험기간 중 식이와 물은 자유롭게 섭취하도록 하였다. 식이섭취량은 매일, 체중은 주 1회 일정 시각에 측정하였다. 실험동물은 실험 3주차에 3% DSS(MP Biomedicals Korea, Seoul, Korea)를 음용수로 공급하는 동시에 상백피 또는 상지열수추출물을 5일간 경구투여하였다. 본 동물실험은 대구가톨릭대학교 동물실험윤리위원회에서 승인(승인번호 제IACUC-2014-041호)한 절차에 따라 수행하였다.
3. 질병활성도 측정
대장염의 유발정도를 평가하기 위하여 DSS를 급여하는 기간 동안 매일 체중, 대변 묽기, 혈변 유무, 항문 출혈정도를 측정하였다. 전반적인 질병의 심한 정도는 Cooper HS 등(1993)이 제시한 임상 평가 시스템에 기초하여 0∼4점 척도로 평가하였다: 0, 체중감소 없음, 대변 묽기 정상, 혈변 없음, 항문 출혈 없음; 2, 5∼10% 체중 감소, 약간 묽은 대변, 갈색 변, 항문 출혈 보임; 3, 10∼20% 체중 감소, 묽은 대변, 붉은색 변, 항문 출혈; 4, 20% 이상 체중 감소, 설사, 혈변, 항문 출혈 심함.
4. 혈액 및 장기 채취
희생 전 12시간 절식 후, 실험동물은 CO2로 마취하여 개복을 하고, 복부 대정맥으로부터 헤파린(1,000 IU/mL) 처리된 주사기를 사용하여 채혈하였다. 혈액은 13,200 rpm, 4℃에서 10분간 원심 분리하여 혈장을 분리한 후 -80℃ 급속냉동고에서 분석 전까지 보관하였다. 채혈 후 즉시 맹장 아래부터 항문까지 적출하여 길이를 측정한 다음, 대장 내용물을 생리식염수로 씻고 물기를 제거한 후 무게를 측정하였다. 대장 조직은 proximal, middle, distal 세 부분으로 나누었으며, 일부 개체의 distal 부분은 10% 포르말린에 고정하여 조직형태학적분석 전까지 보관하였고, 나머지 조직은 액체질소로 급속 동결하여 -80℃ 초저온냉동고에서 시료분석 전까지 보관하였다.
5. 혈액분석
혈장 nitric oxide(NO), tumor necrosis factor(TNF)-α, interleukin(IL)-6 농도는 각각 NO detection kit(iNtRON, Sungnam, Korea), Mouse TNF-α ELISA Ready-SET-Go kit(eBioscience, San Diego, CA, USA), Mouse IL-6 ELISA Ready-SET-Go! kit(eBioscience)를 사용하여 제조사의 설명서에 따라 측정하였다.
6. 조직형태학적 분석
포르말린에 고정한 마우스 distal 조직은 형태학적 분석을 위해 파라핀 조직 표본을 제작한 다음 4 μm 두께로 절편하였다. Hematoxylin & eosin으로 염색한 후 광학 현미경을 이용하여 40배의 배율에서 관찰하였다. 점막 두께는 Leica Application Suite program(ver. 4.7.1)을 이용하여 측정하였으며, 8개의 다른 부위 측정값의 평균으로 나타내었다.
7. Myeloperoxidase(MPO) 활성 측정
Krawisz JE 등(1984)의 방법에 따라, 일정한 양의 대장조직(10% wt/vol)에 0.5% hexadecyl trimethyl ammonium bromide를 포함한 50 mM sodium phosphate buffer(pH 6.0) 1 mL를 가하여 초음파 분쇄한 후 12,000 rpm, 4℃에서 10분 동안 원심분리하여 상층액을 효소액으로 사용하였다. 효소액 100 μL에 Ο-dianisidine(20 mg/mL) 30 μL를 가한 후 H2O2가 최종농도 0.0005%가 되게 가하여 20℃에서 10분간 반응시켰다. 2% sodium azide 30 μL를 가하여 반응을 종료시킨 후, 25℃, 460 nm에서 SpectraMax M2 Microplate Reader로 효소활성을 측정하였다. MPO 활성 l unit은 25°C에서 H2O2 1 μmole/min을 분해하는 효소의 활성을 나타내며. 단백질 g 당 MPO unit(U)으로 표시하였다.
8. 통계처리
실험의 모든 결과는 SPSS(ver. 19, IBM, Armonk, NY, USA) 통계 처리 프로그램을 사용하였고, 각 항목에 따라 평균값±표준오차(Standard error, S.E.)를 구하였다. 각 군별 유의성 검증은 one-way analysis of variance(ANOVA) test를 하였고, 여러 군 간의 차이는 Duncan’s multiple range test에 의해 유의 수준 p<0.05 에서 사후검정을 실시하였다.
결과 및 고찰
1. 질병활성도 및 대장 길이와 무게에 미치는 영향
MRB 및 MT 추출물의 투여가 대장염의 발생 정도를 완화시키는지 알아보기 위하여 먼저 HPD를 급여한 DSS 유도 대장염 모델에서 질병활성도, 대장 길이 및 무게의 변화를 분석하였다. DSS를 급여하는 동안 대장염의 악화 정도를 반영하는 체중, 대변 묽기, 혈변 유무, 항문출혈 정도를 평가하여 질병활성도를 측정한 결과, DSS를 급여하기 전에는 군간 질병활성도의 차이는 없었다(Fig. 1A). 그러나 DSS를 급여하는 5일 동안 실험동물들의 질병활성도는 control군에 비하여 DSS를 급여한 군들에서 DSS 급여 이틀째부터 유의적으로 상승하였고, DSS군(질병대조군)에 비해서는 MRB군과 MT군의 질병활성도가 유의적으로 감소하였다. DSS 급여 마지막 날 측정한 결과는 DSS군에 비해 MRB군에서 질병활성도의 감소가 가장 뚜렷이 나타났다. 동물 희생 후 대장을 적출하여 대장 길이와 무게를 측정한 결과, control군에 비하여 DSS를 급여한 군들에서 유의적인 대장 길이의 감소 및 대장 무게의 증가가 나타났으나, MRB와 MT 추출물 투여에 따른 차이는 없었다(Fig. 1B, C).
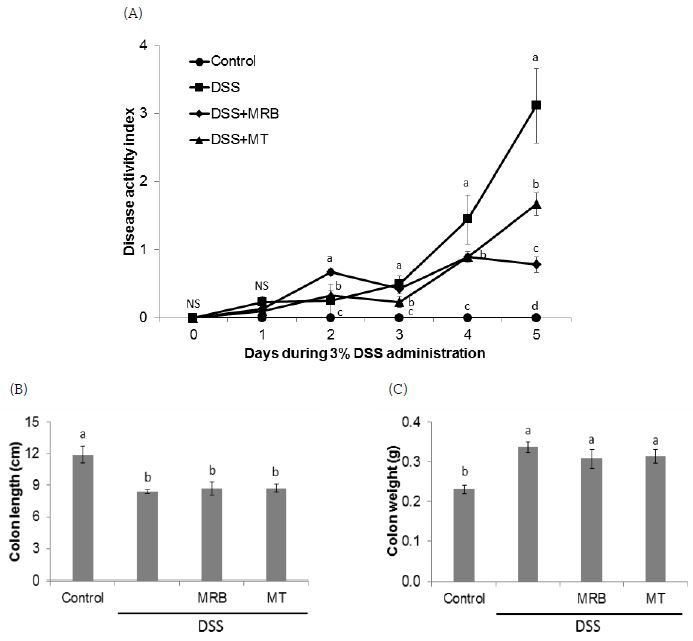
Effects of MRB and MT water extracts on DSS-induced colitis in mice.(A) Clinical scores of mice in each experimental group were daily monitored for period of DSS treatment. (B) Colon length and (C) colon weight were measured. All data are presented as mean±S.E. Means with different letters are significantly different at p<0.05 by Duncan's multiple range test. The alphabet a in the figure was given to the largest number. NS, not significant. HPD, high protein diet; DSS, dextran sodium sulfate; MRB, mulberry root bark; MT, mulberry twig.
세계보건기구(WHO) 산하 국제암연구소(IARC)의 보고 자료에 의하면 우리나라 대장암 발병율은 인구 10만명당 45명으로 조사대상 184개국 중에서 1위로 나타났다(http://gco.iarc.fr.). 이는 서구화된 식습관과 무관하지 않은 결과로 전세계적으로도 대장암은 고지방, 고열량, 고단백식을 하는 선진국에서 그 발생율이 증가하고 있다(Molodecky NA 등 2012). 한편, 많은 임상연구에서 UC를 가지고 있는 환자의 경우, 일반 사람들보다 대장암이 발생할 상대적인 위험도가 2∼8배 높은 것으로 나타났는데(Hardy RG 등 2000), 이는 염증조직에서의 다양한 병태생리학적 변화가 암세포의 증식 및 성장을 촉진할 뿐만 아니라, 이미 형성된 종양의 경우에는 악성 암종으로의 진전을 유도하기 때문이다(Marelli G 등 2017). 따라서 본 연구에서는 선재적인 대장염 중재를 통하여 대장염과 연관된 대장암 발생율을 줄일 수 있는 방안을 찾기 위한 노력의 일환으로 HPD를 급여한 DSS 유도 마우스 대장염 모델에서 뽕나무의 MRB와 MT 추출물의 대장염 완화효능을 최초로 확인하였다.
DSS 유도 마우스 대장염 모델은 형태학적으로 그리고 질병의 증상면에서 사람의 UC와 많은 유사점을 나타내는 우수한 전임상 동물모델로서 1∼5%의 DSS 레진을 음용수로 수일간 공급하였을 때 대장점막에 염증과 궤양이 유발된다(Cooper HS 등 1993; Cooper HS 등 2000; Tanaka T 등 2006). 한편, 본 연구에서는 식이의 50%가 카제인으로 구성된 HPD를 모든 동물들에게 공급하였는데 총 열량의 20% 이상을 단백질로 제공하는 HPD의 섭취는 사람과 동물 모두에서 대장염과 대장암의 발생을 증가 및 악화시키는 것으로 보고되고 있다(Kim E 등 2013). 최근 우리나라에서 대장염과 대장암 발생의 급격한 증가는 육류섭취의 증가와 무관하지 않고, 다이어트 및 체중감량 시 자주 섭취하는 식사 또한 고단백 저탄수화물식의 형태이므로 이러한 식생활을 반영하여 HPD의 급여로 DSS에 의한 대장염이 더 악화되는 동물모델에서 MRB와 MT의 항대장염 효능을 연구하고자 시도하였다. 주지할 사항은 정상단백식이대조군과 HPD 급여군과의 대장염 및 대장암 유발정도의 차이는 본 연구실에서 수행된 선행연구에서 이미 보고(Byun SY 등 2015; Tak KH 등 2017)된 바 본 연구에서는 HPD 급여 대장염 모델에서의 연구에 한정하였다.
실험결과, Melero A 등(2017)이 보고한 바와 같이 3% DSS를 5일 동안 급여한 마우스에서 대조군에 비해 DSS군에서 대장염 질병활성도가 유의적으로 증가하였고, DSS 유도 대장염 모델에서 특징적으로 나타나는 대장 길이의 감소 및 대장 무게의 증가(Fiocchi C 1998; Hendrickson BA 등 2002)도 나타났다. 그러나 MRB와 MT 투여군의 경우, DSS에 의한 질병활성도는 유의적으로 감소되었으나, 대장 길이의 감소 및 대장 무게의 증가를 경감시키지는 못하였다. Choi IY 등(2011)은 5% DSS를 7일간 급여한 마우스 대장염 모델에서 MT 물 추출물을 급여한 결과, DSS군에 비해 질병활성도는 유의적으로 감소하였고, 대장 길이는 증가하였음을 보고한 바 있다. 본 연구에서는 3% DSS를 5일간 급여하였는데, 그 이유는 본 실험에 사용한 HPD의 경우, 앞서 보고(Tak KH 등 2017)한 바와 같이, 정상식이(20% 카제인)에 비하여 대장염 악화로 인한 실험동물의 생존율이 현저히 감소되었기 때문에 상대적으로 저용량의 DSS와 MRB, MT 추출물을 짧은 기간 동안 급여하는 것으로 실험하였다. 종합하면, 5일간의 MRB, MT의 투여는 DSS에 의한 대장염 질병활성도는 감소시킬 수 있었으나, 대장염으로 인해 줄어든 대장 길이 및 증가한 대장 무게를 정상화시키기에는 충분하지 못한 기간이 었던 것으로 사료된다. 향후 MRB, MT 투여를 DSS 급여 전에 HPD 공급과 함께 실시하는 실험모델에서 이들 추출물의 대장염 예방효과를 확인해 볼 필요가 있을 것으로 생각된다.
2. 조직 형태학적 변화 및 점막 두께에 미치는 영향
DSS 유도 마우스 대장염 모델에서 대장 조직은 크립트의 파괴 및 소실, 염증세포의 침투, 궤양 등 대장 구조의 전형적인 염증성 변화를 보인다(Clapper ML 등 2007; Park YH 등 2015). 본 실험에서도 DSS군은 control 군에 비해 대장 크립트의 소실 및 대장점막의 비후가 현저히 관찰되었으나(Fig. 2A), MRB와 MT군에서는 DSS로 인한 대장조직의 형태학적 변화가 상쇄되는 것을 관찰할 수 있었다.
한편, 만성 염증이 암 발생에 기여하는 이유 중 하나로 염증조직에서 생성되는 다양한 염증성 사이토카인과 성장인자들이 apoptosis를 억제하고, 세포 증식을 촉진하는 요인으로 작용하는 것을 들 수 있다(Philip M 등 2004). 본 실험에서도 염증으로 인한 대장점막세포의 증식정도를 분석해 보기 위하여 대장점막 두께를 측정한 결과, control군(166.87±35.3 μm)에 비해 DSS군(615.04±98.5 μm)에서 점막 두께가 크게 증가하였으며, DSS군에 비해 MRB군(397.28±94.9 μm)과 MT군(342.36±83.4 μm)에서 유의적으로 감소함을 확인하였다(Fig. 2B). Tak KH 등(2017)의 연구결과에서 보면 DSS 유도 마우스 대장염 모델에서 50% 카제인(50P)을 급여한 군의 대장점막 두께가 20% 카제인(20P)을 급여한 정상식이군의 점막두께에 비하여 2배 이상 증가하였으며, 세포증식의 지표로 proliferating cell nuclear antigen(PCNA) 면역염색을 했을때도 50P군의 PCNA 염색세포수가 20P군보다 3배 더 많았다. 본 DSS 유도 대장염 모델에서 HPD의 급여로 증가된 대장점막의 병리학적 변화와 대장점막 두께를 MRB와 MT 추출물이 30% 정도 상쇄시킬 수 있는 것으로 나타난 결과는 향후 MRB와 MT 추출물을 HPD 섭취에 따른 대장염 발생을 예방할 수 있는 기능성 식품으로 개발할 가치가 있음을 제시한다.
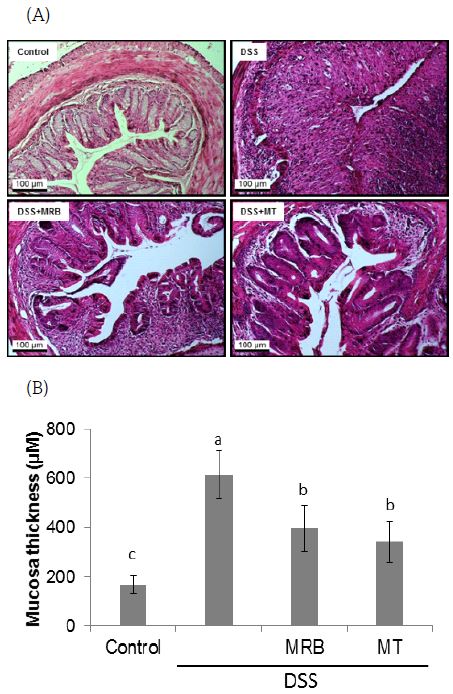
Histopathological change of DSS-induced colitis in mice.The distal part of large intestine was removed and fixed in 10% formalin. (A) Tissue sections were stained with hematoxylin and eosin to determine the morphological lesions and colonic mucosa changes. Representative histological images of control, DSS, DSS+MRB, DSS+MT are shown at 20 × magnification. (B) Mucosal thickness was measured microscopically. Data are presented as mean±S.E. Values with different letters above the bars are significantly different by ANOVA with Duncan's multiple range test at p<0.05. The alphabet a in the figure was given to the largest number. HPD, high protein diet; DSS, dextran sodium sulfate; MRB, mulberry root bark; MT, mulberry twig.
3. 혈장 염증성 사이토카인 및 대장조직 MPO 활성에 미치는 영향
DSS는 TNF-α, IL-6, IL-10 등을 포함하여 모든 전염증성 사이토카인들의 증가를 야기시키는 것으로 알려져 있다(Randhawa PK 등 2014). MRB와 MT 추출물의 대장염 완화효능을 확인하기 위하여 혈장 염증 지표들을 분석한 결과, NO 농도는 control군에 비해 DSS군에서 증가하였고, DSS군에 비해 MRB군과 MT군에서 유의적으로 감소하였다(Fig. 3A). 특히 MT군의 NO 농도는 control군 수준으로 감소하였다. TNF-α 농도는 DSS군에 비해 MRB군과 MT군에서 감소하는 경향을 나타내었으나 유의적인 차이는 없었다(Fig. 3B). 혈장 IL-6 농도는 control군(64.1±0.4 pg/mL)에 비해 DSS군(75.8±7.0 pg/mL)에서 증가하는 경향을 보였으나, 유의적인 차이는 없었다. 이는 대조군의 IL-6 농도가 다소 높게 측정되었기 때문으로 보이며, 염증성 사이토카인들의 농도는 영양상태나 음식섭취에 영향을 받는다는 연구결과들(Smidowicz A & Regula J 2015; Galland L 2010)에 비추어 보았을 때 HPD의 급여로 인한 일시적인 혈장 IL-6 농도 상승으로 사료된다. 그러나 NO와 TNF-α 농도는 대조군에 비해 DSS군에서 유의적으로 증가하였으므로 IL-6가 더 민감하게 식이에 영향을 받는지에 대해서는 더 구체적인 연구가 필요할 것으로 사료된다. DSS군과 비교했을 때에는 MRB군(65.8±5.1 pg/mL)보다는 MT군(58.3±3.8 pg/mL)에서 IL-6의 유의적인 감소를 보였다(Fig. 3C). 호중구의 조직 침투정도를 반영하는 생화학적 지표로 대장조직 MPO 활성을 측정한 결과, DSS 급여군들 중에서 MRB군의 활성이 control군 수준으로 감소함을 보였다(Fig. 3D). MT군에서는 MPO 활성이 감소하는 경향을 보였으나, DSS군에 비해 유의적인 차이는 없었다.
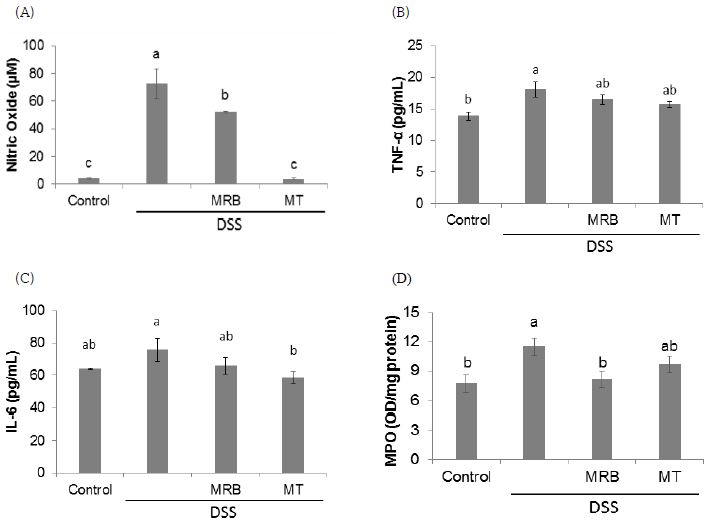
The levels of inflammatory mediators in plasma and MPO activity in colon tissues.(A) Plasma nitric oxide(NO), (B) tumor necrosis factor-alpha(TNF-α), (C) interleukin-6(IL-6), and (D) myeloperoxidase(MPO) activity in colon tissues were measured. Plasma sample and colon tissues were collected and examined as described in the Materials and Methods. Data are presented as mean±S.E. values with different letters above the bars are significantly different by ANOVA with Duncan's multiple range test at p<0.05. The alphabet a in the figure was given to the largest number. NS, not significant. HPD, high protein diet; DSS, dextran sodium sulfate; MRB, mulberry root bark; MT, mulberry twig.
지금까지 MRB와 MT 추출물의 항염증효능에 관해서는 다수의 연구결과가 발표되었으나, 대부분은 마우스 대식세포인 Raw264.7 세포에서 수행된 in vitro 실험결과에 국한된다. Kim Y 등(2017)은 lipopolysaccharide(LPS)로 염증반응을 유도시킨 Raw264.7 세포에 MRB 및 MT 에탄올 추출물을 처리했을 때 cyclooxygenase(COX)-2와 inducible nitric oxide synthase(iNOS)의 mRNA 발현뿐만 아니라, NO, prostaglandin E2, IL-6 수준이 모두 유의적으로 감소하였음을 보였다. Eo HJ 등(2014)도 Raw264.7 세포에서 LPS의 처리로 인해 증가된 iNOS, p-ERK1/2, 핵 내 p65의 단백질 수준이 MRB 추출물의 처리로 인해 감소하였다고 보고하였다. 또한 Raw 264.7 세포에 MRB 및 MT의 주요 지표성분인 oxyresveratrol을 처리했을 때도 LPS로 증가한 IL-6의 농도가 정상군 수준으로 감소하였다(Park GS 등 2016). Choi IY 등(2011)은 마우스의 복강 대식세포에 LPS와 r interferon-γ를 처리했을 때 증가한 NO가 청일뽕 MT 물 추출물의 처리로 감소하였음을 보였다. 한편, in vivo 생체실험에서는 streptozotocin으로 유도한 당뇨 쥐의 간에서 TNF-α와 NF-κB의 단백질 수준이 MT의 급여로 인해 대조군수준으로 감소하였다는 보고(Yin XL 등 2017)가 있다. 마우스 대장염 모델에서 MRB와 MT 추출물이 DSS급여로 인한 혈장과 대장의 염증 지표들을 감소시키는 효과를 보인 것은 본 연구결과가 처음으로 특히, 혈장 NO와 IL-6 농도의 감소면에서는 MT의 효과가, 대장조직 MPO 활성 감소면에서는 MRB의 효과가 좋은 것으로 보인다.
요약 및 결론
본 연구는 HPD를 급여한 DSS 유도 대장염 마우스모델에서 MRB와 MT 열수 추출물의 대장염 완화 효과를 확인하고자 HPD를 급여한 ICR 마우스에 5일 동안 3% DSS와 함께 MRB 및 MT 추출물을 경구 투여한 후, 대장염의 임상적 지표 및 염증에 미치는 영향을 분석하였다. MRB와 MT 추출물은 대장염으로 인해 증가된 질병활성도, 대장 점막 두께, 그리고 혈장 NO 농도를 감소시킨 것이 확인되었으며, 특히 MT는 DSS 급여에 의한 혈장 IL-6 농도를, MRB는 대장조직 MPO 활성을 유의적으로 감소시켰다. 그러나 MRB와 MT 추출물은 DSS 급여에 따른 대장 길이의 감소, 대장 무게 및 혈장 TNF-α 농도의 증가에는 영향을 미치지 않았다. 종합적으로, 본 연구에서 제시된 결과로 미루어 보아 MRB와 MT는 단백질을 과량으로 섭취하는 식사형태에서 물로 우려내는 차의 형태로 섭취하였을 때 대장염 예방 효능이 있을 것으로 기대된다. 향후 MRB와 MT 열수 추출물의 주요 생리활성물질인 oxyresveratrol의 대장염 예방효과 및 HPD 급여로 인한 장내환경변화에 미치는 영향에 관한 연구 수행이 필요하며, 안전성과 기능성이 확보된다면 대장염 예방용 천연 기능성 소재 및 식품으로 개발할 가치가 있을 것으로 사료된다.
Acknowledgments
MRB와 MT 열수 추출물을 제공해 주신 최상원 교수님께 감사드리며 이 결과는 2015년도 대구가톨릭대학교 교내연구비 지원에 의해 수행되었습니다.
REFERENCES
-
Byun, SY, Kim, DB, Kim, E, (2015), Curcumin ameliorates the tumor-enhancing effects of a high-protein diet in an azoxymethane-induced mouse model of colon carcinogenesis, Nutr Res, 35, p726-735.
[https://doi.org/10.1016/j.nutres.2015.05.016]

-
Chang, LW, Juang, LJ, Wang, BS, Wang, MY, Tai, HM, Hung, WJ, Chen, YJ, Huang, MH, (2011), Antioxidant and antityrosinase activity of mulberry (Morus alba L.) twigs and root bark, Food Chem Toxicol, 49, p785-790.
[https://doi.org/10.1016/j.fct.2010.11.045]

-
Choi, IY, Lee, KT, Kim, MC, Kim, SJ, Kim, DS, Jeon, YD, Park, YJ, Kim, HS, Um, JY, Hong, SH, (2011), Anti-inflammatory effects of Cheongilppong on DSS-induced ulcerative colitis in mice, Orient Pharm Exp Med, 11, p35-39.
[https://doi.org/10.1007/s13596-011-0009-3]

-
Choi, SW, Jang, YJ, Lee, YJ, Leem, HH, Kim, EO, (2013), Analysis of functional constituents in mulberry (Morus alba L.) twigs by different cultivars, producing areas, and heat processings, Prev Nutr Food Sci, 18(4), p256-262.
[https://doi.org/10.3746/pnf.2013.18.4.256]

-
Clapper, ML, Cooper, HS, Chang, WC, (2007), Dextran sulfate sodium-induced colitis-associated neoplasia: a promising model for the development of chemopreventive interventions, Acta Pharmacol Sin, 28, p1450-1459.
[https://doi.org/10.1111/j.1745-7254.2007.00695.x]

- Cooper, HS, Murthy, SN, Shah, RS, Sedergran, DJ, (1993), Clinicopathologic study of dextran sulfate sodium experimental murine colitis, Lab Invest, 69, p238-249.
-
Cooper, HS, Murthy, S, Kido, K, Yoshitake, H, Flanigan, A, (2000), Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation, Carcinogenesis, 21, p757-768.
[https://doi.org/10.1093/carcin/21.4.757]

-
Ding, B, Lv, Y, Zhang, YQ, (2016), Anti-tumor effect of morusin from the branch bark of cultivated mulberry in Bel-7402 cells via the MAPK pathway, RSC Adv, 6, p17396-17404.
[https://doi.org/10.1039/c5ra21321e]

-
Eo, HJ, Park, JH, Park, GH, Lee, MH, Lee, JR, Koo, JS, Jeong, JB, (2014), Anti-inflammatory and anti-cancer activity of mulberry (Morus alba L.) root bark, BMC Complement Altern Med, 14, p200.
[https://doi.org/10.1186/1472-6882-14-200]

-
Fiocchi, C, (1998), Inflammatory bowel disease: etiology and pathogenesis, Gastroenterology, 115(1), p182-205.
[https://doi.org/10.1016/s0016-5085(98)70381-6]

- Galland, L, (2010), Diet and inflammation, Nutr Clin Pract, 25(6), p634-640.
- Global Cancer Observatory, http://gco.iarc.fr Accessed January 16, 2018.
- Hardy, RG, Meltzer, SJ, Jankowski, JA, (2000), ABC of colorectal cancer, Molecular basis for risk factors, BMJ 321(7265), p886-889.
- Harpaz, N, Talbot, IC, (1996), Colorectal cancer in idiopathic inflammatory bowel disease, Semin Diagn Pathol, 13, p339-357.
-
Hendrickson, BA, Gokhale, R, Cho, JH, (2002), Clinical aspects and pathophysiology of inflammatory bowel disease, Clin Microbiol Rev, 15(1), p79-94.
[https://doi.org/10.1128/cmr.15.1.79-94.2002]

-
Kim, E, Coelho, D, Blachier, F, (2013), Review of the association between meat consumption and risk of colorectal cancer, Nutr Res, 33, p983-994.
[https://doi.org/10.1016/j.nutres.2013.07.018]

- Kim, Y, Yang, YK, Kim, D, Kim, JY, (2017), Anti-inflammatory effects of ethanolic mulberry extract on the murine macrophage cell line, Raw 264.7, Korean J Food Sci Technol, 49(3), p343-348.
- Krawisz, JE, Sharon, P, Stenson, WF, (1984), Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models, Gastoenterology, 87(6), p1344-1350.
-
Marelli, G, Sica, A, Vannucci, L, Allavena, P, (2017), Inflammation as target in cancer therapy, Curr Opin Pharmacol, 35, p57-65.
[https://doi.org/10.1016/j.coph.2017.05.007]

-
Melero, A, Draheim, C, Hansen, S, Giner, E, Carreras, JJ, Talens-Visconti, R, Garrigues, TM, Peris, JE, Recio, MC, Giner, R, (2017), Targeted delivery of cyclosporine a by polymeric nanocarriers improves the therapy of inflammatory bowel disease in a relevant mouse model, Eur J Pharm Biopharm, 119, p361-371.
[https://doi.org/10.1016/j.ejpb.2017.07.004]

-
Molodecky, NA, Soon, IS, Rabi, DM, Ghali, WA, Ferris, M, Chernoff, G, Benchimol, EI, Panaccione, R, Ghosh, S, Barkema, HW, Kaplan, GG, (2012), Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review, Gastroenterology, 142(1), p46-54.
[https://doi.org/10.1053/j.gastro.2011.10.001]

-
Park, GS, Kim, JK, Kim, JH, (2016), Anti-inflammatory action of ethanolic extract of Ramulus mori on the BLT2-linked cascade, BMB Rep, 49(4), p232-237.
[https://doi.org/10.5483/bmbrep.2016.49.4.002]

- Park, SY, Jin, BR, Lee, YR, Kim, YJ, Park, JB, Jeon, YH, Choi, SW, Kwon, O, (2016), Postprandial hypoglycemic effects of mulberry twig and root bark in vivo and in vitro, J Nutr Health, 49(1), p18-27.
-
Park, YH, Kim, N, Shim, YK, Choi, YJ, Nam, RH, Choi, YJ, Ham, MH, Suh, JH, Lee, SM, Lee, CM, Yoon, H, Lee, HS, Lee, DH, (2015), Adequate dextran sodium sulfate-induced colitis model in mice and effective outcome measurement method, J Cancer Prev, 20(4), p260-267.
[https://doi.org/10.15430/jcp.2015.20.4.260]

-
Philip, M, Rowley, DA, Schreiber, H, (2004), Inflammation as a tumor promoter in cancer induction, Semin Cancer Biol, 14, p433-439.
[https://doi.org/10.1016/j.semcancer.2004.06.006]

-
Prideaux, L, Kamm, MA, De Cruz, PP, Chan, FK, Ng, SC, (2012), Inflammatory bowel disease in Asia: a systematic review, J Gastroenterol Hepatol, 27, p1266-1280.
[https://doi.org/10.1111/j.1440-1746.2012.07150.x]

-
Randhawa, PK, Singh, K, Singh, N, Jaggi, AS, (2014), A review on chemical-induced inflammatory bowel disease models in rodents, Korean J Physiol Pharmacol, 18(4), p279-288.
[https://doi.org/10.4196/kjpp.2014.18.4.279]

-
Smidowicz, A, Regula, J, (2015), Effect of nutritional status and dietary patterns on human serum C-reactive protein and interleukin-6 concentrations, Adv Nutr, 6(6), p738-747.
[https://doi.org/10.3945/an.115.009415]

-
Tak, KH, Ahn, E, Kim, E, (2017), Increase in dietary protein content exacerbates colonic inflammation and tumorigenesis in azoxymethane-induced mouse colon carcinogenesis, Nutr Res Pract, 11(4), p281-289.
[https://doi.org/10.4162/nrp.2017.11.4.281]

-
Tanaka, T, Kohno, H, Suzuki, R, Hata, K, Sugie, S, Niho, N, Sakano, K, Takahashi, M, Wakabayashi, K, (2006), Dextran sodium sulfate strongly promotes colorectal carcinogenesis in ApcMin/+ mice: inflammatory stimuli by dextran sodium sulfate results in development of multiple colonic neoplasms, Int J Cancer, 118, p25-34.
[https://doi.org/10.1002/ijc.21282]

-
Toden, S, Bird, AR, Topping, DL, Conlon, MA, (2005), Resistant starch attenuates colonic DNA damage induced by higher dietary protein in rats, Nutr Cancer, 51, p45-51.
[https://doi.org/10.1207/s15327914nc5101_7]

-
Toden, S, Bird, AR, Topping, DL, Conlon, MA, (2006), Resistant starch prevents colonic DNA damage induced by high dietary cooked red meat or casein in rats, Cancer Biol Ther, 5, p267-272.
[https://doi.org/10.4161/cbt.5.3.2382]

-
Toden, S, Bird, AR, Topping, DL, Conlon, MA, (2007), Differential effects of dietary whey, casein and soya on colonic DNA damage and large bowel SCFA in rats fed diets low and high in resistant starch, Br J Nutr, 97, p535-543.
[https://doi.org/10.1017/s0007114507336817]

-
Jang, YJ, Leem, HH, Jeon, YH, Lee, DH, Choi, SW, (2015), Isolation and identification of α-glucosidase inhibitors from morus root bark, J Korean Soc Food Sci Nutr, 44, p1090-1099.
[https://doi.org/10.3746/jkfn.2015.44.7.1090]

-
Yin, XL, Liu, HY, Zhang, YQ, (2017), Mulberry branch bark powder significantly improves hyperglycemia and regulates insulin secretion in type II diabetic mice, Food Nutr Res, 61(1), p1368847.
[https://doi.org/10.1080/16546628.2017.1368847]


