비타민나무 잎 및 열매의 영양성분과 추출물의 항산화 활성
Abstract
Nutritional components and antioxidant activities of sea buckthron (Hippophae rhamnoides L.) leaf and berry extracts were evaluated. The fructose contents of leaves (6.64 g/100 g) and berries (2.92 g/100 g) were higher than those of other free sugars, such as glucose, and sucrose. Organic acids (malic acid, lactic acid, acetic acid) were detected, with malic acid (118.06 mg/g) being most abundant. Nine fatty acids were detected, with linolenic acid (42.38%) being most abundant. The total phenol contents of leaves extracted with water, 50% ethanol, and 80% ethanol were 133.09 mg/g, 146.18 mg/g, and 155.09 mg/g, respectively. Therefore, extractions with ethanol were more effective than those with water. Moreover, the total flavonoid content of leaves (32.39 mg/g) extracted by 50% ethanol was higher than that of the other extracts. The order of nitrite-scavenging abilities at pH 1.2 was ascorbic acid (92.62%)>50% ethanol (93.07%)>80% ethanol (90.66%)>water (84.34%). Electron donating ability was highest for leaves (87.62 mg/mL) extracted with 50% ethanol. Overall, the results of this study suggest that sea buckthron has nutritional effects and antioxidant activities, making it a great potential functional food.
Keywords:
Sea buckthron, nutritional components, antioxidant activity서 론
기대수명의 증가와 더불어 건강에 대한 관심이 높아지면서 천연물인 다양한 식물의 잎, 열매, 뿌리 등에 함유된 기능성 성분과 항산화 물질을 규명함으로써 보다 부가가치가 높은 식품소재로 제공하고자 하는 연구가 활발히 진행되고 있다. 특히 식물에 존재하는 항산화 물질은 외부 환경에 의한 공격으로부터 생물체를 보호하는 기능을 가지고 있어 노화 과정에서 야기되는 암, 관절염 등 여러 질병에의 노출 저하와 관련이 있다(Oh KJ 등 2015; Kim SH & Jeong YJ 2012).
본 연구에서 실험 소재로 사용한 비타민나무(Hippophae rhamnoides L.)는 보리수과의 관목으로 산자나무로도 불리며, 오렌지색의 작은 열매를 맺고 내한성이 매우 강한 식물이다. 비타민나무의 잎과 열매는 아미노산과 비타민 C, E 등의 함량이 높고, 면역성, 항염성 및 노화방지에 뛰어난 것으로 알려져 있어 유럽 등 일부 국가에서는 건강보조제나 차와 같은 기능성 식품으로 개발되어 있다(Tiffany TYG 등 2005).
그동안 비타민나무에 관련하여 수행된 연구는 주로 생리 활성에 관한 것으로 항당뇨, 항암, 항균효과 검증(Park YH 등 2010a), 항염 활성물질 분리(Park YH 2010b), 미백효과(Ko MS 등 2012), 타이로시네이즈 저해활성(Kim EJ 등 2011), 식이보충과 당뇨흰쥐 간장의 항산화효소 수준에 미치는 영향(Kim MW 2013), 주름개선 효능(Choi SJ 등 2016) 등이 보고된 바 있다.
하지만 비타민나무의 식품소재로서의 활용 가능성은 아직 연구가 미흡한 실정으로 본 연구에서는 식품의약품안전처 식품원재료에 식용으로 등록되어 있는 비타민나무의 잎과 열매를 국내에서 재배 수확하여 영양성분을 분석하고, 항산화 효능을 물, 50% 및 80% 에탄올 등 다양한 용매로 추출하여 그 차이를 알아봄으로써 비타민나무의 기능성 및 항산화성을 산업적으로 활용하는데 기초자료로 제시하고자 한다.
재료 및 방법
1. 재료
본 실험에 사용된 생 비타민나무 잎과 열매(강원도 화천, 2017년 7월 수확)는 동결건조(FD-8515, Ilsin, Korea)한 후 분쇄기(M20, IKA, Germany)를 사용하여 20∼30 mesh 크기로 조분쇄하고, -40℃에 냉동보관하면서 시료로 사용하였다.
2. 실험 방법
일반성분은 AOAC법(A.O.A.C. 1995)에 따라 행하였다. 즉, 수분은 105℃ 상압건조법, 조지방은 Soxhlet 추출법, 조단백은 semi micro Kjeldahl법(N × 6.25), 조회분은 550℃ 회화법으로 정량하였다. 탄수화물은 100%에서 수분, 조지방, 조단백, 조회분을 뺀 값으로 하였다.
유리당은 Lee JW 등(2014)의 방법과 같이 시료 5 g에 25 mL의 물을 섞고, acetonitrile로 50 mL까지 채운 다음 sonicator(Bransonic, 8510E-DTH, CT, USA)를 이용하여 45∼50℃ 온도를 유지하면서 30분 동안 추출하고 3,000 rpm 원심분리기(Combi 514R, Hanil, Gangwon-do, Korea)에서 15분간 분리한 후, 상등액을 0.45 μm membrane filter로 여과하여 시험용액으로 하였다. 표준물질은 fructose, glucose, sucrose, lactose, maltose(Sigma-Aldrich Chemical Co. St. Louis, MO, USA)를 이용하여 0.2 mg/g, 0.5 mg/g, 1 mg/g, 2 mg/g, 5 mg/g, 10 mg/g의 농도로 조제하고 표준검량곡선을 작성하였으며, Table 1의 조건 하에서 HPLC로 분석하였다.
유기산은 Bang CM 등(2016)의 방법에 따라 측정하였다. 시료 1 g에 증류수 50 mL를 넣고 80℃ 항온 수욕 상에서 4시간 가열시켜 주었다. 이를 원심분리(3,000 rpm, 15 min)하고, 상등액을 취해 0.45 μm membrane filter로 여과를 하였다. Column은 KC-LG와 KC-811을 직렬로 연결한 Shodex RS pak KC-LG guard를 사용하였다. 표준물질은 citric acid, tartaric acid, malic acid, succinic acid, lactic acid, acetic acid(Sigma-Aldrich Chemical Co. St. Louis, MO, USA)를 이용하여 0.2 mg/g, 0.4 mg/g, 0.6 mg/g, 0.8 mg/g 및 1 mg/g의 농도로 조제하고 표준검량곡선을 작성하였으며, Table 2의 조건에 따라 HPLC로 분석하였다.
지방산 조성 분석을 위한 시료의 제조는 AOCS법(A.O.C.S. 1990)에 따라 행하였다. 즉, 시료 중의 지방을 에틸에테르로 추출한 후 250 mL 삼각플라스크에 0.15∼0.2 g 정도 취하여 0.5 N NaOH/methanol 4 mL를 가한 후 환류, 냉각하면서 10분간 가열하였다. 다음으로 14% BF3/methanol 5 mL를 가하고 2분간 반응시킨 다음 hexane 5 mL를 가하고 1분간 더 가열하였다. 반응 후 삼각플라스크를 분리 냉각시키고, 이를 test tube에 옮겨 포화 식염수를 가하고, hexane층을 분취하여 Table 3의 조건으로 분석하였다.
(1) 추출물 제조
동결 건조한 비타민나무 잎과 열매를 분쇄기(MCH600SI, Tongyang Magic Co., LTD., Seoul, Korea)로 40 mesh로 조분쇄한 후 시료 20 g에 20배의 물, 50% 및 80% 에탄올을 각각 첨가하여 환류냉각장치를 이용하여 80℃에서 4시간 동안 추출하였다. 각각의 추출물은 여과지(Whatman No. 2)로 여과하고, 남은 잔사에 다시 용매를 가하여 위와 동일한 방법으로 3반복하여 추출하였다. 이 추출물을 40±1℃에서 농축기(rotary evaporator N-1000, Eyela, Tokyo, Japan)로 감압농축하여 용매를 제거한 후 동결건조(freeze dryer, FD, DF8517, ilshinbiobase Co Ltd, Dongducheon, Korea)하여 측정시료로 사용하였다. 제조된 각각의 추출물 시료는 -40℃ 냉동실(MDFU50V, Sanyo, Tokyo, Japan)에 보관하면서 실험에 사용하였다.
(2) 총 페놀 함량 측정
총 페놀 함량은 Folin O & Denis W(1912)의 방법에 따라 시료용액(500 μg/mL) 0.2 mL에 2% sodium carbonate 용액 2 mL를 가하고 3분간 방치하였다. 여기에 1 N Folin-Ciocalteu's phenol reagent(Sigma-Aldrich Chemical Co. St. Louis, MO, USA) 0.1 mL를 가하고 30분간 암소에 방치한 후 반응액의 흡광도를 750 nm에서 측정하였다. 이때 표준검량곡선은 gallic acid(Sigma-Aldrich Chemical Co.)를 사용하여 작성하였으며, 표준곡선 작성에 이용한 gallic acid의 농도는 0 μg/mL, 50 μg/mL, 150 μg/mL 및 200 μg/mL이었다. 총 페놀 함량은 시료 g당 mg gallic acid equivalent로 나타내었다.
(3) 총 플라보노이드 함량 측정
총 플라보노이드 함량(Kang YH 등 1996)은 시료용액(2 mg/mL) 1 mL와 diethylene glycol 10 mL를 혼합하고, 여기에 1 N NaOH용액 1 mL를 가하여 37℃에서 1시간 반응시킨 후, 420 nm에서 흡광도를 측정하였다. 이때 표준검량곡선은 quercetin(Sigma-Aldrich Chemical Co.)을 사용하여 작성하였으며, 표준곡선 작성에 이용한 quercetin의 농도는 0 μg/mL, 25 μg/mL, 50 μg/mL, 75 μg/mL 및 100 μg/mL이었다. 총 플라보노이드 함량은 시료 g당 mg quercetin으로 나타내었다.
(4) 아질산염 소거능 측정
아질산염(NaNO2) 소거능은 Gray JI & Dugan LR(1975)의 방법으로 측정하였다. 즉, 1 mM NaNO2 용액 2 mL에 시료 용액(2 mg/mL) 1 mL를 가하고 0.1 N HCl(pH 1.2), 0.2 M 구연산완충액(pH 3.0 및 pH 6.0)으로 각각 pH 1.2, 3.0 및 6.0으로 조정한 후 반응액을 10 mL로 하였다. 이 용액을 37℃에서 1시간 반응시킨 후 각 반응액을 1 mL씩 취하여 2% 초산용액 5 mL와 Griess 시약(30% 초산용액에 1% sulfanilic acid와 1% naphthylamine을 1:1 비율로 혼합한 것) 0.4 mL를 가하여 잘 혼합하였다. 이 혼합액을 15분간 실온에 방치한 후 520 nm에서 흡광도를 3반복 측정하여 아질산량을 구하였다. 대조구는 Griess 시약 대신 증류수를 0.4 mL 가하여 동일하게 행하였다. 아질산염 소거작용은 시료를 첨가한 경우와 무첨가한 경우의 아질산염 백분율로 나타내었으며, 비교군은 ascorbic acid(2 mg/mL)를 사용하였다.
N: 아질산염 소거능
A: 1 mM NaNO2 용액에 시료를 첨가하여 1시간 반응후의 흡광도
B: 1 mM NaNO2 용액에 시료 대신에 증류수를 첨가하여 1시간 반응후의 흡광도
C: 시료 추출물 자체의 흡광도
(5) DPPH에 의한 전자공여능 측정
DPPH에 의한 전자공여능(electron donating ability; EDA)은 Blois MS(1958)의 방법을 약간 변형하여 측정하였다. 즉, 일정농도의 시료(0.01∼0.5 mg/mL) 1.0 mL를 각각 취하고, 1.0×10-4 M DPPH(1,1-diphenyl-2-picrylhydrazyl; Sigma Co.)용액 4.0 mL를 잘 혼합하여 실온 암소상태에서 30분 동안 반응시킨 후 517 nm에서 흡광도를 3반복 측정하였다. DPPH에 의한 전자공여능은 시료 첨가구와 시료 대신 용매를 첨가한 대조군의 흡광도 차이를 아래의 식에 의하여 백분율(%)로 구하였으며, 단순회귀분석을 통하여 DPPH 래디칼을 50% 감소시키는데 필요한 시료의 농도(mg/mL)를 IC50값으로 나타내었다. 비교군은 ascorbic acid(Sigma-Aldrich Chemical Co.)를 이용(0.01 mg/mL, 0.02 mg/mL, 0.03 mg/mL 및 0.04 mg/mL)하였다.
A: 시료첨가구의 흡광도
B: 시료 무첨가구의 흡광도
3. 통계 처리
실험결과는 SAS package(release 8.01, SAS Institute., Cary, NC, USA)를 이용하여 평균±표준편차로 표시하였고, 평균값의 통계적 유의성은 p<0.05 수준에서 Duncan's multiple range test에 의해 검정하였다.
결과 및 고찰
1. 일반성분 함량
본 연구에 사용한 비타민나무 잎과 열매의 일반성분은 Table 4와 같았다. 수분함량은 잎 11.59%, 열매 10.49%, 조단백은 잎 17.15%, 열매 10.48%, 조지방은 잎 6.12%, 열매 12.27%, 조회분은 잎 3.99%, 열매 2.77% 그리고 탄수화물은 잎 61.15%, 열매 63.99%이었다. 조지방 외에 모든 성분에서 잎의 일반성분 함량이 열매보다 많은 것으로 나타났다.
2. 유리당 함량
유리당 조성은 Table 5와 같이 잎에서는 fructose, glucose, sucrose가 확인되었고, 열매에서는 sucrose가 검출되지 않았으며, 총 유리당 함량은 잎은 9.15 g/100 g, 열매는 4.78 g/100 g으로 잎에서 함량이 2배 정도 더 많았다. 유리당의 조성별로 보면 잎에서 fructose가 6.64 g/100 g으로 가장 많았으며, sucrose 1.54 g/100 g, glucose 0.97 g/100 g의 순이었고, 열매에서는 fructose 2.92 g/100 g, glucose 1.86 g/100 g의 함량을 보였다.
Kim JH 등(2003)은 홍화 꽃의 유리당 분석에서 fructose, sucrose, glucose의 함량이 각각 7.31 g/100 g, 2.48 g/100 g, 0.08 g/100 g으로 보고하여 본 연구와 비슷하였다. 그러나 Jo AK(2015)는 장미의 유리당은 fructose, glucose, sucrose로 각각 1.14 g/100 g, 0.73 g/100 g, 0.55 g/100 g으로 비타민나무 잎과 열매보다 낮았으며, 조성에 따른 함량에도 차이를 보였다. 또한 Shin SR(1999)은 민들레 잎과 뿌리의 유리당 분석에서 fructose, glucose, sucrose 3종을 분리하고, sucrose가 잎과 뿌리에서 각각 0.84 g/100 g, 1.38 g/100 g으로 가장 많았다고 하였고, Jung GT 등(2013)은 꾸지뽕나무 열매의 유리당 분석에서 sucrose는 검출되지 않고 glucose와 fructose만 숙기가 진행됨에 따라 증가한다고 하여 차이를 보였는데, 이는 식물의 종류와 재배환경에 따라 유리당의 조성과 함량이 달라지는 것으로 추정된다.
3. 유기산 함량
유기산 조성과 함량을 보면 Table 6과 같이 3종의 유기산이 확인되었으며, 총 유기산은 열매에서 129.71 mg/g으로 잎의 15.52 mg/g에 비해 약 8배 정도 더 많았다. 유기산의 종류에 따라서는 열매의 malic acid가 118.06 mg/g으로 가장 많아 다른 유기산 함량과 큰 차이를 나타내었다. Acetic acid도 열매가 6.76 mg/g으로 잎의 6.19 mg/g보다 더 많은 반면 lactic acid는 잎(6.50 mg/g)에서 열매(4.89 mg/g)보다 더 많은 함량을 나타내었다. 개망초 꽃, 잎, 줄기, 뿌리의 부위별 지방산 분석(Jeong CH 등 2005)에서는 oxalic acid, tartaric acid, malic acid, citric acid, succinic acid 5종의 유기산이 확인되었는데, 이 중 꽃에서 succinic acid가 19.72 mg/g으로 가장 함량이 많았다고 하였고, 꾸지뽕나무 열매의 유기산(Jung GT 등 2013)에도 malic acid와 succinic acid가 숙성시기에 관계없이 가장 많이 함유되어 있다고 하여 본 연구와 차이를 보였다.
4. 지방산 조성
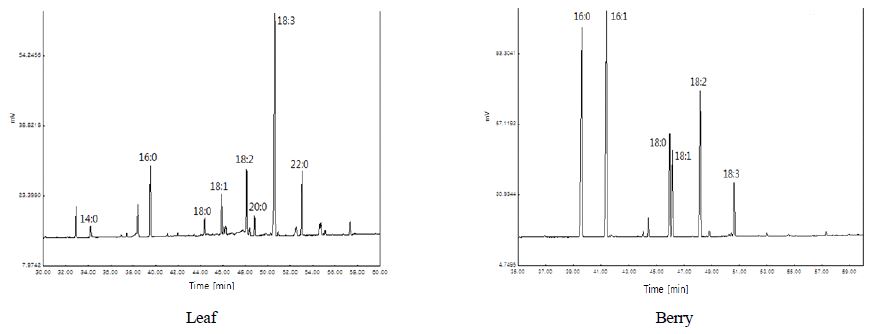
지방산 조성은 Table 7, Fig. 1과 같이 잎에서는 8종, 열매에서는 6종이 확인되었다. 포화지방산의 경우, palmitic acid(C16:0)와 stearic acid(C18:0)의 2종류는 잎과 열매 모두에서 확인되었고, mysristic acid(14:0), arachidic acid(20:0), behenic acid(22:0)는 잎에서만 확인되었다. 불포화지방산은 oleic acid(18:1), linoleic acid(18:2), linolenic acid(18:3)의 3종류가 잎과 열매 모두에서 확인되었고, palmitoleic acid(16:1)는 열매에서만 확인되었다.
잎에서는 linolenic acid가 42.38%로 가장 비율이 높았으며, 다음은 behenic acid 11.93%, palmitic acid 11.51%, linoleic acid 10.35%의 조성을 나타내었다. 열매에서는 palmitic acid가 30.44%로 가장 비율이 높았고, palmitoleic acid 28.44%, linoleic acid 15.86%, stearic acid 11.26%, oleic acid 8.74%의 조성을 보였다. 총 불포화지방산 함량에서 보면 잎 58.86%, 열매 58.28%였고, 총 포화지방산 함량에서는 잎 31.21%, 열매 41.70%로 잎과 열매 모두에서 불포화지방산 함량이 포화지방산 함량보다 더 많아 영양적으로 우수함을 알 수 있었다.
Jeong CH 등(2005)의 국화과 개망초의 지방산 분석에서는 총9종이확인되었으며, linoleic acid 21.15%, oleic acid 20.92%, myristic acid 20.18%, palmitic acid 17.59%, linolenic acid 14.28%로 비타민나무의 불포화지방산 함량이 더 많은 것을 알 수 있었다. 또한 Jo AK(2015)는 장미꽃, 동백꽃 및 맨드라미꽃의 지방산 조성을 분석한 결과, 맨드라미꽃에서 필수지방산인 oleic acid, linoleic acid, linolenic acid가 각각 18.88%, 40.79%, 17.78%로 가장 높았다고 하였는데, 이와 비교할 때 linolenic acid의 함량은 비타민나무 잎에서 더 높은 것으로 나타났다.
5. 항산화 효과
생리활성을 가지는 각종 phytochemical이 식물에 다양하게 함유되어 있으며, 이 중 식물에 널리 분포되어 있는 페놀 화합물의 2차 대사산물은 다양한 구조를 나타낸다. 특히 생체 내에서 페놀성 화합물이 다양한 생리활성을 나타내는 것으로 알려지면서 식품에서 페놀성 물질을 확인하려는 연구가 수행되었다(Jeong CH 등, 2011).
비타민나무 잎과 열매 추출물의 총 페놀 함량은 Fig. 2와 같이 잎에서는 80% 에탄올(155.09 mg/g)>50% 에탄올(146.18 mg/g)>물(133.09 mg/g)의 순으로 80% 에탄올로 추출했을 때 가장 많은 함량을 나타내었다. 열매에서는 50% 에탄올(68.11 mg/g)>80% 에탄올(62.87 mg/g)>물(56.59 mg/g)의 순을 보였으며, 추출용매의 종류에 상관없이 잎에서 열매보다 약 2.5배 정도 더 많은 것으로 나타났다. 이로써 추출방법에 따라 총 페놀 함량에 차이가 있으며, 비타민나무 잎과 열매 모두 생리활성 성분이 함유되어 있음을 확인할 수 있었다.
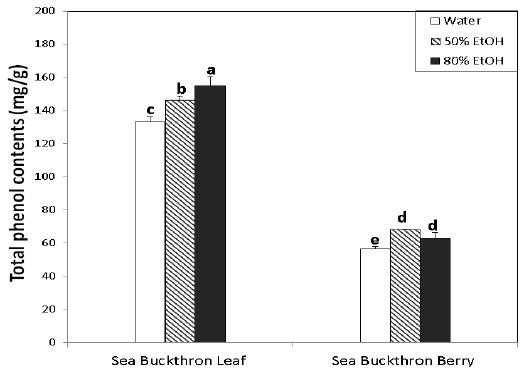
Total phenol contents of sea buckthron leaf and berry extracts.1) Values are mean±S.D.(n=3).a∼e Means with the different letters above the bars are significantly different(p<0.05) by Duncan’s multiple test.
Kim JH & Kang KO(2016)는 오미자의 페놀함량이 물 추출 시 47.9 mg/g, 에탄올 추출 시 53.4 mg/g으로 에탄올 추출에서 페놀 함량이 더 많았다고 하였고, Lim JH(2009)도 매실농축액의 페놀함량이 물 추출 시 58.5 mg/g, 메탄올 추출 시 100.8 mg/g으로 유기용매를 사용하여 추출했을 때 더 높았다고 하여 본 연구와 같은 결과를 나타내었다.
총 플라보노이드 함량은 Fig. 3과 같이 잎에서는 50% 에탄올(32.39 mg/g)>80% 에탄올(26.07 mg/g)>물(24.04 mg/g)의 순으로 50% 에탄올로 추출했을 때 가장 많은 함량을 나타내었다. 열매에서도 50% 에탄올(5.87 mg/g)>80% 에탄올 (5.50 mg/g)>물(4.48 mg/g)의 순으로 같은 경향을 보였으며, 추출 용매의 조건에 상관없이 잎이 열매보다 약 5배 정도 더 함량이 많은 것으로 나타났다.
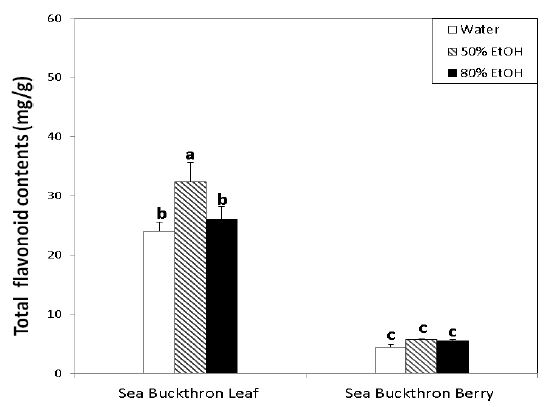
Total flavonoid contents of sea buckthron leaf and berry extracts.1) Values are mean±S.D.(n=3).a∼c Means with the different letters above the bars are significantly different(p<0.05) by Duncan’s multiple test.
오디분말 메탄올 추출물의 총 플라보노이드 함량은 13.0%, 물 추출물은 9.4%로 물보다 메탄올로 추출했을 때 총 플라보노이드 함량이 더 많다고 보고되었고(Kim SG 2012), 야콘(Kang KO 2013)에서도 메탄올 추출물(9.2%)이 물 추출물(7.8%)보다 플라보노이드 함량이 더 많아 본 연구의 결과와 유사하였으며, 비타민나무의 플라보노이드 함량이 오디나야콘보다 더 많은 것을 알 수 있었다.
질산염이 많이 함유된 식품을 섭취하게 되면 위장내의 낮은 산성조건에서 아질산염과 nitroso화 반응이 쉽게 일어나 발암물질로 알려진 nitrosamine을 생성한다(Kyun SH 등 2007). 이러한 반응을 억제하기 위해서는 amine의 생성을 저해시키거나 아질산염 소거능이 우수한 식품을 함께 섭취함으로써 nitrosamine에 의한 유해 물질의 생성을 줄일 수 있다.
비타민나무 잎과 열매의 물, 50% 에탄올, 80% 에탄올 추출물과 비교군인 ascorbic acid의 아질산염 소거능을 pH 1.2, pH 3.0 및 pH 6.0의 조건에서 측정한 결과는 Table 8과 같았다. 전반적으로 볼 때 추출액의 pH 조건에 따라서는 모든 시료에서 pH가 내려갈수록 아질산 소거능이 증가하였으며, 열매보다는 잎의 아질산 소거능이 더 높은 것으로 나타났다. 또한 잎의 추출용매에 따른 pH 1.2 조건에서의 아질산염 소거능은 50% 에탄올(93.97%)>ascorbic acid(92.62%)>80% 에탄올(90.66%)>물(84.34%)의 경향으로 50% 에탄올 추출물에서 ascorbic acid보다도 높은 매우 우수한 아질산 소거능을 가지고 있음을 알 수 있었다. 그리고 열매에서도 50% 에탄올(73.04%)>80% 에탄올(71.99%)>물(11.60%)의 순으로 나타나, 비타민나무의 아질산 소거능을 극대화하기 위해서는 50% 에탄올을 사용하여 pH 1.2의 조건에서 추출하는 것이 좋을 것으로 사료된다.
Lee SJ 등(2000)의 연구에서 토마토, 매실, 자두 및 포도주스의 아질산염 소거능이 pH 1.2 58.0∼100%, pH 4.2 29.0∼100%, pH 6.0 18.0∼82.9%로 반응액의 pH가 산성일수록, 시료의 첨가량이 많을수록 높게 나타난다고 하였다. 그러나 Ju MJ 등(2009)은 오디 추출물의 pH가 감소함에 따라 아질산염 소거능이 증가하지만 에탄올 추출물보다 물 추출물에서 활성이 더 높다고 하였고, Park CS 등(2002)의 연구에서도 pH 1.2에서 쑥 물 추출물 37%, 에탄올 추출물 27%로 물 추출물이 에탄올 추출물보다 더 높다고 하여 본 연구와 차이를 보였다.
DPPH는 비교적 안정한 free radical을 가지고 있는 화합물로써 항산화력이 있는 물질과 만나게 되면 환원작용에 의해 radical이 소거되는 점을 이용하여 항산화 효과를 측정한다(Blois MS, 1958). 그러므로 다양한 식물 추출물의 항산화 효과 검증에 DPPH에 의한 전자공여능 측정법을 많이 사용하고 있어 전자공여능은 항산화 작용의 지표로 인식되고 있으며, 전자공여능은 인체 내에서 생성되는 free radical에 의한 노화와 질병을 억제하는 것으로 알려져 있다(Ko MS 2012).
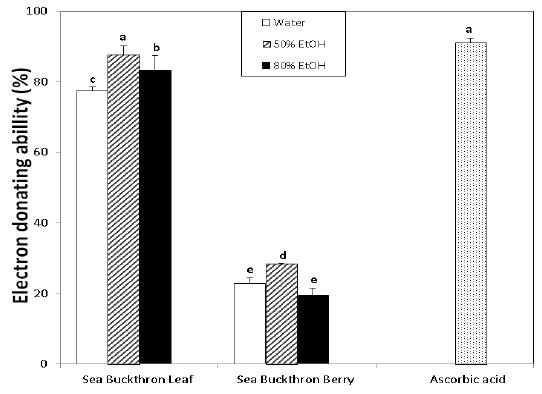
Fig. 4와 같이 잎의 용매에 따른 추출액의 전자공여능은 50% 에탄올(87.62%)>80% 에탄올(83.12%)>물(77.33%)의 수준으로 ascorbic acid 91.11%보다는 낮았지만 잎이 우수한 전자공여능을 가지고 있었다. 그리고 비타민 열매에서는 50% 에탄올(28.47%)>물(22.73%)>80% 에탄올(19.63%)의 순으로 나타나 다른 경향을 보였고, 전자공여능이 잎보다 낮음을 알 수 있었다. Ko MS 등(2012)은 비타민나무 열매 메탄올 추출물의 농도별 전자공여능을 측정한 결과, ascorbic acid보다는 낮지만 전반적으로 높은 항산화 작용을 가지며, Choi SJ 등(2016)도 잎과 열매 모두 에탄올 추출물이 물 추출물보다 활성이 더 높으며, 또한 잎이 열매보다 전자공여능이 더 뛰어났다고 하였다.
요약 및 결론
비타민나무 잎 및 열매의 산업적 활용의 가능성을 알아보기 위한 기초연구로 영양성분 및 추출물의 항산화 활성을 분석하였다.
총 유리당 함량에서 잎은 9.15 g/100 g, 열매는 4.78 g/100 g으로 잎에서 함량이 2배가량 더 많았다. 유리당 조성별로 보면 잎에서 fructose가 6.64 g/100 g으로 가장 많았으며, sucrose 1.54 g/100 g, glucose 0.97 g/100 g의 순이었고, 열매에서는 fructose 2.92 g/100 g, glucose 1.86 g/100 g의 함량을 보였다. Malic, lactic, acetic acid로 확인된 총 유기산 함량은 열매에서 129.71 mg/g으로 잎의 15.52 mg/g에 비해 약 8배 정도 더 많았고, 유기산 종류에 따라서는 열매에서 malic acid가 118.06 mg/g으로 가장 많았다. 그리고 지방산 조성에서 포화지방산은 palmitic acid(C16:0)와 stearic acid(C18:0) 2종류, 불포화지방산은 oleic acid(18:1), linoleic acid(18:2), linolenic acid(18:3) 3종류가 잎과 열매 모두에서 확인되었다. 또한 잎에서는 linolenic acid 42.38%, 열매에서는 palmitic acid 30.44%로 가장 비율이 높았으며, 총 불포화지방산 함량은 잎 58.86%, 열매 58.28%였고, 총 포화지방산 함량은 잎 31.21%, 열매 41.70%로 잎과 열매 모두에서 불포화지방산 함량이 포화지방산 함량보다 더 많았다.
총 페놀 함량은 잎에서는 80% 에탄올(155.09 mg/g)>50% 에탄올(146.18 mg/g)>물(133.09 mg/g), 열매에서는 50% 에탄올(68.11 mg/g)>80% 에탄올(62.87 mg/g)>물(56.59 mg/g)의 함량을 보여 잎이 열매보다 약 2.5배 정도 더 많은 것으로 나타났다. 총 플라보노이드는 잎에서는 50% 에탄올(32.39 mg/g)>80% 에탄올(26.07 mg/g)>물(24.04 mg/g), 열매에서는 50% 에탄올(5.87 mg/g)>80% 에탄올(5.50 mg/g)>물(4.48 mg/g)의 경향을 보였다. 아질산 소거능은 pH가 내려갈수록 증가하였으며, 잎은 pH 1.2 조건에서 50% 에탄올(93.97%)>ascorbic acid(92.62%)> 80% 에탄올(90.66%)>물(84.34%)로 50% 추출물에서 ascorbic acid보다 더 우수한 아질산 소거능을 가지고 있었으며, 전자공여능에서도 잎에서 50% 에탄올(87.62%)>80% 에탄올(83.12%)>물(77.33%)로 잎의 항산화 활성이 우수함을 알 수 있었다.
이상에서 비타민나무는 영양적 효능과 항산화 효과가 있는 것으로 나타나, 천연 항산화물질과 같은 기능성 식품소재로 다양한 식품가공에 활용할 수 있을 것으로 판단된다.
REFERENCES
- AOAC, (1995), Official Methods of Analysis, 16th ed, Association of Official Analytical Chemists, Washington, DC, USA, p69-74.
- AOCS, (1990), Official Methods for the Analysis of Fats, Oils and Related Materials, 4th ed, American Oil Chemists' Society, Cd 8-53.
-
Bang, CM, Moon, JK, Hong, SK, (2016), Characteristics of organic acid of Makgeolli by yeast strains type, Korean J Food Cook Sci, 32(1), p44-49.
[https://doi.org/10.9724/kfcs.2016.32.1.44]

-
Blois, MS, (1958), Antioxidant determination by the use of a stable free radical, Nature, 181(10), p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Choi, SJ, Kim, NR, Shin, JY, Lee, KM, Kyong, KY, (2016), Evaluation of anti Wrinkle efficacy in sea buckthorn extracts, oil and nanoemulsion containing them, J Korean Soc Cosmetics & Cosmetology, 6(2), p127-137.
- Folin, O, Denis, W, (1912), On phosphotungstic-phosphomolybdic compounds as color reagents, J Biol Chem, 12(2), p239-243.
-
Gray, JI, Dugan, Jr LR, (1975), Inhibition of N-nitrosamine formation in model food system, J Food Sci, 40(4), p981-985.
[https://doi.org/10.1111/j.1365-2621.1975.tb02248.x]

- Jeong, CH, Nam, EK, Shim, KH, (2005), Chemical components in different parts of Erigeron annuus, J Korean Soc Food Sci Nutr, 34(6), p857-861.
- Jeong, CH, Kim, IH, Shim, KH, Bae, YI, (2011), Nutritional components and antioxidant activities of commercial loquat leaf tea, J Agri Life Sci, 45(4), p105-112.
- Jo, AK, (2015), The quality characteristics and antioxidant activities of Yakju and liquor containing rose, camellia and cockscomb flower, Ph D. Dissertation, Hankyong Natioanl University, Anseong, p26-76.
-
Jung, GT, Ju, IO, Choi, SR, You, DH, Noh, JJ, (2013), Food nutritional characteristics of fruit of Cudrania tricuspidata in its various maturation stages, Korean J Food Preserv, 20(3), p330-335.
[https://doi.org/10.11002/kjfp.2013.20.3.330]

- Ju, MJ, Kwon, JH, Kim, HK, (2009), Physiological activities of mulberry leaf and fruit extracts with different extraction conditions, Korean J Food Preserv, 16(4), p442-448.
- Kang, KO, (2013), Analysis of antioxidant effects and antimicrobial activity of extracts from yacon(Polymnia sonchifolia) powder, J East Asian Soc Dietary Life, 23(3), p374-381.
- Kang, YH, Park, YK, Lee, GD, (1996), The nitrite scavenging and electron donating ability of phenolic compounds, Korean J Food Sci Technol, 28(2), p232-239.
- Kim, EJ, Chae, KY, Park, SN, (2011), Antioxidative and inhibitory activities on tyrosinase of Hippophae rhamnoides leaf extracts, J Soc Cosmetic Sci Korea, 37(3), p265-273.
- Kim, JH, Kim, JK, Kang, WW, Ha, YS, Choi, SW, Moon, KD, (2003), Chemical compositions and DPPH radical scavenger activity in different section of safflower, J Korean Soc Food Sci Nutr, 32(5), p733-738.
-
Kim, JH, Kang, KO, (2016), Analysis of antioxidative effects and antimicrobial activity of Omija(Schizandra chinensis B.) extracts, J East Asian Soc Diet Life, 26(2), p109-116.
[https://doi.org/10.17495/easdl.2016.4.26.2.109]

- Kim, MW, (2013), Effect of sea buckthorn leaves on hepatic enzyme levels in streptozotocin in induced diabetic rats, J Korean Soc Food Sci Nutr, 42(1), p40-45.
- Kim, SG, (2012), Studies on the analysis of antioxidative effects and antimicrobial activity of mulberry powder, MS Thesis, Hankyong National University, Anseong, p26-33.
- Kim, SH, Jeong, YJ, (2012), Extraction solvents of Acanthopanax tea and pan fired time, J Korean Tea Soc, 18(1), p48-53.
- Ko, MS, Lee, HJ, Kang, MJ, (2012), Antioxidant activities and whitening effects of extracts from Hippophae rhammoides L, J East Asian Soc Dietary Life, 22(6), p812-817.
- Kyun, SH, Lee, JS, Lee, KB, Lee, JS, (2007), Antioxidative activity of Gynostemma pentaphyllum Makino extracts, Korean J Food Sci Technol, 39(3), p447-451.
- Lee, JW, Hwang, JB, Nahmgung, B, Pack, JW, (2014), A study on total sugar content in cooked rice and side dishes of eat-out Korean food, Korean J Food Engineering Progress, 18(2), p124-129.
- Lee, SJ, Chung, MJ, Shin, JH, Sung, NJ, (2000), Effect of natural plant components on the nitrite-scavenging, J Fd Hyg Safety, 15(1), p88-94.
- Lim, JH, (2009), The effect of Maesil(Prunus mume) concentrate on the characteristics quality of the wheat flour and products, Ph D Dissertation, Sejong University, Seoul, p65-80.
-
Oh, KJ, Kim, MJ, Han, JS, Ji, EH, Kim, AJ, (2015), Comparative biological properties of Prunus davidiana fruits according to harvest month, Korean J Food & Nutr, 28(4), p643-649.
[https://doi.org/10.9799/ksfan.2015.28.4.643]

- Park, CS, Kwon, CJ, Choi, MA, Park, GS, Choi, KH, (2002), Antioxidative and nitrite scavenging activities of mugwort and pine needle extracts, Korean J Food Preserv, 9(2), p248-252.
- Park, YH, Lim, SH, Ham, HJ, Jeong, HN, Lee, KJ, Kim, KH, Lim, SM, (2010a), Comparison of biological activities of extracts from different parts of sea buckthorn, J Korean Soc Food Sci Nutr, 39(7), p975-979.
- Park, YH, Lim, SH, Ham, HJ, Kim, HY, Jeong, HN, Kim, KH, Lim, SM, (2010b), Isolation of anti inflammatory active substance sitosterol from sea buckthorn stem, J Korean Soc Food Sci Nutr, 39(7), p980-985.
- Shin, SR, (1999), Studies on the nutritional components of dandelion(Taraxacum officinale), Korean J Postharvest Sci Technol, 6(4), p495-499.
- Tiffany, TYG, Stefan, C, Arnie, H, (2005), Effect of drying on the nutraceutical quality of sea buckthorn leaves, J Food Sci, 70, p514-518.