세척 수 및 보관온도가 세척 식용란 품질과 안전에 미치는 영향
Abstract
The objective of this study was to investigate the effects of various washing waters on the quality and safety characteristics of eggs during storage. Eggs were washed with tap water, 100 ppm of sodium hypochlorite, or 30 ppm of slightly acidic electrolyzed water and stored at 10℃ and 20℃. Effects of various washing waters on reduction of Salmonella Enteritidis and aerobic plate counts and survival of S. Enteritidis on egg shells were also analyzed at 10℃ and 20℃ for 25 days. As an index of quality, haugh unit, weight reduction, and pHs of egg white and egg yolk were measured. Reduction percentages of haugh unit and weight were higher at 20℃ than at 10℃. Egg qualities were less affected by tap water, slightly acidic electrolyzed water, and sodium hypochlorite, regardless of storage temperature. The greatest reductions in aerobic plate counts and S. Enteritidis were observed with slightly acidic electrolyzed water. The level of S. Enteritidis on egg shells gradually decreased during 20 days of storage at both 10℃ and 20℃, whereas S. Enteritidis survived longer at 20℃ than at 10℃. S. Enteritidis was not detected in eggs at 10℃, 2.13 log CFU/g of S. Enteritidis was detected in eggs washed with sodium hypochlorite after 20 days of storage at 20℃, indicating that S. Enteritidis penetrated into the egg shell during storage at 20℃. In conclusion, slightly acidic electrolyzed water increased microbial reduction and least affected quality of washed eggs. Thus, slightly acidic electrolyzed water can be recommended for washing of graded eggs, at retail markets.
Keywords:
Eggs, slightly acidic electrolyzed water, Salmonella Enteritidis, quality, temperature서 론
계란은 완전 식품으로 계란의 난황과 난백에는 현대인들에게 필요한 영양성분들이 많이 함유하고 있으며, 원재료로 조리하여 섭취하는 경우도 많고, 다양한 가공식품으로 이용되기 때문에 매년 소비량이 증가하는 추세이다(Kim BK 등 2014). 지난 4년간(2008∼2012년) 국내 축산식품 관련 식중독 사고 역학조사 결과, 식중독 발생 빈도가 가장 높았던 주요 원인균은 Salmonella, E. coli, Campylobacter jejuni 순으로 조사되었으며, 그 중 Salmonella 식중독은 총 23건이며, 특히 Salmonella Enteritidis에 의한 식중독 사고가 15건으로 가장 많았으며, 주요 원인 식품은 계란으로 나타났다(Hong SH 등 2015). 이는 전세계적으로 발생하는 식중독의 경향과 동일한 것으로, 국외 Salmonella 식중독 발생현황에 따르면 EU에서는 2006년에 16만 명(10만 명당 31명)의 살모넬라 식중독 환자가 발생하였고, 대부분 계란 제품과 관련된 것으로 나타났다(EFSA 2012). 또한 CDC (2010)의 통계에 따르면, 살모넬라 식중독은 전체 식중독 발생 건수 중 가장 높은 비율을 차지하며, 살모넬라 혈청형 분석 결과, 6,371개(90.5%), 시료 중 S. Enteritidis 1,226개(19.2%), Salmonella Typhimurium 1,024개(16.1%)로 S. Enteritidis와 S. Typhimurium에 의한 살모넬라에 의한 식중독발생의 35.2%를 차지하는 것으로 나타났다(CDC 2010). 이처럼 Salmonella에 의한 식중독 사고는 꾸준히 발생하고 있고, 이와 같이 계란에 의한 식중독 발생이 높은 이유는 Salmonella에 감염된 닭의 경우, 계란의 난각(eggshell)에 오염된 살모넬라균 등 미생물들이 난각의 기공이나 미세한 틈을 통하여 내부로 이동하여(Henzler DJ 등 1994) 난황에서 빠르게 증식하기 때문인 것으로 보고되고 있다(Gast RK 등 2005). 최근 계란의 난황, 난백에서 S. Enteritidis와 S. Typhimurium의 성장패턴에 관련된 논문에 따르면 10℃ 이상의 모든 보관온도에서 난황에서는 두 혈청형 모두 증식이 매우 빠르게 진행되었으나, 난백에서는 35℃에서도 S. Enteritidis와 S. Typhimurium의 증식이 관찰되지 않았다(Moon 등 2016). 또한 알 가공품에서 주요 식중독균의 증식 생존 분석 연구결과(Jo HJ 등, 2015)에 따르면 계란구이에서는 S. Enteritidis가 S. Typhimurium에 비해 증식속도가 더 빨랐으며, 계란찜에서도 S. Typhimurium는 사멸하는 반면, S. Enteritidis의 증식은 잘 이루어져 알가공품에서 S. Enteritidis의 증식위험성은 더 큰 것으로 보고되었다. 따라서 식용란이 생산되는 과정에서 S. Enteritidis 오염예방이 매우 중요하다.
외국의 경우, Salmonella에 의한 식중독 예방을 위하여 각 나라별 유통 환경에 따른 계란의 세척기준이 마련되어 있는 실정이다. 국내에서도 세척된 식용란만이 외관, 투광 및 할란 판정을 거쳐 1+ 등급, 1등급, 2등급, 3등급으로 품질등급을 받을 수 있는데, 국내에서 식용란의 세척 기준은 마련되지 않은 상태로 식용란 수집판매업소 자체적 기준에 따라 세척이 실시되고 있는데, 현재 국내에서는 세척 수의 온도를 43∼51 ℃로 권고하고 있다(KAPE 2005). 반면, 미국은 세척 전 식용란 보관 기준(15.5℃, RH 70%), 세척 수의 온도(32.2 ℃ 이상 또는 계란 온도보다 11.1℃ 이상), 세척 수의 교환 기준, 살균제의 기준(염소 또는 이와 동등한 효력(100∼200 ppm) 및 헹굼 시 온도(세척 시 온도보다 6∼11℃ 높음)등 세척 방법에 대해 상세한 기준과 유통 시 식용란의 유통 온도 및 기한이 정해져 있다(USDA 2000). 식용란 세척의 위생적 효과 관련 연구결과에 따르면, 식용란의 세척 시 식용란의 안전 및 품질에 가장 큰 영향을 미치는 요인은 세척 수의 온도이며, 식용란 세척 수의 온도는 식용란의 온도보다 높아야 한다(EFSA 2005). 특히 세척 수 안의 염소 농도가 살균효과에 큰 영향을 미치나(Bartlett FM 등 1993), 식용란 세척에 사용되는 화학 물질과 소독제는 달걀 표면의 물리적 손상을 야기시키는 것으로 보고되었다(Kim JW & Slavik MF 1996; Wang H & Slavik MF 1998).
미산성 차아염소산수는 2∼6% 염산을 이용해 무격막 전기분해조에서 전기분해로 얻어지는 수용액을 말하며, pH 5∼6.5, 유효염소농도 10∼30 ppm으로 강한 살균력을 가지며, 식품의약품안전처에서 식품첨가물로 안전성을 인정받아 국내외에서 많은 연구가 진행되고 있다(MFDS 2016). 국내에서도 계란 생산 및 소비가 증가하고 있으며, 국내에서 1등급 계란으로 평가 받기 위해서는 반드시 세척과정이 필요하다. 그러나 계란의 품질변화 없이 효과적으로 미생물을 제어할 수 있는 새로운 방법으로 다양한 세척 수에 대한 세척 효과 및 식용란의 품질에 미치는 영향에 대해 국내 연구는 매우 부족한 실정이다. 따라서 본 연구에서는 식용란을 일반 수돗물, 100 ppm 차아염소산나트륨, 30 ppm 미산성 차아염소산수로 세척후 유통환경에서 식용란 보관온도가 세척란의 품질에 미치는 영향을 비교 분석하였다. 또한 일반 수돗물, 차아염소산나트륨, 미산성 차아염소산수를 사용한 세척과정이 난각에 오염된 S. Enteritidis 저감효과 및 보관기간 중 난각에서의 S. Enteritidis 생존에 미치는 영향을 비교 분석하였다.
재료 및 방법
1. 식용란 세척
식용란은 서울시 동대문구에 있는 식용란 수집판매업소 중 농장에서 24 시간 이내에 납품된 식용란을 구입하여 시료로 사용하였다. 본 연구에서 식용란 세척은 수돗물, 차아염소산나트륨, 미산성 차아염소산수를 사용하였다. 차아염소산나트륨은 쎄니크로(Hanson Hygiene, Cheonan, Korea)를 증류수에 400배 희석하여 유효염소농도 100 ppm로 제조 후 사용하였다. 미산성 차아염소산수는 미산성 차아염소산수 생성장치인 Hocler(BC-120, Cosmic Round Korea, Seongnam, Korea)에서 제조된 용액을 유효염소농도 확인 paper(Potassium Iodide Starch Paper, Toyo Roshi Kaisha, Ltd., Niigata, Japan)를 활용하여 염소농도 30 ppm을 확인 후 사용하였다. 세척방법은 멸균된 Specimen Cup(Sewon Medical, Seoul, Korea)에 식용란을 넣고 세척 수 30 mL를 담은 후 Shaking incubator에서 140 rpm으로 30초 간 세척하고 15분 간 건조하였다. 세척된 식용란은 마트에서의 유통기한을 고려하여 10℃와 20 ℃에서 보관하며, 25일 동안 품질변화를 비교 분석하였다.
2. 호우단위(Haugh Unit) 감소율(%)
우단위는 계란의 무게(W)와 농후 난백의 높이(H, mm)를 측정하여 아래의 식을 이용하여 계산하였다. 이 때 난백의 높이는 Vernier calipers(CD-15APX, Mitutoyo, Kawasaki, Japan)로 난황에서 1 cm 떨어진 지점을 측정하였다(Kim BK 등 2014). 최초로 측정한 호우단위를 초기 호우단위로 사용하였으며, 일정 기간마다 측정된 호우단위를 초기 호우단위에 대한 백분율(%)로 나타내 호우단위 감소율(%)을 분석하였다.
Haugh unit = 100×log(H—1.7W0.37+7.57)
여기에서,
H: 농후난백의 높이
W: 계란의 질량
3. 중량 감소율(%)
세척 전 계란의 중량을 측정하여 초기중량으로 사용하였으며, 세척 후 보관기관 중 중량을 측정하여 초기중량에 대한 백분율(%)로 중량 감소율(%)을 나타내었다.
4. pH 측정
계란의 난황과 난백을 분리한 후 각각 멸균된 필터백에 넣고 Stomacher(BAGMIXER 400, Interscience, Saint Nom, France)를 이용하여 약 1분 간 균질화하여, pH meter(IQ240, IQ Scientific Instruments, Carlsbad, USA)를 이용하여 pH를 측정하였다.
5. 세척 수의 미생물 저감화 효과 및 세척란에서의 S. Enteritidis 침투율 분석
비세척 식용란과 수돗물, 차아염소산나트륨, 미산성 차아염소산수로 세척한 식용란의 일반세균의 오염도를 측정하였다. 오염도는 식품공전(MFDS 2013a) 및 축산물의 가공기준 및 성분규격의 미생물 시험법(MFDS 2013b)에 의거하여 분석을 실시하였다. 전처리된 시험액 1 mL를 취한 후 0.1% Peptone water 9 mL에 10진 희석법으로 단계별 희석하여 3M Petrifilm Aerobic Count Plate에 무균적으로 분주하여 36℃에서 24시간 동안 배양한 후 그 평균 집락수에 희석배수를 곱하여 계산하여 log CFU/g으로 각각 표시하였다.
세척 수의 S. Enteritidis 저감화 효과 분석연구를 위하여 시험 균주 S. Enteritidis(KCCM 12021)은 한국미생물보존센터(Korean Culture Center of Microorganisms; KCCM)에서 분양 받아 사용하였다. 균주는 20% glycerol이 첨가된 멸균된 Brain heart infusion(BHI)에 현탁한 뒤 —80℃에 보관하여 stock culture로 이용하였다. 보관한 균주는 상온에서 해동하여 10 μL의 S. Enteritidis는 10 mL의 BHI에 접종하여 36℃에서 24시간 동안 140 rpm 전 배양하여 사용하였다. 본 실험을 위해 식용란은 70% 에탄올에 30초 간 침지하고 15분 간 건조시킨 후, 건조된 식용란의 표면에 S. Enteritidis를 초기농도가 5±0.5 log CFU/g가 되도록 전 배양액 20 μL를 분주하고, 15분 간 방치한 후 세척을 실시하였다. 세척방법은 오염된 식용란을 멸균된 Specimen cup에 넣고 수돗물, 100 ppm 차아염소산나트륨, 30 ppm 미산성 차아염소산수 30 mL로 각각 shaking incubator에서 140 rpm에서 30초 간 세척 후 15분 간 건조하였다. 세척의 효과는 세척한 식용란과 비세척 식용란을 0.1% Peptone water 45 mL에 담근 후, 이 용액의 1 mL를 9 mL의 Peptone water에 희석하여 희석액 100 μL를 Xylose lysine desoxycholate(XLD: OXOID, UK)를 분주하여 36±1℃에 24시간 동안 배양한 후 검은색 colony를 계수하여 측정하였다.
유통기한동안 세척 수가 S. Enteritidis의 생존 및 난각 침투율에 미치는 영향을 분석하기 위해 S. Enteritidis를 인위적으로 접종 후 수돗물, 100 ppm 차아염소산나트륨, 30 ppm 미산성 차아염소산수로 세척한 식용란과 비세척 식용란을 각각 10, 20℃에 20일 동안 보관하여 일정기간마다 식용란의 난각 및 내용물의 S. Enteritidis의 오염 정도를 측정하여 S. Enteritidis 생존 및 난각 침투율을 분석하였다. 난각에서의 생존율을 위해서는 식용란을 0.1% Peptone water 45 mL에 담근 후, 이 용액의 1 mL를 9 mL의 펩톤수에 희석하였다. 희석액 100 μL를 XLD(OXOID, Hampshire, UK)에 분주하여 36±1℃에 24시간 동안 배양한 후 검은색 colony를 계수하여 측정하였다. S. Enteritidis의 난각 침투율을 분석하기 위해 내용물의 오염도는 위 식용란을 70% 에탄올에 30초 담그고 15분 간 건조시킨 후, 무균적으로 계란에 구멍을 내어 계란내용물을 멸균백에 넣고 Stomacher에서 1분 간 균질화한다. 그후 내용물 100 μL을 XLD에 분주하여 36±1℃에 24시간 동안 배양하여 내용물에서의 S. Enteritidis 오염도를 측정하였다.
6. 통계분석
연구결과는 SAS version 9.3(SAS institute Inc., Cary, NC, USA) 통계프로그램을 이용하여 분석하였다. Duncan의 다중 검정법을 이용한 일원분산분석을 이용하여 샘플간의 유의적인 차이를 분석하였다(p<0.05).
결과 및 고찰
1. 세척 수 및 보관 온도가 식용란의 품질에 미치는 영향
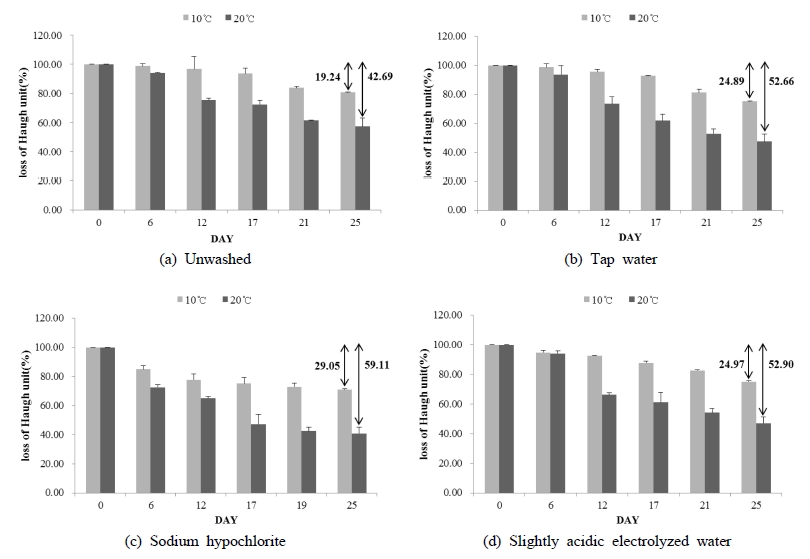
세척 수 종류에 따라 세척된 식용란의 보관 온도별 호우단위 감소(%) 결과는 다음 Fig. 1과 같다. 세척한 식용란의 보관 온도 별로 호우단위 감소(%)를 살펴보면 전반적으로 10℃와 20℃에서 모두 보관 기간 중 계속해서 감소하였으며, 25일 후 10℃에서는 평균 26.3% 감소하였고, 20℃에서는 감소율이 평균 54.89%로 고온에서 더 큰 감소를 보였다. 이와 같은 결과는 온도가 높을수록 호우단위가 감소하는 경향을 보인다는 선행연구 결과가 동일하였다(Kim BK 등 2014; Sabrani M & Payne C 1978). 또한 보관온도가 높을수록 수분의 이동이 커져 난백의 수분이 난황막으로의 이동이 용이해지고, 난황막이 쉽게 깨지게 되어 계란의 신선도와 품질에 영향을 미친다는 연구결과와 동일하였다(Kim JG 등 2015).
세척 수에 따른 식용란의 호우단위 감소율은 보관온도가 10℃의 경우 25일 보관 후 비세척(19.24%), 수돗물(24.89%), 미산성 차아염소산수(24.97%), 차아염소산나트륨(29.05%) 순이며, 20℃에서도 세척 수에 따른 식용란의 호우단위 감소율은 비세척(42.69%), 수돗물(52.66%), 미산성 차아염소산수(52.90%), 차아염소산나트륨(59.11%) 순으로 10℃와 같은 경향을 보였다(Fig. 1). 본 연구결과에서도 비세척란은 온도에 상관없이 세척란에 비해 호우단위 감소율이 적었으며, 차아염소산나트륨로 세척된 식용란은 10℃, 20℃에서 모두 호우단위 감소율이 가장 큰 것으로 나타났다. 반면, 수돗물과 미산성 차아염소산수 세척은 호우단위 감소율에 있어서는 유의적인 차이가 없는 것으로 나타났다. 선행연구인 계란의 난각 처리에 따른 품질 변화 실험결과에 따르면(Lee SM & Hong CH 2005), 난각에 어떤 처리도 하지 않은 비세척란의 호우단위 감소율은 18.2%, 세척란의 호우단위 감소율은 21.7 %로 나타났으며, 세척란의 호우단위가 더 크게 감소하는 것으로 나타나 본 실험과 유사한 결과를 나타냈다. 호우단위는 계란의 신선도 및 기호도에 밀접한 영향을 미치며(Kim BK 등 2014), 미산성 차아염소산수(30 ppm)와 차아염소산나트륨(100 ppm)을 비교했을 때 유효염소농도가 높은 차아염소산나트륨이 호우단위 감소에 더 큰 영향을 미치는 것으로 나타났다. 또한 식용란의 보관기간이 연장됨에 따라 온도가 높을수록 식용란의 품질이 저하되므로(Lee SM & Hong CH 2005), 세척란 보관 시 철저한 온도관리가 요구된다. 현재 국내∙외에서 세척한 계란의 경우, 냉장 온도(10℃)에서 보관 및 유통되고 있다.
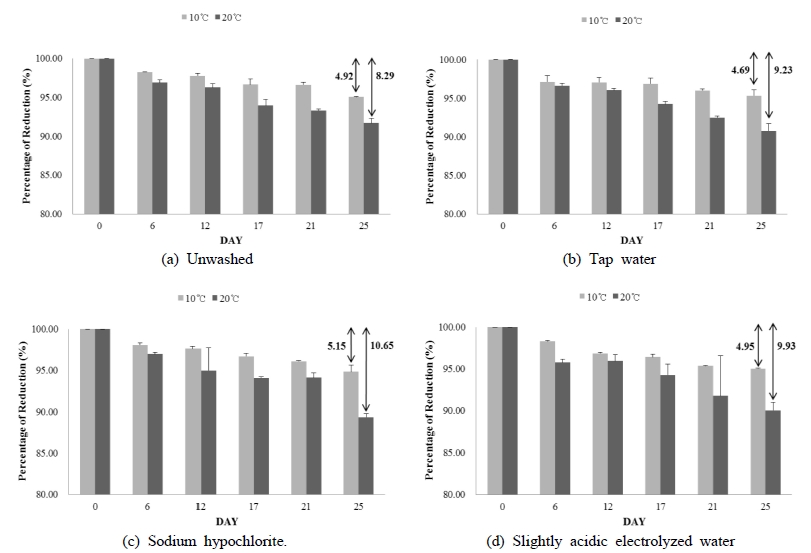
세척 수 종류에 따라 세척된 식용란의 보관온도별 중량감소율 변화(%)는 다음 Fig 2와 같다. 식용란의 보관온도별 중량감소율(%)을 살펴보면 10℃와 20℃에서 25일 보관 후 세척 수 종류에 따른 중량감소율은 온도와 관계없이 비세척, 수돗물, 미산성 차아염소산수, 차아염소산나트륨 순으로 큰 것으로 나타났다. 특히 10℃에서 중량감소율은 수돗물(4.69%), 비세척(4.92%), 미산성 차아염소산수(4.95%), 차아염소산나트륨(5.15%)으로 세척란은 평균 중량이 4.93% 감소하였다. 20 ℃에서는 비세척(8.29%), 수돗물(9.23%), 미산성 차아염소산수 (9.93%), 차아염소산나트륨(10.65%)으로 세척란의 중량 감소율이 평균 9.52%로(Fig. 2) 고온에서 더 높은 감소율을 보였다. 이런 결과는 온도가 높을수록 계란의 중량감소율은 증가한다는 선행연구 결과와 동일하였다(Lee SM & Hong CH 2005). 저온보다 고온에서 중량감소율이 높은 것은 고온에서 계란 껍질 큐티클층의 건조가 빠르기 때문인 것으로 보고되고 있다(Alsobayel A 등 2013). 특히 식용란 세척 시, 세척 수를 사용할 경우, 식용란의 큐티클층에 영향을 미쳐 품질이 저하되는 것으로 보고되고 있다(Hutchison ML 등 2004; Sparks N & Burgess A 1993). 본 연구에서는 차아염소산나트륨(100 ppm)이 미산성 차아염소산수(30 ppm)보다 식용란 큐티클층을 제거하여 식용란의 중량감소에 더 큰 영향을 주었을 것으로 사료되나, 세척시간이 매우 짧아 세척 수의 유효염소농도에 따른 중량감소율의 영향은 미비한 것으로 사료된다.
세척 수 종류에 따라 세척된 식용란의 보관온도 및 기간에 따른 난황 및 난백의 pH 변화는 각각 다음 Table 1 및 Table 2와 같다. 세척 수에 따른 pH의 변화는 차이가 없었으나, 세척 후 보관기간 동안 난백, 난황의 pH 모두 유의적으로 증가하였다. 25일 보관 후 온도에 따라 pH를 비교한 결과, 10℃에서 난백의 pH는 평균 9.26이며, 20℃에서는 평균 9.38로 유의적 차이를 나타냈다(p<0.05). 반면, 10℃에서는 난황의 pH는 평균 6.63이며, 20℃에서는 평균 6.73으로 증가하였지만 유의적 차이는 나타나지 않아 난백의 pH가 난황보다 온도의 영향을 더 받는 것으로 나타났다. 이와 같은 결과는 유통환경에 따른 계란의 품질지수 연구 결과 중 품질의 영향을 미치는 것은 난백이라는 연구결과와 동일한 것으로 나타냈다(Kim BK 등 2014). 또한 본 연구 중 20℃에서 pH가 증가하는 것은 고온에서 계란의 pH가 증가하는 선행연구결과(Kim BK 등 2014; Lee HO 등 2014)와 동일한 결과를 보였으며 pH가 증가하는 이유는 산란 후 시간이 경과하면서 난각 표면의 기공으로 CO2가 소실되기 때문인 것으로 사료된다. 보관온도가 높아질수록 pH의 증가는 알부민 단백질의 미생물번식 억제 기능을 제한하게 되어 계란의 신선도를 떨어지게 하는 원인이 되므로(Akyurek H & Okur AA 2009) 유통온도 관리에 주의가 요망된다.
2. 세척 수의 미생물 저감화 효과 및 세척란에서의 S. Enteritidis 침투율 분석
서울시 동대문구 재래시장에서 구입한 식용란을 수돗물, 100 ppm 차아염소산나트륨, 30 ppm 미산성 차아염소산수로 각각 세척 후 식용란 난각의 미생물 저감화 효과 분석결과는 다음 Table 3과 같다.
본 연구의 선행연구에서 식용란 수집판매업소에서 보관 중인 세척이 되지 않은 식용란 난각 및 내용물의 미생물 위해요소 분석결과, 식용란 난각에서의 일반세균은 평균 2.51± 0.89 log CFU/g으로 나타났으며, 식용란 내용물에서는 0.33± 0.75 log CFU/g로 나타났다. 반면, 살모넬라, 대장균, 대장균 군은 모두 불검출이었다(Yoon KS 2014). 따라서 본 연구에서는 세척 수의 일반세균 감소효과만을 분석하였다. 일반세균의 경우, 비세척 식용란의 오염도는 2.55±0.98 log CFU/g으로 나타났다. 다양한 세척 수에 따른 일반세균의 수준 및 감소율을 분석한 결과, 수돗물은 1.66±0.40 log CFU/g(34.96%), 차아염소산나트륨은 1.16±0.43 log CFU/g(54.34%), 미산성 차아염소산수는 0.52±0.31 log CFU/g(79.42%)으로 계란 세척 시 난각의 일반세균이 감소하였으며, 이는 다양한 세척방법으로 계란을 세척한 결과, 난각의 일반세균이 저감화되었다는 연구결과와 동일하였다(Hutchison ML 등 2004; Park YS 등 2003). 또한 일반세균에 대한 감소효과는 30 ppm 미산성 차아염소산수, 100 ppm 차아염소산나트륨, 수돗물의 순서로 높은 것으로 나타났다. Park YJ 등(2010)은 다양한 생식원료인 현미, 보리, 당근, 감자, 신선초, 케일을 수돗물, 차아염소산나트륨, 미산성 차아염소산수로 세척하여 일반세균의 감소효과를 본 결과, 미산성 차아염소산수가 가장 큰 감소효과를 보여 미산성 차아염소산수의 세척 능력이 본 연구와 동일한 결과를 나타냈다. 따라서 미산성 차아염소산수는 생식원료뿐만 아니라, 계란의 세척 수로도 활용이 가능할 것으로 사료된다.
S. Enteritidis의 경우, 계란 난각에 S. Enteritidis를 5.02±0.32 logCFU/g 수준으로 인위적으로 접종한 후, 다양한 세척 수에 따른 S. Enteritidis 감소율을 분석한 결과, 수돗물은 3.33±0.20 log CFU/g(33.72%), 차아염소산나트륨의 경우, 2.43±0.18 log CFU/g(51.53%), 미산성 차아염소산수는 2.11±0.34 log CFU/g (57.88%)으로 계란 세척 시 난각의 S. Enteritidis는 감소하는 것으로 나타났다. 이와 같은 결과는 세척이 S. Enteritidis를 저감화시키는 선행 연구와 비슷한 결과를 보였으며(Chousalkar K 등 2013; Fabrizio KA 등 2002; Park CM 등 2005), S. Enteritidis의 감소효과 또한 미산성 차아염소산수, 차아염소산나트륨, 수돗물의 순으로 감소효과가 높은 것으로 나타났다. 국외 연구에서도 계란에 Salmonella를 접종 후 동일한 염소농도의 전기분해수, 차아염소산나트륨, 미산성 차아염소산수에 침지한 결과, 미산성 차아염소산수가 가장 강한 살균력을 나타내었고, 미산성 차아염소산수(유효염소: 15 mg/L)에 계란을 3분 간 침지한 결과, 난각의 Salmonella가 6.5 logCFU/g 감소하는 연구결과(Cao W 등 2009)가 보고되어 본 연구와 동일한 결과를 나타났다.
S. Enteritidis는 계육, 고기, 채소, 계란 등 다양한 식품에서 식중독의 원인 세균으로 전세계적으로 S. Enteritidis를 저감화 하는 방법이 요구되고 있다(Russell SM 2003). 미산성 차아염소산수와 같은 전기분해수는 S. Enteritidis뿐만 아니라, E. coli, L. monocytogenes 등 식중독 세균의 저감화에 효과가 있다(Park H 등 2002; Venkitanarayanan KS 등 1999). 본 연구에서 사용한 미산성 차아염소산수는 전기분해수의 일종으로 본 연구결과와 같이 계란 난각의 S. Enteritidis 저감화에도 효과가 큰 것으로 나타나, 계란 세척 수로 활용이 가능할 것으로 사료된다.
수돗물, 차아염소산나트륨, 미산성 차아염소산수로 세척한 세척란의 보관기간 중 S. Enteritidis의 생존 및 침투율 분석 결과는 각각 Table 4, Table 5와 같다. S. Enteritidis를 인위적으로 오염시킨 비세척 식용란 및 세척란의 평균 오염수준은 4.88∼5.76 log CFU/g이었으며 10, 20℃에서 보관기간 중 난각의 S. Enteritidis의 수준은 점점 감소하는 것으로 나타났다. 또한 10℃에서는 보관기간 중 비세척 식용란 및 수돗물, 차아염소산나트륨으로 세척한 식용란은 보관 20일 이후부터 S. Enteritidis가 검출 한계 수준 이하로 나타났으며, 미산성 차아염소산수로 세척한 식용란의 경우 보관 5일 이후부터 검출 한계 수준 이하로 나타났다. 또한 계란 내용물에서의 S. Enteritidis를 분석한 결과, 10℃에서 20일 간 보관 기간 중 비세척란 및 수돗물, 차아염소산나트륨, 미산성 차아염소산수로 세척한 세척란에서는 모두 불검출되어 S. Enteritidis가 침투가 되지 않은 것으로 나타났다(Table 4). 반면, 20℃에서는 비세척 식용란 및 수돗물, 차아염소산나트륨으로 세척한 식용란의 난각에서는 20일까지 S. Enteritidis가 지속적으로 검출되었으며, 미산성 차아염소산수로 세척한 식용란의 난각에서는 보관 5일까지는 검출되었으나, 10일 이후부터 검출 한계 수준 이하로 나타났다(Table 5). 이는 S. Enteritidis는 난각에서 10℃보다 20℃에서 더 오랫동안 생존하였으나, 미산성 차아염소산수로 세척 시 난각에서의 S. Enteritidis의 생존이 억제되는 것으로 나타났다. 계란 내용물의 경우 20℃에서는 비세척란, 수돗물, 미산성 차아염소산수로 세척한 세척란에서는 모두 불검출되었지만, 차아염소산나트륨의 경우, 20일 후 2.13 log CFU/g 수준으로 계란 내용물에서 검출되어 차아염소산나트륨으로 세척한 식용란에서 S. Enteritidis의 침투율은 50%로 나타났다(Table 5). 다른 선행연구 중 세척란의 난각에 Salmonella spp.를 5 log CFU/g 수준으로 분주 후 20℃에서 보관한 결과, 21일 후 난각에서 Salmonella가 검출이 되어 21일 후 침투율을 분석한 결과, 침투율이 50%으로 나타나 본 연구와 비슷한 결과를 보였다(Chousalkar K 등 2013; Gole VC 등 2014). 본 연구에서는 미산성 차아염소산수는 보관기간 중 계란 난각에서의 저감화 효과도 뛰어났으며, 내용물 안으로 S. Enteritidis가 침투를 용이하게 하지 않는 것으로 나타나 계란 세척 수로 차후 활용 가능할 것으로 사료된다.

Effect of washing on the change of S. Enteritidis levels in the egg shell and content as a function of storage day at 10℃
요약 및 결론
본 연구에서는 수돗물, 차아염소산나트륨, 미산성 차아염소산수를 이용하여 식용란의 세척이 보관기간 중 식용란의 품질과 안전에 미치는 영향을 분석하였다. 세척 후 10℃, 20 ℃ 온도에 보관 중인 식용란의 중량감소, pH, 호우단위 변화 결과는 10℃보다 20℃에서 중량감소율, 호우단위는 더욱 큰 감소를 보였고, pH는 증가하여 계란의 품질은 고온에서 저장할 경우 더욱 크게 떨어지는 것으로 나타났다. 세척 수에 따라 중량 및 호우단위 감소율의 경우, 비세척, 수돗물, 미산성 차아염소산수, 차아염소산나트륨 순으로 감소율이 적어 품질을 유지하였으며, pH는 세척 수에 따라 크게 영향을 받지 않았다. 온도와 상관없이 세척을 실시할 경우, 계란의 품질이 빠르게 감소하므로, 세척 식용란의 경우 유통, 보관온도 관리가 필요한 것으로 나타났다.
또한 계란 난각에 자연적으로 부착된 일반세균과 인위적으로 오염시킨 S. Enteritidis를 세척 수에 의한 저감화 효과를 비교 분석하였다. 분석결과에 따르면, 일반세균의 감소율의 경우, 수돗물은 34.96%. 차아염소산나트륨은 54.34%, 미산성 차아염소산수는 79.42%로 나타났으며, S. Enteritidis 감소율의 경우, 수돗물은 33.72%. 차아염소산나트륨은 51.53%, 미산성 차아염소산수는 57.88%로 나타나, 세척 수 중 미산성 차아염소산수가 가장 뛰어난 미생물 저감화 효과를 나타내었다. 또한 세척한 계란의 보관기간 중 S. Enteritidis의 생존 및 침투율 분석결과, 보관기간동안 난각에서의 S. Enteritidis의 생존력은 점차 감소하는 것으로 나타났으며, S. Enteritidis는 10℃보다 20℃에서 오래 생존하는 것으로 나타났다. 10℃ 보관기간 중 계란 내용물에서 S. Enteritidis는 불검출되어 침투가 되지 않은 것으로 나타난 반면, 20℃에서 비세척, 수돗물, 미산성 차아염소산수로 세척한 계란내용물에서는 불검출되었지만, 차아염소산나트륨의 경우 25일 후 2.13 log CFU/g 수준으로 검출이 되었으며 침투율은 50%로 나타났다. 이와 같은 결과는 일반식품의 세척소독수로 사용되고 있는 차아염소산나트륨은 식용란의 세척 수로는 적절치 않은 것으로 나타났다. 또한 현재 유통 중인 등급란은 세척한 계란에 준하여 품질평가를 실시하고 있으며, 상품성을 위해 세척을 실시하는 대형 식용란 수집판매업소가 많이 존재하는 실정이므로 계란의 품질에 적은 영향을 미치면서 좀더 안전하게 세척효과 및 세척에 따른 품질저하를 최소화 할 수 있는 세척 수가 필요한 실정이다. 미산성 차아염소산수의 경우 세척 후 저온 보관할 경우, 20일 동안 품질이 비교적 안전하게 유지되며, 일반세균 및 S. Enteritidis의 저감화 효과도 탁월하다. 따라서 계란의 세척 수로 활용 가능할 것으로 사료되나, 최근 계란의 유통환경이 매우 다양하게 변화되고 있음을 고려할 때 다양한 유통보관 조건하에서 계란의 안전성 및 품질변화를 예측할 수 있는 연구가 필요할 것으로 사료된다.
Acknowledgments
본 연구를 위해 미산성 차아염소산수 생성장치인 HOCLER를 지원해 주신 코스믹라운드 주식회사에 감사드립니다.
References
- Akyurek, H, Okur, AA, (2009), Effect of storage time, temperature and hen age on egg quality in free-range layer hens., J Anim Vet Adv, 8(10), p1953-1958.
-
Alsobayel, A, Almarshade, M, Albadry, M, (2013), Effect of breed, age and storage period on egg weight, egg weight loss and chick weight of commercial broiler breeders raised in Saudi Arabia, J Saudi Soc Agric Sci, 12(1), p53-57.
[https://doi.org/10.1016/j.jssas.2012.06.003]

-
Bartlett, FM, Laird, JM, Addison, CL, McKellar, RC, (1993), The analysis of egg wash water for the rapid assessment of microbiological quality, Poult Sci, 72(8), p1584-1591.
[https://doi.org/10.3382/ps.0721584]

-
Cao, W, Zhu, ZW, Shi, ZX, Wang, CY, Li, BM, (2009), Efficiency of slightly acidic electrolyzed water for inactivation of Salmonella enteritidis and its contaminated shell eggs, Int J Food Microbiol, 130(2), p88-93.
[https://doi.org/10.1016/j.ijfoodmicro.2008.12.021]

- CDC, (2010), Preliminary FoodNet data on the incidence of infection with pathogens transmitted commonly through food - 10 States, 2009. Morbidity and Mortality Weekly Report 1, USA, p1-36.
-
Chousalkar, K, Roberts, J, Sexton, M, May, D, Kiermeier, A, (2013), Effects of egg shell quality and washing on Salmonella infantis penetration, Int J Food Microbiol, 165(2), p77-83.
[https://doi.org/10.1016/j.ijfoodmicro.2013.05.002]

- EFSA, (2005), Opinion of the scientific panel on biological hazards on the request from the commission related to the microbiological risks on washing of table eggs, The EFSA Journal, 3(10), p1-39.
- EFSA, (2012), The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2010, EFSA Journal, 10(3), p3-24.
-
Fabrizio, KA, Sharma, RR, Demirci, A, Cutter, CN, (2002), Comparison of electrolyzed oxidizing water with various antimicrobial interventions to reduce Salmonella species on poultry, Poult Sci, 81(10), p1598-1605.
[https://doi.org/10.1093/ps/81.10.1598]

-
Gast, RK, Holt, PS, Murase, T, (2005), Penetration of Salmonella enteritidis and Salmonella heidelberg into egg yolks in an in vitro contamination model, Poult Sci, 84(4), p621-625.
[https://doi.org/10.1093/ps/84.4.621]

-
Gole, VC, Chousalkar, KK, Roberts, JR, Sexton, M, May, D, Tan, J, Kiermeier, A, (2014), Effect of egg washing and correlation between eggshell characteristics and egg penetration by various Salmonella Typhimurium strains, PloS one, 9(3), pe90987.
[https://doi.org/10.1371/journal.pone.0090987]

-
Henzler, DJ, Ebel, E, Sanders, J, Kradel, D, Mason, J, (1994), Salmonella enteritidis in eggs from commercial chicken layer flocks implicated in human outbreaks, Avian Dis, 38(1), p37-43.
[https://doi.org/10.2307/1591834]

-
Hong, SH, Park, NY, Jo, HJ, Ro, EY, Ko, YM, Na, YJ, Park, KC, Choi, BG, Min, KJ, Lee, JK, Moon, JS, Yoon, KS, (2015), Risk ranking determination of combination of foodborne pathogens and livestock or livestock products, J Food Hyg Saf, 30(1), p1-12.
[https://doi.org/10.13103/JFHS.2015.30.1.1]

-
Hutchison, ML., Gittins, J, Walker, A, Sparks, N, Humphrey, TJ, Burton, C, Moore, A, (2004), An assessment of the microbiological risks involved with egg washing under commercial conditions, J Food Prot, 67(1), p4-11.
[https://doi.org/10.4315/0362-028X-67.1.4]

-
Jo, HJ, Choi, BF, Yan, W, Moon, JS, Kim, YJ, Yoon, KS, (2015), Microbiological quality and growth and survival of foodborne pathogen in ready-to-eat egg products, J Food Hyg Safety, 30(2), p1-11.
[https://doi.org/10.13103/jfhs.2015.30.2.178]

- KAPE, (2005), http://www.ekapepia.com/293.su?00017852 Accessed, October 12, 2016.
-
Kim, BK, Park, CE, Kim, BS, Kim, YS, (2014), Quality factors affecting egg freshness and palatability during storage, Korean J Food Sci Technol, 46(3), p295-302.
[https://doi.org/10.9721/KJFST.2014.46.3.295]

-
Kim, JG, Park, JY, Kim, JS, (2015), Effects of storage time and temperature on the hygienic quality of shell eggs, J Environ Health Sci, 41(6), p438-448.
[https://doi.org/10.5668/jehs.2015.41.6.438]

-
Kim, JW, Slavik, MF, (1996), Changes in eggshell surface microstructure after washing with cetylpyridinium chloride or trisodium phosphate, J Food Prot, 59(8), p859-863.
[https://doi.org/10.4315/0362-028X-59.8.859]

-
Lee, HO, Kim, JY, Kim, BS, (2014), Choosing quality indicators for quality prediction of egg in circulation, Korean J Food Preserv, 21(5), p609-617.
[https://doi.org/10.11002/kjfp.2014.21.5.609]

- Lee, SM, Hong, CH, (2005), Changes of egg quality according to eggshell treatment and storage condition, Korean J Vet Serv, 28(3), p225-234.
- MFDS, (2016), http://www.foodsafetykorea.go.kr/portal/safefoodlife/foodAditive/foodAdditiveRvlv.do?page_gubun=1&procs_cl=1&menu_no=306&menu_grp=MENU_GRP01 Accessed, June 30, 2016.
- MFDS, (2013a), http://www.foodsafetykorea.go.kr/foodcode/menu_01_01.jsp Accessed, July 18, 2013.
- MFDS, (2013b), http://www.mfds.go.kr/index.do?mid=1013&seq=7542&cmd=v Accessed, July 18, 2013.
-
Moon, HJ, Lim, JG, Yoon, KS, (2016), Comparative study of change in Salmonella Enteritidis and Salmonella Typhimurium population in egg white and yolk, J Food Hyg Saf, 31(5), p342-342.
[https://doi.org/10.13103/JFHS.2016.31.5.342]

-
Park, CM, Hung, YC, Lin, CS, Brackett, RE, (2005), Efficacy of electrolyzed water in inactivating Salmonella Enteritidis and Listeria monocytogenes on shell eggs, J Food Prot, 68(5), p986-990.
[https://doi.org/10.4315/0362-028X-68.5.986]

-
Park, H, Hung, YC, Brackett, RE, (2002), Antimicrobial effect of electrolyzed water for inactivating Campylobacter jejuni during poultry washing, Int J Food Microbiol, 72(1), p77-83.
[https://doi.org/10.1016/S0168-1605(01)00622-5]

-
Park, YJ, Yoo, JY, Jan, KI, (2010), Storage attribute of Angelica keiskei juice treated with various electrolyzed water, J Korean Soc Food Sci Nutr, 39(12), p1846-1853.
[https://doi.org/10.3746/jkfn.2010.39.12.1846]

-
Park, YS, Yoo, IJ, Jeon, KH, Kim, HK, Chang, EJ, Oh, HI, (2003), Effects of various eggshell treatments on the egg quality during storage. Asian-Australas, J Anim Sci, 16(8), p1224-1229.
[https://doi.org/10.5713/ajas.2003.1224]

-
Russell, SM, (2003), The effect of electrolyzed oxidative water applied using electrostatic spraying on pathogenic and indicator bacteria on the surface of eggs, Poult Sci, 82(1), p158-162.
[https://doi.org/10.1093/ps/82.1.158]

-
Sabrani, M, Payne, C, (1978), Effect of oiling on internal quality of eggs stored at 28 and 12℃, British Poult Sci, 19(5), p567-571.
[https://doi.org/10.1080/00071667808416515]

- Schlosser, W, Henzler, D, Mason, J, Kradel, D, (1994), The Salmonella Enteritidis pilot project and the Pennsylvania egg quality assurance program, Proceedings of the Annual Meeting-United States Animal Health Association, 98, p425-425.
-
Sparks, N, Burgess, A, (1993), Effect of spray sanitizing on hatching egg cuticle efficacy and hatchability, British Poult Sci, 34(4), p655-662.
[https://doi.org/10.1080/00071669308417624]

- USDA, (2000), Egg-Grading Manual. United States Department of Agriculture Agricultural Handbook Number 75, Washington DC, USA, p6-9.
- Venkitanarayanan, KS, Ezeike, GO, Hung, YC, Doyle, MP, (1999), Efficacy of electrolyzed oxidizing water for inactivating Escherichia coli O157: H7, Salmonella Enteritidis, and Listeria monocytogenes, Appl Environ Microb, 65(9), p4276-4279.
-
Wang, H, Slavik, MF, (1998), Bacterial penetration into eggs washed with various chemicals and stored at different temperatures and times, J Food Prot, 61(3), p276-279.
[https://doi.org/10.4315/0362-028X-61.3.276]

- Yoon, KS, (2014), The development of the HACCP generic model for the wholesale egg distributor, Korea Livestock Products HACCP Accreditation Service, Korea, p65-68.