
생팥 및 삶은 팥의 열수 추출물의 유용 생리활성 평가
Abstract
Raw-red bean (RR) should be boiled in hot water, and only boiled-red bean (BR) has been used in the food industry. In the course of development of functional food using red- bean (Phaseolus radiatus L), hot- water extracts (HWEs) of RR and BR were prepared, respectively and their components and various biological activities were compared. The extraction yield at 100℃ of RR (16.2%) was higher than that of BR (14.8%), and contents of total polyphenols, total flavonoids and reducing sugars of HWE of RR were 2.5-fold, 2.1-fold and 1.5-fold higher than those of HWE of BR. In anti-oxidation activity assay, scavenging activities against DPPH anion and ABTS cation as well as reducing power of RR was higher than those of BR. The results suggest that the anti-oxidant compounds in red bean might be heat-liable or discarded during boiling in hot-water as a cooking drip. Unexpectedly, nitrite scavenging activity was stronger in HWE of BR than RR. In anti-microbial activity assay, HWE of RR (500 μg/disc) showed growth inhibition activity against gram-positive bacteria, whereas HWE of BR did not show any activity against any tested bacteria and fungi. Assay of in-vitro anti-diabetes and anti-thrombosis activities, which were previously reported in ethanol extract of red-bean, revealed that HWEs of RR and BR did not show significant activities against α-amylase, α-glucosidase, thrombin, prothrombin, or blood coagulation factors. Our results suggest that the anti-oxidation, anti-diabetes and anti-thrombosis activities of HWEs of RR and BR were lower than those of ethanol extracts of red bean, and bioactive substances in RR were destroyed during boiling or discarded after boiling. Further research on suitable boiling and re-use of cooking drip of red bean is necessary.
Keywords:
Antimicrobial, bioactivity, boiled-red bean, cooking drip, Phaseolus radiatus L.서 론
팥(Phaseolus radiatus L.)은 장미목 콩과의 한해살이 식물로, 가늘고 긴 원통형의 꼬투리 내에 6∼10개의 종자(팥알)가 들어있으며, 가식부위인 팥알은 그 형태와 구조는 콩과 비슷하나, 중앙에 흰색 띠를 가지는 특징이 있다(Choi SY et al 2002). 팥의 식물학적 기원은 분명하지 않으나, 과거로부터 중국, 한국, 일본 등 동양의 온대지방에서만 주로 재배되어 왔으며, 다른 작물에 비해 생육기간이 짧고 고냉지에서도 재배가 가능하여 우리나라에서는 콩 다음으로 생산량이 많은 중요한 두류작물이다(Kim CK et al 2003). 또한 팥은 국내 다양한 석기시대 유물에서 발견될 만큼 우리 민족과는 오래 전부터 깊은 문화적, 경제적, 식품적 관계를 가지고 있는 작물이다. 식품학적으로 팥은 68%의 탄수화물, 20%의 단백질, 라이신 등을 포함한 필수아미노산, 비타민 B1을 포함한 각종 비타민 및 미네랄을 다량 함유하고 있어 영양적으로 매우 우수한 식품원재료이며(Koh KJ et al 1997; Song SB et al 2013), 그 자체로 삶아 팥죽, 떡 등의 고물로 이용하거나, 양갱 및 과자에 첨가하거나, 밥을 지을 때 쌀, 보리, 잡곡과 섞어 식용하고 있다. 한편, 한방에서는 팥을 적소두로 부르며, 설사, 이질, 수종, 비만을 치료하는 데 사용하고 있으며, 민간에서는 팥 삶은 물을 이뇨 및 배변 촉진작용을 통한 붓기 제거용 및 다이어트 음료로 애용하고 있다(Hwang E et al 2014). 현재 국내 1인당 연간 소비량은 0.9∼1.0 kg이며, 생산량의 정체로 자급률은 20%에 머물고 있다. 그러나 빙수 및 빙과류 소비 증가로 총 소비량은 빠르게 증가되고 있어 중국산 팥의 수입이 증가되고 있는 실정이다(Lee RK et al 2014).
팥은 그 딱딱한 구조와 함께 아린 맛을 내는 시아니딘 배당체와 사포닌 성분 및 trypsin inhibitor, haemagglutination substance와 같은 비영양인자를 포함하고 있기 때문에(Yoshida C & Yoshikawa M 1975; Tanaka Y et al 1983; Grant G et al 1983) 가열하지 않고 생으로 섭취할 수는 없다. 통상 팥의 아린 맛을 제거하고, 비영양 인자들을 불활성화시키기 위해, 90℃ 정도의 고온에서 10∼20분간 삶아 1차 삶은 액을 버린 후, 다시 한번 삶아 삶은 팥을 만들고, 이를 적당한 방법으로 건조하여 앙금 및 분말로 제조하여 섭취한다.
팥에 대한 연구는 중국, 일본, 한국에서 주로 진행되고 있으며, 종자개량(Song SB et al 2011), 팥의 안토시아닌계 색소 연구(Bae DG & Jung YS 2010) 등이 있으며, 유용 생리활성에 대한 연구는 항산화(Lee HK et al 2010; Woo KS et al 2010), 항비만(Kim M et al 2015), 발암억제 효과(Choi YH et al 1998), 관절염 완화효과(Jeong SH et al 2012), 구강세균에 대한 항균 활성(Kang SJ et al 2012), 혈압 상승억제(Mukai Y & Sato S 2009) 및 혈전용해 활성(Oh HS et al 2003), 팥 및 팥 꼬투리의 항염증 활성(Yu T et al 2011; Mukai Y & Sato S 2011) 등이 알려져 있다. 그러나 상기의 대부분의 연구는 팥의 에탄올 추출물에 한정되어 있다. 실제 식품으로서 팥의 이용을 고려한다면 열수 추출물에 대한 연구가 필요하며, 최근 일본 및 한국에서의 팥의 열수 추출물에 대한 연구 결과는 팥의 에탄올 추출물과 열수 추출물은 성분 및 일부 활성에서 차이가 있음이 보고되고 있다. 팥 열수 추출물에서 보고된 활성은 DNA 손상 억제효과(Park YM et al 2011), 항세균 활성(Hori Y et al 2006), 피부 광노화 억제 활성(Hwang JT et al 2014), 혈당 강하효과(Itoh T et al 2009), 조골 및 파골세포 분화조절(Itoh T et al 2014)이 있다.
따라서 본 연구에서는 팥의 유용기능을 이용한 고부가가치 음료제품 개발 연구의 일환으로 생팥 및 증자팥의 열수 추출물에 대한 성분 및 다양한 생리활성에 대해 검토하였으며, 기존의 보고된 팥 에탄올 추출물의 생리활성과 비교하였다. 그 결과, 생팥 및 증자팥의 열수 추출물은 팥이 가진 항산화, 항당뇨, 항혈전 활성을 거의 소실한 상태이나, 팥의 에탄올 추출물과는 달리 생팥 열수 추출물은 항세균 활성을, 증자팥의 열수 추출물은 우수한 nitrite 소거능을 가짐을 확인하여, 고온처리된 팥의 부가적인 이용 가능성을 확인하였기에 이에 보고하는 바이다.
재료 및 방법
1. 실험재료
본 실험에 사용된 팥은 2012년 경북 안동에서 재배한 국내산 팥(충주팥)을 구입하여 사용하였다. 생팥 열수 추출물의 조제의 경우, 생팥의 이물질을 제거하고, 수세, 탈수하여 100∼150 메쉬로 분쇄한 후 30배 무게의 증류수를 가한 후 100 ℃에서 3시간 추출하였으며, 추출액은 filter paper(Whatsman No. 2)로 거른 후 50℃에서 감압 농축(Eyela Rotary evaporator N-1000, Tokyo Rikakikai Co., Ltd. Japan)하여 분말로 조제하였다. 증자팥의 열수 추출물 조제를 위해서는 먼저 수세한 팥에 2.5배의 물을 가한 후 90℃에서 1시간 삶은 후 액을 버리고, 다시 100℃에서 1시간 삶아 증자팥을 조제한 후 동결건조(PVTFD 100R, Ilsin Biobase Co., Kora)하여 분말을 조제하였다. 이후 100∼150 메쉬로 분쇄한 후, 증자팥 분말의 30배 무게의 증류수를 가해 100℃에서 3시간 추출하였으며, 상기와 동일한 방법으로 추출물을 조제하였다. 각각의 열수 추출물들은 DMSO에 적당한 농도로 녹여, in-vitro 항산화, 항균, 항당뇨 및 항혈전 활성 평가에 사용하였다. 기타 사용한 시약은 시약급 이상으로 Sigma Co.(USA)의 제품을 구입하여 사용하였다.
2. 팥 열수 추출물의 항산화 활성
생팥 및 증자팥의 열수 추출물의 항산화 활성은 DPPH (1,1-diphenyl-2-picryl hydrazyl) anion scavenging activity[DSA], ABTS[2,2-azobis(3-ethylbenzothiazoline-6-sulfonate)] cation scavenging activity[ASA], nitrite scavenging activity[NSA] 및 환원력 측정으로 평가하였다(Jung IC & Sohn HY 2014). 먼저 DSA 측정의 경우, 다양한 농도로 희석한 시료 20 μL에 99.5% ethanol에 용해시킨 2×10-4 MDPPH 용액 380 μL를 넣고 혼합하여 37℃에서 30분 동안 반응시킨 후, 516 nm에서 microplate reader(Epoch, Biotek Instruments Inc., VT, USA)를 사용하여 흡광도를 측정하였다. DSA(%)는 시료 첨가구와 비첨가구의 백분율로 표시하였다. ASA 측정의 경우, 7 mM ABTS (Sigma Co., USA) 5 mL와 140 mM potassium persulfate 88 mL를 섞은 후 상온에서 16시간 빛을 차단하여 ABTS 양이온을 형성시켰으며, 이후 이 용액을 414 nm에서 흡광도 값이 1.5가 되도록 ethanol로 희석하였다. 조제된 희석용액 190 μL와 시료 10 μL를 혼합한 후 상온에서 6분간 반응시킨 후 734 nm에서 흡광도를 측정하고, 다음의 식에 의해 ASA(%)를 결정하였다.
C: DMSO 첨가 시 흡광도
S: 시료 첨가 시 흡광도.
한편, NSA 측정의 경우, 아질산염 용액(1 mM)에 시료용액을 가하고, 여기에 0.1 N HCl을 가해 pH 1.2로 조정한 후, 37 ℃에서 1시간 반응시킨 후 Griess reagent(Sigma Co., USA)를 가하고 혼합하였다. 이후 15분간 실온에서 방치 후 520 nm에서 흡광도를 측정하여 잔존 nitrite 양을 측정하였다(Ahn SM et al 2011). NSA(%)는 다음의 식에 의해 계산하였으며, A는 1 mM nitrite 용액에 팥 열수 추출물을 첨가하여 1시간 반응시킨 후의 흡광도, B는 1 mM nitrite 용액의 흡광도, C는 팥 열수 추출물의 흡광도를 각각 나타낸다.
환원력 평가를 위해서는 ethanol에 용해한 시료 2.5 mL에 0.2 M sodium phosphate buffer(pH 6.6) 2.5 mL와 10% potassium ferricyanide 2.5 mL를 첨가하고 50℃에서 20분간 반응시킨 후, 10% trichloroacetic acid 2.5 mL를 첨가하여 반응을 종료하고, 4,000 rpm에서 10분간 원심분리하여 상등액을 회수하였다. 회수한 상등액은 증류수로 2배 희석한 후, 신선하게 조제된 0.1% ferric chloride 용액과 5:1(v/v) 비율로 혼합하고 700 nm에서 흡광도를 측정하여 평가하였다(Lee RK et al 2014). 상기의 항산화 실험에서 대조구로는 vitamin C(Sigma Co., USA)를 사용하였으며, 용매 대조구로는 DMSO를 사용하였다. 각각의 활성 평가는 각각 3회 반복한 실험의 평균과 편차로 표시하였으며, 각각의 radical 소거활성은 각각의 활성화된 anion, cation 및 nitrite를 50% 소거하는 데 소요되는 시료농도(RC50)를 계산하여 나타내었다(Lee RK et al 2014).
3. 팥 열수 추출물의 항균 활성
생팥 및 증자팥의 열수 추출물의 항균 활성은 기존의 보고된 방법과 동일하게 평가하였다(Jung IC & Sohn HY 2014). 항균 활성평가를 위한 그람 양성세균으로는 Staphylococcus aureus KCTC 1916, Staphylococcus epidermidis ATCC 12228, Listeria monocytogenes KACC 10550, Bacillus subtilis KCTC 1924를, 그람 음성세균으로 Escherichia coli KCTC 1682, Pseudomonas aeruginosa KACC 10186, Proteus vulgaris KCTC 2433, Salmonella typhimurium KCTC 1926, 진균으로는 Candida albicans KCTC 1940 및 Saccharomyces cerevisiae IF0 0233를 사용하였다. 항세균 활성 평가의 경우, Nutrient broth(Difco Co., USA)에 각각의 세균을 접종하여 37℃에서 24시간 동안 배양한 후, 각 균주를 OD600 0.1로 조정하여 Nutrient agar(Difco Co., USA) 배지를 포함하는 멸균 petri dish(90×15 mm, Green Cross Co., Ltd. Korea)에 100 μL 도말하고, 각각의 시료 5 μL를 멸균 disc-paper(지름 6.5 mm, Whatsman No.2)에 가하여, 37℃에서 24시간 동안 배양하였으며, 진균 경우에는 Sabouraud dextrose(Difco Co. USA)를 이용하여 동일한 방법으로 30℃에서 24시간 동안 배양 후, 생육저지환의 크기를 측정하여 항균활성을 평가하였다. 대조구로는 항세균제인 ampicillin과 항진균제인 miconazole(Sigma Co., USA)을 각각 1 μg/disc 농도로 사용하였으며, 생육저지환의 크기는 육안으로 생육이 나타나지 않는 부분의 지름을 mm 단위로 측정하였고, 3회 이상 평가 후 대표 결과로 나타내었다.
4. 팥 열수 추출물의 항당뇨 활성
생팥 및 증자팥의 열수 추출물의 항당뇨 활성은 in-vitro α-amylase 저해 활성과 α-glucosidase 저해 활성을 평가하여 나타내었다. 먼저 α-amylase 저해활성은 기존 보고(Lee RK et al 2014)와 동일하게 열수 추출물 2.5 μL와 50 mM phosphate buffer(pH 6.8)로 희석한 α-amylase(0.25 U/ml) 25 μL를 혼합하여 37℃에서 10분간 preincubation한 후, 0.5% soluble starch (Samchun Chemicals Co., Korea) 25 μL를 가하여 37℃에서 10분간 반응하였다. 이후 100℃에서 5분간 가열하여 반응을 정지시켰으며, 반응액에 150 μL의 DNS(3,5-dinitrosalicylic acid, Sigma Co., USA) 용액을 가하여 100℃에서 5분간 가열하여 발색한 후 상온에서 방냉하였다. 발색액은 96 well microplate reader를 이용하여 540 nm에서 흡광도를 측정하였으며, 각각의 실험은 3회 반복한 후 평균값을 구하여 다음의 식으로 저해율을 계산하였다.
한편, α-glucosidase 저해활성은 pNPG(p-nitrophenol glucoside; Sigma Co., USA)를 이용하여 평가하였으며(Lee RK et al 2014), 팥 열수 추출물 2.5 μL와 50 mM sodium acetate buffer(pH 5.6)로 희석한 α-glucosidase(0.25 U/mL) 25 μL를 혼합하여 37℃에서 10분간 방치하고, 1 mM pNPG 용액 25 μL를 가하여 60℃에서 10분간 반응하였다. 이후 1 M NaOH 25 μL를 가하여 반응을 정지시키고, 405 nm에서 흡광도를 측정하여 다음의 식으로 저해율을 계산하였다.
5. 팥 열수 추출물의 항혈전 활성
생팥 및 증자팥의 열수 추출물의 항혈전 활성은 혈액응고 저해 활성을 평가하였으며, 기존에 보고된 방법(Jung IC & Sohn HY 2014)과 동일하게 Thrombin Time(TT), Prothrombin Time(PT) 및 activated Partial Thromboplastin Time(aPTT)을 측정하여 평가하였다. 혈장은 표준혈장(MD Pacific Co., China)을 구입하여 사용하였으며, 기타 시약은 Sigma Co.(Sigma Co., USA)의 제품을 구입하여 사용하였다. 각각의 TT, PT, aPTT 측정은 3 회 반복한 실험의 평균치로 나타내었으며, TT, PT, aPTT 연장에 따른 혈액 응고 저해활성은 시료 첨가시의 응고시간(초)을 용매 대조구의 응고시간(초)으로 나눈 값으로 나타내었다.
6. 기타 분석
생팥 및 증자팥의 열수 추출물의 total flavonoid (TF)의 함량 측정은 기존의 보고(Valentina U et al 2007)에 따라 측정하였으며, 각각의 시료를 18시간 메탄올 교반 추출하고, 여과한 추출검액 400 μL에 90% diethylene glycol 4 mL를 첨가하고, 다시 1 N NaOH 40 μL를 넣고 37℃에서 1시간 반응 후 420 nm에서 흡광도를 측정하였다. 표준시약으로는 rutin을 사용하였다. Total polyphenol(TP)함량은 추출검액 400 μL에 50 μL의 Folin-Ciocalteau, 100 μL의 Na2CO3 포화용액을 넣고 실온에서 1시간 방치한 후 725 nm에서 흡광도를 측정하였다(Valentina U et al 2007). 표준시약으로는 tannic acid를 사용하였다. 총당 정량의 경우에는 phenol-sulfuric acid 법을, 환원당 정량의 경우에는 DNS 변법을 이용하였다(Valentina U et al 2007). 각각의 분석결과는 3회 반복한 실험의 평균과 편차로 나타내었다. 한편, 팥 시료의 수분함량은 105℃ 건조 후 항량을 측정하여 계산하였으며, 조단백질은 micro-Kjeldahl 법, 조지방은 Soxhlet 추출법, 조회분은 550℃ 직접회화법으로 측정하였다(Jeong CH et al 2008). 조탄수화물은 전체 시료무게에서 수분, 조단백질, 조지방 및 조회분 함량을 뺀 나머지로 산출하였다.
7. 통계분석
실험 결과는 SPSS 21.0 버전을 사용하여 mean±S.D.로 나타내었으며, 각 군 간의 차이는 ANOVA로 분석하였으며, Duncan 다중비교 검증법으로 통계적 유의성 검정을 조사하였다. 유의수준은 p<0.05로 하였다.
결과 및 고찰
1. 팥 열수 추출물의 유용 성분 분석
실험에 사용한 생팥(충주팥)은 평균 크기 0.57±0.11 cm, 평균 무게 0.135±0.002 g이었으며, 영양성분 분석결과 다량의 단백질과 탄수화물을 포함하여 332.5 kcal/100g을 나타내어 영양적으로 우수함을 확인하였다(Table 1). 증자팥의 경우에는 생팥에 비해 수분함량이 약 3.8배 증가되었으나, 조단백질 및 조탄수화물 함량은 각각 생팥의 47% 및 58% 수준을 나타내었다. 그러나 증자팥의 조회분 함량은 생팥의 3.6%보다 낮은 1.2%를 나타내었다. 따라서 증자한 팥의 경우 186.2 kcal/100g을 나타내어 생팥보다 약 56% 열량이 감소함을 확인하였다.
생팥의 1차 열수 추출물은 강한 아린 맛과 설사를 유발하는 문제 등으로 인해 음용할 수 없으므로, 민간에서는 생팥을 1차적으로 삶아 액을 버린 후 증자팥을 조제하고, 이후 증자팥을 삶아 조제된 열수 추출물을 붓기 제거 및 다이어트용으로 이용하여 왔다(Choi SY et al 2002; Kang SJ & Han YS 2012). 본 연구에서는 생팥 열수 추출물을 기준으로 증자팥의 열수 추출물의 유용성분을 비교하고자 하였으며, 각각의 추출효율 및 추출물의 성분 분석 결과는 Table 2에 나타내었다.
먼저 생팥 및 증자팥의 추출효율은 각각16.2% 및 14.8%를 나타낸 바, 1차 삶기과정의 제거액에 약 1.4%의 고형분이 포함되어 있을 것으로 추측되며, 팥의 에탄올 추출효율 1.5∼1.8%에 비해 열수 추출효율은 8.2∼10.8배 높음을 확인하였다(Lee RK et al 2014). 생팥 추출물의 경우, TP 함량은 증자팥보다 2.5배 높은 19.61 mg/g을, TF 함량은 증자팥보다 2.1배 높은 4.16 mg/g을 나타내었다. 반면, 총당에 있어서는 증자팥에서 1.7배 높은 함량을 나타내었으며, 환원당 함량은 생팥에서 1.5배 높게 나타났다. 따라서 삶기 과정중 다양한 polyphenol, flavonoid 물질 및 환원당의 손실이 있음을 알 수 있으며, 향후 유용성분의 손실을 최소화하면서도 관능성, 안정성이 우수한 증자팥 제조 연구가 필요하다고 판단된다.
2. 팥 열수 추출물의 항산화 활성
생팥 및 증자팥의 열수 추출물의 항산화 활성을 DSA, ASA 및 환원력으로 평가한 결과, 전체적으로 생팥이 증자팥에 비해 강한 활성을 나타내었다(Fig. 1).
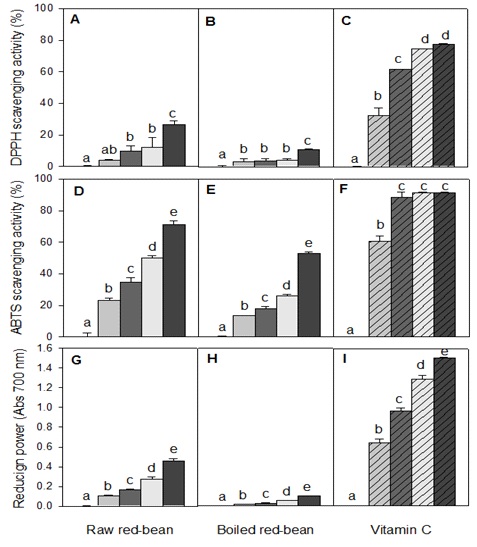
Comparison of anti-oxidant activities of the hot-water extracts between raw red-bean and boiled red-bean.Symbols for vitamin C (C, F and I): , 0 μg/mL; , 6.25 μg/mL; , 12.5 μg/mL; , 25 μg/mL, and , 50 μg/ mL, respectively. Symbols for red-bean (A, B, D, E, G and H): , 0 μg/mL; , 62.5 μg/mL; , 125 μg/mL; , 250 μg/mL, and , 500 μg/mL, respectively.Values are means±standard deviation of triplicate determinations.Different superscript in a column indicate significant differences at p<0.05 by Duncan’s multiple range test.
생팥의 경우, 500 μg/mL 농도에서 26.4%의 DSA 및 71.1%의 ASA를 나타내었으나, 증자팥의 경우 동일농도에서 10.6%의 DSA 및 52.3%의 ASA를 나타내었다. 반면, 대조구로 사용된 vitamin C의 경우 6.25 μg/mL 농도에서 29.4%의 DSA 및 63.3%의 ASA를 나타내어 생팥 및 증자팥의 radical 소거능은 vitamin C의 약 1/55∼1/75에 해당하였다(Fig. 1). 또한 환원력의 경우에도 생팥은 0.46(OD 700 nm) 값을 나타내었으나, 증자팥은 0.102 값을 나타내어 생팥이 우수한 항산화력을 나타내었다. 그러나 nitrite 소거능의 경우에는 100 μg/mL 농도에서 생팥이 18.0%, 증자팥이 33.2%의 소거능을 나타내어, 오히려 증자팥이 생팥보다 1.8배 우수한 소거 활성을 보였으며, 증자팥의 nitrite 소거능은 vitamin C의 1/75수준으로 나타났다. 한편, 활성 radical 50% 소거능인 RC50을 계산하였으며(Table 3), 이를 기존의 보고(Lee RK et al 2014)와 비교한 결과, 팥 열수 추출물의 항산화 활성은 에탄올 추출물의 1/3∼1/4 수준으로 나타났으며, 팥의 항산화 활성의 대부분은 열에 민감한 물질에 의해 나타남을 알 수 있었다.
또한 nitrite 소거능과 관련된 물질은 팥의 에탄올 추출물과는 달리, 증자팥의 열수 추출물과 관련 있음을 확인하였다.
3. 팥 열수 추출물의 항균활성
생팥 및 증자팥 열수 추출물의 항세균 및 항진균 활성을 평가하였다. 먼저 양성 대조구로 사용된 ampicillin(1 μg/disc)은 그람 양성 및 그람 음성 세균에 광범위한 항균 활성을 나타내었으며, miconazole(1 μg/disc)은 우수한 항진균 활성을 나타내었다. 생팥 열수 추출물(500 μg/disc)은 그람 양성 세균 4종 모두에서 양호한 항균 활성을 나타내었으나, 그람 음성세균 및 진균에 대해서는 항균력이 없었다(Table 4).
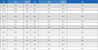
Anti-microbial activity of the hot-water extracts of raw- red bean and boiled-red bean against pathogenic and food-spoilage bacteria and fungi
반면, 증자팥의 경우 500 μg/disc 농도까지 실험균주 모두에 대해 항균력이 나타나지 않았다. 이러한 결과는 생팥 및 증자팥의 에탄올 추출물에서는 항균력이 나타나지 않는 기존의 보고(Lee RK et al 2014)와, 생팥의 70% 에탄올 추출물이 그람양성 및 그람음성의 구강세균에 대해 2,000 μg/disc 농도에서 항균활성을 나타낸다는 기존보고(Kang SJ & Han YS 2012)를 고려하면, 생팥의 수용성 성분이 항세균 활성에 관련되며, 이는 팥을 삶는 과정 중에 소실 또는 실활된다고 추측된다. 항세균 활성은 생팥의 열수 추출물에서만 나타나므로 향후 이의 활성성분 규명 연구 및 그람 양성균에 대한 항균활성 기작에 대한 연구가 필요하다고 판단된다.
4. 팥 열수 추출물의 항당뇨 활성
생팥 및 증자팥의 항당뇨 활성을 500 μg/mL 농도에서 in-vitro α-amylase 및 α-glucosidase 활성을 측정하여 평가한 결과, 모두 10% 이하의 무시할 만한 저해활성을 나타내었다. 임상에서 2형 당뇨병 치료제로 사용되고 있는 acarbose의 경우, 62.5 μg/mL 농도에서 44.3%의 α-amylase 저해 및 47.8%의 α-glucosidase 저해를 나타낸 것과 비교하면, 팥의 열수 추출물은 상대적으로 미미한 α-amylase 및 α-glucosidase 저해활성을 나타내는 것을 알 수 있으며, 기존의 팥의 에탄올 추출물과 비교 시에도 1/3∼1/4의 저해활성을 나타내었다(Lee RK et al 2014). 따라서 팥의 경우, 열수 추출 시 전분 분해관련 효소의 저해활성이 소실됨을 확인하였다.
5. 팥 열수 추출물의 항혈전 활성
생팥 및 증자팥의 열수 추출물의 혈액응고저해활성을 평가한 결과는 Table 5에 나타내었다.
먼저 양성 대조구로 사용된 아스피린(1.5 mg/mL)은 TT, PT, aPTT를 무첨가구에 비해 각각 1.9배, 1.7배 및 1.9배 연장시켜 우수한 혈전 생성 억제활성을 나타내었다. 그러나 생팥 및 증자팥의 열수 추출물의 경우 5 mg/mL 농도에서도 TT, PT, aPTT의 변화가 나타나지 않아, 항혈전 활성은 인정되지 않았다. 생팥 에탄올 추출물의 경우 2.5 mg/mL 농도에서도 PT 및 aPTT를 무첨가구에 비해 15배 이상 연장함을 고려할 때(Lee RK et al 2014), 생팥의 강력한 항혈전 활성 물질은 열에 약한 이열성 지용성 물질이거나 1차 삶은 액을 제거할 때 소실된 것으로 판단된다. 본 연구결과는 생팥 및 증자팥의 열수 추출물의 항산화, 항당뇨 및 항혈전 활성이 에탄올 추출물보다 미약하며, 생팥의 유용활성이 증자팥에서는 거의 남아 있지 않음을 제시하고 있다. 상기 결과는 생팥의 유용성분이 이열성 성분이거나, 또는 팥 삶기 과정 중의 증자액으로 소실됨을 의미하고 있다. 따라서 팥을 이용한 고부가가치 식품 제조 시 적합한 삶기 공정 및 폐기되고 있는 팥의 1차 증자액의 효율적인 이용에 대한 연구가 필요함을 제시하고 있다.
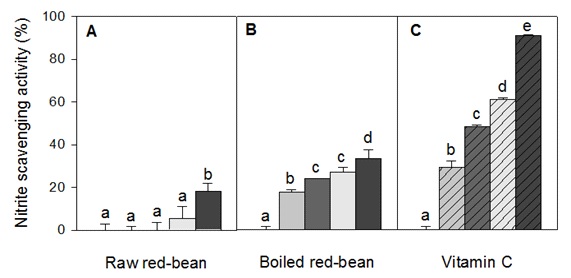
Comparison of nitrite scavenging activities of the hot-water extracts between raw-red bean and boiled-red bean.Symbols for vitamin C (C): , 0 μg/mL; , 6.25 μg/mL; , 12.5 μg/mL; , 25 μg/mL and , 50 μg/mL, respectively. Symbols for red-bean (A and B) : , 0 μg/mL; , 12.5 μg/mL; , 25 μg/mL; , 50 μg/mL and , 100 μg/mL, respectively.Values are means±standard deviation of triplicate determinations.Different superscript in a column indicate significant differences at p<0.05 by Duncan’s multiple range test
요 약
식품으로 사용되는 팥은 생팥이 아닌 증자팥을 사용하며, 고온의 열수로 삶은 후 제조된다. 본 연구에서는 팥을 이용한 고부가가치 식품개발 연구의 일환으로, 생팥의 열수 추출물 및 팥을 삶은 후 증자액을 폐기하고 제조한 증자팥의 열수 추출물을 조제하고 이들의 유용성분 및 항산화, 항균, 항당뇨 및 항혈전 활성을 비교 평가하였다. 생팥 및 증자팥의 추출효율은 각각 16.2% 및 14.8%로 생팥이 1.1배 높았으며, 총 폴리페놀, 총 플라보노이드 및 환원당 함량은 생팥이 증자팥보다 각각 2.5배, 2.1배 및 1.5배 높았다. 생팥의 DPPH 음이온 및 ABTS 양이온 소거능 및 환원력 평가 결과, 증자팥보다 모두 높게 나타나, 팥의 항산화 활성이 고온의 열수 삶기 과정 중 소실됨을 알 수 있었다. 반면, nitrite 소거능은 생팥보다 삶은 증자팥에서 더욱 강하게 나타났다. 항균 활성 평가결과, 생팥의 열수 추출물에서만 그람양성 세균에 대한 활성이 나타났으며, 증자팥의 경우 항균 활성은 500 μg/disc 농도까지 나타나지 않았다. 또한 in-vitro α-amylase 및 α-glucosidase에 대한 저해활성과 항혈전 활성에 관련된 thrombin, prothrombin, coagulation factors에 대한 저해활성 평가 결과, 생팥의 비가열 추출물과는 달리, 생팥 및 증자팥의 열수 추출물은 전분분해 저해 및 항혈전 활성이 인정되지 않았다. 본 연구결과는 생팥 및 증자팥의 열수 추출물의 항산화, 항당뇨 및 항혈전 활성이 비가열 에탄올 추출물보다 미약하며, 생팥의 유용활성이 증자팥에서는 거의 남아 있지 않음을 제시하고 있으며, 팥을 이용한 고부가가치 식품 제조 시 적합한 삶기 공정 및 팥 증자액의 효율적인 이용에 대한 연구가 필요함을 제시하고 있다.
Acknowledgments
본 연구는 중소기업청에서 지원하는 2014년도 산학연공동기술개발사업(No. C0184835)의 연구수행으로 인한 결과물임을 밝힙니다.
REFERENCES
-
Ahn, SM., Hong, YK., Kwon, GS., Sohn, HY., (2011), Evaluation of antioxidant and nitrite scavenging activity of seaweed extracts, J Life Sci, 21, p576-583.
[https://doi.org/10.5352/JLS.2011.21.4.576]

- Bae, DG., Jung, YS., (2010), Colorant extracting and its storage stability from red bean and black bean seed coat, Agric Rex Bull Kyungpook Natl Univ, 28, p31-38.
- Choi, YH., Kang, MY., Nam, SH., (1998), Inhibitory effect of various cereal and bean extracts on carcinogenicity in vitro, Korean J Food Sci Technol, 30, p964-969.
- Choi, SY., Jeong, YJ., Lee, SJ., Chi, OH., Chegal, SA., (2002), Food and Health for Modern People, Dongmyungsa, Seoul, Korea, p244-246.
-
Grant, G., More, LJ., McKenzie, NH., Stewart, JC., Pusztai, A., (1983), A survey of the nutritional and haemagglutination properties of legume seeds generally available in the UK, Br J Nutr, 50, p207-214.
[https://doi.org/10.1079/BJN19830090]

-
Hori, Y., Sato, S., Hatai, A., (2006), Antibacterial activity of plant extracts from azuki beans (Vigna angularis) in vitro, Phytother Res, 20, p162-164.
[https://doi.org/10.1002/ptr.1826]

-
Hwang, E., Park, SY., Lee, HJ., Sun, ZW., Lee, TY., Song, HG., Shin, HS., Yi, TH., (2014), Vigna angularis water extracts protect against ultraviolet B-exposed skin aging in vitro and in vivo, J Med Food, 17, p1339-1349.
[https://doi.org/10.1089/jmf.2013.3017]

-
Hwang, JT., Oh, HM., Kim, MH., Jeong, HJ., Lee, C., Jang, HJ., Lee, SW., Park, CS., Rho, MC., (2014), Simultaneous quantitation and validation of triterpenoids and phytosteroids in Phaseolus angularis seeds, Molecules, 19, p10309-10319.
[https://doi.org/10.3390/molecules190710309]

-
Itoh, T., Kobayashi, M., Horio, F., Furuichi, Y., (2009), Hypoglycemic effect of hot-water extract of adzuki (Vigna angularis) in spontaneously diabetic KK-A(y) mice, Nutrition, 25, p134-141.
[https://doi.org/10.1016/j.nut.2008.08.001]

-
Itoh, T., Nakamura, M., Nakamichi, H., Ando, M., Tsukamasa, Y., Furuichi, Y., (2014), Regulation of the differentiation of osteoblasts and osteoclasts by a hot-water extract of adzuki beans (Vigna angularis), Biosci Biotechnol Biochem, 78, p92-99.
[https://doi.org/10.1080/09168451.2014.877182]

- Jeong, CH., Choi, SG., Heo, HJ., (2008), Analysis of nutritional components and evaluation of functional activities of Sasa borealis leaf tea, Korean J Food Sci Technol, 40, p586-592.
- Jeong, SH., Kim, SH., Kim, HK., Yun, BR., Lee, HW., Lim, JH., Rho, MC., Kim, DH., (2012), Effect of Vigna anugularis ethanol extract on papain-induced arthritis in mice, Korean J Oriental Physiol Pathol, 26, p665-671.
-
Jung, IC., Sohn, HY., (2014), Antioxidation, antimicrobial and antithrombosis activities of aged black garlic (Allium sativum L.), Korean J Microbiol Biotechnol, 42, p285-292.
[https://doi.org/10.4014/kjmb.1407.07002]

-
Kang, SJ., Han, YS., (2012), Studies on the anti oralmicrobial activity and selected functional component of small red bean extract, Korean J Food Cookery Sci, 28, p41-49.
[https://doi.org/10.9724/kfcs.2012.28.1.041]

- Kim, CK., Oh, BH., Na, JM., Sin, DH., (2003), Comparison of physicochemical properties of Korean and Chinese red bean starches, Korean J Food Sci Technol, 35, p551-555.
-
Kim, M., Park, JE., Song, SB., Cha, YS., (2015), Effects of black adzuki bean (Vigna angularis) extract on proliferation and differentiation of 3T3-L1 preadipocytes into mature adipocytes, Nutrients, 7, p2772-2792.
[https://doi.org/10.3390/nu7010277]

- Koh, KJ., Shin, DB., Lee, YC., (1997), Physicochemical properties of aqueous extracts in small red bean, mung bean and black soybean, Korean J Food Sci Technol, 29, p854-859.
-
Lee, HK., Hwang, IG., Kim, HY., Woo, KS., Lee, SH., Woo, SH., Lee, JS., Jeong, HS., (2010), Physicochemical characteristics and antioxidant activities of cereals and legumes in Korea, J Korean Soc Food Sci Nutr, 39, p1399-1404.
[https://doi.org/10.3746/jkfn.2010.39.9.1399]

-
Lee, RK., Kim, MS., Lee, YS., Lee, MH., Lee, JH., Sohn, HY., (2014), A comparison of the components and biological activities in raw and boiled red beans (Phaseolus radiates L.), Korean J Microbiol Biotechnol, 42, p162-169.
[https://doi.org/10.4014/kjmb.1402.02006]

-
Mukai, Y., Sato, S., (2009), Polyphenol-containing azuki bean (Vigna angularis) extract attenuates blood pressure elevation and modulates nitric oxide synthase and caveilin-1 expression in rats with hypertension, Nutr Metab Cardiovasc Dis, 19, p491-497.
[https://doi.org/10.1016/j.numecd.2008.09.007]

-
Mukai, Y., Sato, S., (2011), Polyphenol-containing azuki bean (Vigna angularis) seed coat attenuates vascular oxidative stress and inflammation in spontaneously hypertensive rats, J Nutr Biochem, 22, p16-21.
[https://doi.org/10.1016/j.jnutbio.2009.11.004]

- Oh, HS., Kim, JH., Lee, MH., (2003), Isoflavone contents, antioxidative and fibrinolytic activities of red bean and mung bean, Korean J Soc Food Cookery Sci, 19, p263-270.
-
Park, YM., Jeong, JB., Seo, JH., Lim, JH., Jeong, HJ., Seo, EW., (2011), Inhibitory effect of red bean (Phaseolus angularis) hot water extracts on oxidative DNA and cell damage, Korean J Plant Res, 24, p130-138.
[https://doi.org/10.7732/kjpr.2011.24.2.130]

-
Song, SB., Ko, JY., Kim, JI., Lee, JS., Jung, TW., Kim, KY., Kwak, DY., Oh, IS., Woo, KS., (2013), Changes in physicochemical characteristics and antioxidant activity of Adzuki bean and Adzuki bean tea depending on the variety and roasting time, Korean J Food Sci Technol, 45, p317-324.
[https://doi.org/10.9721/KJFST.2013.45.3.317]

-
Song, SB., Seo, HI., Ko, JY., Lee, JS., Kang, JR., Oh, BG., Seo, MC., Yoon, YN., Kwak, DY., Nam, MH., Woo, KS., (2011), Quality characteristics of Adzuki bean sediment according to variety, J Korean Soc Food Sci Nutr, 40, p1121-1127.
[https://doi.org/10.3746/jkfn.2011.40.8.1121]

- Tanaka, Y., Tsunogae, Y., Hayakawa, Y., Tanaka, I., Yamane, T., Ashida, T., Ishikawa, C., Watanabe, K., Nakamura, S., Takahashi, K., (1983), Preliminary crystallographic study of Bowman-Birk protease inhibitor (adzuki bean) and its complex with trypsin, J Biochem, 94, p611-613.
- Valentina, U., Facic, J., Stampar, F., (2007), Sugars, organic acids, phenolic composition and antioxidant activity of sweet cherry (Prunus avium L.), Food Chem, 107, p185-192.
- Woo, KS., Song, SB., Ko, JY., Seo, MC., Lee, JS., Kang, JR., Oh, BG., Nam, MH., Jeong, HS., Lee, J., (2010), Antioxidant components and antioxidant activities in methanolic extract from adzuki beans (Vigna angularis var. nipponensis), Korean J Food Sci Technol, 42, p693-698.
- Yoshida, C., Yoshikawa, M., (1975), Purification and characterization of proteinase inhibitors from adzuki beans (Phaseolus angularis), J Biochem, 78, p935-945.
-
Yu, T., Ahn, HM., Shen, T., Yoon, K., Jang, HJ., Lee, YJ., Yang, HM., Kim, JH., Kim, C., Han, MH., Cha, SH., Kim, TW., Kim, SY., Lee, J., Cho, JY., (2011), Anti-inflammatory activity of ethanol extract derived from Phaseolus angularis beans, J Ethnopharmacol, 137, p1197-1206.
[https://doi.org/10.1016/j.jep.2011.07.048]

