강황 추출물의 항산화 및 면역 활성 증진 효과
 ; Eun Byeol Lee1
; Eun Byeol Lee1 ; Si Hyun Kim1 ; Ji-Hye Choi1, 2
; Si Hyun Kim1 ; Ji-Hye Choi1, 2 ; Ji Su Kim1
; Ji Su Kim1 ; Ju-Hui Kim1
; Ju-Hui Kim1 ; Un Yul Jeong1
; Un Yul Jeong1 ; Hwal Choi1
; Hwal Choi1 ; You-Seok Lee3
; You-Seok Lee3 ; Sung Hyen Lee4, †
; Sung Hyen Lee4, †
Abstract
This study sought to investigate the antioxidant and immune-stimulatory effects of different Curcuma longa (C. longa) extracts based on their color (random, light, medium, dark orange), the soil of cultivation (clay, granite), drying temperature (50∼80℃), and extraction methods (water, ethanol). The antioxidant factors of C. longa were determined by the total phenolic content and DPPH and ABTS radical scavenging activities. The nitric oxide (NO) production of the macrophage cell line (RAW264.7) and the proliferation of splenocytes were investigated to assess the immune-enhancing effects of C. longa. The antioxidant activity was higher in the dark color and the ethanol extracts. All the types of extracts were nontoxic and enhanced the production of NO in RAW264.7 at less than 250 μg/mL of C. longa. When mouse splenocytes were exposed to various concentrations of hot water or ethanol extracts of C. longa with media, concanavalin A (Con A), lipopolysaccharide (LPS), and cyclophosphamide (CPA), their proliferation increased. Specifically, the 70% ethanol extract of C. longa showed the highest levels of splenocyte proliferation among all samples. These results suggest that the antioxidant and immune-stimulating activities of C. longa were most affected by the extracting solvent rather than color, soil in which it was cultured, and drying temperature. Appropriate extraction methods for C. longa should be researched further to develop good healthy foods with high antioxidant and immune-enhancing activities.
Keywords:
Curcuma longa, extract, antioxidant, immunity enhancement서 론
전 세계적으로 건강에 대한 소비자 인식이 높아지면서 기능성 식품에 대한 관심이 증가하고 있다. 건강한 삶을 바라지만 서구화된 식생활, 스트레스 등에 의한 만성질환의 발병률이 높아짐에 따라 질병의 예방 및 개선을 위해 항산화 및 면역 활성 증진 효과를 가진 기능성 식품소재와 다양한 제품 개발에 대한 연구가 진행되고 있다(Jeong IS 등 2019).
인체는 자연스러운 대사과정에서 활성산소를 생성하며, 활성산소는 염증 발생 및 유전자 손상에 따른 단백질 손상을 유발하고, 생리적 기능 저하로 인한 각종 질병과 노화의 원인이 되고 있다(Seo HJ 등 2018; Lim HJ 2021). 한편, 면역체계는 외부에서 유입되는 다양한 감염원으로부터 인체를 보호하기 위한 방어 작용으로(Lee EB 등 2020), 백혈구, 대식세포, 자연살해세포 등 다양한 면역세포들 간의 상호작용에 의해 유지된다. 특히 대식세포는 NO(nitric oxide)와 염증성 사이토카인인 TNF-α, IL-β, IL-6 등을 생산하여 면역조절에 중요한 역할을 하는 것으로 알려져 있다(Heo SI & Jung SM 2021).
강황(Curcuma longa Linn. 또는 tumeric)은 생강과에 속하는 다년생 초본 식물로 대한민국, 인도, 중국, 태국, 인도네시아, 일본 등에서 재배되고 있다(Sung KC 2011). 강황의 재배환경은 20∼30℃의 온난 다습한 기후가 적합하고 풍부한 일조량과 배수가 잘 되는 비옥한 토양에서 잘 자라는 것으로 알려져 있다(Sung KC 2011). 구조상으로 볼 때 크게 덩이뿌리를 뜻하는 울금과 뿌리와 줄기를 일컫는 강황을 포함하고 있으며, 울금은 오렌지색 그리고 강황은 진한 노란색을 띤다고 알려져 있다(Youn SJ 등 2020). 강황은 탄수화물, curcumin, demethoxycurcumin, bisdemethoxycurcumin 등의 정유성분을 함유하고 있고(Chae YB 등 2012; Ra HN & Kim HY 2016; Ha HY 2020), 항산화, 항염, 항암, 심혈관 질환 예방 등 다양한 효능이 보고되었다(Sung KC 2011; Chae YB 등 2012; Ha HY 2020; Youn SJ 등 2020).
그러나 이렇게 다양한 기능성에도 불구하고, 강황은 일부 단순가공품으로 활용되고 있을 뿐이며, 생산량에 비해 소비량이 매우 적은 실정이다. 또한 강황의 색, 재배법, 건조 온도 및 추출 방법에 따라 성분과 기능성이 다를 것으로 예상되나 소재 특이성에 대한 비교 연구가 없어 제품 개발이 어려운 상황이다. 따라서 본 연구에서는 강황의 기능성에 영향을 줄 수 있는 주요 요소로서 강황의 색, 재배 토양, 건조 온도 및 추출 방법(열수, 주정 농도)을 선정하고, 최근 관심이 증가하고 있는 항산화 및 면역 활성 증진 효과를 비교하였다.
재료 및 방법
1. 강황 추출물의 준비
연구에 사용된 강황은 전라남도 진도군에 소재한 여러 강황 재배 농가에서 구입하였고, 증거 표본은 국립농업과학원에 보관하였다. 보통 강황은 부위에 따라 3가지 색깔을 갖고 있으며, 시료 절단시 밝은 주황, 중간 주황, 진한 주황 3가지 색으로 구분된다. 본 연구에서는 스크린을 위해 강황 전체 부위(랜덤)와 색깔별 3종을 포함한 총 4종의 시료, 재배 토양(점질토, 마사토) 및 건조 온도별(50℃, 60℃, 70℃, 80℃) 시료들을 dimethyl sulfoxide(DMSO, Sigma-Aldrich Co., St. Louis, MO, USA)에 녹여 추출물로 사용하였다. 한편, 추출 용매에 의한 영향을 비교하기 위해 일반(랜덤) 강황을 열수(10배, 30배)와 주정(30%, 50%, 70% 수준에서 시료의 10배)으로 추출하였다. 열수와 주정 추출물은 filter paper(NO. 6, ADVANTEC, Tokyo, Japan)를 이용하여 여과하고, 감압농축기(N-1000, EYELA, Tokyo, Japan)로 농축한 후 동결 건조하여 사용하였다.
2. 항산화 효과 평가
강황 추출물 시료 20 μL를 96 well plate에 넣고 증류수 80 μL를 가한 후, 40 μL의 Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하여 3분간 실온에 방치하였다. 10%의 Na2CO3 용액을 60 μL 첨가하고 실온에서 2시간 반응시킨 후 725 nm에서 흡광도를 측정하였다. 표준물질로는 gallic acid(Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 표준 곡선을 구해 정량하였다(Song BN 등 2020).
강황 추출물 시료 50 μL에 0.2 mM 2,2-diphenyl-1-picrylhydrazyl(DPPH, Sigma-Aldrich Co., St. Louis, MO, USA) 용액 200 μL를 넣고 혼합한 뒤 상온에서 30분간 반응시킨 후 517 nm에서 흡광도를 측정하였다. Sample blank는 증류수에 녹인 시료이며, control은 DPPH solution을 사용하였다. 추출물의 DPPH 라디칼 소거능 비교를 위해 대조군으로 L-ascorbic acid(Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였다(Song BN 등 2020).
7.4 mM 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS, Sigma-Aldrich Co., St. Louis, MO, USA)와 2.6 mM potassium persulfate를 1:1로 혼합하여 24시간 보관하고 라디칼을 형성시킨 다음에, 실험 직전 용액을 760 nm에서 흡광도가 0.7∼0.75가 되도록 증류수로 희석하여 사용하였다. 희석된 용액 200 μL에 추출물 50 μL를 넣고 암소에서 10분간 반응시킨 후 760 nm에서 흡광도를 측정하였다(Song BN 등 2020). Sample blank는 증류수에 녹인 시료이며, control은 ABTS solution을 사용하였다.
3. 면역 증진 효과 평가
RAW264.7 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. 세포는 10% heat inactivated fetal bovine serum(FBS, GenDEPOT, Katy, TX, USA)과 1% penicillin-streptomycin solution(HyClone, Cytiva, Utah, USA)이 포함된 Dulbecco’s modified Eagle’s media(DMEM, GenDEPOT) 배지를 사용하여 37℃, 5% CO2 incubator에서 배양하였다. 배양용 플라스크에서 RAW264.7 세포를 배양하고 약 80% 이상 밀집하면 부착된 세포를 떼어낸 후 실험에 사용하였다.
RAW264.7 세포를 2 × 105 cells/mL의 농도로 96 well plate에 100 μL씩 분주하여 37℃, 5% CO2 incubator에서 4시간 배양하였다. Phosphate buffered saline(PBS)을 이용하여 10 mg/mL 농도로 제조한 시료를 0.2 μm 필터(Syringe Filter, PVDF filter media, Whatman, Cytiva)로 여과시켰다. 세포 생존율 실험 직전에 배지로 추출물을 농도별(15.6, 31.3, 62.5, 125, 250 μg/mL)로 희석하고 세포에 추출물을 처리하였다. RAW264.7의 세포 생존율은 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS, Promega Co., Madison, WI, USA) assay 키트를 이용하여 측정하였다(Lee EJ 등 2020). 세포를 24시간 배양한 다음 MTS(Promega Co., Madison, WI, USA)를 첨가하고 2시간 배양 후에 490 nm에서 흡광도를 측정하였다. 세포 독성 정도는 배지를 처리한 세포군(대조군)과 강황 추출물 처리군의 비율로 계산하였다.
NO 생성량은 Griess assay 방법으로 측정하였다(Lee EJ 등 2020). RAW264.7 세포를 2 × 105 cells/mL의 농도로 96 well plate에 100 μL씩 분주하여 4시간 배양한 후에 강황 추출물을 농도별(15.6, 31.3, 62.5, 125, 250 μg/mL)로 100 μL 처리하고 37℃, 5% CO2 incubator에서 24시간 배양하였다. 세포를 배양한 상등액 100 μL와 Griess 시약(Sigma-Aldrich Co., St. Louis, MO, USA) 100 μL를 혼합하여 상온에서 15분 동안 반응시킨 후, 540 nm에서 흡광도를 측정하였다. Nitrite standard(Promega Co., Madison, WI, USA)로 표준 곡선을 작성하여 NO 함량을 산출하였다.
항산화 및 RAW264.7 세포를 이용한 면역 관련 평가에서 강황의 색, 재배 토양, 건조 온도 및 추출 용매에 따른 차이를 비교하였다. 그러나 비장세포의 증식능에서는 일반적으로 유통되는 강황(랜덤)을 가지고 추출 용매(열수, 주정) 및 조건(최적 열수 비율로서 시료의 30배, 시료의 10배 수준에서 30%, 50%, 70% 주정)을 달리하여 비장세포의 증식능을 비교하였다. 즉, 마우스의 비장을 적출한 후 Hank’s balanced salt solution(HBSS, Gibco, ThermoFisher Scientific, Waltham, MA, USA)으로 2회 세척하였고, 배양 접시에 10 mL의 HBSS를 추가한 후, 40 μm nylon cell strainer(BD Biosciences, San Jose, CA, USA)를 이용하여 균질화하였다. 균질화된 비장세포는 histopaque(Sigma-Aldrich Co., St. Louis, MO, USA)에 넣고 1,500 rpm에서 3분간 원심분리하여 림프구를 분리하였다. 분리된 비장세포액 2 × 105 cells/mL를 96 well plate에 100 μL씩 분주한 각 well에 50, 125, 250 μg/mL 농도의 강황 열수(30배) 및 주정(30%, 50%, 70%) 추출물을 50 μL 첨가하였다. 그리고 이들 추출물이 면역과 관련된 다양한 환경에서 세포 증식에 어떤 영향을 줄 수 있는지를 비교하였다. 즉, 단순한 세포 배양용 배지, mitogen인 concanavalin A(Con A, Sigma-Aldrich Co., St. Louis, MO, USA) 5 μg/mL와 lipopolysaccharide(LPS, Sigma-Aldrich Co., St. Louis, MO, USA) 1 μg/mL, 면역억제제인 cyclophosphamide(CPA, Sigma-Aldrich Co., St. Louis, MO, USA) 1 μg/mL를 각 well에 50 μL씩 분주하였고, 37℃, 5% CO2 incubator에서 45시간 배양하였다. 배양이 종료된 후 각 well 당 10 μL의 MTS(Promega Co., Madison, WI, USA)를 첨가하여 2시간 동안 반응시킨 후, 490 nm에서 흡광도를 측정하여 비장세포의 증식능을 평가하였다(Kim P 등 2010). 대조군(Control)은 시료 처리 없이 배지만을 비장 세포에 첨가하여 같은 시간 동안 배양하였고, 흡광도를 측정하였다.
4. 통계분석
통계는 SPSS 프로그램(version 18.0, SPSS, Chicago, IL, USA)을 이용하여 분산분석(ANOVA) 후 유의차가 있는 항목에 대하여는 Duncan’s multiple range test로 p<0.05 수준에서 시료 사이의 차이를 검정하였다.
결과 및 고찰
1. 강황 추출물의 항산화 효과
본 실험에 사용된 일반 강황(랜덤)은 한 개 내에 3가지 색을 모두 갖고 있는데, 색도를 측정한 결과, L과 a, b의 수치는 각각 76.60±3.59, 7.85±2.80, 75.53±4.66이었다. 밝은 주황의 L, a, b는 83.04±0.19, —0.72±0.53, 59.74±1.96이고, 중간 주황은 78.70±0.10, 7.07±0.50, 71.60±0.87로 나타났다. 그리고 진한 주황의 L, a, b의 수치는 74.98±2.16, 14.38±1.62, 72.72±2.10으로 나타났다(RDA, 2021). 또한 추출 용매에 의한 영향을 비교하기 위하여 일반 강황(랜덤)의 열수(10배, 30배) 및 주정(30%, 50%, 70%) 추출물에 대한 총 페놀 함량을 측정하였다. 분석 결과(Table 1), 총 페놀 함량은 시료 농도에 따라 유의적으로 증가하였다. 강황은 색깔이 짙어질수록 총 페놀 함량이 높았으며(1,861.17∼2,815.17 μg GAE/g), 마사토(1,763.83 μg GAE/g)보다 점질토(2,160.67 μg GAE/g)에서 재배된 강황에 총 페놀 함량이 많았다. 강황의 색에 의한 비교 연구는 없었지만, 시료의 색에 따른 페놀 함량을 조사한 연구에 따르면 꿀의 색도와 총 페놀 함량은 상관관계를 가지며, 짙은 색깔에서 페놀 함량이 높게 측정되는 것으로 보고되었다(Pontis JA 등 2014). 강황 추출물의 총 페놀 화합물은 색이 어두워질수록 총 페놀 함량이 증가되었으나, 건조 온도에 따른 총 페놀 농도는 크게 차이를 보이지 않았다(1,702.33∼1,997.00 μg GAE/g). 열수와 주정 추출물의 총 페놀 함량을 측정한 결과, 시료의 10배 증류수 첨가(1,734.67 μg GAE/g) 보다 30배(2,298.33 μg GAE/g) 비율로 추출한 시료에서 총 페놀 함량이 높았으며, 주정의 비율이 높아질수록 총 페놀 농도가 증가하였다(2,784.00∼5,681.50 μg GAE/g). 선행 연구에서 감귤박의 열수 추출물과 80% 주정 추출물의 총 페놀 함량에 차이가 없었고(Song YW 등 2013), 강황 잎의 열수(10배)와 주정(70%) 추출물의 총 페놀 함량은 282.92 μg/mg과 283.56 μg/mg으로 추출법에 따른 총 페놀 함량에 차이가 없었다(Choi WY & Lee HY 2014). 그러나 강황 추출물 1 mg의 경우, 열수(10배, 30배) 추출물이 1.73 mg GAE/g과 2.30 mg GAE/g이었으며, 주정(30%, 50%, 70%) 추출물이 2.78, 3.60, 5.68 mg GAE/g이었다. 본 연구에서 제조된 강황 추출물의 총 페놀 함량은 강황 잎의 열수나 주정 추출물의 총 페놀 함량보다 많게 나타났다. 강황 열수(30배) 및 주정(70%) 추출물의 총 페놀 함량은 열수(10배) 및 주정(30%, 50%) 추출물보다 약 1.3∼2배 정도 높았으며, 주정 추출물의 총 페놀 함량이 열수 추출물보다 높았다. Shin YS 등(2008)의 연구에서 참외 껍질, 과육, 태좌 주정 추출물은 열수 추출물보다 총 페놀 함량이 높았고, Kang HR 등(2020)은 보리수나무 잎의 주정 추출물에서 주정 비율이 높아짐에 따라 총 페놀 함량이 증가됨을 보고하였다.
본 연구에서 강황 추출물의 총 페놀 함량은 열수보다 주정 그리고 주정 비율을 높였을 때 유의적으로 증가하였다. 총 페놀 화합물은 증류수보다 극성이 낮은 유기용매에 용해성이 높기 때문에 에탄올이나 메탄올과 같은 유기용매가 첨가된 추출 용매가 총 페놀 화합물을 추출하는 데 효과적이라고 보고되었다(Özbek HN 등 2020). 또한, Mussatto SI 등(2011)은 감귤 껍질과 홍차, 보리, 마슈아 덩이줄기, 약초 등의 천연 자원에서 페놀 화합물을 추출하기에 알코올이 증류수보다 효율적이라고 보고하였다. 따라서 강황 추출물은 열수보다 주정 추출법, 그리고 주정 비율이 높아짐에 따라 총 페놀 함량이 증가한 것으로 판단된다.
항산화 효과를 측정하기에 가장 간단한 방법인 DPPH 라디칼 소거능은 항산화제로 인해 안정적인 라디칼이 비라디칼로 전환되면서 보라색에서 노란색으로 탈색되는 특징을 이용한 방법이다(Bollgon AA 등 2014; Gulcin I 2020). 색깔, 재배 토양, 건조 온도별 강황 추출물과 용매별 강황 추출물의 DPPH 라디칼 소거능 측정한 결과는 Table 2와 같다. 추출물 250∼1,000 μg/mL 농도에서 DPPH 라디칼 소거능은 강황의 색이 짙어짐에 따라 증가하였다. 하지만 125 μg/mL 이하 농도에서는 강황의 색깔과 상관없이 DPPH 라디칼 소거능은 비슷한 수치를 나타냈다. 재배 토양별 DPPH 라디칼 소거능을 확인한 결과, 250 μg/mL 이하 농도에서는 마사토보다 점질토에서 높은 항산화능을 나타냈지만, 500과 1,000 μg/mL 농도에서는 마사토에서 높은 항산화능을 확인하였다. 건조 온도별 강황 추출물의 경우, 500 μg/mL 이하 농도에서 50℃와 60℃, 70℃와 80℃에서 비슷한 수치의 DPPH 라디칼소거능이 나왔으며, 80℃ 건조 후 추출한 시료에서 가장 높은 라디칼 소거능이 나타났다. 열수 추출물의 경우, 10배(20.15∼48.21%)보다 30배(21.43~56.33%) 열수 추출물에서 DPPH 라디칼 소거능이 높았으며, 추출물 농도가 증가함에 따라 소거능도 유의적으로 증가하였다. 주정 추출물 또한 열수 추출물과 비슷한 경향을 나타내며, 주정 비율이 높고 추출물의 농도가 높아질수록 DPPH 라디칼 소거능이 유의적으로 증가하였다. 모든 강황 추출물의 DPPH 라디칼 소거능은 비슷하였지만, 50%와 70% 주정 추출물 250 μg/mL 농도 이상에서 53.46∼80.92%와 58.22∼82.60%의 소거능을 보이며, 다른 시료에 비해 높은 DPPH 라디칼 소거능을 나타냈다. 이전 연구에서 강황 잎 열수 추출물의 DPPH 라디칼 소거능은 74.65%, 주정 추출물은 80.11%였으며, 울금 주정 추출물의 DPPH 라디칼 소거능은 74.2%, 열수 추출물이 50%로 주정 추출물의 항산화 효능이 열수 추출물보다 더 높게 측정되었다(Kim HJ 등 2011; Choi WY & Lee HY 2014). 환삼덩굴, 참외, 감귤박도 열수보다는 주정 추출물에서 높은 DPPH 라디칼 소거능을 보였다(Shin YS, 2008; Song YW 등 2013; Chae J 등 2021). 시료에 따라 열수와 주정 추출물 사이에 유의적 차이를 보이지 않았던 결과도 있지만(Lim HJ 2021), 많은 연구에서 열수보다는 주정 그리고 주정 비율이 높아짐에 따라 DPPH 라디칼 소거능이 더 높게 측정되었다(Kang HR 등 2020).
본 연구에서도 이전 보고와 유사하게 전반적으로 열수 추출물보다 주정 추출물에서 더 높은 라디칼 소거능을 나타냈으며, 주정의 비율이 높아짐에 따라 항산화 효과는 증가하였다. 그러나 극성 페놀 화합물이 더 추출된 시료에서 높은 DPPH 라디칼 소거능이 나타나 주정보다 열수 추출물에서 DPPH 라디칼 소거능이 높게 측정되었다는 보고도 있다(Min KY 등 2014). 따라서 DPPH 라디칼 소거능은 시료에 따라 다른 경향을 보이지만, 강황의 경우 DPPH 라디칼 소거 활성과 관련하여 열수보다는 주정을 이용한 추출법이 더 유용할 것으로 판단된다.
ABTS 라디칼은 안정적이고 증류수와 유기용매에 용해성을 가지며, 친수성 및 친유성 시료의 항산화 효과를 측정할 때 사용하는 방법이다(Bollgon AA 2014; Gulcin I 2020). 강황의 색깔, 재배 토양, 건조 온도별, 열수 및 주정 추출 등 다양한 강황 추출물의 항산화 활성을 평가하기 위해 ABTS 라디칼 소거능을 측정하였으며, 그 결과는 Table 3에 나타내었다. 색이 짙어지고(10.55∼100.22%) 건조 온도가 증가함(11.53∼108.44%)에 따라 ABTS 라디칼 소거능이 증가하였다. 점질토와 마사토에서 재배한 강황의 ABTS 라디칼 소거능은 비슷한 수치를 나타냈다(13.66∼100.32%, 12.11∼98.60%). 열수 추출물의 경우, 10배에서 23.68∼100.05%, 30배에서 20.70∼98.59% ABTS 라디칼 소거능이 측정되었으며, 62.5∼500 μg/mL 농도에서 30배 열수 추출물이 10배 열수로 처리한 경우보다 높은 항산화 효과를 보였다. 용매 비율에 따라 30% 주정 추출물에서 19.82∼100.08%, 50%에서 23.21∼100.29%, 70%에서 23.55∼100.17%의 ABTS 라디칼 소거능이 나타났는데, 50% 주정 추출물에서 다른 주정 추출물보다 항산화 효과가 높게 관찰되었다. 30배 열수 추출물과 주정(30%, 50%, 70%) 추출물의 125 μg/mL 농도에서 50% 이상의 항산화 효과를 나타냈으며, 중간 주황색과 진한 주황색을 띤 강황 추출물과 재배 토양별 강황 추출물, 10배 열수 추출물의 경우, 250 μg/mL 농도에서 50% 이상의 항산화 효과를 나타냈다. 각 농도별 강황 추출물의 라디칼 소거능을 비교하였을 때, 50% 주정 추출물의 ABTS 라디칼 소거능에 의한 항산화 효과가 전반적으로 가장 높게 확인되었다. Lim HJ(2021)은 가미수미원의 열수 및 80% 주정 추출물의 항산화 효능을 비교했는데, 열수 및 주정에서 20% 전후의 수준을 보였고 유의적인 차이는 없었다. 또한 건조된 매실은 86.20∼87.48%(Seo HJ 등 2018), 아마란스는 색에 따라 67.84∼83.25%의 ABTS 라디칼 소거 활성이 보고되었다(Park SJ 등 2022). Kang HR 등(2020)은 보리수나무 잎 추출물의 ABTS 라디칼 소거능이 열수 추출물(IC50 15.38 μg/mL)보다 주정 추출물(IC50 10.87~12.95 μg/mL)에서 우수함을 확인하였다.
본 연구에서 측정된 ABTS 라디칼 소거능은 이전 보고된 결과와 유사한 경향을 나타내었는데, 밝은 색보다는 진한 색, 열수보다 주정 추출물에서 ABTS 라디칼 소거 활성이 높게 나타났다. 열수 추출물은 추출 용매 비율이 시료 대비 10배 보다 30배, 열수보다 주정 추출물에서 높은 ABTS 라디칼 소거능을 보였다. 따라서 강황 추출물은 전반적으로 열수보다 주정으로 추출한 경우에 높은 항산화 활성을 보였고, 보리수나무 잎, 매실, 가미수미원, 아마란스 추출물보다 높은 ABTS 라디칼 소거능을 갖고 있어 우수한 항산화 소재로서 기대된다.
2. 강황 추출물의 면역 증진 효과
강황 추출물(색깔, 재배 토양, 건조 온도, 용매별)의 세포 독성 여부를 확인하기 위해 RAW264.7 세포에 추출물을 농도별로 처리하고 MTS assay를 수행하였다. 강황 추출물에 대한 세포 생존율의 분석 결과(Fig. 1), 배지를 처리한 대조군의 세포 생존율은 100%였으며, LPS를 처리한 대조군의 세포 생존율은 91.87∼98.82%이었다. 그리고 250 μg/mL 미만의 농도에서 여러 종류의 강황 추출물에 대해 세포 독성은 보이지 않았고 세포 생존율이 증가하였다.
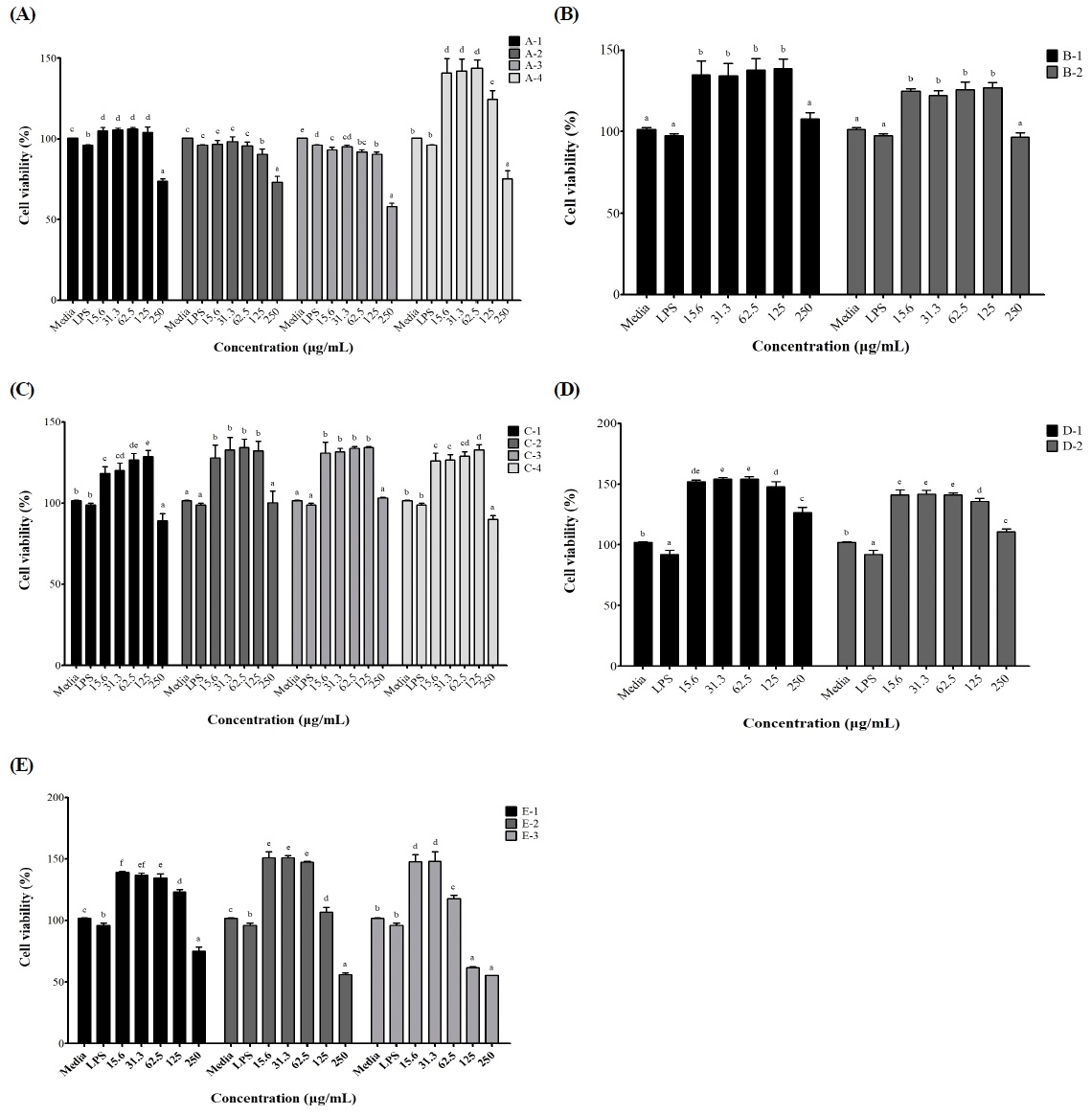
Effects of different types of C. longa extracts on the cell viability of RAW264.7.C. longa extracts were treated at the concentration of 15.63, 31.25, 62.5, 125, and 250 μg/mL. Final concentration of LPS was 1 μg/mL. A-1, random; A-2, light orange; A-3, medium orange; A-4, dark orange; B-1, Curcuma longa cultivated in clay soil; B-2, granite soil; C-1, dried at 50℃; C-2, dried at 60℃; C-3, dried at 70℃; C-4, dried at 80℃; D-1, 10-fold hot water extract; D-2, 30-fold hot water extract; E-1 30% ethanol extract; E-2, 50% ethanol extract; E-3, 70% ethanol extract. Results were expressed as the mean±S.D. Different letters on bars are significantly different among different concentrations by Duncan’s multiple range test (p<0.05).
대식세포는 탐식된 병원균을 죽이기 위해 NO를 생성하고, 생성된 NO는 병원균을 죽이는 매개체로써 중요한 역할을 한다(Jung JI 등 2019). 과다한 NO의 생성은 혈관 확장이나 염증 반응에 의한 조직 손상을 일으켜 생체 내 유해한 작용을 나타낼 수 있으나, 적당량의 NO 생성 촉진은 면역 기능을 증진시킬 수 있는 지표로 사용되고 있다(Jeong IS 등 2019). 본 연구에서 음성대조군인 무처리군의 NO 생성량은 0.91∼1.14 μM이었고, 양성대조군인 LPS 처리군은 NO 분비능이 크게 증가하였다(Fig. 2). 색깔, 재배 토양 및 건조 온도별로 처리된 강황 추출물을 첨가하였을 때, NO 생성량은 농도에 의한 차이를 보이지 않았으나, 열수 추출물 처리군에서 농도 의존적으로 NO 생성량이 증가하였다. 주정 추출물 처리군에서도 농도가 증가함에 따라 NO 생성량이 증가하였고, 30% 주정 추출물을 처리한 경우에 가장 많은 NO 생성량을 보였다. 추출물의 농도 기준으로 250 μg/mL 수준에서 NO 생성량은 10배 열수 추출물(4.34 μM), 50% 주정 추출물(2.33 μM), 30% 주정 추출물(2.07 μM), 30배 열수 추출물(2.06 μM) 순으로 나타났으며, 색깔, 재배 토양, 건조 온도에 의한 영향은 적게 나타났다. 괭생이 모자반(Kim DS 등 2018), 도라지, 더덕 및 당귀 추출물은 농도 의존적으로 NO 생성량을 증가시켰고(Jeong IS 등 2019), 오갈피는 열수 추출물이 주정 추출물보다 높은 NO 생성능을 보였다(Choi JH 등 2020). 이는 본 연구에서 강황의 열수 추출물이 주정 추출물보다 많은 NO 생성량을 보인 것과 유사한 결과였다. 이와 같이 NO 생성 촉진은 면역 활성 증진에 기여하는 것으로 보고되고 있어, 강황 추출물은 NO 생성 촉진을 통해 면역력 증진에 도움을 줄 수 있을 것으로 기대된다.
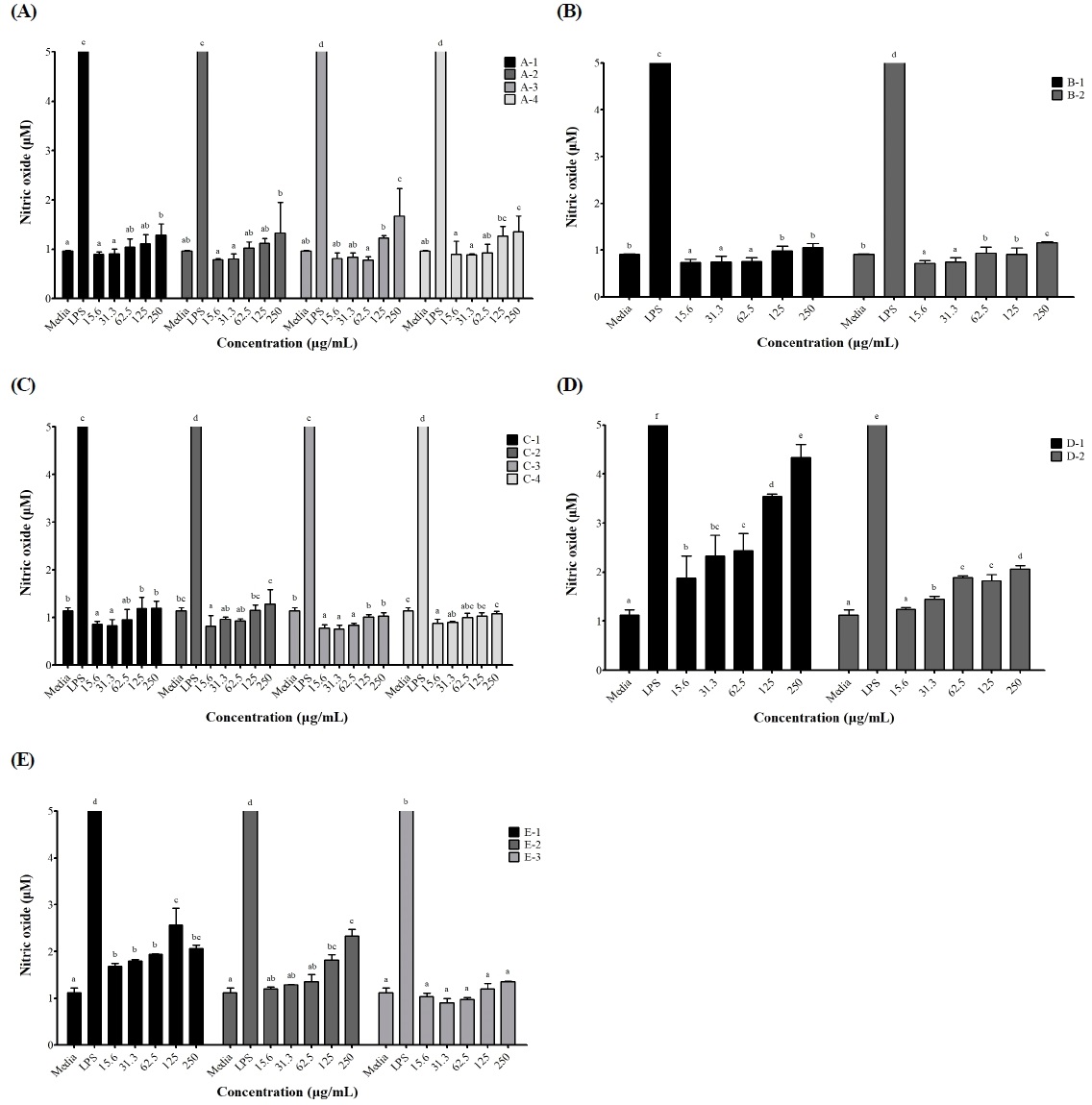
Effects of different types of C. longa extracts on the production of nitric oxide in RAW264.7.C. longa extracts were treated at the concentration of 15.63, 31.25, 62.5, 125, and 250 μg/mL. Final concentration of LPS was 1 μg/mL. A-1, random; A-2, light orange; A-3, medium orange; A-4, dark orange; B-1, Curcuma longa cultivated in clay soil; B-2, granite soil; C-1, dried at 50℃; C-2, dried at 60℃; C-3, dried at 70℃; C-4, dried at 80℃; D-1, 10-fold hot water extract; D-2, 30-fold hot water extract; E-1 30% ethanol extract; E-2, 50% ethanol extract; E-3, 70% ethanol extract. Results were expressed as the mean±S.D. Different letters on bars are significantly different among different concentrations by Duncan’s multiple range test (p<0.05).
강황의 항산화와 RAW264.7 세포에 의한 면역 조절 활성은 강황의 색깔, 재배 토양, 시료의 건조 온도에 의한 영향보다 추출 용매의 조건에 따라 많은 차이를 보였다. 그리고 강황의 유통 현황과 가공환경 및 경제성 등을 고려할 때 일반(랜덤) 형태에서 기능성을 평가하는 것이 바람직하다고 생각되었다. 따라서 비장세포의 증식 평가에서는 일반(랜덤) 강황의 시료 대비 최적 비율인 30배의 열수, 30∼70%의 주정으로 추출하여 사용하였다. 비장은 B 및 T 림프구의 성숙과 항원의 자극에 의한 림프구의 분화가 이루어지는 림프기관으로 비장세포는 면역반응과 밀접한 관련을 나타낸다. 비장 세포의 크기나 수는 면역지표로 사용되며, 비장의 무게 증가는 면역반응 및 특이적 면역반응의 증가에 중요한 지표로 인식되고 있다(Sohn EH 등 2012; Choi JH 등 2019; Kim DS 등 2019). Mitogen은 특정 면역세포를 자극하여 면역세포의 활성을 촉진시켜주는 물질이며, 대표적으로 Con A와 LPS가 있다. Con A는 T 세포를 자극하여 세포 증식을 유도하고 LPS는 B 세포를 자극하여 세포활성을 유도시킨다(Kim DS 등 2019). CPA는 면역활성 억제와 산화 스트레스를 유도하는 DNA 알킬화 화합물로 알려져 있으며, CPA 반응성 대사 산물은 NK세포, T 및 B 세포에서 면역 억제 반응을 유발시킨다(Lee EB 등 2020). 본 연구에서 재배 토양과 건조 온도별 일반 강황(랜덤)의 총 페놀 함량과 라디칼 소거능, 세포 생존율, NO 함량에서는 유사한 수치를 나타냈으나, 30배 열수 및 주정 추출법에 의해 얻은 시료의 라디칼 소거능과 NO 생성량은 다른 시료에 비해 높게 나타났다. 이에 강황 열수(30배) 및 주정(30%, 50%, 70%) 추출물을 선택하여 비장세포 증식능을 측정하였다. 본 연구에서 대조군은 균질화된 비장세포에 배지만을 처리한 후 배양하여 흡광도(O.D.)를 측정하였는데, 배지, Con A, LPS, CPA를 각각 처리한 후 강황 추출물을 농도별로 처리하였을 때, 전반적으로 비장세포 증식능을 증가시켰다(Fig. 3). 특히, 추출 용매로 사용된 주정 비율이 높을수록 그리고 추출물의 농도 의존적으로 비장세포 증식이 활성화되었다. 비장세포 증식능은 기능성 소재의 추출 용매 및 mitogen에 의해 영향을 받는다고 하였는데(Hwang YK 등 2008; Kim P 등 2010; Ryu HS 2015; Kim DS 등 2019), 본 연구에서도 강황 추출물은 농도 의존적인 영향을 준 것으로 예상된다. 따라서, 강황의 열수 및 주정 추출물은 세포 증식 및 활성을 통해 면역반응을 증진시킬 수 있고, 앞으로 자세한 기전 연구가 필요한 것으로 보인다.
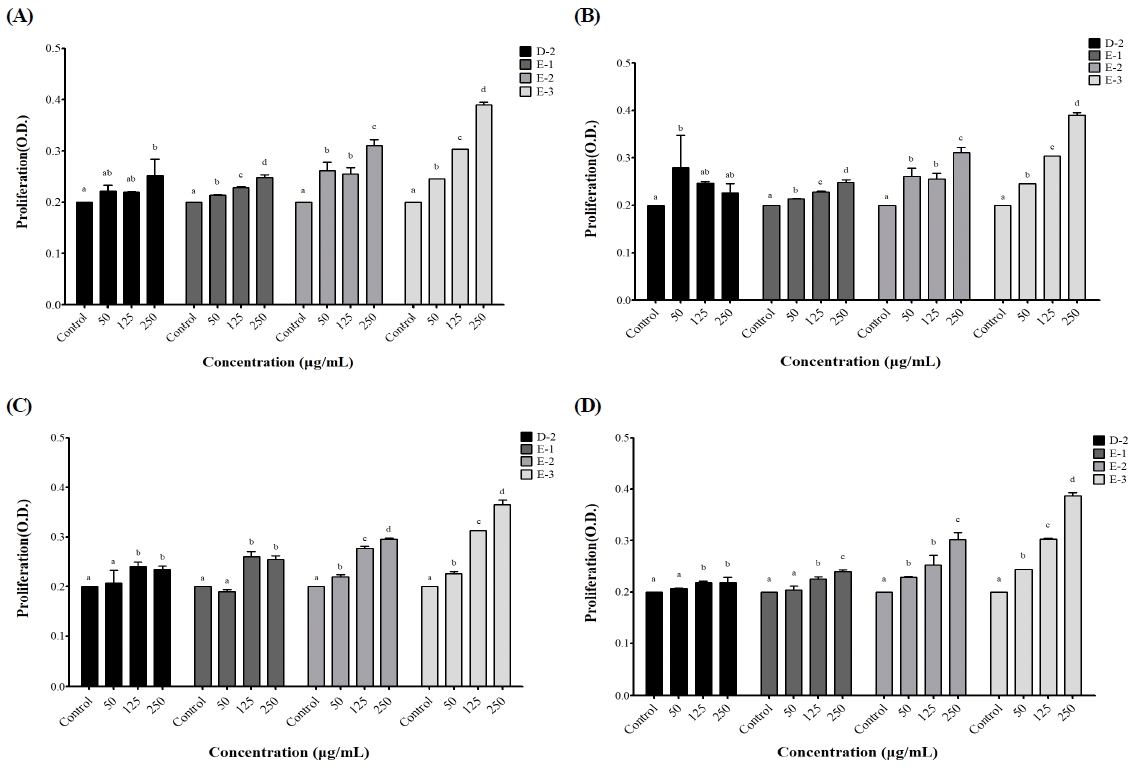
Effects of C. longa extracts on the proliferation of mouse splenocytes in vitro.(A) Stimulated with media, (B) stimulated with Con A, (C) stimulated with LPS, (D) stimulated with CPA. Control, cultured with media without C. longa extracts. D-2, 30-fold hot water extract; E-1 30% ethanol extract; E-2, 50% ethanol extract; E-3, 70% ethanol extract. Results were expressed as the mean±S.D. Different letters on bars are significantly different among different concentrations by Duncan’s multiple range test (p<0.05).
요약 및 결론
본 연구는 강황의 색깔, 재배 토양, 건조 온도 및 용매 조건별 추출물의 항산화 및 면역 증진 효과를 비교하기 위해 수행되었다. 주요 항산화 요인으로 총 페놀 함량, DPPH와 ABTS 라디칼 소거능을 평가하였고, 면역 관련 요인으로 대식세포의 안전성과 NO 생성능 및 비장세포의 증식능을 분석하였다. 그 결과, 강황은 색이 진할수록 그리고 열수보다 주정에서 총 페놀 함량이 많았고, 추출물의 함량이 증가함에 따라 유의적으로 DPPH 및 ABTS 라디칼 소거능이 증가하였다. 강황 추출물은 대체적으로 250 μg/mL 미만에서 RAW246.7 세포에 대해 독성을 나타내지 않았으며, 추출물 농도가 증가함에 따라 NO 생성이 촉진되었다. 또한 비장세포 증식능은 열수보다는 주정 그리고 주정의 비율이 높은 조건에서 생산된 추출물에서 높게 나타났다. 따라서, 국내 진도군에서 생산된 강황의 주정 추출물은 안전하고 항산화 및 면역 증진 효과가 우수한 것으로 나타났으며 기능성 식품 재료로서 활용 가능성이 높은 것으로 판단된다. 또한 앞으로 강황의 활성 물질에 대한 분석과 기전 구명 및 수입산과의 비교 연구를 통해, 국제 경쟁력을 갖춘 항산화 및 면역 증진 효과가 우수한 고부가가치의 식의약 소재로 활용될 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ01583902) 지원에 의해 수행되었다.
References
-
Bollgon AA, Machado MM, Athayde ML (2014) Technical evaluation of antioxidant activity. Med Chem 4(7): 517-522.
[https://doi.org/10.4172/2161-0444.1000188]

- Chae J, Jo H, Yeom H, Lee JY (2021) Antioxidation and functional cosmetics activity of Humulus japonicus Sieboid & Zucc. according to collection time and extraction solvent. J Korean Soc For Sci 110(2): 254-265.
-
Chae YB, Chung KT, Kim SG, Yoo BH, Kim MM (2012) Effect of Curcuma longa hot water extract on activity of neuronal cells related to oxidative stress. J Life Sci 22(5): 657-664.
[https://doi.org/10.5352/JLS.2012.22.5.657]

- Choi JH, Lee EB, Park YG, Lee HK, Jang HH, Choe J, Hwang KA, Park SY, Hwang IG, Hong HC, Lee HJ, Jeong HC, Kim HJ, Lee SH (2019) Aged doraji (Platycodon grandiflorum) ameliorates cyclophosphamide-induced immunosuppression in mice. Kore J Pharmacogen 50(3): 219-225.
-
Choi JH, Kim NY, Kim SY, Park HR, Yu KW, Lee HS (2020) Immunoregulatory effects of deer antler mixture extract. J Korean Soc Food Sci Nutr 49(1): 19-27.
[https://doi.org/10.3746/jkfn.2020.49.1.19]

-
Choi WY, Lee HY (2014) Enhancement of antioxidant activities of Curcuma longa leaves by ultra high pressure extraction. Korean J Medicinal Crop Sci 22(2): 121-126.
[https://doi.org/10.7783/KJMCS.2014.22.2.121]

-
Gulcin I (2020) Antioxidants and antioxidant methods: An updated overview. Arch Toxicol 94(3): 651-715.
[https://doi.org/10.1007/s00204-020-02689-3]

- Ha HY (2020) Effects of vitamin-C and Curcuma longa ethanol extract (CLEE) on the human skin moisturizing. J Invest Cosmetol 16(2): 113-118.
-
Heo SI, Jung SM (2021) Immunity enhancement efficacy of the extracts prepared from blanched and dried aerial part in Cirsium setdens Nakai. Korean J Food Preserv 28(5): 685-691.
[https://doi.org/10.11002/kjfp.2021.28.5.685]

- Hwang YK, Yang M, Pyo MY (2008) Effects of heated pear juice on the proliferation and cytokines production of mouse splenocytes in vitro. Cancer Prev Res 13(1): 68-73.
-
Jeong IS, Kim EH, Park SM, Chung MJ (2019) Immunostimulatory effect of sweet potato peel-based plant mixture on RAW264.7 macrophages. Korean J Food Preserv 26(7): 828-836.
[https://doi.org/10.11002/kjfp.2019.26.7.828]

-
Jung JI, Kim JM, Kim HS, Kim HS, Kim EJ (2019) Immunostimulatory effect of wild-cultivated ginseng extract via the increase in phagocytosis and cytokine secretions in RAW264.7 macrophages. J Korean Soc Food Sci Nutr 48(6): 686-691.
[https://doi.org/10.3746/jkfn.2019.48.6.686]

-
Kang HR, Jung JK, Park SH, Lee JY, Yang SA (2020) Anti-oxidant, anti-inflammatory, and anti-bacterial effects of extracts from Elaeagnus umbellata leaves obtained using different extract conditions. Korean J Food Preserv 27(3): 374-384.
[https://doi.org/10.11002/kjfp.2020.27.3.374]

-
Kim DS, Sung NY, Park SY, Kim G, Eom J, Yoo JG, Seo IR, Han IJ, Cho YB, Kim KA (2018) Immunomodulating activity of Sargassum horneri extracts in RAW264.7 macrophages. J Nutr Health 51(6): 507-514.
[https://doi.org/10.4163/jnh.2018.51.6.507]

-
Kim DS, Sung NY, Han IJ, Lee BS, Park SY, Nho EY (2019) Splenocyte-mediated immune enhancing activity of Sargassum horneri extracts. J Nutr Health 52(6): 515-528.
[https://doi.org/10.4163/jnh.2019.52.6.515]

-
Kim HJ, Lee JW, Kim YD (2011) Antimicrobial activity and antioxidant effect of Curcuma longa, Curcuma aromatica and Curcuma zedoaria. Korean J Food Preserv 18(2): 219-225.
[https://doi.org/10.11002/kjfp.2011.18.2.219]

- Kim P, Ko SK, Pyo MY (2010) Effects of hot water extract of chaga mushroom on the proliferation and cytokines production of mouse splenocytes in vitro. Yakhak Hoeji 54(3): 187-191.
- Lee EB, Choi JH, Jang HH, Hong HC, Lee HJ, Jeong HC, Lee SJ, Lee SH (2020) Effects of aged Platycodon grandiflorum on cyclophosphamide-induced immunosuppression in mice. Kor J Pharmacogn 51(4): 340-348.
-
Lee EJ, Lee DB, Song BN, Park BR, Lee SH, Choi JH, Park SY (2020) Physicochemical properties and anti-inflammatory effects of Astragalus membranaceus (Fisch.) Bunge fermented by Aspergillus awamori. Korean J Medicinal Crop Sci 28(5): 347-353.
[https://doi.org/10.7783/KJMCS.2020.28.5.347]

- Lim HJ (2021) Comparative study of the antioxidant activity effects of gami-sumiwon extract using water and 80% ethanol. J Korean Appl Sci Technol 38(5): 1302-1313.
-
Min KY, Lee KA, Kim HJ, Kim KT, Chung MS, Chang PS, Park H, Paik HD (2014) Antioxidative and anti-inflammatory activities of Citrus unshiu peel extracts using a combined process of subcritical water extraction and acid hydrolysis. Food Sci Biotechnol 23(5): 1441-1446.
[https://doi.org/10.1007/s10068-014-0197-y]

-
Mussatto SI, Ballesteros LF, Martins S, Teixeira JA (2011) Extraction of antioxidant phenolic compounds from spent coffee grounds. Sep Purif Tehcnol 83(15): 173-179.
[https://doi.org/10.1016/j.seppur.2011.09.036]

-
Özbek HN, Halahlih F, Göğüş F, Yanık DK, Azaizeh H (2020) Pistachio (Pistacia vera L.) hull as a potential source of phenolic compounds: Evaluation of ethanol-water binary solvent extraction on antioxidant activity and phenolic content of pistachio hull extracts. Waste Biomass Valori 11(5): 2101-2110.
[https://doi.org/10.1007/s12649-018-0512-6]

-
Park SJ, Yang Y, Hwang EH (2022) Antioxidative activities of ethanol extract from amaranth seeds. J Korean Soc Food Sci Nutr 51(2): 134-140.
[https://doi.org/10.3746/jkfn.2022.51.2.134]

-
Pontis JA, Costa LAMA, Silva SJR, Flach A (2014) Color, phenolic and flavonoid content, and antioxidant activity of honey from Roraima, Brazil. Food Sci Technol 34(1): 69-73.
[https://doi.org/10.1590/S0101-20612014005000015]

-
Ra HN, Kim HY (2016) Antioxidant and antimicrobial activities of Curcuma aromatica Salisb. with and without fermentation. Korean J Food Cook Sci 32(3): 299-306.
[https://doi.org/10.9724/kfcs.2016.32.3.299]

- RDA (Rural Development Administration) (2021) Evaluation of the Functional Characteristics of Turmeric and Research on the development of utilization technologies. Korea. p 5.
-
Ryu HS (2015) Enhancing effect of Acanthopanax senticosus extracts on mouse spleen and macrophage cells activation. Korean J Food Nutr 28(2): 253-257.
[https://doi.org/10.9799/ksfan.2015.28.2.253]

-
Seo HJ, Yim SH, Song JH (2018) Antioxidant activity of major cultivars Prunus mume in Korea. Korean J Org Agric 26(3): 477-488.
[https://doi.org/10.11625/KJOA.2018.26.3.477]

- Shin YS, Lee JE, Yeon IK, Do HW, Cheung JD, Kang CK, Choi SY, Youn SJ, Cho JG, Kwoen DJ (2008) Antioxidant and antimicrobial effects of extract with water and ethanol of oriental melon (Cucumis melo L. var. makuwa Makino). J Korean Soc Appl Biol Chem 51(3): 194-199.
-
Sohn EH, Yoon JW, Koo HJ, Park DW, Jeong YJ, Namkoong S, Han HS, Kang SC (2012) Immunomodulating effects of red ginseng on the regulation of cytokine release in vivo. Korean J Plant Res 25(5): 578-585.
[https://doi.org/10.7732/kjpr.2012.25.5.578]

-
Song BN, Lee DB, Lee SH, Park BR, Choi JH, Kim YS, Park SY (2020) Physicochemical properties and antioxidant activity of extract from Astragalus membranaceus Bunge leaf fermented with lactic acid bacteria. Korean J Medicinal Crop Sci 28(6): 428-434.
[https://doi.org/10.7783/KJMCS.2020.28.6.428]

-
Song YW, Moon KS, Cho SK (2013) Antioxidant activity and nutrient content of ethanol and hot-water extracts of Citrus unshiu pomace. J Korean Soc Food Sci Nutr 42(9): 1345-1350.
[https://doi.org/10.3746/jkfn.2013.42.9.1345]

- Sung KC (2011) A study on the pharmaceutical & chemical characteristics and analysis of natural curcumin extract. J Korean Oil Chesitsts’ Soc 28(4): 393-401.
-
Youn SJ, Han G, Lee GY, Na DH, Lee H (2020) Determination of optimum culture conditions and screening of bacterial isolates from kimchi for fermentation of turmeric (Curcuma longa L.). Food Eng Prog 24(4): 383-388.
[https://doi.org/10.13050/foodengprog.2020.24.4.383]