
Cyclophosphamide에 의해 유도된 면역저해 마우스에서 도라지 추출물의 면역기능 조절 효과
Correspondence to: †Sung Hyen Lee, Tel: +82-63-238-3681, Fax: +82-63-238-3843, E-mail: lshin@korea.kr
Abstract
The root of Platycodon grandiflorum (PG) has been used as a food and a traditional oriental medicine to treat diseases such as asthma, bronchitis and pulmonary tuberculosis. However, not much research has been conducted on its effects to stimulate immune system in an immuno-suppressed model. This study was performed to examine the immunomodulative effects of PG in immuno-suppressed mice and this immune-suppression was induced by cyclophosphamide. The immunostimulating effects of ethanol PG extract in this in vivo model were examined by measuring the body and immune related organ weights, the serum immunoglobulin and cytokine levels, the splenocytes proliferation rate and the NK cell activity. After the experiment, there was no significant difference in the body, thymus and spleen weights of all the groups. The serum IgA and IgM values increased in the PG-treated groups. However, the significant difference from the control was shown only in the PG-2A group. The serum Th1 type cytokines (IL-1β, IL-12, IFN-γ) levels increased in the PG groups, and the PG-2A group showed significantly higher serum Th1 type cytokines values than those of the control group. The Th2 cytokines (IL-6, TNF-α) decreased in the PG groups and a significant difference of the serum Th2 type cytokines values was found in the PG-A group. Splenic T cell proliferation increased in the PG groups, but there was no significant difference as compared to that of the experimental groups. Splenic NK cell activity significantly increased in the PG groups. Thus, the PG extract can increase the serum immunoglobulin level, the Th1 cytokine levels and the NK cell activity, and can normalize the Th2 cytokines levels. The results suggest that PG has a great potential as a healthy food by itself or as a supplement.
Keywords:
Platycodon grandiflorum, immunoglobin, splenocytes proliferation, cytokine, NK cell activity서 론
도라지(桔梗, Platycodon grandiflorum)는 초롱꽃과(Campanulaceae)에 속하는 여러해살이풀로서, 한국을 비롯한 중국, 일본 등지에 자생한다. 도라지는 식용 및 약용으로 이용되고 있으며(Sung NJ 등 1996), 우리가 흔히 말하는 도라지는 길경(Platycodi radix)이라 불리는 도라지의 뿌리 부분을 말한다. 도라지는 영양학적으로 섬유질, 칼슘 및 철이 많이 함유되어 있어 생채, 나물 및 무침 등의 음식에 이용되고(Chung JH 등 1997; Shon MY 등 2001), 한방에서 거담, 배농, 기관지염 그리고 천식 등의 기관지계 질환에 효과가 있는 것으로 알려져 있다(Hong MW 1974).
도라지의 약리학적 활성은 도라지에 함유된 유효성분에 기인하는 것으로, platycodin A, C, D 및 polygalacin D 등과 같은 사포닌이 다량 함유되어 있다(Tada T 등 1975; Konishi T 등 1976). 특히, platycodin D는 항염(Kim SY 등 2012), 비만 및 당뇨 예방(Kwon OJ 등 2013) 외에 항암 효과가 있는 것(Choung MG 등 2011; Park SE 등 2013)으로 밝혀져 있다.
최근 현대인들은 사회적 이슈인 미세먼지와 같은 환경오염이나 스트레스 등 다양한 원인에 의해 발생하는 면역기능 저하에 대응하기 위하여 면역 증강 효과가 있는 식ㆍ의약품에 관심이 많다(Lee HJ 등 2018). 국내 소비자 실태조사 통계에 따르면 건강기능식품 구매 시 ‘면역력 증진’을 고려하는 비율이 46.9%로 높은 비율을 차지하는 것으로 나타났으며(Huh SH 2014), 소비자들의 수요에 맞추어 면역 증진 소재 개발연구도 활발히 진행 중이다.
면역은 인체가 항원에 대하여 스스로를 방어하는 보호기작으로서 선천성 면역반응과 후천성 면역반응으로 구분된다. 다양한 면역원을 통한 경험을 바탕으로 얻어진 후천적 면역반응은 특이 항원을 인식하여 면역반응이 일어나게 되며, T 세포나 B 세포가 관여한다(Yu AR 등 2012). 후천성 면역 반응은 병원체 등 항원의 노출에 의해 획득한 면역으로서 특이성, 다양성, 기억, 자기/비자기의 인식이라는 네 가지의 특징을 가지고 있다(Hyun SH 등 2018). 항암제나 면역억제제로 사용되는 cyclophosphamide(CPA)는 알킬화제로서 장기 이식이나 골수 이식 시 나타나는 거부반응의 억제제 및 악성종양의 치료목적으로 사용된다. 그러나 CPA의 비선택적 독성으로 인하여 정상세포에도 독성이 나타나게 되어 빈혈, 탈모증, 혈소판 감소 등의 부작용(Balmer C 등 1992)을 유발하고, 장기적인 사용 시 문제가 잇따라 제기되어 왔다. 따라서 독성을 가진 면역억제제의 부작용 및 독성을 억제시킬 수 있는 물질 개발의 중요성이 대두되었고, 생리활성물질 탐색 연구가 활발히 진행되고 있다(Lee YS 등 2007).
홍삼, 더덕, 잔대 등의 뿌리채소는 면역 세포의 증식 및 면역 증강에 효과가 있는 것으로 알려져 있고(Ryu HS 등 2009; Hyun SH 등 2018; Kim EH 등 2018), 도라지 생산농가가 증가함에 따라 도라지로부터 면역증진 효과를 확인하려는 연구들이 시도되고 있다. Ryu HS(2014)는 도라지 물 추출물을 마우스에게 경구 투여하였을 때, 500 mg/kg 체중 수준에서 비장세포의 증식과 복강 대식세포의 활성화를 유도하여 면역기능이 증진된다고 보고하였다. 그러나 면역이 저하된 상태에서 도라지 추출물이 면역에 미치는 영향이나 기전 및 효능이 보고된 바가 없으므로 이에 대한 연구가 필요한 실정이다.
최근, 재배 기간이 약 3년인 재래종 일반 도라지보다 성장이 빨라 1∼2년 내에 재배가 가능하며, 생산력이 40% 증가(Joe SY 2012)된 으뜸도라지(tetraploid ‘Etteum’ variety in Platycodon grandiflorum)에 대한 관심이 높아지고 있다(Kang DK 등 2017). 으뜸도라지는 재래종(domestic diploid variety in Platycodon grandiflorum)에 콜히친 처리하여 4배체 육성하고, 재래종 도라지의 2배인 36개 염색채 수를 가지고 있는 2007년에 등록을 마친 품종이다. Kang DK 등(2017)은 으뜸 도라지가 일반도라지보다 조단백, 조사포닌 및 총 페놀 함량이 높고, DPPH 라디칼 소거능, SOD 유사활성 등의 항산화능이 우수하여 건강기능식품 소재로서 활용가치가 높다고 보고한 바 있다.
우수한 품종으로 개발된 으뜸도라지가 다양한 생리 활성을 나타낼 것으로 생각되고 있으나, 연구결과가 많지 않아 다양한 효능에 대한 연구가 필요한 실정이다. 따라서 본 연구에서는 특히 최근 문제가 되고 있는 면역저하 증상을 고려하여 마우스에 면역저하를 유도하고, 으뜸 도라지의 추출물이 면역 기능에 미치는 영향을 확인하였다.
재료 및 방법
1. 도라지 추출물의 제조
본 연구에 사용한 도라지(Platycodon grandiflorum)는 충북 영동에서 구입하였고, 증거 표본(RDAPG01)은 국립농업과학원 농식품자원부에 보관하였다. 도라지는 세척 후 열풍건조(60℃ 이하, 48시간)하고, 분쇄(FM909T, Hanil, Wonju, Korea)한 후에 30 mesh 체에 통과된 것을 사용하였다. 다음에는 도라지 분말을 70% 주정으로 실온에서 24시간 2회 추출하였으며, 여과 후 농축 및 동결건조(PVTFD 10R, Ilsin Lab, Yangju, Korea)한 것을 시료로 사용하였다.
2. 실험동물의 사육 및 실험식이
본 시험에는 Specific-pathogen free(SPF) 상태의 C57BL/6 mouse(6주령, 수컷) 24마리를 ㈜중앙실험동물(Seoul, Korea)로부터 구입하여 사용하였다. 사육기간 중의 식이는 일반 고형사료와 물을 자유섭취 시켰으며, 온도 23±2℃, 습도 50±10%, 12시간 단위로 명암주기를 조절하였다. 마우스는 1주 동안 실험환경에 적응시킨 후, CPA를 1일에 150 mg/kg, 3일에 100 mg/kg을 복강 투여하여 면역저하 모델을 만들었다. 마지막 투여가 끝난 24시간 후에 실험동물의 체중을 측정하였고 난괴법(randomized complete block design)에 따라 대조군(Control)과 도라지 추출물의 수준에 따른 PG-A(75 mg/kg)와 PG-2A(150 mg/kg)의 2개 실험군(n=8/군)으로 구성하였다. 대조군은 추출물을 용해한 용매(PBS)만을, 용해된 추출물은 PG-A와 PG-2A군에 10일간 경구 투여(1회/일)하였다. 본 연구에 사용된 동물실험에 관련된 모든 실험은 농촌진흥청 국립농업과학원 동물실험윤리위원회의 승인(NAS-201807) 절차와 윤리 규정을 준수하여 수행되었다.
3. 혈액 및 면역장기의 채취
10일의 시험물질 경구 투여 후에 마우스의 체중을 측정하였고, CO2로 마취 후에 심장에서 혈액을 채혈하였다. 채혈된 혈액은 원심 분리용 시험관에 담아 2,000 rpm, 4℃에서 15분간 원심 분리하여 혈청을 얻었으며, 면역글로불린 및 면역 관련 사이토카인의 분석에 이용하였다. 혈액이 채집된 마우스는 CO2를 사용하여 최종 안락사 후 비장과 흉선을 적출하여 그 무게를 측정하였다. 장기의 무게는 실험동물 체중의 차이에 따른 변이를 없애고, 이를 표준화하기 위하여 체중에 대한 상대 장기중량(% of body weight)으로 제시하였다.
4. 혈청 면역글로블린 및 사이토카인의 함량 측정
도라지의 혈중 면역 관련 지표에 미치는 영향을 평가하기 위해 면역글로블린(IgA, IgM, IgG)과 사이토카인(IL-1β, IL-6, IL-12, IFN-γ, TNF-α) 함량을 측정하였다. 분석에는 ELISA kit(Abcam, London, UK)를 이용하였고, Microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하였다.
5. 비장세포의 증식능 측정
실험동물에서 비장을 적출하여 배양액(RPMI 1640, 10% FBS, 100 U/mL penicillin, 100 mg/mL streptomycin)으로 2회 세척하고, 세포 배양접시에서 10 mL의 배양액을 가한 뒤, 40 μm nylon cell strainer(BD Biosciences, San Jose, CA, USA)로 분리하여 사용하였다. 이렇게 얻어진 비장세포를 Histopaque(Sigma, USA) 위에서 처리 및 세척하고, 면역 세포 증식 및 자연 살해 세포(NK cell; natural killer cell)의 활성 측정에 사용하였다. 세포 증식능 평가는 세포를 배양액에 3.0×106 cells/mL로 분산시킨 후 96-well plate(Nunc, Rosklide, Denmark)에 100 μL씩 분주하여 사용하였다. Con A(SigmaAldrich Co, USA)와 LPS(Sigma-Aldrich Co, USA)는 최종 농도가 각각 5 μg/mL와 1 μg/mL이 되도록 첨가하였고, 대조군에는 배양액을 동량 분주하였으며, 37℃, 5% CO2 조건의 incubator에서 배양하였다. 46시간 배양이 끝난 후, 각 well 당 10 μL의 MTS(Promega Corporation, Madison, WI, USA)를 이용하여 2시간 동안 반응시켰고, microplate reader(Molecular Devices, Sunnyvale, CA, USA)를 이용, 490 nm에서 흡광도(OD)를 측정한 결과를 가지고 비장세포의 증식능을 비교하였다.
6. 복강 NK 세포의 분리
마우스 복강 내에 4% FBS-RPMI 1640(Difco, USA)를 5 mL 주사하여 NK 세포가 모이도록 5분간 마사지한 뒤, 복강 내부에서 세포를 수집하였다. 4℃, 3,000 rpm에서 10분간 원심분리한 후 세포를 10% FBS-RPMI 1640으로 1×106 cells/mL가 되도록 희석하여 사용하였다.
7. NK 세포의 활성 측정
비장 및 복막에서 채취한 NK 세포를 96-well plate에 각각 well당 1×106 cells/mL와 1×105 cells/mL씩 분주하였다. 표적 세포는 Yac-1 세포로 1×104 cells/well이 되도록 처리하고(effector-to-target 세포비가 100:1, 10:1), 37℃, 5% CO2에서 24시간 동안 배양하였다. 배양 후 MTS Assay kit(Promega Corporation, Madison, WI, USA)를 이용하여 Microplate reader(Molecular Devices, Sunnyvale, CA, USA)로 490 nm에서 흡광도를 측정하였다.
8. 통계처리
모든 데이터는 Mean±S.E.로 나타내었고 통계처리는 SPSS 프로그램(Statistical Package for the Science ver. 24, IBM Corp, Armonk, NY, USA)을 이용하여 One-way ANOVA(one-way analysis of variance)를 실시한 후, p<0.05 수준에서 유의성을 표시하였다.
결과 및 고찰
1. 도라지 추출물이 체중과 장기무게에 미치는 영향
CPA 투여는 면역억제를 유발하는 것으로 알려져 있으며, 본 실험에서는 CPA 투여에 의한 면역저하 환경에서 도라지 추출물이 마우스의 면역 활성에 미치는 영향을 확인하였다. 보고(Koo SW 등 2015) 된 바와 같이 CPA 투여로 마우스의 체중이 약 10% 감소하였고, 실험을 진행하면서 PBS 혹은 도라지 추출물을 경구 투여하면서 상태를 관찰하였다. 실험기간 동안 실험동물의 식이 및 음용수 섭취량과 행동유형은 모든 실험군과 대조군 사이에 차이를 보이지 않아 도라지는 사용된 수준(75, 150 mg/kg 체중)에서 면역저하 동물모델의 안전성에 문제가 없는 것으로 나타났다.
도라지 추출물이 마우스의 체중 및 면역 관련 장기인 비장과 흉선 무게에 미치는 영향을 살펴보았다. 체중을 자료로 제시하지는 않았으나 대조군 25 g, 도라지 추출물 섭취군에서 약 24 g으로 유의한 차이가 없었고, 사용된 도라지 추출물의 급여 수준에 의한 영향도 없는 것으로 나타났다. 또한, CPA 투여는 비장과 흉선의 무게를 감소시키는 것으로 보고되었는데(Joyce RA 등 1979; Miyauchi 등 1990; Kim EH 등 2018), 본 연구에서 도라지 추출물을 투여한 결과, 비장의 무게가 대조군(700 mg)과 PG-A군은 700 mg 그리고 PG-2A군 840 mg으로 유의한 차이는 없었고, 흉선의 무게도 대조군(95 mg), PG-A(98 mg) 그리고 PG-2A(109 mg) 사이에 유의적인 차이를 보이지 않았다. 그러나 PG-2A군에서 비장 무게가 대조군 대비 약 20% 증가한 것으로 나타나 도라지 추출물의 급여 수준에 따른 연구가 수행되어야 할 것으로 보인다(Fig. 1).
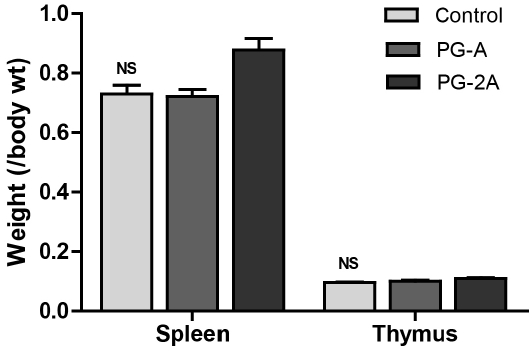
Effects of PG extract on spleen and thymus weights of C57BL/6 mice immunosuppressed by CPAAll data are shown as mean±SEM (n=8). Statistical analyses were performed by Duncan’s multiple range test after one-way ANOVA using SPSS software. Differences were considered statistically significant at p<0.05.
2. 혈청 면역글로불린 및 사이토카인 수준
도라지 추출물의 급여가 마우스의 면역 활성에 미치는 영향을 확인하기 위해, 혈중 면역 관련 지표인 면역글로불린과 사이토카인의 수준을 분석하였다. IgG는 대조군(325 μg/mL)과 두 수준의 도라지 추출물 섭취군(326 μg/mL, 323 μg/mL) 사이에 유의한 차이를 보이지 않았으나, IgA 수준은 농도 의존적으로 대조군보다 PG-A군 16 μg/mL(2.5%)와 PG-2A군은 108 μg/mL(16.4%)가 증가하였고, IgM 수준도 도라지 추출물 섭취군에서 대조군보다 140 μg/mL(PG-A, 3.5%)와 202 μg/mL(PG-2A, 5%)가 증가하여 농도 의존적으로 높게 나타났다(Fig. 2). 따라서 도라지는 혈중 면역 관련 지표인 면역글로불린 수준에 영향을 줄 수 있는 것으로 보인다.
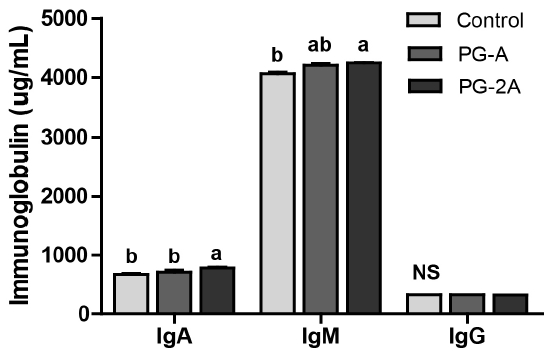
Effects of PG extract on serum immunoglobulin levels of C57BL/6 mice immunosuppressed by CPAAll data are shown as mean±SEM (n=8). Statistical analyses were performed by Duncan’s multiple range test after one-way ANOVA using SPSS software. Differences were considered statistically significant at p<0.05.
CPA는 T 림프구의 수를 감소시켜 면역세포로부터 분비되는 단백질로서 표적 세포에 신호를 전달하고, 면역반응 조절에 중요한 역할을 담당하는 사이토카인의 분비를 억제시킨다(Miyauchi A 등 1990; Xun CQ 등 1994; Kim HS 등 2014). 본 연구에서 도라지 추출물의 급여가 면역 저해된 마우스의 사이토카인 수준에 영향을 줄 수 있는지 분석한 결과, 도라지 추출물은 세포성 면역력을 증진시키는 Th1 사이토카인 및 체액성 면역력에 영향을 미치는 Th2 사이토카인들의 분비에 영향을 미치는 것으로 나타났다(Fig. 3). 즉, CPA 투여에 의해 감소된 혈중 IL-1β, IL-12 및 IFN-γ의 함량은 도라지 추출물의 급여에 의해 증가하였는데, 혈중 IL-1β는 대조군(4.87 pg/mL)에 대비하여 농도 의존적으로 PG-A군 6.74 pg/mL(138.4%)와 PG-2A군 7.81 pg/mL(160.4%)로 증가하였다. 또한, 혈중 IL-12에서 대조군은 3,733 pg/mL, PG-A군은 5,884 pg/mL(157.6%) 그리고 PG-2A군은 5,015 pg/mL(134.3%)로 증가하였다. IFN-γ 수준은 대조군(12.8 pg/mL) 대비, PG-A군에서 12.8 pg/mL로 영향을 받지 않았지만 PG-2A군에서 16.83 pg/mL(130.9%)로 유의하게 향상되었다.
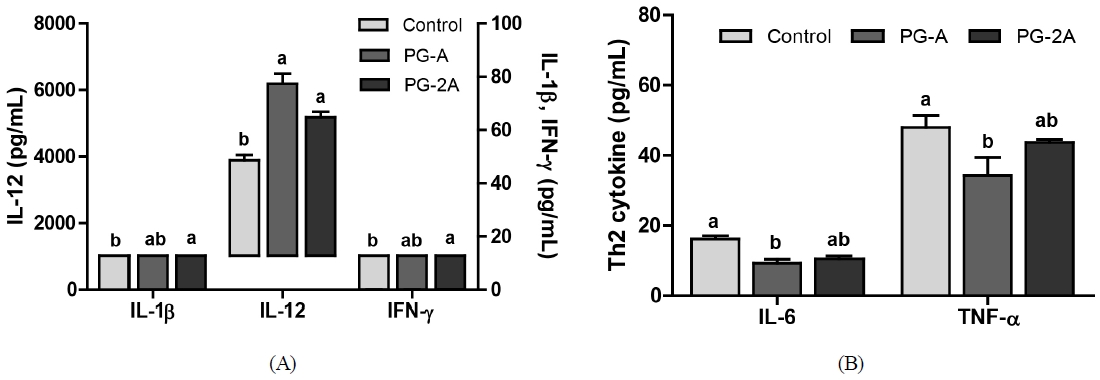
(A) Effects of PG extract on serum Th1 type cytokine (IL-1β, IL-12, IFN-γ) levels and (B) Th2 type cytokine (IL-6, TNF-α) levels of C57BL/6 mice immunosuppressed by CPAAll data are shown as mean±SEM (n=8). Statistical analyses were performed by Duncan’s multiple range test after one-way ANOVA using SPSS software. Differences were considered statistically significant at p<0.05.
한편, Th2 사이토카인 수준을 분석한 결과, 혈중 IL-6 수준은 대조군(15.1 pg/mL)과 비교하여 도라지 추출물 섭취군에서 PG-A군은 8.2 pg/mL(46%)와 PG-2A군은 9.6 pg/mL(63%)로 감소하였고, TNF-α 수준은 대조군(44.5 pg/mL)과 도라지 추출물 섭취군 PG-A군 37.1 pg/mL, PG-2A군 42.8 pg/mL로 PG-A군에서 감소하는 경향을 보였다. 따라서, 도라지 추출물은 Th1 및 Th2 사이토카인들의 분비 조절에 관여하고, 이들의 비율을 조절함으로써 홍삼 등과 같이 화학요법에 의한 면역 억제 증상 개선(Hyun SH 등 2014)에 효과가 있을 것으로 기대된다.
3. 면역 억제 마우스의 T 및 B 림프구 증식능에 미치는 영향
CPA는 자가면역질환에 사용되는 알킬레이팅 물질로서 대사체들은 비장세포의 DNA를 알킬레이션하여, T 및 B 임파구에 의한 면역반응을 억제시킨다고 알려져 있다(Artym J 등 2004). 비장은 혈액을 여과할 뿐 아니라, 이차 림프조직으로 작용하며, 혈액 속 항원을 제거하고, 면역 세포를 활성화시켜 외부 항원에 대해 적응 면역반응이 시작되는 곳이다. T 세포와 B 세포는 혈액을 따라 순환하며, 비장에서 유입과 배출이 지속적으로 이루어지므로 비장세포 수의 변화는 림프구의 변화를 나타낸다(Lee IH 등 2014).
본 연구에서 도라지 추출물의 급여가 비장세포의 증식에 미치는 영향을 확인하고자 세포 배양시 미토젠을 첨가하였고, 비장세포 증식을 비교하였다. 그 결과, Proliferation index는 도라지 추출물 투여군에 Con A를 처리하였을 때, 대조군 1.15과 비교하여 PG-A군은 1.26, 그리고 PG-2A군은 1.25로 유의적이지는 않았지만, 비장세포 증식능이 증가하는 경향을 보였다(Fig. 4). Chun EY(1997) 및 Kim J(2005)는 어성초 추출물이 T 세포에 대하여 세포 증식능을 향상시켜 면역을 증진하는 효과가 있는 것으로 보고하였다. 따라서 도라지도 비장세포의 증식을 통해 체내 림프구의 면역능력을 강화시키고, 감염을 예방해주는 효과가 있을 것으로 보이며, 면역증진을 갖는 후보 소재로 활용이 기대된다.
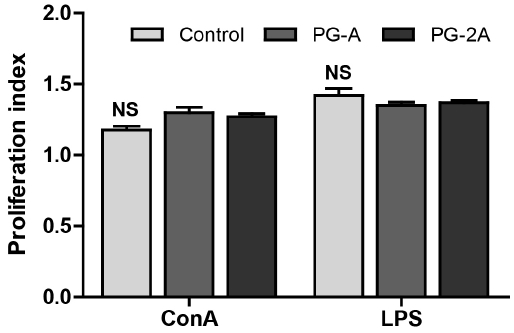
Effects of PG extract on T and B cell proliferation from splenocytes of C57BL/6 mice immunosuppressed by CPASplenocytes (1×106 cells/well) were incubated for 48 h and cell proliferation was measured by ELISA microplate reader. All data are shown as mean±SEM (n=8). Statistical analyses were performed by Duncan’s multiple range test after one-way ANOVA using SPSS software. Differences were considered statistically significant at p<0.05.
4. 면역 억제 마우스의 NK 세포 활성에 미치는 영향
선천적 면역계(innate immune system)는 대식세포(macrophage)와 자연 살해 세포(NK cell) 등을 포함하여 백혈구, cytokine 등으로 구성되어 있고, 감염에 대한 적응 면역이 발생하기 전에 1차적인 방어 역할을 한다. NK 세포는 세포 내의 미생물에 의해 감염된 세포나 암세포를 직접 살해하거나, 단핵구나 수지상세포 등 타 포식세포를 활성화시키는 사이토카인을 포함한 수용성 인자를 분비하는 역할을 한다(Wu D 등 2007; Kim YH 등 2008). 따라서 NK 세포는 선천면역계의 핵심적인 요소로 알려져 있는데(Vivier E 등 2004), 본 연구에서 면역이 저하된 마우스의 복강 NK 세포에서 도라지 추출물은 NK 세포의 활성을 대조군(52.4%)과 비교하여 PG-A군에서 56.0%, PG-2A군은 51.0%로 유의한 차이가 없었다. 그러나, 비장 NK 세포의 활성은 대조군(47.6%)과 비교하여 PG-A군은 71.6%, PG-2A군은 74.1%로 도라지 추출물 섭취군에서 유의한 수준으로 증가하였다(Fig. 5). 따라서 도라지 추출물의 급여는 면역력이 저하된 상태에서 선천면역을 조절하여 면역력을 증진시킬 수 있을 것으로 기대된다.
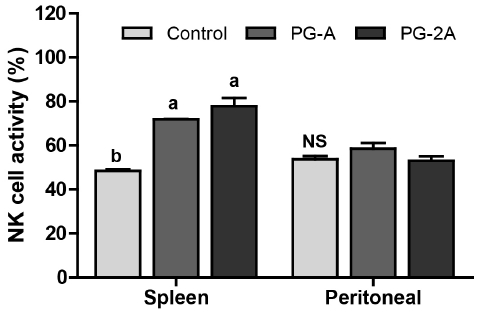
Effects of PG extracts on NK cell activity against Yac-1 in splenocytes and peritoneal cells of C57BL/6 mice immunosuppressed by CPANK cells (1×106, 1×106 cells/well) in splenocytes and peritoneal cells were coincubated with Yac-1 cells (1×104 cells/well) for 24 h. NK cell activity was measured by ELISA reader. All data are mean±SEM (n=8). Statistical analyses were performed by Duncan’s multiple range test after one-way ANOVA using SPSS software. Differences were considered statistically significant at p<0.05.
요 약
최근 면역저하에 관련된 질환 발병이 빈번해짐에 따라 면역 증진 소재 발굴에 대한 연구가 활발히 추진되고 있다. 특히 도라지는 항균 및 항암 목적으로 널리 사용되어 왔으나, 면역 관련 연구는 부족한 실정이다. 따라서 본 연구에서는 CPA 투여로 인하여 면역력이 억제된 마우스에게 10일간 도라지 추출물을 급여하고, 면역 관련 인자에 미치는 영향을 분석하였다. 그 결과, 도라지 추출물은 농도 의존적으로 혈중 면역글로불린(IgA, IgM) 함량을 향상시키고, 혈중 Th1(IL-1β, IL-12, IFN-γ) 및 Th2 사이토카인(IL-6, TNF-α)의 수준을 조절하는 효과가 있는 것으로 나타났다. 또한, 비장의 NK 세포 활성을 증가시켜 선천적 면역계에 관여하는 것으로 보인다.
지금까지의 분석 결과를 종합해 볼 때, 도라지 추출물은 면역이 억제된 마우스의 면역 조절에 도움을 줄 수 있는 것으로 나타났다. 따라서 국산 도라지는 면역 증진에 관련된 기능성 소재로서 사용될 수 있고, 도라지의 소비 기반 확보와 농가의 소득 증대 및 식ㆍ의약품 시장 경제 활성화에 영향을 줄 수 있을 것이다. 또한 도라지를 이용한 면역 개선 소재의 개발로 고령화 시대의 사회적 비용 절감과 삶의 질 향상에도 기여할 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 2019년도 농촌진흥청 시험연구사업(PJ01381001, PJ01327901)의 연구비 지원으로 이루어졌으며, 동물실험에 협조해 주신 농산물안전성부 유아선, 전경미 박사님과 김민숙 선생님에게 깊이 감사를 드립니다.
REFERENCES
- Artym, J, Zimecki, M, Kruzel, ML, (2004), Effect of lactoferrin on the methotrexate-induced suppression of the cellular and humoral immune response in mice, Anticancer Res, 24(6), p3831-3836.
- Balmer, C, Valley, AW, (1997), Basic Principles of Cancer Treatment and Cancer Chemotherapy. Pharmacotherapy: A Pathophysiologic Approach, Third Edition, Appleton and Lange, USA, p2403-2465.
-
Choung, MG, Shon, EH, (2011), Anti-tumor activity of saponin fraction of Platycodon grandiflourm through immunomodulatory effects associated with NO production in RAW264.7 cells, Korean J Plant Res, 24(5), p557-563.
[https://doi.org/10.7732/kjpr.2011.24.5.557]

- Chun, EY, (1997), Partial purification of Houttuynia cordata Thunb extract and characterization of its immunological activites in human, MS Thesis, Seoul National University, Seoul.
- Chung, JH, Shin, PG, Ryu, JC, Jang, DS, Cho, SH, (1997), Chemical compositions of Platycodon grandiflorus (jacquin), A De Candolle Agric Chem Biotechnol, 40, p148-151.
- Hong, MW, (1974), Statistical analyeses of Platycodi radix prescriptions, Korea J Pharmacogn, 5, p61-67.
- Huh, SH, (2014), Health Functional Food Market Trends and Consumer Survey, Korea Health Supplements Association Seongnam Korea.
-
Hyun, SH, Kim, ES, Lee, SM, Kyung, JS, Lee, SM, Lee, JW, Kim, MR, Hong, JT, Kim, YS, (2014), Comparative study on immuno-enhancing effects of red ginseng fractions, J Korean Soc Food Sci Nutr, 43(11), p1665-1673.
[https://doi.org/10.3746/jkfn.2014.43.11.1665]

-
Hyun, SH, Kim, YS, Lee, JW, Han, CK, Seon, PM, So, SH, (2018), Immunomodulatory effects of arginine-fructose-glucose enriched extracts of red ginseng, J Korean Soc Food Sic Nutr, 47(1), p1-6.
[https://doi.org/10.3746/jkfn.2018.47.1.001]

- Joe, SY, (2012), Short-term Cultivation of Bell-flower Roots, Goesan Agricultural Technology & Extension Center, Goesan, Korea.
- Joyce, RA, Hartmann, O, Chervenick, PA, (1979), Splenic granulopoiesis in mice following administration of cyclophosphamide, Cancer Res, 39, p215-218.
-
Kang, DK, Kim, Ej, Park, YJ, Kim, TJ, Kim, MR, (2017), Comparison of antioxidant activities and quality characteristics between domestic diploid variety and tetraploid ‘Etteum’ variety in Platycodon grandiflorum, J Korean Soc Food Sci Nutr, 46, p196-201.
[https://doi.org/10.3746/jkfn.2017.46.2.196]

-
Kim, EH, Gwak, JY, Jung, MJ, (2018), Immunomodulatory acitvity of Platycodon grandiflorum, Codonopsis lanceolata, and Adenophora triphylla extracts in macrophage cells, J Korean Soc Food Sci Nutr, 47(11), p1069-1075.
[https://doi.org/10.3746/jkfn.2018.47.11.1069]

-
Kim, HS, Chung, KT, Lee, IH, Choi, WB, Lee, JH, Hyun, SK, Kim, BW, Hwang, HJ, (2014), Effects of Alpinia officinarum ethanol extract on immunoregulatory activities in the mice, J Life Science, 24(1), p61-66.
[https://doi.org/10.5352/jls.2014.24.1.61]

- Kim, J, Ryu, HS, Shin, JH, Kim, HS, (2005), In vitro and ex vivo supplementation of Houttuynia cordata extract and immunmodulation effect in mice, J Korean Soc Food Sci Nutr, 34(2), p167-175.
- Kim, SY, Lee, EB, Jeong, EJ, (2012), Anti-inflammatory components of Platycodi radix butanol fractions, J East Asian Dietary Life, 22(6), p772-781.
- Kim, YH, Kwon, HS, Kim, DH, Park, IH, Park, SJ, Shin, HK, Kim, JK, (2008), Immunomodulatory effects of propolis and fermented-proplis in BALB/c mice, Korean J Food Sci Technol, 40(5), p574-579.
- Konishi, T, Tada, A, Shoji, J, Tanaka, O, (1976), The structures of platycodin A and C, monoacetylated saponins of the roots of Platydocon grandiflorum, Chem Pharm Bull, 26, p668-670.
-
Koo, SW, Lim, MK, Lee, KW, (2015), Immmunomodulatory effects of Zingiber officinale in cyclophosphamide-induced immunosuppress mice, J of Vet Clin, 32(1), p56-61.
[https://doi.org/10.17555/jvc.2014.02.32.1.56]

- Kwon, OJ, Lee, SW, Pail, SH, Han, SR, Ahn, YM, Ahn, SY, Lee, BC, (2013), The effects of Platycodi radix on obese type 2 diabetes mouse model induced by high fat, high carbohydrate diet, J Korean Oriental Med, 34(1), p1-14.
- Lee, HJ, Seung, YC, Lee, MS, (2018), Immune regulation effects of Gentianae radix extract in LPS-induced acute inflammatory mice, Kor J Herbol, 33(2), p79-84.
-
Lee, IH, Kwon, DH, Lee, SH, Lee, SD, Kim, DW, Lee, JH, Hyun, SK, Kang, KH, Kim, CM, Kim, BW, Hwang, HJ, Chung, KT, (2014), Immune-modulation effect of Ulmus macrocarpa Hance water extract on Balb/c mice, J Life Science, 24(10), p1151-1156.
[https://doi.org/10.5352/jls.2014.24.10.1151]

- Lee, YS, Lee, GH, Park, JH, Kwon, YK, Shin, SW, (2007), Water extracted Evodiae fructus possesses immunomodulatory activities on cyclophosphamide induced immunesuppression, Korean J Physiology & Pathology, 21(6), p1450-1455.
-
Miyauchi, A, Hiramine, C, Tanaka, S, Hojo, K, (1990), Differential effects of a single dose of cyclophosphamide on T cell subsets of the thymus and spleen in mice: Flow cytofluorometry analysis, Tohoku J Exp Med, 162, p147-167.
[https://doi.org/10.1620/tjem.162.147]

-
Park, SE, Lee, SY, Shin, DY, Jeong, JW, Jim, MH, Park, SY, Chung, YH, Hwang, HJ, Hong, SH, Choi, YH, (2013), Pro-apoptotic effects of platycodin D isolated form Platycodon grandiflorum in human leukemia cells, J Life Science, 23(3), p389-398.
[https://doi.org/10.5352/jls.2013.23.3.389]

-
Ryu, HS, (2014), Effects of water extract from Platycodon grandiflorum on mouse immune cell activation ex vivo by oral administration, Korean J Food Nutr, 27(1), p99-104.
[https://doi.org/10.9799/ksfan.2014.27.1.099]

-
Ryu, HS, Kim, KO, Kim, HS, (2009), Effects of plant water extract Codonopsis lanceolatae on mouse immune cell activation ex vivo, Korean J Food Nutr, 42(3), p207-212.
[https://doi.org/10.4163/kjn.2009.42.3.207]

- Shon, MY, Seo, JK, Kim, HJ, Sung, NJ, (2001), Chemical compositions and physiological activities of doraji (Platycodon grandiflorum), J Korean Soc Food Sci Nutr, 30, p717-720.
- Sung, NJ, Lee, SJ, Shin, JH, Lee, JS, Chung, YH, (1996), Effects of Platycodon grandiflorum extract on blood glucose and lipid composition in alloxan induced hyperhlycemic rats, J Korean Soc Food Sci Nutr, 25(6), p986-992.
- Tada, T, Kaneiwa, Y, Shoji, J, Shibat, S, (1975), Saponins of the root P. grandiflorum isolation and the structure of platycodin D, Chem Pharm Bull, 23, p2965-2969.
-
Vivier, E, Nunes, JA, Vely, F, (2004), Natural killer cell signaling pathway, Science, 306, p1517-1519.
[https://doi.org/10.1126/science.1103478]

-
Wu, D, Pae, M, Ren, Z, Guo, Z, Smith, D, Medydani, SN, (2007), Dietary supplementataion with white button mushroom enhances natural killer cell activity in C57BL/6 mice, J Nutr, 137, p1472-1477.
[https://doi.org/10.1093/jn/137.6.1472]

- Xun, CQ, Thompson, JS, Jennings, CD, Brown, SA, Widmer, MB, (1994), Effects of total body irradiation, busulfan-cyclophosphamide, or cyclophosphamide conditioning on inflammatory cytokine release and development of acute and chronic graftversus-host disease in H-2-incompatible transplanted SCID mice, Blook, 83, p2360-2367.
-
Yu, AR, Park, HY, Choi, IW, Park, YK, Hong, HD, Choi, HD, (2012), Immune enhancing effect of medicinal herb extracts on a RAW 264.7 macrophage cell line, J Korean Soc Food Sci Nutr, 41(11), p1521-1527.
[https://doi.org/10.3746/jkfn.2012.41.11.1521]

-
Yu, AR, Park, HY, Kim, YS, Ha, SK, Hong, HD, Choi, HD, (2012), Immuno-enhancing effect of seed extracts on a RAW 264.7 macrophage cell line, J Korean Soc Food Sci Nutr, 41, p1671-1676.
[https://doi.org/10.3746/jkfn.2012.41.12.1671]
