김치에서 분리한 Lactobacillus plantarum B19 및 이를 이용한 발효두유의 유기산 생성 특성
Abstract
Lactic acid bacteria isolated from traditional Kimchi were tested on the characteristics and organic acid production during soymilk fermentation. Fifteen strains were selected as lactic acid producing bacteria, and two strains were selected based on their ability for curd formation (B19 and B29). The morphological and biochemical characteristics, carbohydrate utilization and 16S rRNA gene sequencing analysis were conducted. Both strains were identified as Lactobacillus plantarum at a medium temperature. L. plantarum B19 was finally selected and used for soymilk fermentation. An analysis of the probiotic properties of B19 revwaled it to be highly tolerant to 108% of bile acid and 86% of low pH, and antibacterial activity was observed for five pathogenic strains, of which Bacillus cereus showed the highest antibacterial effects When fermented at 37℃ for 15 hours, the viable cell count reached up to 1.1 × 109 CFU/mL. The organic acid analysis results in a distinctly higher lactic acid than the citric acid and formic acid. Therefore, L. plantarum B19 is a potential probiotic strain for the manufacture of fermented soymilk. Morover, the fermentation process of soymilk can be used as basic data for the manufacture of healthy functional soymilk products.
Keywords:
lactic acid bacteria, L. plantarum B19, soymilk, organic acid서 론
유산균은 발효과정을 통해 유기산, 향기성분, 항생물질 및 다당류 등을 생성하며, 효소에 의한 단백질의 분해시에도 부패성 물질을 생성하지 않는 유익한 미생물이다(Klaenhammer TR 1988; Sybesma W 등 2006). 또한, 당, 단백질 및 지방성분 등을 이용하여 식품의 풍미를 향상시켜 주고 관능개선 효과가 있으며, 생성된 항생물질과 다량의 유기산 등은 유해균의 증식을 억제하는 등 식품의 보존성과 안전성을 높여준다(Leroy F & De Vuyst L 2004; Kim MJ & Kim GR 2006). Probiotics는 체내에 들어가서 건강에 좋은 효과를 주는 살아 있는 균을 말하는 것으로, 건강기능성으로는 유산균 증식 및 유해균 억제, 장내 세균총의 균형을 유지하고 배변활동 원활에 도움을 줄 수 있다(Lourens-Hattingh A & Viljoen BC 2001; Seo JG 등 2010). 특히, 섭취 후 장내 소화기관들에서 분비되는 소화효소 등에 견딜 수 있는 내담즙성과 내산성이 우수하여 장내 생존력이 높아야 하며, 항균물질의 생산 등에 의한 유해균 제어기능도 우수해야 한다(Salminen S & Von Wright A 1998). 한편, 국내에서 산업적으로 이용되고 있는 유산균 종균의 경우는 대부분 수입에 의존하고 있는 실정이며, 이는 국내의 유산균 개발관련 산업이 서구선진국들에 비해 아직 활성화되지 못한 것을 원인으로 볼 수 있다.
김치는 우리나라의 대표적인 식물성 발효식품으로서 최근에는 김치의 건강기능적인 효능에 관한 연구가 활발해지면서 김치 발효과정에 관여하는 유산균에 대한 관심이 높아지고 있고(Cheigh HS & Hwang JH 2000), 이러한 김치유래 유산균들은 항균작용, 면역기능 강화 등의 다양한 건강 증진 기능성이 보고되고 있다(Kim SJ 2005; Shida K 등 1998; Yasui H 등 1999). 김치 유래 유산균은 김치의 종류와 관계없이 Lactobacillus 속이 발효후기에 왕성하게 증식한다(Han HU 등 1990; Kim M & Chun J 2005). 김치 유래 유산균에 대한 연구는 L. sakei 383(Kim EA 등 2013), W. koreensis KO3(Jung MG 등 2016), L. plantarum(Jang DH & Kang DK 2004; Moon GE 등 2015; Kim SK & Lim SD 2017), Leuconostoc 속과 Lactobacillus 속(Ko KH 등 2013) 등 여러 보고가 진행되어 있다. 하지만 아직 토종 분리유산균을 이용하는 산업화는 미흡한 수준으로 이를 활성화하기 위한 다양한 연구가 필요하다.
콩은 우리나라를 비롯하여 아시아지역에서 오랜 기간 재배되고 있는 곡물로서, 쌀을 주식으로 하는 식생활에서 부족하기 쉬운 단백질이나 지방의 급원으로서 중요한 역할을 해왔다(Son DY & Kim YJ 2010). 대두의 일반성분 조성은 수분함량이 9% 수준일 때 단백질 41.3%, 지방 17.6% 및 탄수화물 26.1%로 양질의 단백질과 지방성분을 비교적 다량 함유하고 있다. 대두단백질의 구성은 glycinin 84%, albumin 4%, proteose 4%, 비단백태 질소화합믈 6% 수준이며, methionine과 tryptophan을 제외한 필수아미노산을 고르게 함유하고 있어 영양가가 우수한 식물성 단백질식품이다(Kwon YJ 등 1998). 또한, 대두에는 식물성 스테롤, 올리고당, 사포닌, 아이소플라본, 대두 펩타이드 등 많은 기능성 성분들(Graf E & Eaton JW 1993; Henn RL & Netto FM 1998; Ryu KJ 등 2008)을 함유하고 있어 혈중 콜레스테롤 저하(Sugano M 등 1990), 심혈관질환 예방(Omori M 등 1987; Kim JS 1996; Shin HC 등 2004) 등 생리적 기능성에 대하여 많이 보고되고 있다. 대두를 이용한 대표적인 가공품중 하나인 두유는 대두를 분쇄한 것 또는 분쇄하여 수용성분을 추출한 것으로서, 양질의 단백질과 필수지방산이 풍부하고, 우유에 대한 대용식품으로서도 많이 이용되고 있는 추세이다(Chou CC & Hou JW 2000). 이와 같이 액상두유 제품은 높은 영양가와 기능성 성분들을 함유하고 있지만, lipoxygenease 등에 의한 콩비린내 또는 이취(off-flavor, beany-flavor)로 표현되는 특이취가 식품선호도를 낮춘다고 알려져 있는데, 두유를 발효시키면 이취를 개선하고, 소화율과 기능성을 높일 수 있는 장점이 있다(Yoo JC 등 1984; Kim CJ 1988; Ruas-Madiedo P 등 2002). 그러나 아직 발효두유에 대한 연구는 미흡한 실정이다.
따라서 본 연구에서는 전통발효김치로부터 내산성과 내담즙성, 항균활성 등 프로바이오틱 활성이 우수한 신규 유산균을 분리하고, 이를 적용한 두유의 발효특성과 유기산 생성 등에 대한 평가를 통해 기능성이 높은 두유발효유 제조를 위한 기초자료로 제공하고자 하였다.
재료 및 방법
1. 재료 및 시약
유산균 분리용 시료는 재래시장에서 전통발효김치를 구매하여 사용하였으며, 두유는 고형분 함량 7.4%의 국내산 전두유(Hanmi, Korea)를 구입하여 사용하였다. 유산균 분리 및 증균용 배지는 MRS 배지(Difco, USA)와 BCP 배지(Eiken chemical Co., Ltd., Japan)를 사용하였으며, 항균활성 실험에는 MRS 배지 및 BL(Difco, USA) 배지를 사용하였고, 대조군 유산균은 상업균주인 Lactobacillus acidophilus CSLA(Culture systems, USA)를 사용하였다. 내산성과 내담즙성 실험에는 1N HCl(Daejung chemicals & metals, Korea)과 Bile salts (Oxoid, England)을 사용하였으며, 당발효 실험에는 API 50 CHL Kit(biomerieux, France)을 사용하였고, 유기산 표준품은 Sigma Aldrich(USA)로부터 구입하여 사용하였다.
2. 유산균의 분리 및 선발
김치시료 10 g씩을 멸균수에 25배 희석한 후 MRS(Difco Laboratories, Detroit, MI, USA) 평판배지를 이용하여 37℃에서 48시간 동안 배양하고, 집락을 크게 형성하는 균락을 1차적으로 15 균락 분리하였다. 선별한 colony를 다시 BCP 평판배지에 획선 접종하여 젖산 생성으로 노란색을 형성하는 균락을 유산균으로 확인하였다. 젖산생성균으로 확인된 분리균 중 젖산생성능이 가장 우수한 2개의 colony를 선발한 후 대두단백질 커드 형성능을 확인하기 위하여 멸균두유에 분리균 배양액을 1%씩 접종하고, 37℃에서 8시간 동안 배양하면서 커드 형성상태를 실험하였다.
3. 분리균주의 형태학적 분석 및 생장특성
분리균주의 형태관찰은 MRS 평판배지에서 37℃, 24 hr동안 배양하고 crytstal violet으로 그람염색 한 다음 광학현미경(×1,000) 및 주사전자현미경(SEM)으로 관찰하였다. 주사전자현미경 관찰은 TM3030 plus(Hitachi, Japan)을 사용하였다. 분리균주를 MRS agar에 streaking하여 24시간 동안 증식시킨 후 단일 colony를 백금이로 취하여 slide glass에 균일하게 도포하였으며, 이를 SEM용 샘플 holder에 고정시켰다. 샘플 holder를 SEM에 위치시킨 후 진공상태를 형성하여 외부 공기를 차단시킨 다음, 저진공에서 15 kV로 imaging 하였다. 이미징 사이즈는 15,000∼30,000 배율로 형태를 관찰하였다. 생화학적 특성으로 catalase test를 실시하였으며, 단일 colony를 slide glass에 옮기고, 3% hydrogen peroxide(H202)를 피펫으로 1∼2 방울 떨어뜨려 기포 발생 유무를 관찰하였다. 최적생장온도는 분리균주를 BCP 평판배지에 획선 접종하고, 35℃와 45℃의 온도조건과 혐기 Jar를 이용한 aerobic 및 anaerobic 조건에서 배양하여 생장 유무를 확인하였다.
4. 분리균주의 당분해 특성
분리균주를 MRS agar에 접종하여 37℃에서 24시간 동안 배양한 다음 형성된 colony를 무균적으로 취하여 API 50CHL medium(Bio Meriex Co., Lyon, France)에 현탁하고, 이 현탁액을 API 50 CHL strip에 기포가 생기지 않도록 분주한 다음, 미네랄 오일을 적하하여 혐기조건을 형성하였으며, 37℃에서 48시간 동안 배양한 후, 각각의 당 이용 패턴을 확인하였다. 스트립의 판독은 각 튜브의 색변화로 negative(—), positive(+) 등으로 판정하였으며, API 50 CHL database를 이용하여 동정하였다.
5. 분리균주의 16S rRNA 염기서열 분석
분리균주의 동정은 16S rRNA gene 분석을 통하여 최종적으로 실시하였다. 선발균주는 MRS 액체배지에서 24시간 배양하여 genomic DNA를 추출 후 rRNA gene 증폭을 위하여 forward primer 27F(5'-AGA GTT TGA TCC TGG CTC AG-3')와 reverse primer 1492R(5'-GGT TAC CTT GTT ACG ACT T-3')을 사용하였으며, 염기서열은 ABI PrismTM BigdyeTM Terminator Cycle Sequencing Ready Reaction kit v3.1(Applied Biosystems, Foster, CA, USA)와 ABI 3730XL capillary DNA Sequencer(Applied Biosystems)를 사용하여 분석하였다. 염기서열 결정은 NCBI genebank에 등록된 염기서열 정보를 토대로 상동성을 비교하여 유전학적 동정을 실시하였으며, 염기서열 분석에 기초하여 phylogenetic tree를 나타내었다.
6. 분리균주의 생장특성
분리균주의 생장률을 확인하기 위해 균주의 증식정도를 pH 변화와 생균수로 측정하였다. 비교 균주로 상업균주인 Lactobacillus acidophilus CSLA을 구매하여 사용하였다. MRS broth에 각 균주를 접종한 후 37℃에서 12시간 동안 배양하면서 2시간 간격으로 시료를 취하고, Spectrophotometer(X-ma 1200, Human corporation, Korea)로 660 nm에서의 흡광도를 측정한 후 각 시간대별 시료를 MRS agar배지에 증식시켜 생균수를 확인하고 생육곡선을 작성하였으며, pH의 변화를 측정하였다.
7. 분리균주의 내산성 및 내담즙성 측정
내산성은 Clark PA 등(1993)의 방법을 응용하여 실시하였으며, 분리균주를 MRS broth에 접종하여 37℃에서 24시간 배양한 배양액을 1 N-HCl로 보정하여 만든 pH 3.0 MRS broth에 각각 107 CFU/mL 수준으로 접종하여 37℃에서 3시간 배양방법으로 테스트하였다. 또한 내담즙성은 Park SY 등(1996)의 방법에 준하여 시험하였으며, 분리균주 배양액을 0.3% bile salts(Oxoid, England)를 첨가한 MRS broth에 각각 접종하여 37℃에서 6시간 배양방법으로 테스트하였다. 각각 배양된 샘플을 멸균수에 십진 희석하고 1 mL 채취하여 MRS agar에 접종한 다음, 37℃에서 24시간 배양하여 생성된 콜로니를 계수하고, 초기 균수와 배양 후의 균수를 비교하여 산성 pH 및 염기성 pH에 대한 내성을 확인하였다.
8. 분리균주의 병원성균 성장억제 효과
분리균주의 항균활성 테스트는 paper disc 방법을 이용하여 Bacillus cereus ATCC27348, Listeria monocytogenes ATCC15313, Salmonella typhimurium ATCC14028, Escherichia coli KCCM32396, Staphylococcus aureus ATCC25923 등의 5개 병원성 미생물을 각각 tryptic soy broth에 접종한 뒤, 35℃에서 24시간 동안 배양한 후 시료로 사용하였다. 분리 유산균배양액은 MRS broth에 분리균주를 접종하여 37℃에서 12시간 동안 배양시킨 후 샘플로 사용하였으며, 비교 유산균으로 상업균주인 L. acidophilus CSLA를 동일한 방법으로 전배양하여 사용해 비교균주로 하였다. 각 피검균주를 MRS 배지와 BL 배지를 같은 비율로 혼합하여 만든 평판배지에 100 μL씩 유리막대로 고르게 도말한 다음, 멸균한 paper disc(ø8 × 1.5 mm, Toyo Roshi Kaisha Ltd., Japan)를 올려 각 유산균 배양액 샘플 50 μL를 적가하고, 37℃에서 48시간 동안 배양한 후 clear zone의 형성 여부를 확인하였다. 실험 결과는 저해환의 크기가 12 mm 초과(++), 12∼9 mm(+)와 9 mm미만(w)로 표시하였다.
9. 두유발효유 제조
고형분함량 7.4%의 전두유액을 95℃에서 10분간 가열살균하고 37℃로 냉각한 다음 유산균을 접종하였다. 유산균은 분리균주와 대조구로서 상업균주인 L. acidophilus CSLA를 106 CFU/mL 수준으로 접종하고, 37℃에서 12시간 동안 배양시켜 발효유를 제조한 후 4℃에서 저장하면서 실험에 사용하였다.
10. 발효두유의 pH 및 유산균수 측정
발효 중 pH는 3시간 간격으로 시료를 취한 후 pH-meter(Orion 3 star plus, USA)를 이용하여 측정하였다. 유산균수의 측정은 시료를 멸균수로 10배 희석 방법을 이용하여 10—7 CFU/mL 수준으로 희석한 다음, BCP 평판배지에 도말한 후 37℃에서 48시간 동안 배양하고 생성된 colony를 log CFU/mL로 나타내었다.
11. 발효두유의 유기산 정량
유기산 정량은 건강기능식품공전 시험방법을 이용하여 UHPLC(UltiMate 3000, Thermo, USA)로 분석을 하였다. 표준품은 Acetic acid(99%), Citric acid(99.5%), Formic acid(95%), Lactic acid(85%)을 Sigma Aldrich(USA)에서 구입하여 사용하였다. 검량선 작성은 10 μg/mL의 표준용액을 증류수로 순차적으로 희석하여 1 μg/mL, 5 μg/mL, 10 μg/mL, 25 μg/mL, 50 μg/mL 농도로 조제한 후 분석하여 크로마토그램피크의 면적에 대하여 농도별 검량선을 작성하였다. 발효유시료는 1 g을 정량하여 10배수의 증류수를 첨가한 후 1시간 동안 환류추출기(MS-EAMD 9404-06/1 L, Misung Scientific, Korea)를 이용하여 1회 가열 추출하여 0.45 μm syringe filter로 여과한 후 Table 1의 조건으로 분석하였다.
결과 및 고찰
1. 분리유산균의 형태 및 생화학적 특성
재래식 전통김치로부터 유산균을 분리하였으며, 시료 10 g씩을 멸균수에 25배 희석한 후 MRS 평판배지를 이용하여 37℃에서 48시간 동안 배양하고, 집락을 크게 형성하는 균락을 1차 선발하여 15 colony를 순수분리 하였다. 분리한 colony들 중 BCP 평판배지에서 노란색 환을 크게 형성하는 젖산생성능이 가장 우수한 2개 균주(B19, B29)를 선발하고, 형태적, 생화학적 특성을 분석한 결과는 Table 2와 같았다. 현미경 관찰을 통해 rod 형태를 가지는 것을 확인하였고, 그람염색을 통해 그람(+)균임을 확인하였다. 또한, catalase test 결과, 음성 반응을 나타내었고, 45℃에서는 잘 증식하지 못한 반면 35℃에서 잘 증식하였으며, 산소 유무와 관계없이 잘 증식하는 통성혐기성균으로 확인하였다. 즉, 분리균주들은 전형적인 유산균이면서 중온성균의 특성을 보였다. Kim SK & Lim SD(2017)는 김치에서 분리한 L. plantarum K6을 MRS 배지에서 45℃ 및 15℃로 배양한 결과, 잘 생장하지 않는 것을 확인하고, 37℃에서 생장특성 실험을 실시하였다.
2. 단백질 커드형성능이 우수한 유산균 선발
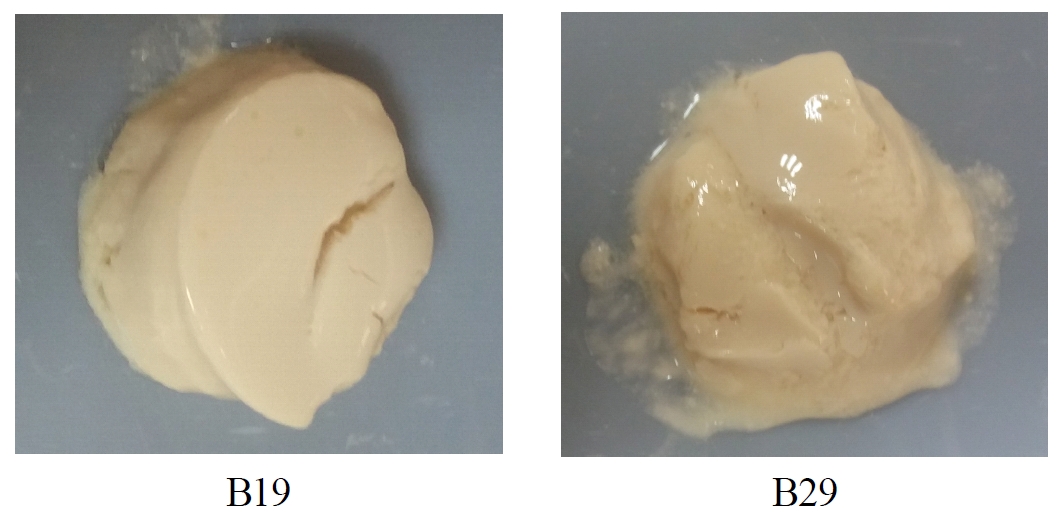
분리균주의 대두단백질을 이용한 커드 형성능을 확인하기 위하여 고형분 함량 7.4%의 전두유에 MRS broth로 12시간 동안 증식시킨 배양액을 1%씩 접종하고, 37℃에서 8시간 동안 배양하면서 커드 형성상태를 실험한 결과 아래 Fig. 1과 같다. 분리균 중 두유단백질 커드 형성능은 B19균이 가장 단단한 굳기의 커드를 형성하였으며, B29균은 비교적 소프트한 커드를 형성하면서 상이한 형태를 보였다. Kim EA 등(2013)은 김치유래 유산균들을 이용하여 37℃에서 두유발효실험을 진행한 결과, 유기산 생성과 함께 단단한 커드를 형성하였으며, 이때 커드의 경도는 유산균 종류에 따라 다양한 형태를 보였다.
3. 분리유산균의 당분해 특성
분리균주를 API 50 CHL medium에 현탁한 후 strip에 분주하여 37℃에서 48시간 동안 배양하였으며, 각 튜브의 색변화를 negative(—), positive(+)로 판정하고, API 50 CHL database를 이용하여 동정한 결과는 Table 3과 같다. 두 균주 모두 raffinose 및 lactose를 포함하여 양성 반응을 나타내는 것을 확인하였고, 각각 99.8% 및 99.9%의 상동성을 가지면서 Lactobacillus plantarum으로 동정되었다. Kim SK & Lim SD(2017)가 김치에서 분리한 L. plantarum K6은 raffinose 및 lactose를 발효하는 특성에서는 유사한 경향을 보였지만 Inulin, Rhamnose 및 L-Sorbose는 발효하지 않아 다소 차이를 보였다.
4. 분리 유산균의 DNA Sequence
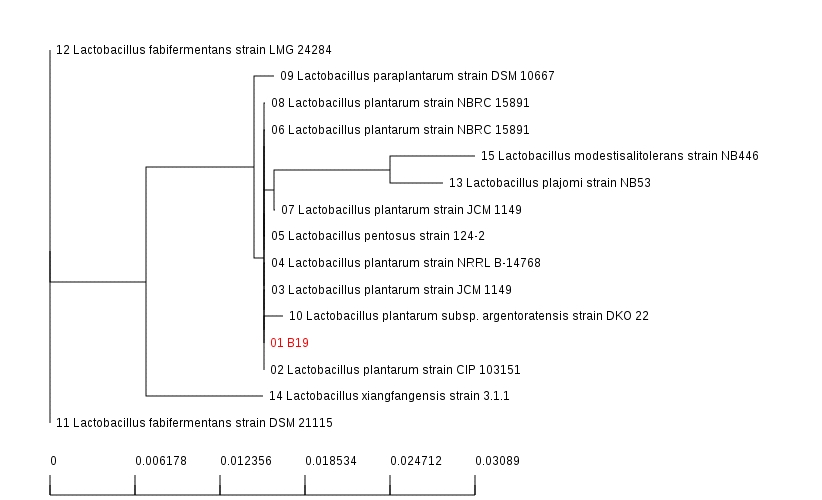
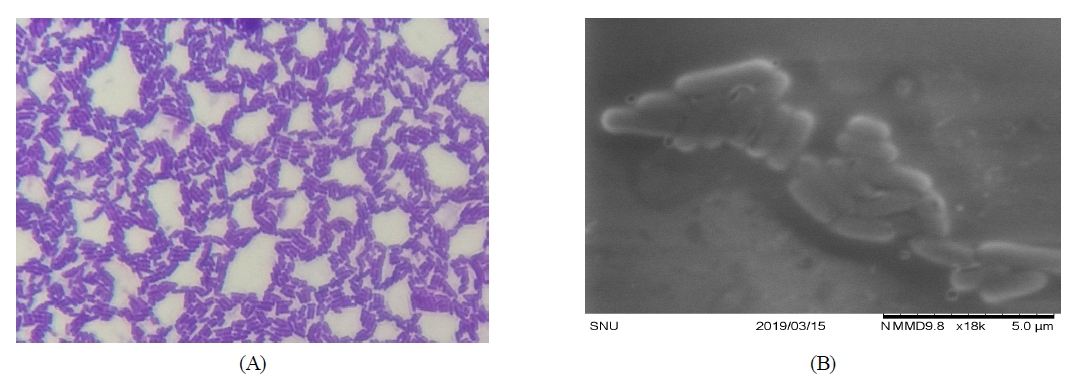
대두단백질의 커드형성능이 우수하고 당분해 반응에서 비교적 다양한 탄수화물의 분해능을 가진 B19를 최종 선발하였으며, 이의 정확한 동정을 위하여 16S rRNA gene분석을 통한 유전학적 동정을 실시하였다. 일반적으로 97% 이상으로 염기서열 상동성을 나타내는 균주들의 경우를 하나의 종으로 분류할 수 있는데, 분석 결과 99% 이상의 상동성을 가지는 Lactobacillus plantarum으로 동정되었다. 김치유래 유산균은 김치의 종류와 관계없이 Lactobacillus 속이 발효후기에 왕성하게 증식한다(Han HU 등 1990; Kim M & Chun J 2005). Phylogenetic tree는 Fig. 2와 같이 나타내었으며, 광학현미경 및 주사전자현미경(SEM) 관찰결과는 Fig. 3과 같이 Gram(+)의 단간균 형태로서 크기는 약 3 μm를 보였다.
5. L. plantarum B19의 생장특성
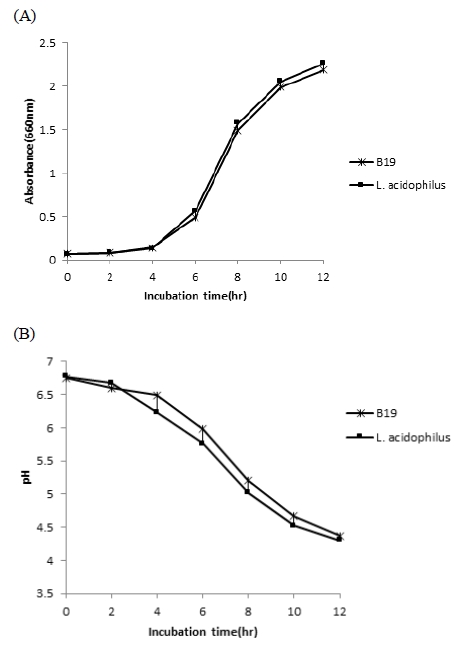
분리 균주(B19)의 생장률을 확인하기 위해 MRS broth에서 37℃로 증식정도를 pH 변화(B)와 생균수(A)로 측정한 결과, Fig. 4와 같이 배양 6시간에서 10시간 사이에 대수증식기를 보였으며, 10시간 이후에는 증가세가 완만하여 정체기에 접어들고 있음을 알 수 있었다. 분리 균주(B19)와 대조균(L. acidophilus CSLA)의 생장 형태는 유사한 경향을 보여 분리균주(B19)가 대조군인 상업균주 L. acidophilus CSLA와 같이 우수한 생장능력이 있음을 확인할 수 있었다. 또한, pH의 변화는 분리균과 대조균이 생장곡선에 비례하여 6시간에서 10시간 사이에 급격한 저하를 보였고, 대수증식기 이후 pH 4.5수준을 보였다. Kim EA 등(2013)은 김치에서 분리한 L. sakei 383을 35℃에서 24시간 배양시 최적의 생장률을 보였다고 하였으며, Park JH(2011)는 동치미에서 분리한 L. sakei J4를 30℃ 조건으로 MRS배지에서 12시간 이상 배양시 최적의 생장을 보였다고 하였다.
6. L. plantarum B19의 내산성 및 내담즙성
내산성 확인은 pH 3.0 MRS broth에서 37℃, 3시간 배양방법으로 테스트하였으며, Table 4와 같이 초기균수 대비 86.0%의 생존률을 보였으며, 이는 일반적으로 pH 2.5∼3.5에서 90% 이상의 내산성으로 보이는 것으로 알려진 L. acidophilus 균종보다는 조금 낮은 수준이었지만, 거의 유사한 수준의 우수한 내산성을 보이는 것을 확인하였다. 일반적인 발효유는 pH 4.0 이상인 것을 고려할 때 분리 균주(B19)는 발효유 스타터로 사용이 적합한 것으로 판단되었다. pH 2.0에서 억제되지 않고 100%의 생존성을 보인 Kim SK & Lim SD(2017)의 결과보다는 낮은 수준이지만, pH 2.5에서 60∼80%의 생존율을 보인 것과 유사한 결과이다(Pennacchia C 등 2004).
Survival of Lactobacillus plantarum B19 in HCl solution (pH 3.0, 3 hr) and bile salts solution (0.3%, 6 hr)
내담즙성 확인은 0.3% bile salts를 첨가한 MRS broth에서 37℃, 6시간 배양방법으로 테스트 하였으며, 초기균수 대비 108.0%의 생존율을 나타냈다. 이는 Bile salts 0.3% 농도에서는 분리균주(B19)의 생장이 억제되지 않고 다소 증식이 가능하였음을 보인 것으로 매우 우수한 내담즙성을 나타내었다. Probiotics는 섭취 후 장내 소화기관들에서 분비되는 소화효소 등에 견딜 수 있는 내담즙성과 내산성이 우수하여 장내 생존력이 높아야 한다(Salminen S & Von Wright A 1998). 이를 통해 분리균주(B19)는 발효유 제조용으로 사용시 유산균의 장내 생존성을 높여주어 프로바이오틱 기능성을 향상시켜줄 수 있을 것으로 판단되었다.
7. Lactobacillus plantarum B19의 항균활성
분리 균주(B19)의 5개 병원성 미생물에 대한 항균활성 테스트는 paper disc agar diffusion method을 이용하여 clear zone의 형성 여부를 확인한 결과는 Table 5와 같다. 표에서와 같이 Salmonella typhimurium ATCC14028와 Listeria monocytogenes ATCC 15313에 대하여는 약 9 mm의 저해환을 형성하였으며, Staphylococcus aureus ATCC25923와 Escherichia coli KCCM32396은 약 8 mm로 비교적 약한 항균성을 보였으며, Bacillus cereus ATCC27348에 대하여는 약 13 mm로 우수한 저해능을 보였다. 시험한 5개 모두의 병원성 균주에 대해 항균 활성을 나타내었고, 포도상구균을 제외한 다른 4종의 병원성균에 대하여 모두 대조군인 L. acidophilus CSLA보다 우수한 항균특성을 보였다. 일반적으로 유산균은 젖산을 생성하여 산도를 낮춤으로써 병원성 세균의 생육을 억제하며, bacteriocin 등의 항균물질을 생성하여 항균작용을 나타내는 것으로 알려져 있다(Leroy F & De Vuyst L 2004; Kim MJ & Kim GR 2006). 따라서 본 발명의 항균 활성이 우수한 분리 균주(B19)는 생균제로 이용시 유해균의 증식을 억제하여 장내균총을 개선시키는 probiotic 효과를 기대할 수 있을 것으로 사료된다.
8. L. plantarum B19를 이용한 발효두유의 pH 및 생균수 변화
두유발효유는 L. plantarum B19와 상업균주인 L. acidophilus CSLA를 각각 106 CFU/mL수준으로 접종한 후 37℃에서 15시간 동안 발효시켜서 두유발효유를 제조하였으며, 발효과정 중의 pH 및 유산균수 변화는 Fig. 5와 같다.
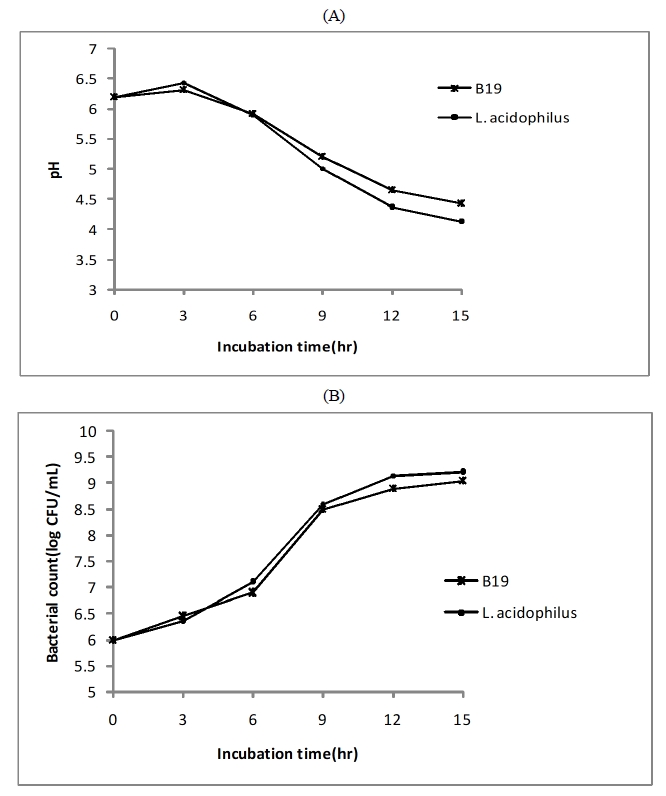
Change of pH (A) and bacterial counts (B) of soy milk yogurt during fermentation at 37℃ for 15 hr with L. plantarum B19 and L. acidophilus CSLA.
두유배지에서의 생장은 L. plantarum B19와 대조군 모두 MRS 배지에서의 생육에서와 유사한 형태로 배양 6∼9시간 사이에 가장 큰 폭의 pH 변화를 보이며 잘 생장하였고, 배양 15시간 후에는 각각 pH 4.43과 pH 4.12를 나타내었다. 생균수 또한 분리균과 대조군 모두에서 pH 저하 경향과 유사한 형태로 배양 6시간 이후 빠르게 증가하였고, 배양 15시간 후에는 1.1 × 109 CFU/mL와 1.6 × 109 CFU/mL를 나타내어 발효유뿐만 아니라, 농후발효유의 유산균수 기준인 1.0 × 108 CFU/mL에도 적합한 생장형태를 보였다. 김치 유래 분리균을 이용한 두유발효에서 pH가 3.9∼4.2를 나타낸 결과와 유사한 경향을 보였으며(Kim KO & Kim WH 1994; Kim JS 1996), 생균수에 있어서는 30℃에서 12시간 발효시 생균수가 8.71 × 108 CFU/mL를 보인 Jung MG 등(2016)의 발효두유 선행연구에서 보다는 높은 경향을 보였는데, 이는 균종 및 최적 배양온도 조건의 차이가 영향을 미친 것으로 사료된다.
9. 발효두유의 유기산 정량
분리유산균인 L. plantarum B19와 대조군인 L. acidophilus CSLA를 이용하여 37℃에서 12시간 동안 발효시켜 발효두유를 제조하고, HPLC를 이용하여 lactic acid, acetic acid, citric acid 및 formic acid 등의 유기산 함량을 측정한 결과는 Table 6과 같다. 표에서와 같이 분리유산균 및 대조군 모두에서 lactic acid의 생산량이 1,074 mg/100 g과 1,076 mg/100 g으로 다른 유기산에 비하여 크게 높은 생성량을 보였고, formic acid는 168 mg/100 g 및 284 mg/100 g을 생산하였고, citric acid는 113 mg/100 g과 111 mg/100 g을 각각 생산하였으며, acetic acid는 두 시료 모두에서 검출되지 않았다. 유산균에 의한 젖산 발효는 생성된 유기산에 의해 저장성을 높여주며, 섭취시 장내 유해미생물의 생장을 억제하고 유익균의 생장을 도와주는 장내 환경개선 효과를 줄 수 있다(Seo JG 등 2010). 분리유산균 L. plantarum B19는 두유발효에서 상업균주인 L. acidophilus CSLA와 매우 유사하면서 우수한 수준의 유기산 생성능력이 확인된 것으로 발효유용 스타터 및 probiotic으로서의 이용 가능성을 확인할 수 있었다.
요 약
본 연구에서는 김치로부터 유산균을 분리 동정하여 특성을 확인하였고, 두유 발효 중 유기산 생성능을 확인하였다. 산생성이 우수한 15균락 중 두유액의 커드형성능이 우수한 2균주(B19, B29)를 임의로 선발하고, 형태 및 생화학적 특성과 당분해 특성 및 16S rRNA 유전자 염기서열 분석을 실시하였으며, 2개 균주 모두 중온성의 Lactobacillus plantarum으로 동정되었다. 분리균의 프로바이오틱 특성을 분석한 결과, 내산성은 86.0%, 내염기성은 108.0%의 우수한 내성을 나타내었으며, 항균활성은 5개 병원성 균주에 대하여 항균활성을 나타내었으며, 그중 Bacillus cereus에 대하여 가장 높은 항균작용을 보였다. 이중 프로바이오틱 활성이 우수한 L. plantarum B19균을 최종 선발하고 발효두유를 제조하였으며, 두유배지에서의 생육특성은 37℃에서 15시간 발효시켰을 때 생균수가 1.1 × 109 CFU/mL를 보였다. 유기산 분석결과는 lactic acid을 뚜렷하게 높게 생성하였으며, citric acid와 formic acid는 유사한 수준으로 생산하였다. 따라서 프로바이오틱 활성이 우수한 B19유산균의 발효두유 제조용 스타터로서 사용가능성을 확인하였으며, 또한 두유의 발효공정을 통해 유기산 생성량을 크게 높여줌으로써 건강기능적인 두유 가공품 제조를 위한 기초자료로서 활용 가능할 것으로 판단된다.
References
- Cheigh, HS, Hwang, JH, (2000), Antioxidative characteristic of Kimchi, Food Industry and Nutrition, 5(3), p52-56.
-
Chou, CC, Hou, JW, (2000), Growth of bifidobacteria in soymilk and their survival in the fermented soymilk drink during storage, Int J Food Microbiol, 56(2-3), p113-121.
[https://doi.org/10.1016/s0168-1605(99)00201-9]

- Clark, PA, Cotton, LN, Martin, JH, (1993), Selection of Bifidobacteria for use as dietary adjuncts in cultured dairy foods : Ⅱ-Tolerance to simulated pH of human stomachs, Cultured Dairy Products J, 28(1), p11-14.
-
Graf, E, Eaton, JW, (1993), Suppression of colonic cancer by dietary phytic acid, Nutr Cancer, 19(1), p11-19.
[https://doi.org/10.1080/01635589309514232]

- Han, HU, Lim, CR, Park, HK, (1990), Determination of microbial community as an indicator of Kimchi fermentation, Korean J Food Sci Technol, 22(1), p26-32.
-
Henn, RL, Netto, FM, (1998), Biochemical characterization and Enzymatic hydrolysis of different commercial soybean protein isolates, J Agric Food Chem, 46(8), p3009-3015.
[https://doi.org/10.1021/jf980074i]

- Jang, DH, Kang, DK, (2004), The new Lactobacillus plantarum isolated from Kimchi and having high resistance ability of acid and bile, and products containing it, Korea Patent 10-0455832.
-
Jung, MG, Kim, SI, Hur, NY, Seong, JH, Lee, YG, Kim, HS, Chung, HS, Kim, DS, (2016), Isolation, identification, and characteristics of lactic acid bacteria for production of fermented soymilk which has improved sensory quality, Microbiol and Biotechnol Lett, 44(1), p74-83.
[https://doi.org/10.4014/mbl.1511.11008]

-
Kim, CJ, (1988), Physico-chemical, nutritional, and flavor properties of soybean extracts processed by rapid-hydration hydrothermal cooking, Retrospective Theses and Dissertations, Paper 8857.
[https://doi.org/10.31274/rtd-180813-11470]

-
Kim, EA, Mann, SY, Kim, SI, Lee, GY, Hwang, DY, (2013), Isolation and identification of soycurd forming lactic acid bacteria which produce GABA from kimchi, Korean J Food Preserv, 20(5), p705-711.
[https://doi.org/10.11002/kjfp.2013.20.5.705]

- Kim, JS, (1996), Current research trends of bioactive function of soybean, Korean Soybean Digest, 13(2), p17-24.
- Kim, KO, Kim, WH, (1994), Changes in properties of Kimchi prepared with different kinds and levels of salted and fermented seafoods during fermentation, Korean J Food Sci Technol, 26(3), p324-329.
-
Kim, M, Chun, J, (2005), Bacterial community structure in kimchi, a Korean fermented vegetable food, as revealed by 16S rRNA gene analysis, Int J Food Microbiol, 103(1), p91-96.
[https://doi.org/10.1016/j.ijfoodmicro.2004.11.030]

- Kim, MJ, Kim, GR, (2006), In vitro evaluation of cholesterol reduction by lactic acid bacteria extracted from Kimchi, Korea J Culinary Res, 12(4), p259-268.
- Kim, SJ, (2005), Physiochemical characteristic of yogurt prepared with lactic acid bacteria isolated from Kimchi, Korean J Food Culture, 20(3), p337-340.
- Kim, SK, Lim, SD, (2017), Physiological characteristics and anti-obesity effect of Lactobacillus plantarum K6 isolated from Kimchi, J Milk Sci Biotechnol, 35(4), p221-231.
- Klaenhammer, TR, (1988), Bacteriocins of lactic acid bacteria, Biochimie, 70(3), p337-349.
-
Ko, KH, Liu, W, Lee, HH, Yin, J, Kim, IC, (2013), Biological and functional characteristics of lactic acid bacteria in different Kimchi, J Korean Soc Food Sci Nutr, 42(1), p89-95.
[https://doi.org/10.3746/jkfn.2013.42.1.089]

- Kwon, YJ, Kwon, JH, Park, KH, Park, YK, Yang, HC, (1998), Food Chemistry, Youngji Press, Seoul, p474-475.
-
Leroy, F, De Vuyst, L, (2004), Lactic acid bacteria as functional starter cultures for the food fermentation industry, Trends Food Sci Tech, 15(2), p67-78.
[https://doi.org/10.1016/j.tifs.2003.09.004]

-
Lourens-Hattingh, A, Viljoen, BC, (2001), Yogurt as probiotic carrier food, Int Dairy J, 11(1), p1-17.
[https://doi.org/10.1016/s0958-6946(01)00036-x]

- Moon, GE, Oh, YJ, Park, SY, Jung, DS, (2015), Cultivation of lactic acid bacteria using radish juice, and organic acid and sugar profiles in fermented radish juices, J Natural Science, SWINS, 27(1), p11-18.
-
Omori, M, Yano, T, Okamoto, J, Tsushida, T, Murai, T, Higuchi, M, (1987), Effect of anaerobically treated tea (Gabaron tea) on blood pressure of spontaneously hypertensive rats, J Agr Chem Soc Jpn, 61(11), p1449-1451.
[https://doi.org/10.1271/nogeikagaku1924.61.1449]

- Park, JH, (2011), A study on the antimicrobial activity of the culture broth of lactic acid bacteria from Dongchimi on some pathogens, MS Thesis, Hankyong National University, Anseong, p50-51.
- Park, SY, Ko, YT, Jeong, HK, Yang, JO, Chung, HS, Kim, YB, Ji, GE, (1996), Effect of various lactic acid bacteria on the serum cholesterol levels in rats and resistance to acid, bile and antibiotics, Kor J Appl Microbiol Biotechnol, 24(3), p304-310.
-
Pennacchia, C, Ercolini, D, Blaiotta, G, Pepe, O, Mauriello, G, Villani, F, (2004), Selection of Lactobacillus strains from fermented sausages for their potential use as probiotics, Meat Sci, 67(2), p309-317.
[https://doi.org/10.1016/j.meatsci.2003.11.003]

-
Ruas-Madiedo, P, Hugenholtz, J, Zoon, P, (2002), An overview of the functionality of exopolysaccharides produced by lactic acid bacteria, Int dairy J, 12(1), p163-171.
[https://doi.org/10.1016/s0958-6946(01)00160-1]

- Ryu, KJ, Xin, Z, Bak, SS, Kim, BK, Jeon, JT, Park, KY, (2008), In vitro anticancer effect of chungkukjangs from Folk Villages of SunChang region in HT-human colon cancer cells, Cancer Prev Res, 13(1), p62-67.
- Salminen, S, Von Wright, A, (1998), Lactic Acid Bacteria: Microbiology and Functional Aspects. Series: Food Science and Technology, Marcel Dekker Inc., New York, p211-253.
- Seo, JG, Lee, GS, Kim, JE, Chung, MJ, (2010), Development of probiotic products and challenges, KSBB Journal, 25(4), p303-310.
-
Shida, K, Makino, K, Morishita, A, Takamizawa, K, Hachimura, S, Ametani, A, Kumagai, Y, Sato, T, Habu, S, Kaminogawa, S, (1998), Lactobacillus casei inhibits antigen-induced IgE secrection through reguluation of cytokine production in murine splenocyte cultures, Int Arch Allergy Immunol, 115(4), p278-287.
[https://doi.org/10.1159/000069458]

- Shin, HC, Seong, HS, Sohn, HS, (2004), The industrial development and health benefits of the soymilk, Korean Soybean Digest, 21(1), p15-27.
- Son, DY, Kim, YJ, (2010), Allergenicity of soybeans depending on their variety, Korean J Food Sci Technol, 42(5), p627-631.
-
Sugano, M, Goto, S, Yamada, Y, Yoshida, K, Hashimoto, Y, Matsuno, T, Kimoto, M, (1990), Cholesterol-lowering activity of various undigested fraction of soybean protein in rats, J Nutr, 120(9), p977-981.
[https://doi.org/10.1093/jn/120.9.977]

-
Sybesma, W, Hugenholtz, J, de Vos, WM, Smid, EJ, (2006), Safe use of genetically modified lactic acid bacteria in food, bridging the gap between consumers, green groups, and industry, Electron J Biotechnol, 9(4), p424-448.
[https://doi.org/10.2225/vol9-issue4-fulltext-12]

- Yasui, H, Shida, K, Matsuzaki, T, Yokokura, T, (1999), Immunomodulatory function of lactic acid bacteria, Antonie van Leeuwenhoek, 76(1), p383-389.
- Yoo, JC, Lim, SJ, Ko, YT, (1984), Manufacture of yogurt from soy protein concentrate, Food Sci Biotechnol, 16(2), p143-148.