백합 구근 추출물의 항산화 활성 및 인체 암세포에 대한 독성효과
Abstract
Lilium davidii has been used as a traditional herbal medicine to treat bronchitis and neuralgia in Asia. This study investigated the antioxidant activities and cytotoxicities of ethanol extract (EL) and hot-water extract (WL) of dried Lilium davidii root. Antioxidant activities of the Lilium davidii extracts were evaluated by 2,2-diphenyl-1-picrylhydrazyl (DPPH) assay and 2-2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) assay. Antioxidant activities of the EL and WL were concentration-dependent in both methods, and EL showed higher antioxidant activity than WL in both assays. In addition, the total polyphenol and flavonoid contents of EL (104.44 mg GAE/g and 22.92 mg QE/g) were higher than those of WL (86.80 mg GAE/g and 15.87 mg QE/g). Cytotoxicities of the extracts in human cancer cells (HeLa, Hep3B, and A549) were evaluated by thiazoly blue tetrazolium bromide (MTT) and sulforhodamine B (SRB) assays. The cytotoxicity of EL in the tested cancer cells was higher than that of the WL. In particular, the cytotoxicity of EL in HeLa cells in the MTT and SRB assays was 92.19% and 91.57% at 400 μg/mL, respectively. Additionally, the extracts showed strong inhibitory effects on cancer cell growth. Overall, the results of this study suggest that EL has excellent antioxidant activity and cytotoxicity, making it a valuable resource for the development of natural functional materials.
Keywords:
Lilium davidii, antioxidant activity, cytotoxicity, ethanol extract, hot-water extract서론
생활수준이 향상되고 고령화 시대로 접어들면서 질병 예방 및 건강에 대한 사회적 관심이 더욱 높아지고 있다. 질병과 노화를 촉진시키는 원인 중 하나로 활성산소종(reactive oxygen species; ROS)이 지목되고 있는데, 활성산소증은 세포를 손상시키고, 염증 및 노화를 촉진시키며, 암을 발생시키는 것으로 보고되었다(Kim SK 등 2005). 체내에서는 활성산소종에 대응하는 항산화 시스템이 유지되고 있으나, 이 시스템의 방어력을 넘는 산화적 스트레스 상태가 되면 여러 질병이 유발될 수 있다. 따라서 산화적 스트레스를 저하시킬 수 있는 항산화 물질을 함유한 천연물에 대한 연구가 수행되고 있다.
천연 항산화 화합물은 주로 플라보노이드, 탄닌, 안토시아닌 등과 같은 폴리페놀과 카로티노이드 및 유기산이 주를 이루고 있다(Choi MH 등 2015). 따라서 이들 항산화 물질을 많이 함유하고 있는 천연물에 대한 연구들이 활발히 수행되고 있다. 이러한 천연물 중 전통적으로 약재로 사용되어 온 한약재는 안전성도 보장되어 이들의 항산화성에 대한 연구도 진행되었는데, 황기, 삼백초, 구기자, 감초, 국화, 당귀, 작약, 천궁 등 여러 한약재의 항산화성에 대해 연구되었으며(Park YS 2002; Kim SK 등 2005; Park BH 등 2005; Seo HS 2008; Lee KJ 등 2011; Park SJ 등 2011), 이들 한약재에서 항산화 성분은 대부분 플라보노이드 계통의 페놀성 화합물인 것으로 보고되었다.
한편, 암은 통계청이 발표한 2017년 우리나라 사망원인 1위를 차지한 질병으로(Korean Statistical Information Service), 100세의 건강장수를 기대하는 현대인들은 암을 예방하고 암질환 개선에 도움을 줄 수 있는 식품에 대한 관심이 높다. 건강인의 경우 일상생활에서 쉽게 섭취함으로써 암과 같은 질병을 예방하는데 도움을 주는 건강기능식품을 선호하고 있으며, 암환자의 경우 치료를 위한 화학요법에 사용되는 항암제들이 여러 부작용을 나타내기 때문에 최근에는 부작용의 우려가 적은 천연물로부터 발굴된 항암 물질에 많은 관심을 보이고 있다. 한약재에는 항암의 약리 활성을 가진 것들이 많기 때문에 이에 대한 연구들이 수행되었는데, Jeon YH 등(2008)은 산수유 추출물이 항돌연변이성과 암세포 성장억제 활성을 가지고 있다고 하였고, Jeong JW 등(2015)은 천궁 에탄올 추출물의 인체 혈구암세포의 apoptosis 유발효과에 대해 보고하였으며, Nam SW & Kim MR(2017)은 건여주 추출물이 인체간암, 폐암, 자궁암 세포에 대한 세포독성이 우수하다고 보고하였다. 이 외에도 건칠, 유근피 및 신석 추출물의 AGS 인체위암 세포에 대한 항암 활성 연구(Baek I 등 2015), 길경 추출물의 HCT-116 대장암 세포주에서의 autophagy와 apoptosis 유발 효과 연구(Hong SH 등 2014), 등심초로부터 분리된 화합물의 암세포 성장 억제 효과 연구(Kim YJ 등 2014) 등 한약재의 항암활성과 관련된 여러 연구들이 수행되었다.
백합(Lilium davidii)은 백합과(Liliaceae) 백합속(Lilium)에 속하는 내한성 경구근초(hardy bulbous)로 건조된 꽃과 구근은 약리 효과를 가지는 것으로 알려져 있어 아시아에서는 예로부터 기관지염 및 신경통 치료를 위한 약재로 이용되어 왔으나(Lee JA & Chun HP 1996), 아직까지 항산화 활성과 항암 활성에 대한 연구는 미흡한 실정이다. 따라서 본 연구에서는 새로운 기능성 식품소재로서의 이용 가능성을 살펴보기 위하여 백합 구근 추출물을 제조하여 추출물의 총 폴리페놀 함량, 총 플라보노이드 함량, DPPH 라디칼 소거능, ABTS 라디칼 소거능 측정을 통해 항산화 활성을 분석하고, 인체암세포에 대한 세포 증식 억제 효과를 확인하였다.
재료 및 방법
1. 실험재료 및 시약
본 실험에 사용한 백합은 음건된 형태로 시판되는 한약규격품을 대구 약령시에서 구입하여 사용하였다. 2,2-Diphenyl-1-picrylhydrazyl(DPPH), 2-2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), L-ascorbic acid, dimethyl sulfoxide(DMSO), thiazoly blue tetrazolium bromide(MTT), trichloroacetic acid(TCA), sulforhodamine B(SRB), Folin-Ciocalteu's phenol reagent, potassium hydroxide, potassium chloride, sodium chloride, gallic acid, quercetin는 Sigma Chemical Co.(USA)에서 구입하였다. 또한, 세포주 배양에 사용한 Roswell Park Memorial Institute medium(RPMI-1640 with L-glutamin), Dulbecco's modified eagle's minimal essential medium(DMEM/High glucose), fetal bovine serum(FBS), trypsin 0.25% EDTA solution, penicillin-streptomycin solution은 Hyclone Co.(USA)에서 구입하였다.
2. 백합 구근 추출물 제조
백합 구근 50 g에 80% 에탄올 500 mL를 가하고 25℃에서 24시간 동안 저어주면서 교반하여 에탄올 추출물을 얻었다. 또한 열수 추출물은 백합 구근 50 g에 증류수 500 mL를 가한 뒤 water bath에서 100°C를 유지하면서 6시간 동안 환류 추출하였다. 이들 추출액은 여과지(Whatman No 2. England)로 여과한 다음 감압농축기(Heidolph Instruments GmbH & Co., Germany)로 농축시켰다. 이를 동결건조기(Eyela, Tokyo Rikakikai Co., Japan)를 이용하여 동결건조한 다음 -18℃에서 보관하였다.
3. 총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin-Ciocalteu(FC)법에 따라 분석하였다(Singleton VL & Rossi JA 1965). 증류수를 이용하여 백합 추출물 1 mg/mL를 제조한 후 증류수 5 mL와 Folin-Ciocalteu's phenol reagent 0.5 mL를 가해 vortex로 혼합하였다. 8분 후 7% Na2CO3 10 mL를 첨가하고, 여기에 증류수를 이용하여 부피를 25 mL로 맞춰 암소에서 2시간 동안 방치한 후 spectrophotometer(DU 800, Beckman, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid를 표준물질로 사용한 검량곡선에 시료의 흡광도를 대입하여 g당 gallic acid mg당량(mg GAE/g)을 구하였다.
4. 총 플라보노이드 함량 측정
총 플라보노이드 함량 분석을 위해 각 시료 500 μL에 10% aluminum nitrate 1 mL, 1 M potassium acetate 100 μL와 80% 에탄올 4.3 mL를 가하고 40분 동안 암소에서 반응시킨 후 spectrophotometer로 510 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 quercetin을 표준물질로 사용한 검량곡선에 시료의 흡광도를 대입하여 g당 quercetin mg당량(mg QE/g)을 구하였다(Moreno MI 등 2000).
5. DPPH 라디칼 소거능 측정
Blois MS(1958)의 방법을 이용하여 백합 추출물의 DPPH 라디칼 소거능을 측정하였다. 즉, 0.1 M sodium acetate buffer(pH 5.5)로 희석한 시료 1 mL에 7.5 × 10-5 M DPPH 용액 2 mL을 혼합하고, 37℃에서 30분간 방치한 후 517 nm에서 spectrophotometer를 이용하여 흡광도를 측정하였다. 대조군은 L-ascorbic acid를 사용하였으며, DPPH 라디칼 소거능은 아래의 식을 이용하여 백분율로 나타내었다.
6. ABTS 라디칼 소거능 측정
백합 추출물의 ABTS 라디칼 소거를 통한 항산화 활성은 Roberta R 등(1999)의 방법에 따라 측정하였다. 즉, 7 mM ABTS와 2.45 mM potassium persulfate를 1:1로 혼합하고, 30℃의 암소에서 12시간 동안 방치하여 ABTS+을 형성시킨 후 5mM potassium phosphate buffer(pH 7.4)를 이용하여 413 nm에서 흡광도가 0.7이 되도록 희석하였다. 희석된 ABTS 시약 4 mL에 시료 40 μL를 가하여 1분 동안 반응시킨 뒤 413 nm에서 흡광도를 측정하였다. 대조군으로 L-ascorbic acid를 사용하였으며, 각 시료의 ABTS 라디칼 소거능은 DPPH 라디칼 소거능 측정에 사용한 식을 이용하여 구하였다.
7. 세포주 배양
실험에 사용한 인체 암세포는 폐암 세포인 A549, 간암 세포인 Hep3B 및 자궁경부암 세포인 HeLa로서 한국세포주은행(Korea cell line bank, Seoul, Korea)으로부터 분양받았다. A549, HeLa는 RPMI 1640 배지를, Hep3B는 DMEM 배지를 사용하여 배양하였고, 각각의 배지에 10% FBS와 1% penicillin-streptomycin을 첨가하여 사용하였다. 세포는 4일 간격으로 37℃, 5% CO2 incubator에서 계대 배양하면서 실험에 사용하였다.
8. MTT Assay
암세포에 대한 추출물의 암세포 증식억제 효과를 측정하기 위해 Carmichael J 등(1987)의 방법으로 MTT assay를 실시하였다. 배양된 암세포를 1 × 105 cells/mL 농도가 되도록 pH 7.5 phosphate buffered saline(PBS)로 희석한 후 96 well plate에 분주하고, 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 세포를 배양한 후 배지 80 μL를 제거하고, 각 well에 추출물을 농도별로 100 μL 첨가한 다음 48시간 동안 배양하고, MTT 용액 20 μL를 첨가하여 4시간 동안 배양한 후 배양액을 제거하였다. 여기에 DMSO:ethanol(1:1) 용액 150 μL를 첨가하여 30분 동안 진탕배양한 뒤 ELISA reader (Versamax, Molecular Device, USA)로 550 nm에서 흡광도를 측정하였다. 3회 반복하여 실험하였고, 암세포 증식억제 효과는 아래의 식을 이용하여 세포독성(cytotoxicity)으로 구하였다.
9. SRB Assay
SRB assay는 Doll R & Peto R(1981)의 방법을 이용하여 측정하였다. 즉, 5 × 104 cells/mL 농도의 암세포를 96 well plate의 각 well에 100 μL씩 첨가하여 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 배양 후, 농도별로 희석된 시료 100 μL를 각 well에 첨가하고 48시간 동안 재배양하였다. 그 후 상등액을 제거하고 10% TCA를 각 well에 100 μL씩 첨가하여 4℃에서 1시간 동안 반응시킨 다음, TCA를 제거하고 멸균수로 5번 세척하여 실온에서 건조하였다. 여기에 1% acetic acid에 용해시킨 0.4% SRB 용액을 각 well에 100 μL씩 첨가하여 30분 동안 염색한 후 1% acetic acid로 5회 세척하여 건조시키고, 10 mM tris buffer(pH 10.5) 100 μL를 첨가하여 540 nm에서 흡광도를 측정하였다. 암세포에 대한 세포독성은 MTT assay와 동일한 식으로 계산하였으며, 3회 반복하여 실험한 후 평균값으로 나타내었다.
10. 통계분석
실험결과는 평균값±표준편차로 나타내었고, 각 실험군별 평균 간의 차이는 SPSS 통계프로그램(10.0 version)을 이용하여 분산분석(ANOVA) 및 t-test을 실시하였다. 측정한 각 시료간의 유의성 검증은 p<0.05 수준에서 하였고, 사후검증은 Duncan's multiple range test를 이용하여 실시하였다.
결과 및 고찰
1. 추출 수율, 총 폴리페놀 및 총 플라보노이드 함량
백합 구근 에탄올 추출물(EL)과 백합 구근 열수 추출물(WL)의 추출수율은 Table 1과 같이 EL이 6.15%, WL이 4.38%로 나타났다. EL과 WL의 총 폴리페놀 함량은 각각 104.44 mg GAE/g과 86.80 mg GAE/g으로, EL의 총 폴리페놀 함량이 유의적으로 더 높게 나타났다. 또한, 백합 구근 추출물의 총 플라보노이드 함량을 분석한 결과, EL이 22.92 mg QE/g, WL이 15.87 mg QE/g으로 나타나, EL이 WL보다 유의적으로 많은 총 플라보노이드를 함유하고 있는 것으로 나타났다. 한약재인 상지 추출물의 폴리페놀 함량이 열수 추출물보다 에탄올 추출물에서 높게 나타났으며(Park HM & Hong JH 2014), 제주 조릿대 추출물의 총 폴리페놀과 총 플라보노이드 함량도 열수 추출물보다 에탄올 추출물에서 높게 나타나(Lee SH & Lee MS 2017), 본 연구와 유사한 결과를 보였다. 폴리페놀과 플라보노이드 화합물은 식물계에 널리 분포하고 있는데, 폴리페놀 화합물은 2개 이상의 hydroxyl 기를 가지고 있으며, 플라보노이드 화합물은 C6-C3-C6의 기본골격을 가지고 있는 방향족 화합물로 단백질과 쉽게 결합하는 특성을 가진다(Hetog MGL 등 1992; Yu MH 등 2006). 또한 이들 화합물은 에탄올에 잘 용해되므로, 본 연구에서도 에탄올 추출물에 함유된 총 폴리페놀 함량과 총 플라보노이드 함량이 열수 추출물보다 높게 나타난 것으로 보인다. 백합 구근 추출물의 총 폴리페놀 함량을 다른 한약재와 비교해 보면, 창출 에탄올 추출물은 10.38 mg GAE/g (Park MH & Kim MR 2017), 오매 에탄올 추출물은 16.92 mg GAE/g(Jeon YH 등 2008), 감초 에탄올 추출물은 50.55 mg GAE/g(Kim E & Kim M 2018), 미숙과 건여주 에탄올 추출물은 9.95 mg GAE/g(Nam SW & Kim M 2017)으로 보고되어 이들 한약재보다 백합 구근 추출물의 총 폴리페놀 함량이 좀더 높게 나타났다. 또한, 총 플라보노이드의 경우, 창출 에탄올 추출물은 4.73 mg QE/g(Park MH & Kim MR 2017), 감초 에탄올 추출물은 6.87 mg QE/g(Kim E & Kim M 2018), 미성숙 건여주 에탄올 추출물은 5.24 mg QE/g(Nam SW & Kim M 2017)의 총 플라보노이드를 함유하고 있다고 보고되어, 백합 구근 추출물의 총 플라보노이드 함량이 이들 한약재 추출물보다 높은 것으로 나타났다. 선행연구에 따르면 백합구근에는 알칼로이드, 스테로이드, 사포닌, 플라보노이드, 폴리페놀 등이 함유되어 있다고 보고되었으나(Mimaki Y & Sashida Y 1991; Niu LX 등 2007; You X 등 2010), 아직까지 항산화 활성과 관련된 화합물들이 상세히 분석되어 있지 않아 향후 이들 물질의 분석에 대한 연구가 더 필요한 것으로 보인다.
2. DPPH 라디칼 소거능
EL과 WL의 DPPH 라디칼 소거능을 측정한 결과는 Fig. 1과 같다. EL과 WL은 농도가 증가할수록 DPPH 라디칼 소거능이 증가하는 경향을 보였으며, 실험한 전체 농도에서 EL이 WL보다 유의적으로 높은 DPPH 라디칼 소거능을 보여 추출 용매에 따라 소거능에 차이를 나타내었다. EL은 500 μg/mL와 1,000 μg/mL에서 각각 75.38%와 81.69%의 높은 DPPH 라디칼 소거능을 보여 우수한 항산화 활성을 가지고 있는 것으로 나타났으나, WL은 500 μg/mL와 1,000 μg/mL에서 17.10%, 26.19%의 소거능을 보여 EL에 비해 DPPH 라디칼 소거능이 낮았다. 이는 앞의 실험결과에서 나타났듯이 항산화 활성이 높은 폴리페놀 화합물과 플라보노이드 화합물이 WL보다 EL에 더 많이 함유되어 있어 DPPH 라디칼에 대한 전자공여능이 더 높았기 때문으로 생각된다. 분자 내 hydroxyl 기를 많이 가지고 있는 폴리페놀 화합물은 효과적으로 라디칼을 제거하는 항산화제로서 작용할 수 있으며, 페놀성 물질과 플라보노이드는 항산화 작용의 지표성분으로써 이들과 전자공여능 사이에 높은 상관관계가 있다고 보고되어(Kim EY 등 2004; Kwak CS 등 2005), 백합 구근 에탄올 추출물에 함유된 이들 물질이 항산화 활성 증가에 영향을 준 것으로 사료된다. 한편, 약용식물인 조릿대 에탄올 추출물은 1,000 μg/mL의 농도에서 65.58%의 DPPH 라디칼 소거능을 가진다고 보고되었고(Song WY 등 2015), 같은 농도에서 백지, 당귀, 갈근의 메탄올 추출물이 11.5%, 13.7%, 18.4%의 DPPH 라디칼 소거능을 보였으며(Moon JS 등 2004), 해동피, 홍화, 황련의 에탄올 추출물도 같은 농도에서 각각 44.69%, 24.15%, 31.87%의 라디칼 소거능을 나타내었다고 보고되어(Choi SY 등 2005), 백합 구근의 에탄올 추출물이 높은 항산화 활성을 가지고 있음을 확인할 수 있었다.
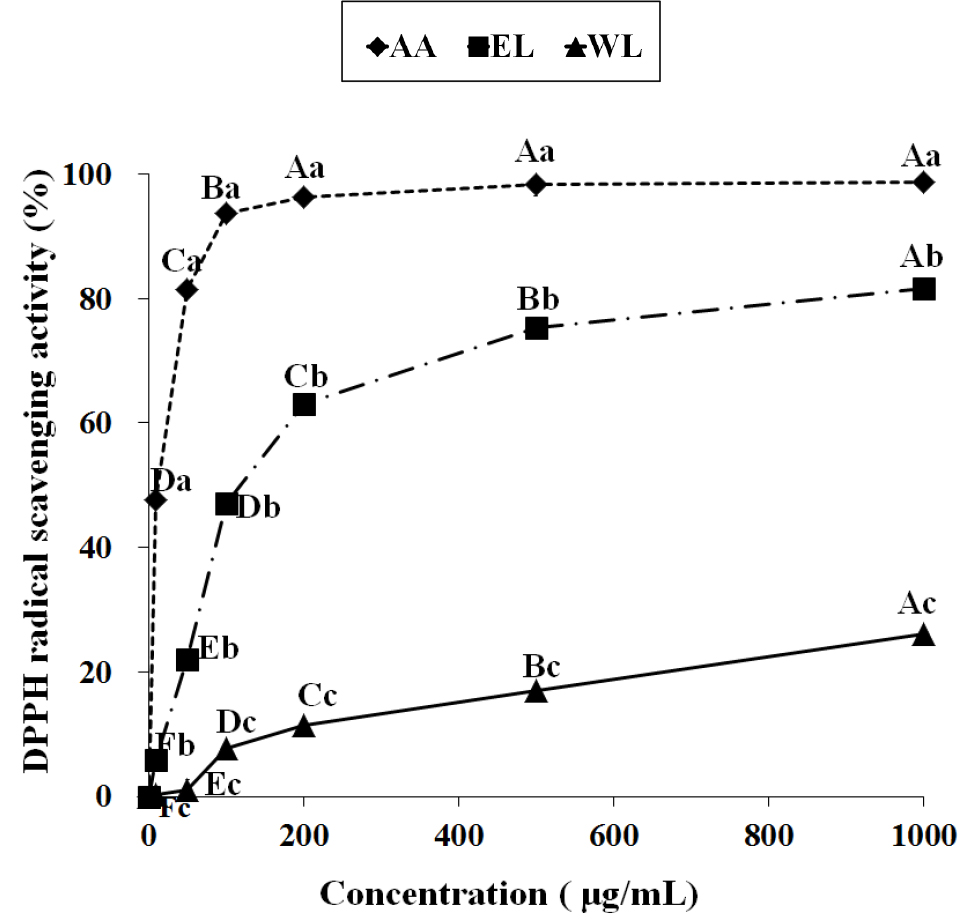
The electron donating ability of ethanol extract and water extract from Lilium davidii using the DPPH assay.EL: Ethanol extract from Lilium davidii, WL: Water extract from Lilium davidii, A.A: Ascorbic acid. The capital letters (A~F) are significantly different among the different concentrations in the same sample by Duncan's multiple range test (p<0.05). The small letters (a~c) are significantly different among the different samples in the same concentration by Duncan's multiple range test (p<0.05).
3. ABTS Assay
EL과 WL의 ABTS 라디칼 소거능을 분석한 결과, 10~1,000 μg/mL 농도에서 WL은 1.22~41.68%, EL는 2.60~83.93%의 소거능을 보였고, 추출물의 농도에 의존적으로 ABTS 라디칼 소거능이 증가하였다(Fig. 2). 또한 WL보다 EL의 ABTS 라디칼 소거활성이 유의적으로 높게 나타나 앞의 DPPH 라디칼 소거능 실험결과와 일치하였다. ABTS 라디칼 소거능은 활성 ABTS+가 항산화 물질과 반응하여 활성 양이온이 소거되면서 청록색에서 무색으로 탈색되는 원리로 항산화 활성을 측정할 수 있다(Lee SG 등 2008). 한약재의 항산화 활성에 대한 선행연구에 따르면 쇠비름의 ABTS 라디칼 소거능은 500 μg/mL의 농도에서 30.31%로 보고되었으며, 합환피는 43.43%로 보고되어(Joo SY 2013), 같은 농도에서 81.69%의 ABTS 라디칼 소거능을 보인 백합 구근이 이들에 비해 더 높은 항산화 활성을 가진 것으로 나타났다. 항산화 활성을 가진 화합물은 라디칼에 전자를 공여하여 식품에서는 지질산화를 억제하고 체내에서는 발생하는 활성 산소종을 제거하여 노화나 질병 억제에 도움을 줄 수 있다(Ak T & Gulcin I 2008). 따라서 DPPH assay와 ABTS assay 결과를 종합적으로 볼 때, EL은 높은 항산화 활성을 가지고 있어 식품성분의 산화를 억제하고, 활성 산소종을 효과적으로 제거할 수 있는 천연 항산화제로서 활용이 가능할 것으로 사료된다.
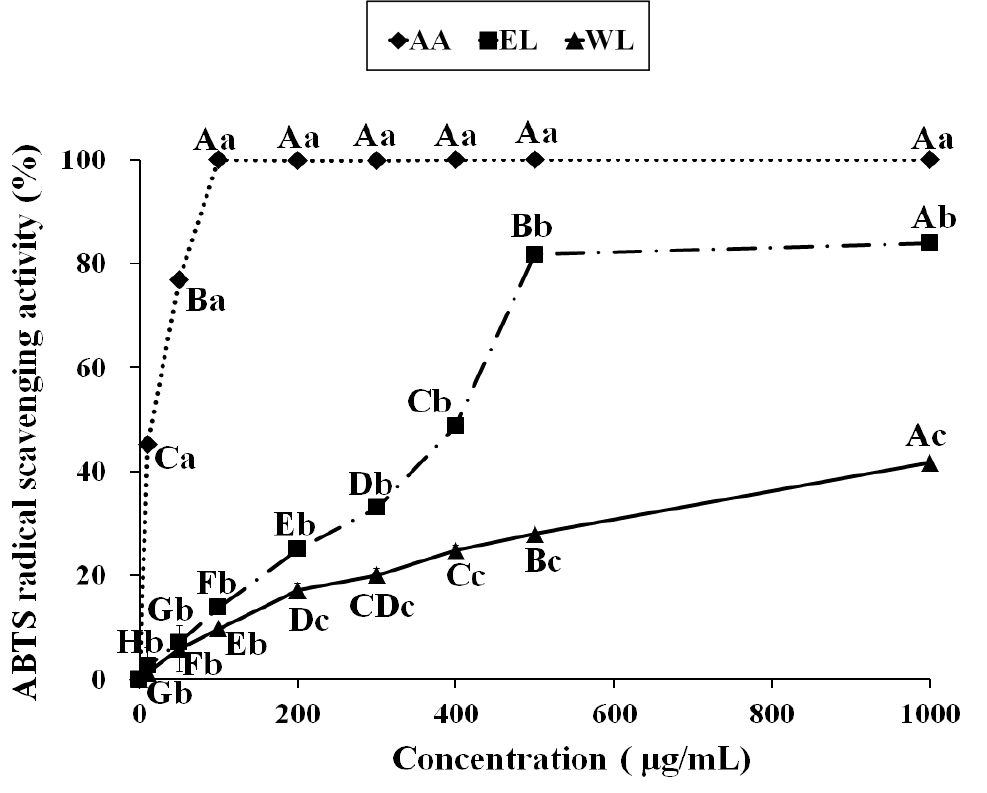
ABTS radical scavenging activity of ethanol extract and water extract from Lilium davidii.EL: Ethanol extract from Lilium davidii, WL: Water extract from Lilium davidii, A.A: Ascorbic acid. The capital letters (A~H) are significantly different among the different concentrations in the same sample by Duncan's multiple range test (p<0.05). The small letters (a~c) are significantly different among the different samples in the same concentration by Duncan's multiple range test(p<0.05).
4. MTT Assay
MTT assay는 암세포의 미토콘드리아에서 나오는 탈수소효소의 작용으로 인하여 MTT 시약이 환원되어 formazan crystal이 생성되는 정도를 흡광도로 측정하여 세포독성을 측정하는 방법이다. EL과 WL의 암세포에 대한 세포독성을 확인하기 위해 인체 암세포주인 자궁경부암 세포(HeLa), 폐암세포(A549), 간암 세포(Hep3B)를 이용해 MTT assay를 실시한 결과는 Fig. 3과 같다. 실험한 모든 암세포주에 대해 EL과 WL의 농도가 증가함에 따라 농도 의존적으로 암세포 증식억제 효과가 높아졌다. HeLa에 대한 EL과 WL의 세포독성은 25~400 μg/mL 농도에서 각각 40.40~92.19%, 34.87~91.34%로 나타났으며, 특히 400 μg/mL의 농도에서는 EL과 WL 모두 90% 이상의 높은 암세포 증식 억제 활성을 보였다. 또한 400 μg/mL의 농도를 제외하고는 EL이 WL보다 유의적으로 높은 세포독성을 보여 백합 구근 에탄올 추출물이 열수추출물보다 높은 암세포 증식 억제 효과를 가지고 있는 것으로 확인되었다. A549의 경우에도 EL의 세포독성이 400 μg/mL의 농도에서 94.14%로 나타나 실험한 3종류의 암세포 가운데 가장 높은 암세포 증식 억제 활성을 보였으며, 25~400 μg/mL의 농도에서 EL이 WL보다 유의적으로 높은 세포독성을 나타내었다. Hep3B에 대해서는 HeLa와 A549에 비해 상대적으로 약간 낮은 세포독성이 나타났으나, 400 μg/mL 농도에서 EL은 83.07%의 높은 세포독성을 보였다. 또한 Hep3B에서도 EL이 WL보다 유의적으로 높은 세포독성을 보여, 전체적으로 볼 때 3종류의 암세포에 대해 백합구근에탄올 추출물이 열수 추출물보다 암세포 증식 억제 효과가 우수한 것으로 확인되었다.
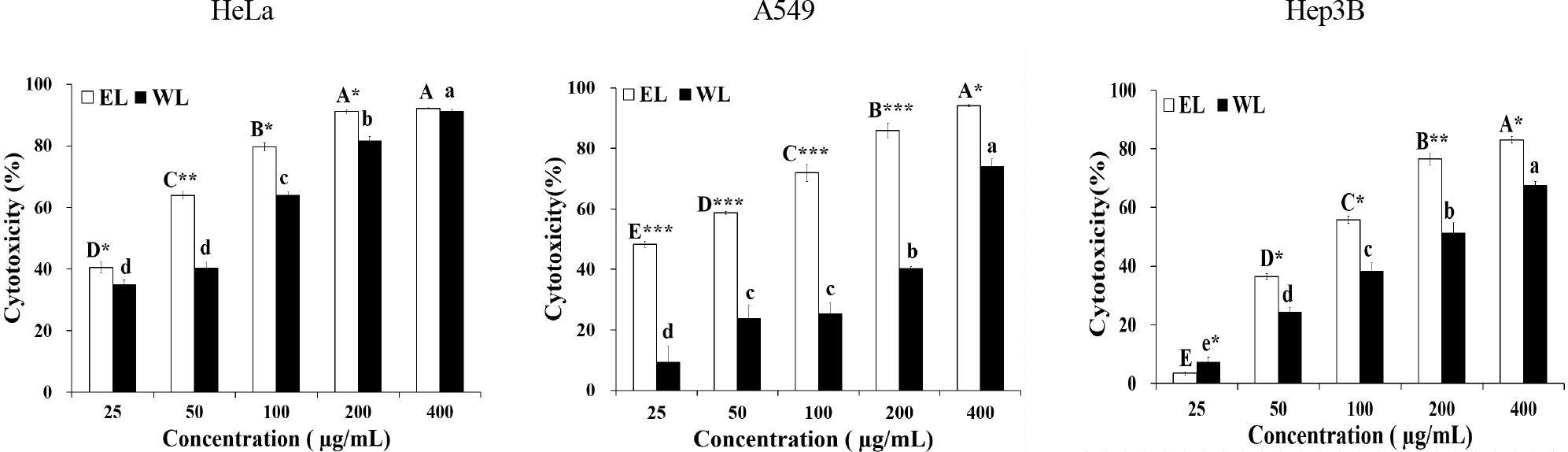
Cytotoxicity effect of ethanol extract and water extract from Lilium davidii using the MTT assay.EL: Ethanol extract from Lilium davidii, WL: Water extract from Lilium davidii, Means with the different letters are significantly different among the different concentrations in the same sample by Duncan's multiple range test (p<0.05). The star marker indicates significant difference between EL and WL by Student's t-test (*p<0.05, **p<0.01, ***p<0.001).
한편, 활성 산소종은 여러 세포신호 전달경로를 활성화시켜 암 유발에 관여하기 때문에 활성 산소종을 제거하는 항산화 활성이 높은 성분은 항암 활성도 나타내며(Mates JM 등 2012), 특히, 폴리페놀 성분은 phenolic ring이 발암성을 갖는 유리기와 결합함으로써 발암성 물질을 불활성화시키기 때문에 항암에 효과적인 것으로 보고되었다(Lewandowska U 등 2016). 실제 한약재를 이용한 선행연구에서도 인삼(Lee CK 등 2003), 마가목(Lee MK 등 2002)은 우수한 항암활성을 보였는데, 이는 추출물에 함유된 플라보노이드, 폴리페놀 화합물과 관련성이 있다고 하였고, 개똥쑥에서 분리된 플라보노이드가 Cox-2 신호 경로의 활성을 저해하여 암세포의 증식을 억제한다고 보고되어(Jorge FSF 등 2010), 한약재의 플라보노이드와 폴리페놀이 항암 활성에 중요한 역할을 하고 있는 것으로 나타났다. 따라서 본 연구에서도 백합 구근 추출물에 다량 함유되어 있는 플라보노이드 및 폴리페놀 화합물이 암세포의 증식 억제에 기여했을 것으로 생각된다.
5. SRB Assay
SRB assay는 세포 단백질을 aminoxanthene 염색액으로 염색하여 세포 독성을 평가하는 방법으로 MTT assay에 비해 환경 변화에 덜 민감하고, 안정한 end point를 제공해주는 장점이 있다(Papazisis KT 등 1997). EL과 WL이 암세포 증식에 미치는 영향을 SRB assay를 통해 분석하였으며, 그 결과를 Fig. 4에 나타내었다. HeLa에 대한 EL과 WL의 세포독성은 25~400 μg/mL의 농도에서 각각 36.67~91.57%, 10.02~85.08%로 나타났으며, 추출물의 농도의존적으로 세포독성이 증가하였다. EL은 HeLa에 대해 400 μg/mL에서 90% 이상의 세포독성을 나타내어 앞의 MTT assay 결과와 같이 우수한 암세포 증식 억제효과를 보였다. A549에 대한 세포독성도 400 μg/mL의 농도에서 EL이 89.73%, WL은 78.23%로 나타나 에탄올 추출물과 열수 추출물 모두 높은 암세포 증식 억제 효과를 보였다. Hep3B에 대한 세포독성도 400 μg/mL 농도에서 EL은 85.33%, WL은 80.49%로 나타나 두 추출물 모두 80% 이상의 높은 암세포 증식 억제 효과를 보였다. 또한, 3종류의 암세포 모두에서 EL의 세포독성이 WL보다 유의적으로 높게 나타나 에탄올 추출물의 암세포 증식 억제 효과가 더 높은 것으로 확인되었으며, 이는 MTT assay 결과와 일치하는 것이었다. MTT assay와 SRB assay 결과를 종합적으로 살펴볼 때, 백합 구근 에탄올 추출물의 암세포 증식 억제 활성이 열수 추출물보다 높았으며, 특히 400 μg/mL의 농도에서 HeLa에 대해 90% 이상의 세포독성을 보여 암세포 증식 억제 효과가 우수한 것으로 나타났다.
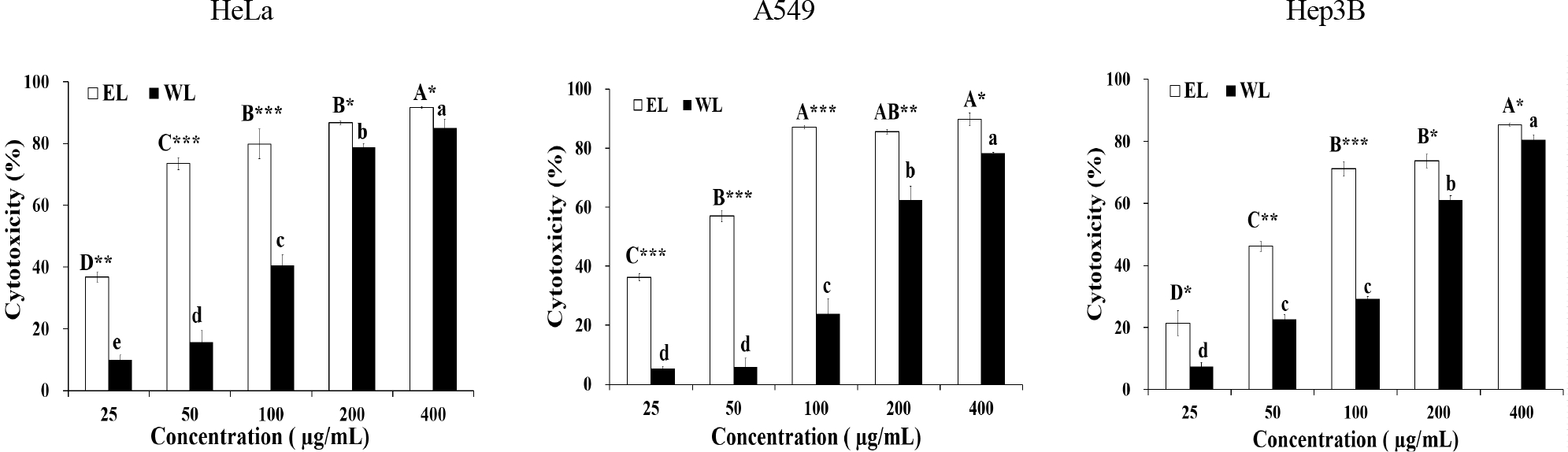
Cytotoxicity effect of ethanol extract and water extract from Lilium davidii using the SRB assay.EL: Ethanol extract from Lilium davidii, WL: Water extract from Lilium davidii, Means with the different letters are significantly different among the different concentrations in the same sample by Duncan's multiple range test (p<0.05). The star marker indicates significant difference between EL and WL by Student's t-test (*p<0.05, **p<0.01, ***p<0.001).
요약
본 연구에서는 백합 구근의 기능성 식품 소재로서의 이용 가능성을 확인하기 위하여 백합 구근을 에탄올과 물로 추출하여 추출물을 제조한 후, 각 추출물의 총 폴리페놀 함량, 총 플라보노이드 함량, 항산화 활성 및 암세포에 대한 세포독성을 측정하였다. EL은 WP보다 총 폴리페놀과 총 플라보노이드를 더 많이 함유하고 있는 것으로 나타났으며, DPPH 라디칼 소거능에서는 50~1,000 μg/mL의 농도에서 EL의 DPPH 라디칼 소거능이 WL보다 유의적으로 높게 나타났다. ABTS 라디칼 소거능 측정에서도 EL이 WL에 비해 높은 라디칼 소거능을 보여 DPPH 라디칼 소거능 실험 결과와 일치하였으며, 1,000 μg/mL에서 83.93%의 높은 ABTS 라디칼 소거능을 보였다. 백합 구근 추출물의 인체 암세포에 대한 세포독성 효과를 측정한 결과, MTT assay에서 EL과 WL은 400 μg/mL에서 HeLa에 대해 90% 이상의 높은 세포독성을 나타내었으며, EL은 A549과 Hep3B에 대해서도 400 μg/mL의 농도에서 94.14%와 83.07%의 높은 세포독성을 나타내 암세포 증식억제 효과가 우수함을 보여주었다. SRB assay에서도 EL은 400 μg/mL 농도에서 HeLa에 대해 91.57%의 높은 세포독성을 보였고, 암세포에 대해 모든 농도에서 WL보다 EL이 유의적으로 높은 세포독성을 나타내었다. 이상의 연구결과를 볼 때, 백합 구근 에탄올 추출물은 높은 항산화 활성 및 암세포에 대한 우수한 증식 억제 효과를 가지고 있는 것으로 확인되어 기능성 식품 소재로서 이용 가능성이 높을 것으로 보인다.
Acknowledgments
이 논문은 2017학년도 경북대학교 연구년 교수 연구비에 의하여 연구되었음.
References
-
Ak, T, Gülçin, I, (2008), Antioxidant and radical scavenging properties of curcumin, Chem Biol Interact, 174(1), p27-37.
[https://doi.org/10.1016/j.cbi.2008.05.003]

-
Baek, I, Im, LH, Park, C, Choi, YH, (2015), Anti-cancer potentials of Rhus verniciflua Stokes, Ulmus davidiana var. japonica Nakai and Arsenium sublimatum in human gastric cancer AGS cells, J Life Sci, 25(8), p849-860.
[https://doi.org/10.5352/jls.2015.25.8.849]

-
Blois, MS, (1958), Antioxidant determination by the use of a stable free radical, Nature, 181(4617), p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Carmichael, J, DeGraff, WG, Gazdar, AF, Minna, JD, Mitchell, JB, (1987), Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing, Cancer Res, 47(4), p936-942.
-
Choi, MH, Jeon, YJ, Shin, HJ, (2015), Anthocyanin analysis of pressure-extracted Korean blueberry juice and in vitro anti-inflammatory in RAW267.4 cell line, KSBB Journal, 30(4), p191-196.
[https://doi.org/10.7841/ksbbj.2015.30.4.191]

- Choi, SY, Lim, SH, Kim, JS, Ha, TY, Kim, SR, Kang, KS, Hwang, IK, (2005), Evaluation of the estrogenic and antioxidant activity of some edible and medicinal plants, Korean J Food Sci Technol, 37(4), p549-556.
- Doll, R, Peto, R, (1981), The causes of cancer: Quantitive estimates of avoiable risks of cancer in the United States today, J Natl Cancer Inst, 66(6), p1191-1308.
- Hetog, MGL, Hollman, PCH, Venema, DP, (1992), Optimization of a quantitative HPLC determination of potentially anti-carcinogenic flavonoids in vegetables and fruits, J Agr Food Chem, 40(9), p1591-1598.
-
Hong, SH, Park, C, Han, MH, Kim, HJ, Lee, MH, Choi, YH, (2014), Effects of Platycodon grandiflorum on the induction of autophagy and apoptosis in HCT-116 human colon cancer cells, J Life Sci, 24(11), p1244-1251.
[https://doi.org/10.5352/jls.2014.24.11.1244]

-
Jeon, YH, Kim, MH, Kim, MR, (2008), Antioxidative, antimutagenic, and cytotoxic activities of ethanol extracts from Cornus officianalis, J Korean Soc Food Sci Nutr, 37(1), p1-7.
[https://doi.org/10.3746/jkfn.2008.37.1.1]

-
Jeong, JW, Choi, YH, Park, C, (2015), Induction of apoptosis by ethanol extract of Cnidium officinale in human leukemia U937 cells through activation of AMPK, J Life Sci, 25(11), p1255-1264.
[https://doi.org/10.5352/jls.2015.25.11.1255]

- Joo, SY, (2013), Antioxdant activities of medicinal plant extracts, Korean J Food Sci Nutr, 42(4), p512-519.
- Jorge, FSF, Devanand, LL, Tomikazu, S, Arne, H, (2010), Flavonoids from Artemisia annua L. as antioxidants and their potential synergism with artemisinin against malaria and cancer, Molecules, 15(5), p3135-3170.
-
Kim, E, Kim, M, (2018), Antioxidant activity and cytotoxicity on cancer cells of extracts from Glycyrrhizae radix cultured with Paecilomyces japonica mycelium, J East Asian Soc Diet Life, 28(3), p188-196.
[https://doi.org/10.17495/easdl.2018.6.28.3.188]

- Kim, EY, Baik, IH, Kim, JH, Kim, SR, Rhyu, MR, (2004), Screening of the antioxidant activity of some medicinal plants, Korean J Food Sci Technol, 36(2), p333-338.
- Kim, SK, Ban, SY, Kim, JS, Chung, SK, (2005), Change of antioxidant activity and antioxidant compounds in Saururus chinensis by extraction conditions, J Korean Soc Appl Biol Chem, 48(1), p89-92.
- Kim, YJ, Park, CI, Park, JS, Ahn, EM, (2014), Antioxidant and cytotoxic activity of compounds from the stem of Juncus effusus, J Appl Biol Chem, 57(1), p47-51.
- Korean Statistical Information Service, (2017), Cancer Registration Statistics, http://kosis.kr accessed 1. 8. 2018.
- Kwak, CS, Kim, SA, Lee, MS, (2005), The correlation of anti-oxidative effects of 5 Korean common edible seaweeds and total polyphenol content, J Korean Soc Food Sci Nutr, 34(8), p1143-1150.
- Lee, CK, Kim, NY, Han, YN, Choi, JW, (2003), Effects of pretreated Korean red ginseng on carbontetrachloride and galactosamine-induced hepatotoxicity in rats, J Ginseng Res, 27(1), p1-10.
- Lee, JA, Chun, HP, (1996), Comparison of essential oil components according to extraction solvents in three Lilium cultivars, J Korean Soc Hort Sci, 43(1), p343-346.
-
Lee, KJ, Park, MH, Park, YH, Lim, SH, Kim, KH, (2011), Antioxidant activity and nitric oxide production of ethanol extracts from Astragali membranaceus Bunge and A. membranaceus Bunge var mongholicus Hisiao, Hisiao. Korean Soc Food Sci Nutr, 40(12), p1793-1796.
[https://doi.org/10.3746/jkfn.2011.40.12.1793]

- Lee, MK, Lee, HY, Lee, JH, Oh, JS, Choi, GP, Kim, JH, Kim, JD, (2002), Anticancer effect of Sorbus commixta Hedl extracts, Kor J Med Corp Sci, 10(5), p403-408.
-
Lee, SG, Yu, MH, Lee, SP, Lee, IS, (2008), Antioxidant activities and induction of apoptosis by methanol extracts from avocado, J Korean Soc Food Sci Nutr, 37(3), p269-275.
[https://doi.org/10.3746/jkfn.2008.37.3.269]

- Lee, SH, Lee, MS, (2017), The research on anti-oxidative effect of Sasa quelpaertensis extractum and assessment of cytotoxicity, 18(3), p687-693.
-
Lewandowska, U, Fichna, J, Gorlach, S, (2016), Enhancement of anticancer potential of polyphenols by covalent modifications, Biochem Pharmacol, 109(1), p1-13.
[https://doi.org/10.1016/j.bcp.2015.12.019]

- Mates, JM, Segura, JA, Alonso, FJ, Marquez, J, (2012), Oxidative stress in apoptosis and cancer, Toxicol, 86(11), p1649-1665.
-
Mimaki, Y, Sashida, Y, (1991), Steroidal saponins and alkaloids from the bulbs of Lilium brownii var. colchesteri, Chem Pharm Bull, 38(11), p3055-3059.
[https://doi.org/10.1248/cpb.38.3055]

- Moon, JS, Kim, SJ, Park, TM, (2004), Activities of anti-oxidation and alcohol dehydrogenase inhibition of methanol extracts from some medicinal herbs, Korean J Food Preser, 11(2), p201-206.
-
Moreno, MI, Isla, MI, Sampietro, AR, Vattuone, MA, (2000), Comparison of the free radical scavenging activity of propolis from several region of Argentina, J Enthrophamacol, 71(1-2), p109-114.
[https://doi.org/10.1016/s0378-8741(99)00189-0]

-
Nam, SW, Kim, M, (2017), Antioxidant activities and cytotoxicities in cancer cells of extracts of dried immature bitter melon (Momordica charantia L.), J Korean Soc Food Sci Nutr, 46(12), p1453-1461.
[https://doi.org/10.3746/jkfn.2017.46.12.1453]

- Niu, LX, Li, ZN, Li, HJ, Zhang, YL, (2007), Study on ultrasonic wave extraction of flavonoids from the bulb of Lilium lancifolium, Zhongyaocai, 30(1), p85-88.
-
Papazisis, KT, Geromichalos, GD, Dimitriadis, KA, Kortsaris, AH, (1997), Optimization of the sulforhodamine B colorimetric assay, J Immunol Methods, 208(2), p151-158.
[https://doi.org/10.1016/s0022-1759(97)00137-3]

- Park, BH, Cho, HS, Kim, DH, (2005), Antioxidative effects of solvent extracts of Lycii fructus powder (LFP) and Maejakgwa made with LFP, J Korean Soc Food Sci Nutr, 34(9), p1314-1319.
-
Park, HM, Hong, JH, (2014), Effect of extraction methods on antioxidant activities of Mori ramulus, J Korean Soc Food Sci Nutr, 43(11), p1709-1715.
[https://doi.org/10.3746/jkfn.2014.43.11.1709]

- Park, MH, Kim, MR, (2017), Analysis of antioxidant activity and cytotoxicity against human cancer cell lines of extract from Atractylodes rhizoma fermented with Ganoderma lucidum mycelium, Korean J Food Nutr, 30(3), p454-463.
-
Park, SJ, Yoon, JH, Kim, YE, Yoon, WB, Kim, JD, (2011), In vitro antioxidant activity of the aqueous of Angelicae gigas Nakai leaves, Korean J Food Preserv, 18(6), p817-823.
[https://doi.org/10.11002/kjfp.2011.18.6.817]

- Park, YS, (2002), Antioxidative activities and contnets of polyphenolic compound of medicinal herb extracts, J East Asian Soc Dietary Life, 12(1), p23-31.
- Roberta, R, Pellegrini, N, Proteggente, A, Pannala, A, Yang, M, Catherine, RE, (1999), Antioxidant activity applying an improved ABTS radical cation decolorization assay, Free Radic Biol Med, 26(9-10), p1231-1237.
- Seo, HS, Chung, BH, Cho, YG, (2008), Antioxidant and anticancer effects of agrimony (Agrimonia pilosa L.) and Chinese lizardtail (Saururus chinensis Baill), Korean J Medicianl Crop, 16(3), p139-143.
- Singleton, VL, Rossi, JA, (1965), Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, Am J Enol Vitic, 16(3), p144-158.
-
Song, WY, Byeon, SJ, Choi, JH, (2015), Anti-oxidative and anti-inflammatory activities of Sasa borealis extracts, Journal of Agriculture & Life Science, 49(3), p145-154.
[https://doi.org/10.14397/jals.2015.49.3.145]

-
You, X, Xie, C, Liu, K, Gu, Z, (2010), Isolation of non-starch polysaccharides from bulb of tiger lily (Lilium lancifolium Thunb) with fermentation of Saccharomyces cerevisiae, Carbohyd Polym, 81(1), p35-40.
[https://doi.org/10.1016/j.carbpol.2010.01.051]

- Yu, MH, Im, HG, Lee, HJ, Ji, YJ, Lee, IS, (2006), Components and their antioxidative activities of methanol extracts from sarcocarp and seed of Zyzypus jujuba var. inermis Rehder, Korean J Food Sci Technol, 38(1), p128-134.